Новое направление в локальной терапии остеоартроза коленных суставов
Статьи Опубликовано в журнале:
«Ревматология. Травматология. Ортопедия» №3, 2011г.
К.м.н. Е.С. ЦВЕТКОВА1, д.м.н., проф. Л.Н. ДЕНИСОВ1, д.м.н., проф. Н.А. ШОСТАК2, к.м.н. Е.И. ШМИДТ3
1 НИИ ревматологии РАМН
2 ГОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздравсоцразвития РФ
3 ГКБ № 1 им. Н.И. Пирогова, Москва
Остеоартроз (ОА) – одно из самых распространенных ревматических заболеваний. Среди всех болезней суставов наибольшее медико-социальное значение имеет именно ОА, определяемый как «гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходами, при которых в патологический процесс вовлекаются хрящ, субхондральная кость, связки, капсула, синовиальная оболочка и околосуставные мышцы» [1].
Показатели распространенности ОА варьируют в различных возрастных и этнических группах, и зависят от локализации патологического процесса и половой принадлежности. В среднем ОА страдает около 10% всего населения и почти половина всех пациентов в мире старше 50 лет [2, 3]. По данным Минздравсоцразвития РФ, с 2000 по 2009 г. число больных ОА увеличилось более чем в 2 раза, а распространенность заболевания (на 100 тыс. населения) возросла за 10 лет на 51,1%. Основными клиническими симптомами ОА является боль в суставах различной интенсивности и продолжительности: у 25% больных старше 50 лет интенсивность боли так высока, что приводит не только к ограничению функциональной активности, но и к полной потере трудоспособности [4, 5]. У пожилых пациентов продолжительность жизни зависит в большей степени от интенсивности боли, чем от сопутствующих заболеваний [5].
Основная цель терапии ОА коленных суставов (ОА КС) – минимизация боли и улучшение качества жизни пациентов. В последние годы в лечении ОА КС достигнут значительный прогресс, однако остается не решенной крайне актуальная проблема безопасности применяемых лекарственных средств, особенно у больных пожилого возраста.
Последние рекомендации OARSI (Osteoarthritis Research Society International) и Общероссийской общественной организации «Ассоциации ревматологов России» по терапии ОА КС регламентируют применение различных групп лекарственных средств, в том числе локальных нестероидных противовоспалительных препаратов (НПВП) [6, 7]. Локальные НПВП широко применяются при ОА, однако риск развития системных (желудочно-кишечных и кардиоваскулярных) нежелательных явлений достаточно высок [8, 9]. В связи с этим поиск средств локальной аналгезии продолжается. Оптимальный лекарственный препарат (или метод) не должен представлять прямой или непрямой опасности для пациента и требовать постоянного медицинского наблюдения [9].
Особый интерес вызывают лечебные пластыри, созданные на основе нанотехнологий, в частности Нанопласт Форте (НФ), обладающий аналгетическим и миорелаксирующим действием. Пластырь содержит магнитный слой из редкоземельных металлов и нанопорошок, продуцирующий длинноволновое инфракрасное излучение.
К моменту начала нашего исследования работ, посвященных изучению сравнительной эффективности пластыря НФ и плацебо, не проводилось.
Цель исследования заключалась в оценке эффективности, системной и локальной переносимости НФ в сопоставлении с пластырем-плацебо у больных ОА КС.
Материалы и методы
В двойное-слепое двухнедельное проспективное сравнительное рандомизированное многоцентровое плацебоконтролируемое исследование было включено 120 пациентов с ОА КС I–III рентгенологических стадий по Kellgren и Lowrence. Критериями включения в исследование являлись подписанное пациентом информированное согласие, интенсивность боли в анализируемом (целевом) суставе ≥ 40 мм по визуальной аналоговой шкале (ВАШ), отсутствие клинически значимых нарушений функции печени и почек, прием НПВП в стабильной дозе не менее 4 недель до исследования, адекватная стабильная терапия сопутствующих заболеваний. В исследование не включали пациентов со вторичным ОА; иными ревматическими заболеваниями (ревматоидный артрит, болезнь Бехтерева и др.); синовитом коленных суставов, требующим введения кортикостероидов; тяжелыми сопутствующими заболеваниями; поражением кожных покровов в области коленного сустава. Первичным критерием эффективности являлось уменьшение боли в целевом коленном суставе (индекс WOMAC, раздел А) на ≥ 50% от исходного уровня. Кроме того, в процессе исследования проводилась в динамике оценка боли по критериям разделов В и С индекса WOMAC; общая оценка эффекта лечения раздельно больным и врачом по ВАШ, ежедневная оценка больным интенсивности боли в мм по ВАШ.
Суммарная оценка эффективности НФ проводилась на 14-й день раздельно врачом и больным по следующим градациям: 1 – значительное улучшение, 2 – улучшение, 3 – отсутствие эффекта; 4 – ухудшение. Потребность в приеме НПВП подсчитывалась на протяжении исследования: рассчитывалась суточная доза, уменьшение дозы или полная отмена НПВП в связи с уменьшением интенсивности болевого синдрома.
Переносимость НФ и пластыря-плацебо оценивалась по частоте и выраженности (в баллах от 1 до 3) локальных и/или системных нежелательных явлений. Статистическая обработка полученных результатов проведена с использованием прикладных программ Statistica.
Таблица.
Начальная характеристика WOMAC и общей оценки пациента и врача
| Показатель | Начальные значения у 120 пациентов. Среднее ± SD (медиана [верхний-нижний квартили]) |
|---|---|
| WOMAC боль, мм | 237,0 ± 87,3 (219 [175-294]) |
| WOMAC скованность, мм | 96,5 ± 48,3 (104 [58-133]) |
| WOMAC функция, мм | 973,7 ± 312,9 (861 [688-1030]) |
| WOMAC суммарно, мм | 1208,3 ± 393,1 (1159 [978-1406]) |
| Общая оценка пациентом, мм | 58,9 ± 15,2 (58 [48-67]) |
| Общая оценка врачом, мм | 46,8 ± 16,2 (58 [37-57]) |
Результаты и их обсуждение
В исследование в соответствии с кодом рандомизации включено 120 пациентов ОА КС, по 60 больных в обеих группах. По возрасту, продолжительности ОА, длительности обострения, индексу массы тела (ИМТ), интенсивности боли в коленных суставах, другим клиническим параметрам и общей активности болезни обе группы были полностью сопоставимы (см. табл.). В целом в анализируемых группах преобладали женщины (97 больных) с II–III стадиями ОА КС (93,3%); продолжительностью ОА 7,7 года и длительностью обострения 8,9 недель. Среднее значение ИМТ составило 29,5 кг/м2. У 55 (73%) больных был диагностирован двухсторонний ОА КС. Среди сопутствующих болезней наиболее часто (57,5%) отмечалась артериальная гипертензия.
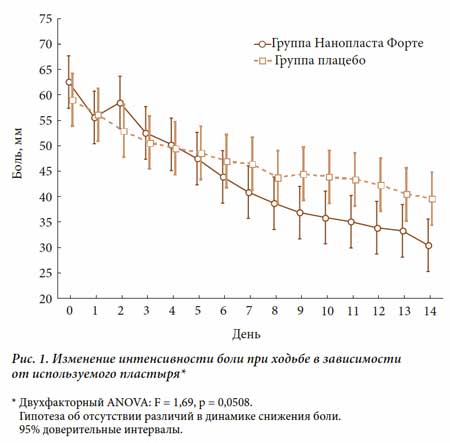
Частота достижения 50-процентного уменьшения боли (под-шкала А индекса WOMAC) была достоверно выше в группе активного НФ, чем в группе плацебо (38,2% и 16,7% соответственно, р = 0,013; точный критерий Фишера). Интенсивность боли при ходьбе уменьшилась только при использовании активного НФ (р = 0,05; двухфакторный анализ ANOVA), причем достоверное уменьшение боли было отмечено уже на 4-й день применения НФ (рис. 1).
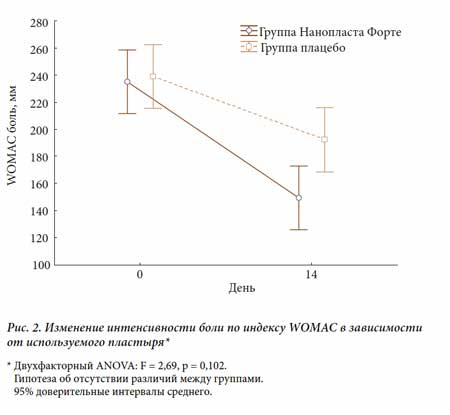
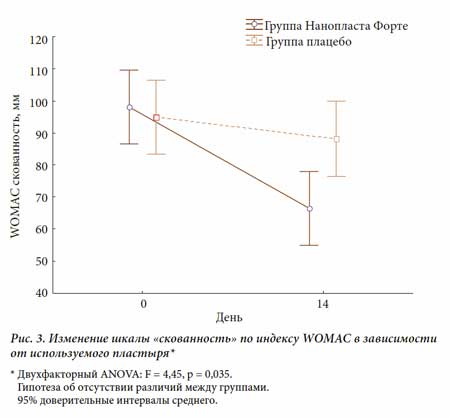
Суммарный показатель боли по индексу WOMAC в основной группе также уменьшился достоверно: с 235,1 до 149,4 мм, что свидетельствует о выраженном аналгетическом эффекте НФ (рис. 2). На фоне лечения в основной группе достоверно уменьшилась утренняя скованность (рис. 3) и увеличилась функциональная активность (рис. 4).
Общее состояние больных по субъективной оценке (р = 0,05) и по мнению врача (р = 0,01) улучшилось статистически значимо. Отмена и уменьшение дозы НПВП происходила достоверно (р = 0,007; точный критерий Фишера) чаще в группе больных, применявших активный НФ, чем в группе плацебо: у 23 и 7 пациентов соответственно, то есть почти у половины больных. При общей оценке эффективности НФ в основной группе у 82% пациентов отмечалось значительное улучшение. На фоне применения плацебо в 52% случаев эффекта от лечения не было, 5% больных оценили свое состояние как ухудшение.
В группе активного лечения все пациенты полностью завершили исследование. Нежелательных явлений (НЯ), связанных с применением НФ, не выявлено. У одного пациента зарегистрировано обострение хронического гастрита, что исследователи не связали с использованием НФ. В группе плацебо отмечались по одному случаю ОРВИ и гипертонического криза, не связанных с применением пластыря-плацебо; зарегистрированы 2 локальных НЯ: кожный зуд слабой выраженности и аллергический дерматит. В связи с последним пластырь-плацебо был отменен на 4-й день.
Заключение
Высокая аналгетическая активность Нанопласта Форте способствует улучшению функциональной активности пациентов ОА КС. Преимуществом НФ является его отличная переносимость и возможность уменьшения дозы или отмены НПВП на фоне применения пластыря. Нанопласт Форте может быть рекомендован как метод дополнительной локальной терапии при ОА КС.
NB
Основная цель терапии остеоартроза коленных суставов (ОА КС) – минимизация боли и улучшение качества жизни пациентов. Особый интерес вызывают лечебные пластыри, созданные на основе нанотехнологий, в частности Нанопласт Форте (НФ), который содержит магнитный слой из редкоземельных металлов и нанопорошок, продуцирующий длинноволновое инфракрасное излучение. Нанопласт Форте обладает аналгетическим и миорелаксирующим действием.Пластырь Нанопласт Форте обладает обезболивающим, противовоспалительным и мышечно-расслабляющим действием, способствует восстановлению функции опорно-двигательного аппарата (суставов, мышц и связок), а также более быстрому уменьшению последствий закрытых травм мягких тканей, опорно-двигательного аппарата (ушибов, растяжений связок и мышц, вывихов суставов, кровоподтеков и кожных гематом и т.д.). Сочетанное воздействие инфракрасного (теплового) излучения и магнитного поля приводит к активизации местного крово- и лимфообращения, улучшению венозного оттока, уменьшению воспалительной реакции: отека, боли. Нанопласт Форте улучшает местный метаболизм, способствует расслаблению мышц и связок. Пластырь может быть использован в составе комплексной терапии, совместим с приемом лекарственных препаратов, не рекомендуется одновременное использование других наружных средств на одних и тех же участках кожи.
Литература
1. Brand K.D., Doherty M., Lohmander L.S. Osteoarthritis. Oxford Univ. press, 1998.
2. Reginster J.Y. Te prevalence and burder of arthritis // Rheumatology. 2002. V. 41. P. 3–6.
3. Lawrence R.S., Helmick C.G., Arnett F.C. et al. Estimates of the prevalence of arthritis and selected musculoskeletal disorders in the US // Arthr. Rheum. 1998. V. 41. P. 778–799.
4. Фоломеева О.М., Лебедева Л.С., Ушакова М.А. Инвалидность, обусловленная ревматическими заболеваниями, среди жителей Российской Федерации // Научно-практическая ревматология. 2001. № 1. С. 15–21.
5. Эрдес Ш.Ф., Фоломеева О.М. Ревматические заболевания и инвалидность взрослого населения Российской Федерации // Научно-практическая ревматология. 2007. № 4. С. 4–10.
6. Zhang W., Nuki G., Moskowitz R.W. et al. OARSI recommendations for the management of hip and knee osteoarthritis. Part III: changes in evidence following systematic cumulative update of research published through // Osteoarth. Cartil. 2010. V. 18. P. 476–499.
7. Насонов Е.Л. Ревматология: клинические рекомендации.М.: Геотар- Медиа, 2010. 752 с.
8. Lin J., Zhang W., Jones A., Doherty M. Efcacy of topical NON-Ste-roidal anti-infammatory drugs in the treatment of osteoarthritis: meta-analysis of randomized controlled trials // BMJ. 2004. V. 329. P. 324–326.
9. Evans J.M., MacDonald T.M. Tolerability of topical NSAIDs in the elderly: do they really convey a safety advantage? // Drugs Aging. 1996. V. 9. P. 101–108.
