Опыт применения Фенотропила при болезни Паркинсона
Статьи Опубликовано в:Атмосфера. Нервные болезни »» № 4 2010
А.В. Карабанов, В.В. Шведков, С.Н. Иллариошкин
Алексей Вячеславович Карабанов – канд. мед. наук, научный сотрудник.
Виктор Васильевич Шведков – канд. мед. наук, руководитель отделения.
Сергей Николаевич Иллариошкин – профессор, зам. директора по научной работе.
Болезнь Паркинсона (идиопатический паркинсонизм) относится к числу распространенных возрастзависимых нейродегенеративных заболеваний и встречается в большинстве популяций мира с частотой 150-250 на 100000 населения [2, 7]. Следует отметить, что традиционные представления о болезни Паркинсона как заболевании лиц исключительно пожилого возраста в последние годы претерпели серьезный пересмотр, и сегодня не вызывает сомнений заметное увеличение числа случаев идиопатического паркинсонизма у пациентов на 5-м и даже на 4-м десятилетии жизни [3]. Каковы бы ни были причины данного феномена (ухудшение экологической ситуации, усугубление действия ряда генетических факторов, улучшение диагностики ранних стадий болезни и т.д.), очевидно, что неуклонное "омоложение" болезни Паркинсона предъявляет особые требования к стратегии лечения. На современном этапе общая стратегия лечения при рассматриваемом заболевании должна, во-первых, ориентироваться на длительную, многолетнюю перспективу и, во-вторых, давать возможность максимального сохранения повседневной активности и качества жизни пациентов [4, 13, 19].
Причиной ведущих клинических проявлений болезни Паркинсона - как моторных, так и немоторных - является дегенерация нейронов, продуцирующих дофамин и другие моноамины, в определенных отделах центральной нервной системы - ЦНС (черная субстанция ножек мозга, голубоватое пятно), а также в периферических нервных ганглиях внутренних органов (желудочно-кишечный тракт и др.) [2]. В связи с этим на протяжении десятилетий начиная с 1960-х годов основу лечения пациентов с болезнью Паркинсона составляют различные методы дофаминергической стимуляции: препараты леводопы (метаболического предшественника дофамина), агонисты дофаминовых рецепторов (АДР), ингибиторы ферментов метаболизма леводопы и дофамина (моноамиоксидазы типа В, катехол-орто-метилтрансферазы, ДОФА-декарбоксилазы) [2, 4, 13].
Дополнительно нередко применяются препараты-корректоры дисбаланса центральных нейротрансмиттеров, характерного для идиопатического паркинсонизма: центральные холинолитики, ингибиторы глутаматных рецепторов (амантадиновые производные), в отдельных ситуациях - бензодиазепины, ß-адреноблокаторы и др. Интенсивно развиваются технологии функциональной стереотаксической нейрохирургии, в первую очередь глубокая высокочастотная электростимуляция мозга, потенциал которой чрезвычайно велик. Все это привело к существенному улучшению прогноза и увеличению выживаемости пациентов.
Тем не менее несомненные успехи в лечении болезни Паркинсона, первоначально сопровождавшиеся определенной "эйфорией" неврологической общественности, не отменяют того очевидного на сегодня факта, что все существующие терапевтические возможности носят преимущественно симптоматический характер и остаются ограниченными в силу продолжающегося прогрессирования болезни. Так, через 2-5 лет от начала лечения леводопой практически у всех больных закономерно развиваются центральные побочные эффекты в виде суточных флуктуаций симптоматики (феномен "изнашивания" дозы, феномен "включения-выключения", эффект "пропуска дозы" и др.) и полиморфных лекарственных дискинезий (хореиформные дискинезии пика дозы, дистония конца дозы, двухфазная дискинезия и т.п.) [9, 14]. Механизм развития этих осложнений связывают со снижением "буферной" способности дегенерирующих дофаминпродуцирующих нейронов, дисфункцией пре- и постсинаптических дофаминовых рецепторов нигростриарной системы, глубокими изменениями экспрессии ряда маркерных генов, продукты которых являются котрансмиттерами стриарных ГАМКергических проекционных нейронов [9, 16, 19].
Одно из центральных мест в клинике болезни Паркинсона занимают немоторные симптомы, которые, как правило, задолго предшествуют манифестации двигательной стадии болезни и впоследствии прогрессируют параллельно основным симптомам паркинсонизма. К основным немоторным проявлениям болезни Паркинсона относятся разнообразные нарушения сна (гиперсомния в активное время суток, фрагментация ночного сна, насильственные движения в фазе "быстрого сна"), нарушение вегетативной регуляции, астения со снижением умственной и физической работоспособности, депрессия, когнитивное снижение, апатия, болевой синдром, расстройства обоняния и др. [13, 19]. Значительная часть этих расстройств связана с тем, что, согласно современной концепции H. Braak et al. [15], нейродегенеративный процесс при болезни Паркинсона начинается в наиболее каудальных отделах ствола мозга (проекционные нейроны нижнего ствола мозга и структуры обонятельного комплекса) и распространяется в восходящем направлении через средний мозг и мезокортекс к плащу. При этом поражение неспецифических активирующих стволовых систем, являющееся весьма ранним признаком заболевания, остается обычно за рамками "традиционных" терапевтических вмешательств при болезни Паркинсона. Между тем у многих больных немоторные проявления могут оказывать негативное влияние на качество жизни даже в большей степени, чем основные двигательные симптомы болезни (брадикинезия, ригидность, тремор покоя) [19].
По мере прогрессирования болезни Паркинсона отмечается нарастание симптомов, резистентных к леводопа-терапии и связанных с другими нейротрансмиттерными системами мозга (аксиальные расстройства, деменция и т.д.) [2, 13]. Еще одной весьма значимой проблемой являются разнообразные ятрогении, связанные с побочными эффектами применяемых противопаркинсонических препаратов. Помимо уже упоминавшихся леводопаиндуцированных флуктуаций и дискинезий классическим примером ятрогений могут служить пароксизмы дневной сонливости на фоне приема препаратов из группы АДР, обусловленные неблагоприятным действием дофаминовых агонистов на альтернативные (недофаминовые) нейротрансмиттерные системы и структуры лимбико-ретикулярного комплекса [10]. Такие эпизоды гиперсомнии чреваты серьезной опасностью несчастных случаев (например, при вождении автомобиля) и существенно ограничивают адаптацию пациентов к повседневной жизни.
Таким образом, многолетнее течение болезни Паркинсона на фоне наблюдающегося ее патоморфоза ставит в повестку дня необходимость дополнения существующих терапевтических схем препаратами, обладающими полимодальными нейромодулирующими свойствами и воздействующими на различные уровни ЦНС.
В этой связи наше внимание привлек оригинальный отечественный препарат Фенотропил (ОАО "Отечественные лекарства"), не имеющий аналогов по спектру своего фармакологического действия. Как представитель группы рацетамов (производных пирролидона), Фенотропил оказывает модулирующее влияние на функционирование основных нейромедиаторных систем мозга - холинергической, дофаминергической, ГАМКергической и глутаматергической [1], обладает комплексным рецепторным механизмом действия [11]. В большом числе экспериментальных и клинических исследований показано уникальное сочетание ноотропного, психоактивирующего, вегетотропного и адаптогенного эффектов Фенотропила [6, 11], причем данный препарат не обладает побочным действием, обычно свойственным психостимуляторам (синдром отмены, развитие зависимости и др.). Фармакокинетика Фенотропила достаточно благоприятна: препарат быстро всасывается из желудочно-кишечного тракта, легко проникает через гематоэнцефалический барьер, обладает практически 100% биодоступностью, а максимальная концентрация препарата в крови достигается через 1 ч (при периоде полувыведения 3-5 ч). В отечественной литературе имеется ряд сообщений, отражающих различные аспекты действия Фенотропила при сосудистых, дегенеративных заболеваниях нервной системы, в нейрореабилитационной практике [8, 11, 12]. Нами впервые проведено открытое исследование эффективности Фенотропила у пациентов с болезнью Паркинсона.
Материал и методы исследования
В исследование были включены 34 пациента с клинической картиной болезни Паркинсона, диагностированной в соответствии с общепринятыми критериями Британского банка мозга [18]. В их числе: 15 мужчин и 19 женщин, средний возраст составил 61,3±15,6 года, средняя длительность заболевания - 5,5±2,1 года. Средняя тяжесть клинической (двигательной) симптоматики по части III Унифицированной рейтинговой шкалы оценки болезни Паркинсона (UPDRS) составила 25,9±8,4 балла, тяжесть по функциональной шкале Хен-Яра (в модификации Линдвалла) - 2,2.
Большинство пациентов, вошедших в исследование (25 больных - 73,5%), были социально активными и продолжали работать, тогда как 9 пациентов (26,5%) были на пенсии и имели группу инвалидности.
Для объективизации динамики состояния больных в процессе лечения применялись следующие шкалы и вопросники:
- шкала UPDRS, части I-III, отражающие мышление, поведение, настроение, повседневную активность, двигательные нарушения [17];
- шкала повседневной активности Шваба-Ингланда;
- госпитальная шкала тревоги и депрессии (HADS) [20];
- анкета балльной оценки сна [5].
26 пациентов имели смешанную (ригидно-дрожательную) форму болезни Паркинсона, 5 пациентов - дрожательную и 3 - акинетико-ригидную форму заболевания. Все пациенты к моменту начала исследования были на стабильной (не менее 4 нед) противопаркинсонической терапии: 9 больных находились на монотерапии агонистами дофаминовых рецепторов (пирибедил или прамипексол), 4 больных принимали агонисты дофаминовых рецепторов в сочетании с амантадина гидрохлоридом (мидантаном), 8 больных - в сочетании с препаратами леводопы (мадопар, сталево), 5 принимали леводопа-препараты в сочетании с мидантаном, а еще 8 были на монотерапии препаратом леводопы.
Фенотропил назначался в дозировке 100 мг 2 раза в день после еды (завтрак, обед, последний прием не позднее 15 ч) на протяжении 4 нед. Указанная комплексная оценка состояния больных проводилась исходно и в конце 4-й недели лечения препаратом. Большинство пациентов продолжали наблюдаться в амбулаторных условиях и после окончания исследования.
Результаты и обсуждение
Полный курс лечения завершили 32 больных, двое пациентов выбыли из исследования.
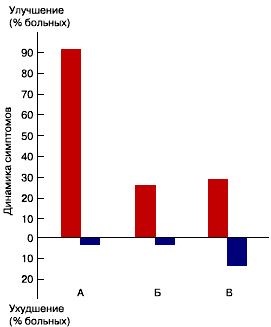
Двадцать девять из 32 пациентов (90,6% больных, завершивших исследование) на фоне проводимой терапии отметили уменьшение физической утомляемости, симптомов астенизации, повышение умственной и физической работоспособности, а также возможностей самообслуживания (рисунок). Двенадцать больных отметили, что они стали лучше справляться с работой, у 2 - улучшилась ходьба и уменьшилась склонность к неустойчивости и падениям. В рамках I части шкалы UPDRS у 17 пациентов (53,1%) отмечено уменьшение или исчезновение проявлений забывчивости, а у 6 пациентов (18,8%) - повышение мотивации и инициативности. Следует отметить, что выявленное субъективное улучшение сохранялось как минимум на протяжении 3-4 нед после завершения курса лечения Фенотропилом.
У 8 пациентов (25,0%), закончивших исследование, зарегистрировано уменьшение выраженности основной неврологической симптоматики (по III части шкалы UPDRS) на 1-4 балла, затрагивающее в основном показатели гипокинезии и/или мышечной ригидности (см. рисунок). У 23 больных показатели моторной части ( III часть) шкалы UPDRS оставались стабильными, и лишь у одного пациента отмечено увеличение суммы баллов (+2 балла).
У 7 больных (21,9%) отмечено уменьшение симптоматики по "тревожной" части шкалы HADS (на 1-2 балла) и еще у 2 пациентов - по разделу "депрессия" этой же шкалы (на 1 балл).
Важным представляется анализ эффектов Фенотропила у данной категории пациентов на расстройства сна. Такие расстройства перед началом лечения имели место у 22 больных. Практически у всех больных (6 человек), имевших до начала лечения проявления повышенной и/или пароксизмальной дневной сонливости, на фоне приема Фенотропила отмечено значительное уменьшение выраженности данного симптома, вплоть до его исчезновения. При этом лишь у 2 пациентов отмечено незначительное (на 1 балл) уменьшение качества ночного сна, а в остальных случаях ночной сон не ухудшался. Из 14 пациентов с нарушением ночного сна в 11 случаях Фенотропил не оказывал какого-либо дополнительного отрицательного влияния на этот показатель, а в 3 случаях было отмечено ухудшение (см. далее при описании побочных эффектов). Таким образом, общая динамика диссомнических расстройств при лечении пациентов с болезнью Паркинсона данным препаратом в целом по группе оказалась позитивной (см. рисунок).
Побочные эффекты различной степени выраженности на фоне применения Фенотропила при болезни Паркинсона отмечены нами у 6 пациентов (17,6%). Они включали:
- трудности засыпания и нарушение структуры ночного сна (3 случая);
- возбуждение (1);
- покраснение лица (1);
- появление транзиторных просоночных галлюцинаций (1).
| Рис. 1. Динамика симптомов на фоне терапии Фенотропилом.
А - общая активность, физическая и психическая утомляемость, симптомы астенизации; Б - двигательные симптомы (часть III шкалы UPDRS); В - диссомнические расстройства. |
 |
В большинстве случаев побочные эффекты носили легкий и кратковременный характер, а у 2 больных вследствие побочных эффектов (бессонница) курс лечения был прекращен. Нами был предпринят дополнительный анализ 5 случаев, в которых побочные эффекты Фенотропила носили центральный характер. При этом было установлено, что трое пациентов имели возраст старше 70 лет и в недавнем прошлом на протяжении от 4 до 9 лет принимали центральные холинолитики. У одного больного со зрительными просоночными галлюцинациями имела место выраженная диффузная атрофия больших полушарий головного мозга.
У всех больных гемодинамические показатели на фоне проводимого лечения оставались стабильными.
Таким образом, Фенотропил при его курсовом назначении у пациентов с болезнью Паркинсона оказывает отчетливый положительный эффект в отношении выраженности основных двигательных и психических проявлений заболевания - умственной и физической утомляемости, уровня мотивации, аффективных и когнитивных расстройств, гипокинезии, мышечной ригидности. Особенно ценным является действие Фенотропила, направленное на купирование одного из наиболее серьезных осложнений терапии агонистами D2-дофаминовых рецепторов - избыточной и пароксизмальной дневной сонливости. Учитывая, что агонисты D2-рецепторов рассматриваются в настоящее время как препарат первого ряда в лечении болезни Паркинсона [4, 10], Фенотропил может служить важным и в некоторых клинических ситуациях незаменимым корректором в рамках базовых схем противопаркинсонической терапии.
Побочные эффекты при применении Фенотропила у пациентов с болезнью Паркинсона не носят серьезного характера. С учетом полученного нами опыта, с осторожностью следует применять Фенотропил у больных пожилого возраста (особенно старше 70 лет), при длительном приеме центральных холинолитиков или близких препаратов (амантадины) в анамнезе, наличии выраженных атрофических изменений головного мозга.
Результаты исследования позволяют рекомендовать Фенотропил в качестве дополнительного препарата вместе с базовой противопаркинсонической терапией у больных болезнью Паркинсона, в том числе в амбулаторной практике.
Список использованной литературы
