Использование препарата силодозин для лечения симптомов нижних мочевыводящих путей (СНМП) у мужчин с подозрением на доброкачественную гиперплазию предстательной железы
СтатьиОпубликовано в журнале:
«EUROPEAN UROLOGY», 2011, № 59, с. 342-352
Christopher R. Chapple a,*, Francesco Montorsi b, Teuvo L.J. Tammela c, Manfred Wirth d, Evert Koldewijn e, Eldiberto Fernández Fernández f, от имени Европейской группы по изучению препарата силодозин (European Silodosin Study Group) 1
a Department of Urology, Royal Hallamshire Hospital, Sheffi eld Teaching Hospital NHS Foundation Trust, Шеффилд, Соединенное Королевство
b Department of Urology, Università Vita Salute San Raffaele, Милан, Италия
c Department of Urology, Tampere University Hospital, Тампере, Финляндия
d Department of Urology, University Hospital Carl Gustav Carus, Дрезден, Германия
e Department of Urology, Catharina Hospital, Эйндховен, Нидерланды
f Department of Urology, University Hospital Ramón y Cajal, Мадрид, Испания
1 Полный список участников исследования представлен в приложении.
* Корреспонденцию направлять: The Royal Hallamshire Hospital, Sheffield Teaching Hospital NHS Foundation Trust, Glossop Road, Sheffield S10 2JF, United Kingdom.
Информация о статье
Статья получена 31 октября 2010 г.
Статья опубликована онлайн до появления в печати 10 ноября 2010 г.
Ключевые слова:
Силодозин
Тамсулозин
ДГЖП
СНМП
Абстракт
Силодозин используют в качестве нового средства, обладающего высокой фармакологической селективностью по отношению к α1A- адренорецепторам.
Цель. Продемонстрировать более высокую эффективность нового препарата силодозин по сравнению с плацебо и его не меньшую эффективность по сравнению с тамсулозином, а также проанализировать полученные результаты в рамках обзора последних литературных данных.
Дизайн, условия и участники исследования. Проведено многоцентровое двойное слепое исследование в параллельных группах с активным и плацебо- контролем. Участники исследования отбирались из 1 228 мужчин в возрасте 50 лет и старше из 72 медицинских учреждений 11 стран Европы, у которых значение баллов по Международной шкале симптомов заболеваний предстательной железы (IPSS — International Prostate Symptom Score) составило ≥ 13, а максимальная скорость потока мочи (Qmax) была > 4 или ≤ 15 мл/с. Пациенты проходили 2-недельный период «отмывания» от предыдущей терапии и вводный период с плацебо в течение 4 нед. В итоге 955 пациентов были рандомизированы в 3 группы (2 : 2 : 1), первая из которых в течение 12 нед. ежедневно получала 8 мг силодозина (n = 381), вторая — 0,4 мг тамсулозина (n = 384), а третья — плацебо (n = 190).
Показатели. Было рассчитано изменение общего балла IPSS по сравнению с началом исследования, определены значения по подшкалам накопления мочи, опорожнения мочевого пузыря и качества жизни (КЖ) из-за существующих нарушений мочеиспускания, а также Qmax. Ответ на лечение определялся как снижение балла IPSS ≥ 25% по сравнению с начальным уровнем, а увеличение Qmax на 30% и более.
Результаты и ограничения. При терапии силодозином и тамсулозином изменение общего балла IPSS по сравнению с начальным уровнем было значительно выше, чем при приеме плацебо (p Пациенты хорошо переносили активную терапию, и процент прервавших терапию из-за развития нежелательных явлений был низким во всех группах (2,1%, 1,0% и 1,6% для силодозина, тамсулозина и плацебо соответственно). Наиболее распространенным нежелательным явлением при приеме силодозина было отсутствие или снижение интенсивности эякуляции при оргазме (14%). Данный эффект является обратимым и возникает вследствие эффективного и селективного антагонистического действия в отношении α1A-адренорецепторов. Для силодозина характерна более высокая частота возникновения данного нежелательного явления, чем для тамсулозина (2%). Однако лишь 1,3% получавших силодозин пациентов прекратили лечение по этой причине.
Заключение. Силодозин является эффективным и хорошо переносимым средством для облегчения состояния при нарушениях опорожнения и накопления мочи у пациентов с СНМП, что свидетельствует о взаимосвязи обструкции шейки мочевого пузыря и доброкачественной гиперплазии предстательной железы. Общая эффективность силодозина не ниже эффективности тамсулозина. Из использованных в исследовании препаратов силодозин имел статистически значимое действие на никтурию по сравнению с плацебо.
Регистрационный номер клинического исследования. ClinicalTrials.gov. Идентификационный номер: NCT00359905.
1. Введение
Доброкачественная гиперплазия предстательной железы (ДГПЖ) представляет собой доброкачественное увеличение предстательной железы в результате гиперплазии железистых и стромальных клеточных элементов 1. Вследствие увеличения предстательная железа может блокировать просвет мочевыводящих путей и препятствовать оттоку мочи 2. Однако в исследованиях было показано, что размер предстательной железы и скорость потока мочи обычно не коррелируют со степенью выраженности СНМП, которая может быть различной 3. В клинической практике пациенты получают лечение СНМП, связанных с обструкцией шейки мочевого пузыря (ИВО — инфравезикальная обструкция) в результате ДГПЖ (это заболевание часто называют «СНМП / ДГПЖ»).
Хотя в случаях развития СНМП / ДГПЖ преобладают симптомы, связанные с опорожнением, именно процесс накопления мочи в мочевом пузыре доставляет наибольшую степень беспокойства пациентам 4. Цель проведения терапии в таких случаях заключается в улучшении состояния СНМП / ДГПЖ, а следовательно, и качества жизни пациента. Кроме того, целью терапии является предотвращение осложнений, таких как острая задержка мочи или расширение верхних мочевых путей вследствие ИВО. В одобренной терапии заболевания используют альфа-адреноблокаторы, которые в настоящее время являются препаратами первой линии для мужчин с СНМП / ДГЖП умеренной или тяжёлой степени 5, а также ингибиторы 5а-редуктазы (5-ARI — 5a-reductase inhibitors), которые рекомендованы для лечения мужчин с умеренными и тяжёлыми формами СНМП / ДГЖП и с увеличенной предстательной железой. Альфа-адреноблокаторы можно использовать независимо от размера предстательной железы, поскольку они оказывают действие на динамическое / нейронопосредованное сокращение мышечной стромы, которая характерна для ДГПЖ. Действие 5-ARI основано на сокращении объёма стромального компонента железы. Полагают, что в развитие данных симптомов и нарушение оттока мочи у пациентов с СНМП / ДГПЖ вносят вклад оба компонента6.
Действие неселективных альфа1-адреноблокатеров направлено на увеличение скорости потока мочи и улучшение симптомов заболевания у мужчин с симптоматической ДГПЖ. Тем не менее при их применении могут быть нежелательные явления, связанные с расширением периферических кровеносных сосудов (например, ортостатическая гипотензия, головокружение и головные боли) 7-9. Напротив, препараты с высокой аффинностью к а1А-адренорецепторам обладают более высокой специфичностью к тканям простаты и поддерживают терапевтический ответ при проведении терапии симптоматической ДГПЖ, оказывая меньшее влияние на артериальное давление и приводя к меньшему количеству нежелательных явлений со стороны сердечно-сосудистой системы в целом 10-11.
Силодозин является новым препаратом с высокой селективностью по отношению к а1А-рецепторам, которых в мочевых путях мужчин больше, чем а1B-рецепторов. В экспериментах in vitro было показано, что отношение связывания силодозина с разными подтипами рецепторов (а1А : а1B) чрезвычайно высоко (162 : 1), что свидетельствует о способности препарата восстанавливать нейрон-опосредованную динамическую релаксацию гладкой мускулатуры нижних мочевых путей с минимальным количеством нежелательных эффектов со стороны артериального давления п. Так, при проведении оценки уроселективности силодозина in vivo по сравнению с таковой для препаратов тамсулозин и празозин была выявлена достаточно высокая уроселективность у крыс и собак (определение уроселективности проводили с использованием соотношения между уменьшающимся с повышением дозы препарата интрауретральным давлением и артериальным давлением)13-14.
В данной работе представлены результаты первого рандомизированного плацебо-контролируемого исследования препарата силодозин при терапии пациентов с СНМП / ДГПЖ, проведенного в странах Европы. В работе действие силодозина сравнивается с эффективным и активно применяемым препаратом тамсулозином 15.
2. Пациенты и методы
2.1. План исследования
Многоцентровое двойное слепое исследование в параллельных группах с активным и плацебо-контролем проводили в 72 медицинских учреждениях и стационарных отделениях в 11 странах Европы. После 2-недельного периода «отмывания» от предыдущей терапии и вводного 4-недельного периода приема плацебо пациенты были рандомизированы в 3 группы (в соотношении 2:2: 1, стратификация по группам, в каждой группе рандомизировали 5 пациентов; рандомизация проводилась международной контрактной исследовательской организацией). Пациенты первой группы один раз в день в течение 12 нед. получали силодозин (8 мг), второй группы — тамсулозин (0,4 мг), а третьей —плацебо. Во всех группах на протяжении всего исследования участники и исследователи получали и проводили терапию слепым методом. Протокол исследования был одобрен этическим комитетом каждого участвующего клинического центра. Исследование проводили в соответствии с Хельсинкской декларацией. Перед началом исследования каждый пациент подписал информированное согласие.
Были предусмотрены 8 контрольных точек: за 42 дня до начала исследования (начало периода «отмывания» от предыдущей терапии), за 28 дней (начало вводного периода терапии плацебо), начальная контрольная точка (до и после рандомизации), а также спустя 7,14,28,56 и 84 дня после начала терапии (или в день досрочного прекращения исследования).
Предрандомизационная процедура состояла из сбора данных анамнеза (включая урологический анамнез), проверки проведения сопутствующей лекарственной терапии, медицинского обследования (включая пальцевое ректальное исследование) и определения количества оставшейся после мочеиспускания мочи при помощи УЗИ.
На этапе включения в исследование, на начальном этапе, а также спустя 7,14,28,56 и 84 дня после начала терапии (или в день досрочного прекращения исследования) пациенты заполняли опросник Международной шкалы симптомов при заболеваниях предстательной железы (IPSS — International Prostate Symptom Score), включая вопрос 8, касающийся качества жизни. Данный опросник представляет собой официальный инструмент оценки степени тяжести симптомов у пациентов с ДГПЖ14. Поскольку исследование проводили в нескольких странах Европы с участием людей, разговаривающих на разных языках, институт MAPI (международная организация, специализирующаяся на лингвистической валидации с целью использования и интерпретации опросников у пациентов различных культур) произвел валидацию текстов на соответствующих языках.
Кроме того, в один день с заполнением вопросника IPSS с помощью стандартных откалиброванных устройств исследователи фиксировали наибольшее значение максимальной скорости потока мочи (Qmax) каждые 2-6 ч после введения дозы препарата. Для того, чтобы оценка была успешной, объем мочеиспускания должен был составлять не менее 125 мл.
В каждой контрольной точке пациентам измеряли систолическое (САД) и диастолическое (ДАД) артериальное давление, а также частоту пульса (ЧП). При этом перед проведением измерений пациент был в состоянии покоя в положении лежа на спине как минимум в течение 5 мин. На этапе отбора и на начальном этапе (до и после приема первой дозы) проводили тест на ортостатическую гипотензию. На этапе отбора, начальном этапе и в конечной точке исследования в случае его преждевременного прекращения проводили лабораторные анализы и 12-канальную ЭКГ. В каждой точке контроля регистрировали нежелательные явления. Появление новых нежелательных симптомов, заболеваний или ухудшения существующего на начальный момент состояния пациентов в период после рандомизации рассматривали как нежелательное явление, возникшее во время лечения (ТЕАЕ — treatment-emergent adverse events).
2.2. Исследуемая популяция
Для участия в исследовании были отобраны мужчины в возрасте ≥ 50 лет с СНМП (стабильный общий балл опросника IPSS ≥ 13) и ПВО (Qmax между 4 и 15 мл/с, минимальный объем мочеиспускания ≥ 125 мл), с удовлетворительным уровнем приверженности терапии (80-120% в течение вводного периода приема плацебо). Основные критерии исключения были следующие: улучшение общего балла IPSS ≥ 25% во время периода вводной терапии; остаточный после мочеиспускания объем мочи ≥250 мл; внутрипузырная обструкция, вызванная не ДГПЖ; имевшее место вмешательство по причине ДГПЖ в анамнезе; текущая инфекция мочевыводящих путей или рецидив инфекции мочевыводящих путей в анамнезе, текущий или хронический простатит; рак предстательной железы или инвазивный рак мочевого пузыря в анамнезе; имевшая место ортостатическая гипотензия; использование 5-ARI в период 6 мес, альфа-адреноблокаторов или фитотерапии в 2-недельный период перед началом исследования.
2.3. Конечные точки исследования и статистический анализ
Первичной конечной точкой исследования считали демонстрацию большей эффективности препарата силодозин по сравнению с плацебо и не меньшую эффективность по сравнению с тамсулозином касательно облегчения симптомов СНМП, вызванных ДГПЖ и связанных с ПВО. За критерий первичной эффективности было принято изменение общего балла по опроснику IPSS (вопросы 1-7).
Количество рандомизированных пациентов составило 820 (328 пациентов получали силодозин в дозе 8 мг, 328 — тамсулозин в дозе 0,4 мг и 164 — плацебо). Целью исследования являлось опровержение гипотезы о неэквивалентности двух режимов активной терапии со следующим допущением: одностороннее стандартное отклонение 5,2; статистическая мощность 90%; предел не меньшей эффективности равен среднему изменению балла IPSS на 1,5; 20% пациентов не соответствуют требованиям к включению их в популяцию, проходившую лечение по протоколу (РР—per-protocol). Размер данной выборки был также достаточным для использования двустороннего критерия с уровнем достоверности 0,05 и статистической мощностью 90% с целью обнаружения среднего изменения общего балла IPSS14 на -2 в каждой активной группе / группе плацебо по сравнению с начальным уровнем.
Параметры вторичной эффективности были следующими: улучшение балла подписал накопления мочи и опорожнения мочевого пузыря, изменения качества жизни вследствие наличия симптомов нижних мочевыводящих путей (вопрос 8 IPSS), Qmax , а также процент пациентов, ответивших на лечение на основании данных IPSS (уменьшение на ≥ 25% по сравнению с начальным уровнем) и Qmax (снижение ≥ 30% по сравнению с начальным уровнем).
Для статистического анализа использовали следующие методы. Для анализа переменной первичной эффективности среди всех пациентов, включенных в исследование (выборка ITT — intent-to-treat), оценивали более высокую эффективность активной терапии (с применением препаратов силодозин и тамсулозин) по сравнению с плацебо. Выборку ITT составили все пациенты, удовлетворившие начальным критериям в соответствии с опросником IPSS и успешно прошедшие не менее одной последующей проверки. Затем не меньшую эффективность силодозина по сравнению с тамсулозином проверяли в РР-популяции (все пациенты, завершившие исследование без нарушений протокола). Наконец, после получения положительных результатов по запланированным тестам была проведена проверка большей эффективности силодозина по сравнению с тамсулозином (на ITT-популяции). Для определения переменных вторичной эффективности сначала провели проверку более высокой эффективности активной терапии (с применением препаратов силодозин и тамсулозин) по сравнению с плацебо, а затем — сравнение эффективностей этих препаратов.
На основании скорректированных средних величин, полученных при проведении основного анализа ковариационной модели, включавшей условия терапии, микшированное среднее и начальное значения, было проведено общее сравнение результатов изменения общего балла IPSS по сравнению с начальным уровнем для групп пациентов, получавших терапию.
При прохождении группой пациентов каждой контрольной точки, а также момента окончания исследования был определен процент пациентов, ответивших на лечение по результатам общего балла вопросника IPSS и значения Qmax. С помощью теста Кохрана-Мантеля-Хензеля было проведено сравнение результатов между группами пациентов, получавших активное лечение и плацебо для препаратов силодозин и тамсулозин. Для обеих популяций стратификацию проводили по совокупному центру.
Вторичный анализ проводили в подгруппах пациентов, у которых на начальном этапе наблюдали никтурию (не менее двух мочеиспусканий в течение ночи по результатам ответа на вопрос 7 опросника IPSS).
При определении безопасности препарата в популяцию безопасности были включены все пациенты, прошедшие рандомизацию и получившие как минимум однократную дозу двойного слепого лечения исследуемым препаратом. В основном безопасность оценивали на основании ТЕАЕ, зарегистрированных в группах после проведения рандомизации. Кроме того, отклонение от начального уровня оценивали в соответствии со следующими параметрами безопасности: ДАД, САД и ЧП в положении лежа на спине и стоя (ортостатическая проба), результатами лабораторных исследований, ЭКГ и результатами медицинского обследования.
3. Результаты
3.1. Распределение участников клинического исследования
В общей сложности скрининг прошли 1 228 пациентов, из которых 955 были рандомизированы на 3 группы. Пациенты первой группы получали силодозин в дозе 8 мг (381), пациенты второй группы — тамсулозин в дозе 0,4 мг (384), а пациенты третьей — плацебо (190). Первый пациент был включен в исследование 18 мая 2006 г., а последний пациент завершил участие в исследовании 10 мая 2007 г. На рис. 1 показано распределение пациентов. Основными причинами прерывания участия в исследовании были нарушение протокола (2,5%) и добровольное прекращение терапии участниками (2,4%). Во всех группах уровень прерывания терапии вследствие ТЕАЕ был невысоким (Рис. 1. Распределение участников исследования. ITT = пациенты, удовлетворившие начальным критериям в соответствии с опросником IPSS и успешно прошедшие не менее одной последующей проверки; РР = группа пациентов, завершивших участие в лечении в соответствии с протоколом
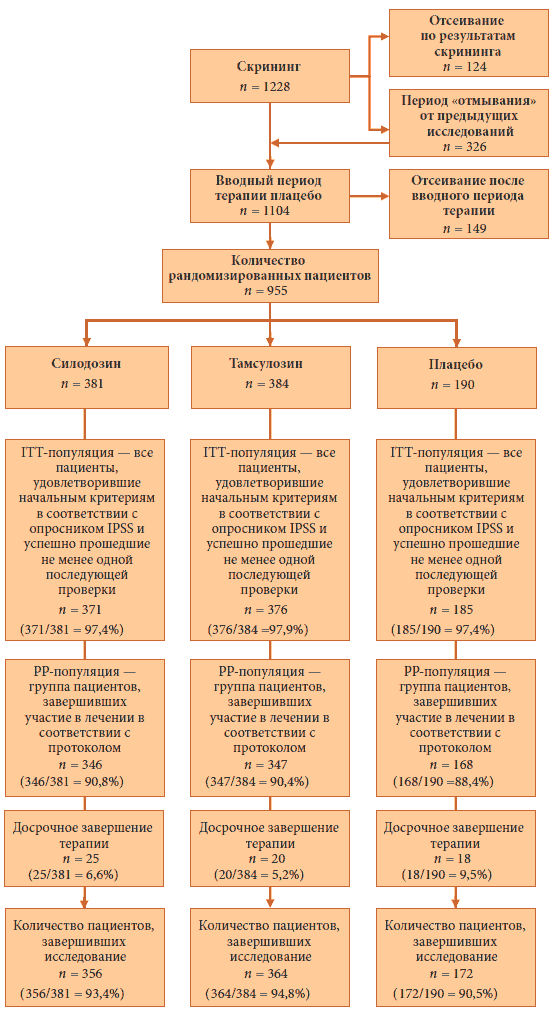
3.2. Демографические характеристики и прочие параметры начальной точки исследования
В табл. 1 представлены демографические характеристики и прочие параметры начальной точки исследования для безопасной популяции. Существенных статистических различий в параметрах возраст, индекс массы тела, общий балл IPSS, баллы подшкал накопления мочи и опорожнения мочевого пузыря, а также снижения качества жизни вследствие наличия симптомов нижних мочевых путей между тремя группами выявлено не было. Необходимо отметить, что гипертензию наблюдали у 424 пациентов (44,4%). При этом большое количество пациентов проходили лечение антигипертензивными препаратами. На исходном уровне многие пациенты имели в анамнезе эректильную дисфункцию (24,0%) или жалобы на нарушение эякуляции. Данные нарушения включали снижение количества семени, выбрасываемого при оргазме (8,3%), снижение интенсивности семяизвержения (6,9%) и отсутствие семяизвержения при оргазме (0,8%). Суммарная доля нарушений эякуляции до начала терапии составила 24%.
Таблица 1. Демографическая характеристика участников исследования и параметры начального уровня
| Силодозин 8 мг (n = 381) | Тамсулозин 0,4 мг (n = 384) | Плацебо (n = 190) | Общее количество участников исследования (n = 955) | Значение р | |
| Возраст, лет, n (%) | |||||
| 50-64 | 158(41,5) | 157(40,9) | 75 (39,5) | 390 (40,8) | |
| 65-74 | 168(44,1) | 183 (47,7) | 93 (48,9) | 444 (46,5) | |
| >75 | 55 (14,4) | 44(11,5) | 22(11,6) | 121 (12,7) | |
| Среднее ± SD | 65,8 ± 7,70 | 65,9 ±7,41 | 66,0 ±7,37 | 65,8 ±7,51 | |
| Среднее | 66,0 | 66,5 | 67,0 | 67,0 | |
| Минимум-Максимум | 50-87 | 50-85 | 50-81 | 50-87 | 0,957 |
| Расовая принадлежность, n (%) | |||||
| Европеоиды | 381 (100,0) | 384 (100,0) | 190 (100,0) | 955 (100,0) | Определить невозможно |
| Индекс массы тела, кг/м2, n (%) | |||||
| <25 | 84 (22,0) | 109 (28,4) | 46 (24,2) | 239 (25,0) | |
| 25-29 | 238 (62,5) | 214(55,7) | 118(62,1) | 570 (59,7) | |
| ≥30 | 59(15,5) | 61 (15,9) | 25 (13,2) | 145 (15,2) | 0,624 |
| Общий балл по опроснику IPSS | |||||
| Среднее ± SD | 19,1 ±4,23 | 18,9 ±4,37 | 19,3 ±4,33 | 19,1 ±4,30 | |
| Среднее | 19,0 | 18,0 | 19,0 | 18,0 | |
| Интервал | 13-33 | 8-33 | 13-35 | 8-35 | 0,517 |
| Балл IPSS по подшкале накопления мочи | |||||
| Среднее ± SD | 7,9 ± 2,49 | 7,9 ±2,51 | 8,0 ± 2,64 | 7,9 ±2,53 | |
| Среднее | 8,0 | 8,0 | 8,0 | 8,0 | |
| Интервал | 1-15 | 0-15 | 1-15 | 0-15 | 0,836 |
| Балл IPSS по подшкале нарушения опорожнения мочевого пузыря | |||||
| Среднее ± SD | 11,3 ± 3,13 | 11,0 ±3,27 | 11,3 ±3,22 | 11,2 ±3,20 | |
| Среднее | 11,0 | 11,0 | 11,0 | 11,0 | |
| Интервал | 2-20 | 3-20 | 4-20 | 2-20 | 0,481 |
| Качество жизни, связанное с симптомами нарушения мочевых путей, n (%) | |||||
| Прекрасное (Delighted) | 0 (0,0) | 3 (0,8) | 0 (0,0) | 3 (0,3) | |
| Хорошее (Pleased) | 2 (0,5) | 6(1,6) | 0 (0,0) | 8 (0,8) | |
| В целом удовлетворительное (Mostly satisfied) | 27(7,1) | 23 (6,0) | 12 (6,3) | 62 (6,5) | |
| Смешанное (Mixed) | 98 (25,7) | 105 (27,3) | 44 (23,2) | 247 (25,9) | |
| В целом неудовлетворительное (Mostly dissatisfied) | 140 (36,7) | 135 (35,2) | 65 (34,2) | 340 (35,6) | |
| Плохое (Unhappy) | 98 (25,7) | 95 (24,7) | 57 (30,0) | 250 (26,2) | |
| Ужасное (Terrible) | 16 (4,2) | 17 (4,4) | 10 (5,3) | 43 (4,5) | |
| Оценка не дана | 0 (0,0) | 0 (0,0) | 2(1,1) | 2 (0,2) | |
| Среднее ± SD | 3,9 ±1,01 | 3,9 ±1,09 | 4,0 ±1,00 | 3,9 ±1,04 | |
| Среднее | 4,0 | 4,0 | 4,0 | 4,0 | |
| Интервал | 1-6 | 0-6 | 2-6 | 0-6 | 0,141 |
| Скорость тока мочи Qmax, мл/с | |||||
| Среднее ± SD | 10,78 ± 2,726 | 10,27 ±2,726 | 10,32 ±2,816 | 10,49 ±2,752 | |
| Среднее | 11,00 | 10,20 | 10,60 | 10,60 | |
| Интервал | 4,0-28,3 | 4,0-20,8 | 4,6-15,0 | 4,0-28,3 | 0,026 |
| ИМТ – индекс массы тела; IPSS = Международный индекс симптомов при заболеваниях простаты; Qmax = максимальная скорость мочетока; SD = стандартное отклонение. |
|||||
3.3. Результаты исследования эффективности
3.3.1. Изменение общего балла международного индекса симптомов при заболеваниях простаты (первичного параметра эффективности) по сравнению с начальным уровнем
Изменение общего балла IPSS (вопросы 1-7) в разных группах пациентов по сравнению с начальным уровнем, а также различия после активной терапии и использования плацебо представлены в табл. 2 и на рис. 2 соответственно.
Таблица 2. Изменение общего балла Международного индекса симптомов при заболеваниях простаты
| Силодозин, 8 мг | Тамсулозин, 0,4 мг | Плацебо | |
| ITT-популяция | n = 371 | n = 376 | n = 185 |
| Начальный уровень, среднее ± SD | 19±4 | 19 ±4 | 19 ±4 |
| Изменение между начальным и конечным уровнями, скорректированные средние величины | -7,0 | -6,7 | -4,1 |
| Расхождение между активной терапией против плацебо (95% CI) | -2,3 (-3,2; -1,4)а | -2,0 (-2,9; -1,1)а | - |
| Расхождение для тамсулозина и силодозина (95% ДИ) | 0,3 (-0,4; 1,0)b | - | - |
| РР-популяция | n = 346 | n = 347 | n = 168 |
| Начальный уровень, среднее ± SD | 19±4 | 19 ±4 | 19 ±4 |
| Изменение между начальным и конечным уровнями, скорректированные средние величины | -7,0 | -6,7 | –4,8 |
| Расхождение между активной терапией против плацебо (95% ДИ) | -2,2 (-3,2; -1,3)а | -1,9 (-2,8; -0 9)а | - |
| Расхождение для тамсулозина и силодозина (95% ДИ) | 0,4 (-0,4; 1,1)b | - | - |
ДИ = доверительный интервал; ITT = пациенты, удовлетворившие начальным критериям в соответствии с опросником IPSS и успешно прошедшие не менее одной последующей проверки; РР = все пациенты, завершившие исследование без нарушений протокола; SD = стандартное отклонение. aр b Не меньшая эффективность
Рис. 2. Расхождения в общем балле Международного индекса симптомов при заболеваниях предстательной железы по сравнению с плацебо
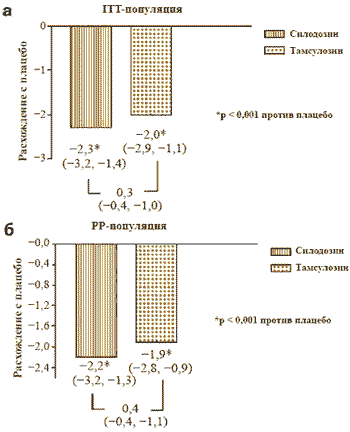
ITT = пациенты, удовлетворившие начальным критериям в соответствии с опросником IPSS и успешно прошедшие не менее одной последующей проверки; PP = все пациенты, завершившие исследование без нарушений протокола
Во всех группах ответ на лечение не выходил на фазу плато. Однако максимальное снижение общего балла IPSS происходило очень быстро в течение первых двух недель после начала лечения. Как в ITT-, так и в РР-популяциях во всех контрольных точках наблюдали более высокую эффективность активных режимов терапии по сравнению с плацебо, и при этом изменения были статистически значимыми (р 3.3.2. Частота ответа на лечение на основании общего балла IPSS
Во всех трех группах наблюдали непрерывное увеличение количества пациентов, ответивших на лечение на основании общего балла IPSS между началом и 12-й неделей терапии. В конечной точке исследования улучшение наблюдали у 66,8 и 65,4% пациентов, получавших силодозин и тамсулозин соответственно, при этом аналогичный показатель в группе пациентов, получавших плацебо, составил 50,8%.
Различие данных, полученных в результате активной терапии по сравнению с плацебо, было высоко статистически значимым (р 3.3.3. Баллы по подшкалам накопления мочи и опорожнения мочевого пузыря
В табл. 3 представлено среднее изменение баллов по подшкалам накопления мочи (вопросы 2,4 и 7) и опорожнения мочевого пузыря (вопросы 1, 3, 5 и 6) за время исследования. Во всех контрольных точках наблюдали статистически значимое отличие эффективности обоих режимов активной терапии по сравнению с плацебо в лучшую сторону. При сравнении силодозина и тамсулозина статистически значимых различий выявлено не было, несмотря на то, что балл подшкалы накопления мочи по IPSS для силодозина был несколько выше. Необходимо отметить, что в подгруппе пациентов с никтурией перед началом исследования (n = 764) наиболее значимое уменьшение проявления никтурии по сравнению с плацебо показал силодозин (изменение на -0,9; -0,8 и -0,7 по сравнению с начальным уровнем для силодозина, тамсулозина и плацебо соответственно; для пары силодозин-плацебо p = 0,013. для пары силодозин-тамсулозин р = 0,314).
Таблица 3. Изменения баллов в подпунктах «накопление мочи» и «мочеиспускание» по Международному индексу симптомов при заболеваниях простаты
| Группа | Нарушение накопления мочи, балл по IPSS | Нарушение мочеиспускания, балл по IPSS | ||
| Изменение по сравнению с начальным уровнем | Расхождение по сравнению с плацебо (95% CI) | Изменение по сравнению с начальным уровнем | Расхождение по сравнению с плацебо (95% ДИ) | |
| Силодозин | -2,5 | –0,7 a (–1,1; –0,2) | –4,5 | –1,7 b (–2,2; –1,1) |
| Тамсулозин | -2,4 | –0,6 a (–1,1; –0,2) | –4,2 | –1,4 b (–2,0; –0,8) |
| Плацебо | -1,8 | –2,9 | ||
3.3.4. Качество жизни
Во всех группах пациентов, получавших лечение по причине наличия симптомов мочевых путей, наблюдали более выраженное улучшение качества жизни по сравнению с начальным уровнем (вопрос 8 опросника IPSS): -1,1 для силодозина, -1,1 для тамсулозина и -0,8 для плацебо. Во всех контрольных точках наблюдали высоко статистически значимые различия между результатами для активной терапии и приема плацебо, которые в конечной точке составили р = 0,002. После окончания исследования доля пациентов с отрицательным (в целом неудовлетворительное, плохое. ужасное) качеством жизни вследствие наличия симптомов мочевых путей в группах силодозина и тамсулозина стало меньше более чем на 50% (от 66,9% до 34,0% и от 64,1% до 29,0% соответственно) и лишь на 1/3 — в группе плацебо (от 69,7% до 45,4%) (табл. 4).
Таблица 4. Обобщенные данные по качеству жизни пациентов с нарушением мочевых путей
| Силодозин, количество (%) | Тамсулозин, количество (%) | Плацебо, количество (%) |
|
| Исходный уровень | |||
| Прекрасное, хорошее или в целом удовлетворительное | 29 (7,8) | 32 (8,5) | 12 (6,5) |
| Смешанное: удовлетворительное и неудовлетворительное примерно в равной степени | 94 (25,3) | 103 (27,4) | 43 (23,2) |
| В целом неудовлетворительное, плохое или ужасное | 248 (66,9) | 241 (64,1) | 129 (69,7) |
| 12-я нед.а | |||
| Прекрасное, хорошее или в целом удовлетворительное | 163 (44,0) | 168 (44,7) | 63 (34,0) |
| Смешанное: удовлетворительное и неудовлетворительное примерно в равной степени | 82(22,1) | 99 (26,3) | 38 (20,5) |
| В целом неудовлетворительное, плохое или ужасное | 126 (34,0) | 109 (29,0) | 84 (45,4) |
| aАнализ данных на 12-й нед. проводили на основании последних полученных результатов. | |||
3.3.5. Максимальная скорость потока мочи
В обеих группах пациентов, получавших активную терапию, наблюдали значительный рост Qmax по сравнению с группой плацебо, однако это увеличение не было статистически значимым. Скорректированная средняя величина изменения между начальным и конечным уровнями составила 3,77 мл/с для силодозина (р = 0,089 по сравнению с плацебо); 3,53 мл/с для тамсулозина (р = 0,221 по сравнению с плацебо) и 2,93 мл/с для плацебо. Доля пациентов, у которых наблюдали увеличение Qmax , была выше в группах, получавших терапию силодозином и тамсулозином, по сравнению с группой плацебо. Однако для обеих получавших терапию групп пациентов статистически значимые различия по сравнению с плацебо в контрольных точках были единичными вследствие высокого результата, продемонстрированного плацебо. В конечной точке исследования доля пациентов, ответивших на лечение, составила 46,6% (р = 0,155 по сравнению с плацебо) и 46,5% (р = 0,141 по сравнению с плацебо) для групп, получавших силодозин и тамсулозин, и 40,5% для группы, получавшей плацебо. Данное различие не являлось статистически значимым.
3.4. Результаты исследования безопасности препарата
3.4.1. Возникшие во время лечения нежелательные явления
В группе, получавшей силодозин, у 34,9% (133 из 381) пациентов наблюдали не менее одного ТЕАЕ, у 28,9% (111 из 384) — в группе, получавшей тамсулозин, и у 24,2% (46 из 190) — в группе, получавшей плацебо (в паре силодозин-плацебо: р = 0,0094; силодозин-тамсулозин: р = 0,0749). В число наиболее распространенных ТЕАЕ (> 2%) вошли следующие нежелательные явления: снижение или отсутствие эякуляции при оргазме (в медицинском словаре нормативно-правовой деятельности данные эффекты объединены под термином «ретроградная эякуляция») и головная боль. Ретроградную эякуляцию наблюдали у 14,2% (54 из 381) пациентов, принимавших силодозин, что значительно превышало аналогичные показатели в группах пациентов, принимавших тамсулозин и плацебо (соответственно 2,1% (6 из 384) и 1,1% (2 из 190)). Данный термин включал следующие понятия: оргазм без семяизвержения, снижение качества эякулята и собственно ретроградную эякуляцию. В группе пациентов, получавших тамсулозин, частота возникновения головной боли в качестве нежелательного явления была выше (5,5%; 21 из 384) по сравнению с группой пациентов, принимавших силодозин (2,9%; 11 из 381). Однако данное значение было сопоставимым с частотой головных болей в группе пациентов, получавших плацебо (4,7%; 9 из 190).
Доля пациентов, прервавших лечение по причине ТЕАЕ, была небольшой и не была статистически различной для разных групп (силодозин 2,1% — 8 пациентов; тамсулозин 1,0% — 4 пациента; плацебо 1,6% — 3 пациента). Наиболее частой причиной досрочного прерывания лечения было отсутствие эякуляции (5 пациентов в группе силодозина и 1 в группе тамсулозина). Данное нежелательное явление носило обратимый характер и исчезало после прекращения терапии.
У 9 пациентов из 955 (0,9%) наблюдали ТЕАЕ серьезной степени тяжести, 3 из которых могли быть связаны с использованием исследуемого препарата: рак предстательной железы и наджелудочковая аритмия (силодозин), а также беспокойство (тамсулозин). За время проведения исследования было зарегистрировано 2 случая летального исхода, оба из которых никак не связаны с исследуемыми препаратами.
3.4.2. Прочие параметры безопасности
Ни в одной группе пациентов за время проведения исследования клинически значимых изменений лабораторных параметров, основных физиологических показателей или ЭКГ зарегистрировано не было. В табл. 5 представлены значения ДАД, САД и ЧП в положении лежа на спине, а также изменения этих показателей в результате приема препаратов силодозин, тамсулозин и плацебо по сравнению с начальным уровнем. При использовании препарата силодозин клинически релевантных или статистически значимых расхождений по сравнению с плацебо отмечено не было. Важной характеристикой препарата является отсутствие клинически релевантных или статистически значимых изменений артериального давления или ЧП по сравнению с приемом плацебо, тогда как при приеме препарата тамсулозин было отмечено небольшое, но статистически значимое расхождение данных параметров по сравнению с плацебо.
Таблица 5. Артериальное давление в положении лежа на спине
| Силодозин, 8 мг (n = 381) |
Тамсулозин, 8 мг (n = 384) |
Плацебо (n = 190) |
|
| Систолическое артериальное давление в положении лежа на спине | |||
| Исходный уровень (среднее ± SD) | 133,8(12,61) | 133,0(13,29) | 132,8(13,57) |
| CFB в конечной точке (скорректированные средние значения) | -1,8 | -2,2 | -0,4 |
| Расхождения между активной терапией и плацебо (95% CI) | -1,4 (-3,0;-0 1) | -1,4 (-3,0;-0,1) | - |
| Значение р против плацебо | 0,075 | 0,022 | - |
| Расхождение между тамсулозином и силодозином (95% CI) | -0,4 (-1,7;-0 9) | - | - |
| Значение р против тамсулозина | 0,536 | ||
| Диастолическое артериальное давление в положении лежа на спине | |||
| Начальный уровень (среднее ± SD) | 80,6 (7,47) | 80,5 (7,99) | 80,6 (7,70) |
| CFB в конечной точке (скорректированные средние значения) | -1,0 | -1,6 | -0,6 |
| Расхождения между активной терапией и плацебо (95% CI) | -0,3 (-1,4; 0,7) | -1,0 (-2,1; 0,0) | - |
| Значение р против плацебо | 0,515 | 0,060 | - |
| Расхождение между тамсулозином и силодозином (95% CI) | -0,7 (-1,5; 0,2) | - | - |
| Значение р против тамсулозина | 0,132 | - | - |
| Частота пульса в положении лежа на спине | |||
| Начальный уровень (среднее ± SD) | 67,4 (8,83) | 67,8 (9,10) | 67,3 (8,43) |
| CFB в конечной точке (скорректированные средние значения) | 0,8 | 1,3 | 1,1 |
| Расхождения между активной терапией и плацебо (95% CI) | -0,3 (-1,6; 1,0) | -0,2 (-1,1; 1,5) | - |
| Значение р против плацебо | 0,643 | 0,753 | - |
| Расхождение между тамсулозином и силодозином (95% CI) | 0,5 (-0,5; 1,5) | - | - |
| Значение р против тамсулозина | 0,340 | - | - |
| CFB = изменение по сравнению с начальным уровнем; ДИ = доверительный интервал; SD = стандартное отклонение. | |||
При проведении ортостатической пробы среди пациентов, прошедших рандомизацию и принявших первую дозу препарата, заметного снижения артериального давления не наблюдали ни у одного из пациентов. В обеих группах пациентов, получавших активную терапию, увеличение ЧП до значения > 20 уд./мин наблюдали лишь у нескольких пациентов, при этом клинически значимых изменений САД или ДАД отмечено не было.
4. Обсуждение
В данном когортном исследовании с мощным статистическим обоснованием проводили оценку эффективности и безопасности нового высокоселективного препарата силодозин, являющегося блокатором а1А-адренорецепторов, для лечения СНМП вследствие ДГПЖ средней и тяжёлой степени. Была отобрана группа пациентов с СНМП вследствие ДГПЖ в соответствии с возрастом, наличием сопутствующих заболеваний и используемым при терапии препаратом. В этой группе приблизительно 60%о пациентов были пожилого возраста, около 57% пациентов получали сопутствующую антигипертензивную терапию. Исследование показало, что силодозин является эффективным средством терапии СНМП вследствие ДГПЖ с нарушениями накопления мочи и опорожнения, поскольку расхождение общего балла IPSS, баллов по подшкалам накопления мочи и опорожнения мочевого пузыря, а также качества жизни вследствие наличия нарушений мочевыводящих путей было статистически значимым и клинически релевантным для групп пациентов, получавших данный препарат и плацебо. Улучшение стало заметным вскоре после начала проведения терапии. Эффективность силодозина была как минимум эквивалентной (а в абсолютных значениях параметров значительно превосходила) эффективности тамсулозина при учете изменения общего балла IPSS, баллов по подшаклам накопления и опорожнения мочевого пузыря, количества пациентов, достигших улучшения состояния даже в том случае, если эти различия не были статистически значимыми. При сравнении параметра качества жизни в группах пациентов, получавших активную терапию препаратами силодозин или тамсулозин, и группой пациентов, получавших плацебо, эффективность активной терапии была более высокой.
Необходимо отметить, что селективное действие исследуемого антагониста а1А-рецепторов является клинически более эффективным для лечения нарушений как мочеиспускания, так и накопления мочи. Также примечательно, что силодозин был более эффективен в отношении никутрии по сравнению с тамсулозином. Однако механизм действия на никтурию до конца не выяснен.
В данном исследовании терапия препаратом силодозин приводила крайнему и продолжительному увеличению максимальной скорости потока мочи Qmax. Тем не менее расхождение данного параметра в сравнении с плацебо не было статистически значимым. Для активного препарата сравнения тамсулозина, значимость расхождения для которого по сравнению с плацебо была подтверждена ранее, скорость потока мочи была того же порядка. Первое рандомизированное двойное слепое исследование препарата силодозин с контролем плацебо было проведено в Японии. В нем участвовали мужчины в возрасте ≥ 50 лет, у которых общий балл вопросника IPSS составил ≥ 8, а параметр QoL ≥ 3. Пациенты были рандомизированы на 3 группы. Пациенты первой группы в течение 12 нед. получали 4 мг силодозина 2 раза в день, второй — 0,2 мг тамсулозина один раз в день (дозировки лекарственных препаратов в Японии и в США различаются), а третьей группы — плацебо 15. Первичной конечной точкой исследования являлось изменение общего балла IPSS по сравнению с начальным уровнем. Всего было рандомизировано 457 пациентов (176 — группа, получавшая силодозин, 192 — группа, получавшая тамсулозин, и 89 — группа, получавшую плацебо). Изменение общего балла IPSS по сравнению с начальным уровнем для групп пациентов, получавших препараты силодозин, тамсулозин и плацебо, составило -8,3; -6,3 и -5,3 соответственно. Начиная с 1-й недели в группе, получавшей силодозин, наблюдали значительное снижение общего балла IPSS по сравнению с плацебо, а начиная со 2-й недели — по сравнению с тамсулозином. В подгруппе пациентов с серьезной степенью тяжести заболевания (IPSS ≥ 20) эффективность терапии силодозином также была значительно выше по сравнению с плацебо (-12,4 против -8,7). Частота развития нежелательных явлений составила 88,6%, 82,3% и 71,6% соответственно, из них 69,7%, 47,4% и 36,4% были связаны с применением препарата. Наиболее распространенные нежелательные явления в группе пациентов, получавших силодозин, включали аномальную эякуляцию, которую наблюдали значительно чаще в группе пациентов, получавших силодозин, по сравнению с группой пациентов, получавших тамсулозин (22,3 против 1,6%). Тем не менее лишь 5 участников (2,9%) прекратили участие в исследовании по причине аномальной эякуляции.
В рамках двух рандомизированных исследований III фазы с плацебо-контролем, проведенных в США, была проведена оценка эффективности и безопасности применения препарата силодозин в дозе 8 мг для лечения ДГПЖ16. Общее количество пациентов составило 457 человек, средний возраст которых был 65 лет. Из них 466 пациентов получали силодозин (8 мг/сут.) во время завтрака в течение 12 нед., а 457 пациентов получали плацебо. Через 0,5 нед. (3-4 сух) после начала лечения у пациентов, получавших силодозин, наблюдали значительное улучшение показателей по общему баллу IPSS (расхождение -1,9;р 17.
В ходе долгосрочного 40-недельного открытого расширенного исследования с участием пациентов из двух вышеупомянутых исследований все участники ежедневно во время завтрака получали 8 мг силодозина 18. Основная цель данного исследования состояла в оценке безопасности препарата. Общее количество участников составляло 661, из них 435 (65,8%) завершили исследование. При этом у 431 участника (65,2%) были отмечены 924 случая проявления нежелательных явлений. Наиболее часто наблюдаемые нежелательные явления включали ретроградную эякуляцию (20,9% пациентов), диарею (4,1% пациентов) и назофарингит (3,6%). У 2,6 и 2,9% пациентов отмечали ортостатическую гипотензию и головокружение. Пациентов предварительно разделили на группы, которые получали двойную слепую терапию (плацебо или силодозином). Доля пациентов с ТЕАЕ была выше у впервые принимавших силодозин пациентов (ранее они получали терапию плацебо, 71,5%) по сравнению с группой пациентов, продолжающих терапию данным препаратом (58,3%). Среди пациентов, прекративших участие в исследовании по причине ретроградной эякуляции, 7,5% получали препарат впервые, а 1,9% уже получали препарат ранее. Среднее изменение балла IPSS (среднее отклонение) на 40-й неделе (число зарегистрированных случаев) по сравнению с начальным уровнем (спустя 12 нед. после проведения предыдущей двойной слепой терапии) составило -4,5 (6,7) для пациентов, получавших силодозин впервые (р Поскольку эффективности препаратов тамсулозин и силодозин очень близки, возникает вопрос о том, имеет ли силодозин какие-либо дополнительные преимущества. На основании результатов недавно проведенных исследований было сделано предположение, что силодозин оказывает меньше нежелательных эффектов на сердечнососудистую систему по сравнению с тамсулозином при применении только силодозина или комбинировании его с другими препаратами (которые влияют на артериальное давление). Данный эффект силодозина связан с его высокой селективностью к разным подтипам адренорецепторов, что особенно важно при использовании препарата пожилыми пациентами.
В работе Kobayashi et al. 19 представлены доказательства высокой селективности силодозина. Исследователи оценивали эффективность препаратов силодозин (антагонист а1А-рецепторов) и тамсулозин (антагонист a1A+1D-рецепторов) в отношении уретры (интрауретральное давление) и сердечно-сосудистой системы (гипотензия) у собак с прогрессирующей ДГПЖ. Под наркозом измеряли рост интрауретрального давления, вызванный стимуляцией подчревного нерва, а также среднее артериальное давление. Собакам внутривенно вводили каждый препарат с увеличением дозы. Силодозин (0,3-300 мкг/кг) дозозависимо ингибировал рост интрауретрального давления, вызванный стимуляцией подчревного нерва (без значительных гипотензивных эффектов) у молодых и старых собак с ДГПЖ. Тамсулозин (0,3-300 мкг/кг) также дозозависимо ингибировал увеличение интрауретрального давления в обеих группах, однако его гипотензивный эффект был значительно выше в группе старых собак с ДГПЖ, чем молодых собак с аналогичным заболеванием. Влияние силодозина на интрауретральное давление было сопоставимо для обеих групп, но при этом препарат не оказывал значимого гипотензивного действия. Авторы пришли к выводу, что, если экстраполировать полученные данные на мужчин, силодозин может быть безопасным и эффективным препаратом для лечения СНМП у пациентов всех возрастных групп.
В рамках открытого перекрестного исследования с контролем плацебо, в котором оценивали возможность взаимодействия с ингибитором фосфодиэстеразы20,22 здоровых мужчины в возрасте 45-78 лет получали 8 мг силодозина в течение 21 дня. На 7, 14 и 21-й дни участники исследования случайным образом получали однократную дозу препаратов силденафил (100 мг), тадалафил (20 мг) или плацебо. Перед началом исследования (начальный уровень) и спустя 1-12 ч после введения однократной дозы соответствующих препаратов были сделаны ортостатические пробы. Одновременный прием здоровыми мужчинами силодозина и препаратов силденафил или тадалафил в максимальных терапевтических дозах не приводил к клинически значимым ортостатическим изменениям артериального давления или ЧП, а также не вызывал ортостатических нарушений. Наиболее часто возникающий при проведении терапии силодозином нежелательный эффект — эякуляторная дисфункция, включающая один из следующих симптомов: оргазм с пониженным качеством семени; оргазм с пониженной интенсивностью семяизвержения или оргазм без семяизвержения.
Хотя мнение о том, что эякуляторная дисфункция является результатом воздействия на шейку мочевого пузыря, широко распространено среди клиницистов, эякуляторная дисфункция представляет собой не ретроградную эякуляцию, а скорее отсутствие эякуляции в результате воздействия на «эякуляторный аппарат» (предстательную железу, семенные пузырьки и семенные протоки). Таким образом, использованный в нескольких клинических исследованиях термин «ретроградная эякуляция» некорректен21. На протяжении многих лет исследователи считали семенные протоки идеальной фармакологической моделью для а1А-рецептора22. Хотя нельзя исключать тот факт, что клинические расхождения в действии силодозина и тамсулозина по сравнению с другими антагонистами a1-адренорецепторов связаны не только с селективностью этих препаратов к подтипам адренорецепторов23, необходимо также учитывать дополнительные свойства данных препаратов, например, непреодолимый антагонизм в семенных протоках 24 или дополнительное действие на прочие рецепторные системы (дофамин и / или серотонин) 25. Наконец, было сделано предположение, что основная регуляция аномальной эякуляции происходит не на уровне семенных протоков, а в участках центральной нервной системы, регулирующей функцию эякуляции26.
Это нежелательное явление антагонистов a1 -адренорецепторов, особенно для препаратов с селективностью к а1А-адренорецепторам, наблюдают наиболее часто, поскольку данный подтип альфа-адренорецепторов распределен в органах, участвующих в фазе эмиссии 27. В рамках неклинических исследований было показано, что a-адренорецепторы (особенно а1А-адренорецепторы) жизненно важны для физиологического сокращения семенных протоков и доставки спермы из семенников в уретру 28. Снижение интенсивности семяизвержения связано с нарушением функции семенных протоков, а не с изменением образования семени и количества семенных протоков 29. При этом не возникает угрозы безопасности, поскольку снижен лишь объем семени, что является обратимым процессом, так как нормализация эякуляции восстанавливается в течение нескольких дней после окончания терапии30,31. Пациенты не считают данное проявление тягостным: во всех группах данного исследования доля прекративших участие в терапии по этой причине была очень низкой и сопоставимой с группой плацебо.
На данный момент установлено, что развитие эякуляторной дисфункции обычно связано как с возрастом пациента, так и с наличием СНМП 32-35. Результаты многонационального анализа у мужчин пожилого возраста-7 (Multinational Survey of the Aging Male-7) подтвердили значительную зависимость между СНМП и эякуляторной дисфункцией у мужчин пожилого возраста.
Ретроспективный анализ исследований препарата силодозин, проведенных в странах Северной Америки16, позволил заключить, что эякуляторная дисфукция может быть прогностическим фактором блокирования a1-адренорецепторов. В работе Roehrborn et al. было обнаружено, что эякуляторная дисфункция была нежелательным явлением при лечении у 28,1 % участников исследований, причем уровень улучшения СНМП в этой группе пациентов был значительно выше, чем в группе пациентов без этого нежелательного явления. Увеличение максимальной скорости оттока мочи также было клинически значимым36. В работе Homma et al.37 был проведен аналогичный анализ и сделана оценка улучшений состояния пациентов по данным исследования, проведенного в Японии 15. В группе пациентов с отсутствием эякуляции, которые получали силодозин, наблюдали более существенное снижение общего балла IPSS по сравнению с пациентами, у которых ухудшения эякуляторной функции не происходило, а также подгруппой плацебо (соответственно -11,8 против -7,2 против -5,3). Представляет интерес тот факт, что частота выбывания получавших силодозин пациентов в обеих группах была практически одинаковой.
Как и следовало ожидать для препарата с высокой уроселективностью, силодозин безопасен, при этом по эффективности он не уступает тамсулозину. Основным преимуществом силодозина является отсутствие нежелательных явлений со стороны сердечно-сосудистой системы. При измерении артериального давления в положении лежа на спине и при проведении ортостатической пробы показано, что препарат не оказывает клинически релевантного действия на артериальное давление. Данный факт важен, поскольку основную долю пациентов, проходящих лечение против СНМП вследствие ДГПЖ, составляют пожилые мужчины, которые нередко также получают сопутствующую антигипертензивную терапию или такие препараты, как ингибиторы фосфодистеразы. При проведении ЭКГ или лабораторных анализов, включая исследование функции печени и определение уровня креатинина и глюкозы, неблагоприятных эффектов препарата выявлено не было.
5. Заключение
В данном большом мультинациональном исследовании подтверждены результаты более ранних работ, в которых была показана эффективность и безопасность препарата силодозин для лечения нарушений мочеиспускания и накопления мочи у пациентов с доброкачественным увеличением предстательной железы вследствие ПВО, вызванной ДГПЖ. Силодозин может быть особенно полезным для терапии пожилых пациентов, у которых велика вероятность взаимодействия препаратов друг с другом, и потому возможность нежелательных явлений со стороны сердечно-сосудистой системы должна быть сведена к минимуму.
Вклад авторов: Christopher R. Chappie располагает всеми данными, полученными в этом исследовании, и отвечает за целостность информации и точность проведения анализа.
Концепция и план исследования: Chappie, Montorsi. Отбор данных: Chappie, Montorsi, Tammela, Wirth, Koldewijn, Fernandez Fernandez.
Анализ и интерпретация данных: Chappie, Montorsi, Tammela, Wirth, Koldewijn, Fernandez Fernandez.
Написание чернового варианта работы: Chappie, Montorsi, Tammela, Wirth, Koldewijn, Fernandez Fernandez.
Рецензирование работы: Chappie, Montorsi, Wirth, Koldewijn, Fernandez Fernandez.
Проведение статистического анализа: Нет. Получение финансирования: Нет.
Оказание административной, технической или материальной поддержки: Нет.
Контроль: Нет. Прочее (указать): Нет.
Финансовая незаинтересованность: Конфликты интересов, включая особые финансовые интересы и принадлежность авторов к каким-либо организациям, имеющим отношение к теме данного исследования или обсуждаемым препаратам (трудоустройство в компании, получение грантов или финансовой поддержки, консультационные услуги, гонорары, владение акциями, проведение экспертных заключений, компенсации, а также наличие заявок на патенты в стадии рассмотрения или полученных патентов): Christopher R. Chappie и Francesco Montorsi оказывают консультационные и научно-исследовательские услуги компании Recordati. Teuvo L.J. Tammela, Manfred Wirth, Evert Koldewijn и Eldiberto Fernandez Fernandez оказывают научно-исследовательские услуги компании Recordati.
Финансовая поддержка и роль организаций, ее оказывающих:
Представители компании Recordati Ireland Ltd (Рингаскидди, графство Корк, Ирландия) участвовали в составлении плана исследования и его проведении; отборе, анализе и интерпретации данных, а также подготовке отчета и утверждении его окончательной версии.
Благодарности: Авторы благодарят главного руководителя клинического проекта Dr. Massimo Casi за неоценимую помощь в написании окончательной версии работы.
Приложение А. Полный список участников исследования
Финляндия: Т. Forsell (Котка); P. Hellstrom (Ойс); М. Multanen (Коувола); T.L.J. Tammela (Тампере) ЛИТЕРАТУРА
Франция: Н. Botto (Сюрен); D. Chevallier (Ницца)
Германия: F. Konig (Берлин); М. Schulze (Марклеберг); J. Willgerodt (Лейпциг); М. Wirth (Дрезден); A. Von Keitz (Марбург)
Италия: F. Gaboardi (Милан); V. Gentile (Рим); М. Motta (Катания); P. Rigatti (Милан); R.M. Scarpa (Орбассано); 0. Risi (Тревильо)
Нидерланды: Е. Koldewijn (Эйндховен); Е. Meuleman (Амстердам); V. Van de Walle (Ситтард-Гелен)
Польша: P. Chlosta (Кельце); В. Darewicz (Белосток); A. Dobrowolski (Мысловице); W. Dudziak (Сьрем); A. Gajda (Варшава); P. Wedzikowski (Лодзь); R. Jarema (Варшава); R. Szwedowski (Ополе); J. Szyperski (Быдгощ); P. Trypens (Варшава); М. Wyczolkowski (Краков)
Румыния: F. Bajan (Питешти); N. Calomfirescu (Бухарест); М. Dinu (Бухарест); С. Gingu (Бухарест); V. Jinga (Бухарест); С. Nitoiu (Бухарест)
Россия: S. Al-Shukri (Санкт-Петербург); VP. Avdoshin (Москва); LA. Gorelov (Санкт-Петербург); I.S. Gorelov (Санкт-Петербург); VK. Kheifets (Санкт-Петербург); BV. Kunin (Санкт-Петербург); V.I. Kuzmin (Санкт-Петербург); О.В. Loran (Москва); Е.В. Mazo (Москва); L.S. Mikhailov (Санкт-Петербург); I. Sedavnykh (Санкт-Петербург); AV Shanava (Санкт-Петербург); VN. Shirshov (Москва); V.N. Surikov (Москва); A. Zhivov (Санкт-Петербург); М. Forkampf-Laue (Санкт-Петербург)
Испания: J. Caballero Alcantara (Марбелья); Е. Leon Duenas (Севилья); Е. Fernandez Fernandez (Мадрид); J.M. Fernandez Gomez (Овьедо); F. Jimenez Cruz (Валенсия); J.A. Portillo Martin (Сантандер)
Украина: A.A. Lyulko (Запорожье); AV. Lyulko (Днепропетровск); I. Gorpynchenko (Киев); F. Kostyev (Одесса); V. Lesovoy (Харьков); S. Pasiechnikov (Киев); V. Pirogov (Киев); V Zaytsev (Черновцы)
Великобритания: C.R. Chappie (Шеффилд); S. Natale (Плимут); R. Persad (Бристоль); M. Speakman (Тонтон, Сомерсетг); A. Thorpe (Ньюкасл-на-Тайне)
1. Chappie С. Medical treatment for benign prostatic hyperplasia. BMJ 1992; 304 1198-9.
2. Clifford GM, Farmer RDT. Medical therapy for benign prostatic hyperplasia: a review of the literature. Eur Urol 2000; 38: 2-19
3. Barry MJ, Cockett AT, Holtgrewe HL, et al. Relationship of symptoms of prostatism to commonly used physiological and anatomical measures of the severity of benign prostatic hyperplasia. JUrol 1993; 150: 351-8
4. Peters TJ, Donovan XL, Kay HE, et al. The International Continence Society "Benign Prostatic Hyperplasia" Study: the botherosomeness of urinary symptoms. J Urol 1997; 157: 885-9.
5. Madersbacher S, Alivizatos G, Nordling J, Rioja Sans C, Emberton M, de la Rosette JJMCH. EAU 2004 guidelines on assessment, therapy and follow-up of men with lower urinary tract symptoms suggestive of benign prostatic obstruction (BPH guidelines). Eur Urol 2004; 46: 547-54.
6. Lepor H. Alpha blockers for the treatment of benign prostatic hyperplasia. Rev Urol 2007; 9: 181-90.
7. Chappie CR. Pharmacological therapy of benign prostatic hyperplasia/lower urinary tract symptoms: an overview for the practicing clinician. BJU Int 2004; 94: 738-44.
8. Lepor H, Auerbach S, Puras-Baez A, et al. A randomised, placebo controlled multicenter study of the efficacy and safety of terazosin in the treatment of benign prostatic hyperplasia. JUrol 1992; 148: 1467-74.
9. Chappie CR, Carter P, Christmas TJ, et al. A three-month doublebhnd study of doxazosin as treatment for benign prostatic bladder outlet obstruction. J Urol 1994; 74: 50-6.
10. Michel MC, Gru bbel B, Mo llhoff S, et al. 1-Adrenoceptor affinities of drugs for the treatment of benign prostatic hyperplasia in human prostate, rat tissues and at cloned subtypes. Abstract presented at: 23rd Congress of the Societe Internationale d'Urologie; September 18-24, 1994; Sydney, Australia. Abstract 649.
11. Hatano A, Takahashi H, Tamaki M, Komeyama T, Koizumi T, Takeda M. Pharmacological evidence of district a ^adrenoceptors subtypes mediating the contraction of human urethra and peripheral artery. Br J Pharmacol 1994; 113: 723-8.
12. Tatemichi S, Kobayashi K, Maezawa A, et al. a^Adenoceptor subtype selectivity and organ specificity of silodosin (KMD-3213). Yakugaku Zasshi 2006; 126: 209- 16.
13. Akiyama К, Нога М, Tatemichi S, et al. KMD-3213, a uroselective and long-acting alpha(la)-adrenoceptor antagonist, tested in a novel rat model. J Pharmacol Exp Ther 1999; 291: 81-91.
14. Akiyama K, Noto H, Nishizawa O, et al. Effect of KMD-3213, an alpha]A- adrenoceptor antagonist, on the prostatic urethral pressure and blood pressure in male decerebrate dogs. Int J Urol 2001; 8: 177-83.
15. Kawabe K, Yoshida M, Homma Y, Silodosin Clinical Study Group. Silodosin, a new alpha]Д-adrenoceptor-selective antagonist for treating benign prostatic hyperplasia: results of a phase III randomized, placebo-controlled, double-blind study in Japanese men. BJU Int 2006; 98: 1019-24.
16. Marks LS, Gittelman MC, Hill LA, Volmn W, Hoel G. Rapid efficacy of the highly selective alpha]A-adrenoceptor antagonist silodosin in men with signs and symptoms of benign prostatic hyperplasia: pooled results of 2 phase 3 studies. J Urol 2009; 181:2634-40.
17. Chappie C. Andersson KE Tamsulosin: an overview. World J Urol 2002; 19: 397-404.
18. Marks LS, Gittelman MC, Hill LA, Volmn W, Hoel G. Silodosm in the treatment of the signs and symptoms of benign prostatic hyperplasia: a 9-month, open-label extension study. Urology 2009; 74: 1318-22.
19. Kobayashi S, Tomiyama Y, Tatemichi S, Hoyano Y, Kobayashi M, Yamazaki Y. Effects of silodosin and tamsulosin on the urethra and cardiovascular system in young and old dogs with benign prostatic hyperplasia. Eur J Pharmacol 2009; 613: 135-40.
20. MacDiarmid SA, Hill LA, Volinn W, Hoel G. Lack of pharmacodynamic interaction of silodosin, a highly selective alphala-adrenoceptor antagonist, with the phosphodiesterase-5 inhibitors sildenafil and tadalafil in healthy men. Urology 2010; 75: 520-5.
21. van Dijk MM, de la Rosette JJMCH, Michel MC. Effects of alpha-1 adrenoceptor antagonists on male sexual function. Drugs 2006; 66: 287-301.
22. Furukawa K, Rosario DJ, Smith DJ, Chappie CR, Uchiyama T, Chess-Williams R. Alpha]A-adrenoceptor-mediated contractile responses of the human vas deferens. Br J Pharmacol 1995; 116: 1605-10.
23. Michel MC, Hanft G, GroB G. Functional studies on alpha-1-adrenoceptor subtypes mediating inotropic effects in rat right ventricle. Br J Pharmacol 1994; 111: 539-46.
24. Noble AJ, Chess-Williams R, Couldwell C, et al. The effects of tamsulosin, a high affinity antagonist at functional alA- and alD-adrenoceptor subtypes. Br J Pharmacol 1997; 120: 231-8.
25. Leonardi A, Hieble JP, Guarneri L, et al. Pharmacological characterization of the uroselective alpha-1 antagonist Rec 15/2739 (SB 216469): role of the alpha-lL adrenoceptor in tissue selectivity, part I. J Pharmacol Exp Ther 1997; 281: 1272-83.
26. Giuliano FA, Clement P, Denys P, Alexandre L, Bernabe J. Comparison between tamsulosin and alfuzosin on the expulsion phase of ejaculation in rats. BJU Int 2006; 98: 876-9.
27. Miller J, Carson CC. Alpha blockers and ejaculatory function: a state of the art review. Curr Sex Health Rep 2007; 4: 141-4.
28. Sanbe A, Tanaka Y, Fujiwara Y, et al. al-Adrenoceptors are required for normal male sexual function. Br J Pharmacol 2007; 152: 332-40.
29. Michel MC. al-Adrenoceptors and ejaculatory function. Br J Pharmacol 2007; 152: 289-90.
30. Hisasue S, Furuya R, Itoh N, Kobayashi K, Furuya S, Tsukamoto T. Ejaculatory disorder caused by alpha-1 adrenoceptor antagonists is not retrograde ejaculation but a loss of seminal emission. Int J Urol 2006; 13: 1311-6.
31. Kobayashi K, Masumori N, Hisasue SI, et al. Inhibition of seminal emission is the main cause of anejaculation induced by a new highly selective alA-blocker in normal volunteers. J Sex Med 2008; 5: 2185-90.
32. Hellstrom WJ, Giuliano F, Rosen RC. Ejaculatory dysfunction and its association with lower urinary tract symptoms of benign prostatic hyperplasia and BPH treatment. Urology 2009; 74: 15-21.
33. Blanker MH, Bosch JL, Groeneveld FP, et al. Erectile and ejaculatory dysfunction in a community-based sample of men 50-78 years old: prevalence, concern, and relation to sexual activity. Urology 2001; 57: 763-8.
34. Blanker MH, Bohnen AM, Groeneveld FP, et al. Correlates for erectile and ejaculatory dysfunction in older Dutch men: a communitybased study. J Am Geriatr Soc 2001; 49: 436-42.
35. Rosen R, Altwein J, Boyle P, et al. Lower urinary tract symptoms and male sexual dysfunction: the Multinational Survey of the Aging Male (MSAM-7). Eur Urol 2003; 44: 637-49.
36. Roehrborn CG, Lepor H, Kaplan SA. Retrograde ejaculation induced by silodosin is the result of relaxation of smooth musculature in the male urogenital tract and is associated with greater urodynamic and symptomatic improvement in male LUTS secondary to BPH. J Urol 2009; 181. Abstract 1922.
37. Homma Y, Kawabe K, Takeda M, Yoshida M. Ejaculation disorder is associated with increased efficacy of silodosin for benign prostatic hyperplasia. Urology 2010; 76: 1446-50.
