Противовирусная активность Ингавирина при экспериментальной летальной гриппозной инфекции у белых мышей, вызванной вирусом гриппа В
Статьи Опубликовано в журнале:«АНТИБИОТИКИ И ХИМИОТЕРАПИЯ»; № 55; 2010; стр. 3-4.
В. В. ЗАРУБАЕВ1, А. В.ГАРШИНИНА1, Н. А. КАЛИНИНА1, А. А. ШТРО1, В. Е. НЕБОЛЬСИН2, О. И. КИСЕЛЕВ1
2 ОАО «Валента Фарм», Москва
Изучена протективная активность Ингавирина® на модели экспериментальной гриппозной инфекции, вызванной вирусом гриппа В, по сравнению с препаратом Арбидол® . Показано, что применение Ингавирина® приводит к достоверному снижению титров вируса в лёгочной ткани животных, нормализации весовых показателей, снижению смертности и увеличению средней продолжительности жизни. При этом активность Ингавирина® превосходила активность препарата сравнения. Приведённые данные позволяют рассматривать Ингавирин® как перспективное средство профилактики и лечения гриппозной инфекции у человека.
Ключевые слова: Ингавирин® , грипп, вирус гриппа В, противовирусная химиотерапия.
Antiviral Activity of Ingavirin® in Experimental Lethal Influenza Due to Influenza Virus B in Albino Mice
V. V. ZARUBAEV, A. V. GARSHININA, N. A. KALININA, A. A. SHTRO, V. E. NEBOLSIN, O. I. KISELEV
Research Institute of Influenza, North-West Branch of the Russian Academy of Medical Sciences, St. Petersburg
JSC Valenta Pharm Co., Moscow
The protective activity of Ingavirin® against experimental infection caused by influenza B virus was studied on albino mice vs. Arbidol® . Oral use of Ingavirin® was shown to decrease the infectious titers of the virus in the animal lung tissue, to normalize the body weight dynamics, to lower the mortality and to increase the average lifespan vs. the placebo-treated animals. The activity of Ingavirin® was higher than that of the reference drug. The results allowed to consider Ingavirin® as a prospective agent for the treatment of influenza infection in humans.
Key words: Ingavirin® , influenza, virus B, antiviral chemotherapy.
Введение
Грипп является высокоинфекционным заболеванием и представляет угрозу здоровью, а часто и жизни людей. Типичной особенностью эпидемий гриппа последних десятилетий является одновременная циркуляция среди населения вирусов гриппа типов А и В. Появление в 2009 г. среди человеческой популяции нового подтипа вируса гриппа H1N1 [1], вызвавшего пандемию, особенно остро поставило вопрос о необходимости разработки новых эффективных противовирусных препаратов.
Арсенал противогриппозных химиопрепаратов на сегодняшний день весьма ограничен. Производные адамантана — амантадин и римантадин — проявляют активность против вируса гриппа А и не эффективны против гриппа В [3]. Более того, начиная с 1990-х годов среди вирусной популяции, даже среди исходно чувствительных подтипов, быстро распространились римантадиноустойчивые варианты, так что к настоящему времени подавляющее большинство вирусных изолятов, в том числе 100% пандемических штаммов, не восприимчивы к этой группе препаратов. Средства второго поколения — ингибиторы вирусной нейраминидазы осельтамивир, занамивир и перамивир — проявляют активность против всех подтипов вируса гриппа [4]. Однако и в отношении этих препаратов следует отметить появление и распространение устойчивых штаммов. Кроме того, в случае позднего начала лечения эти средства не столь эффективны, что в клинической практике может привести к развитию вирусной или вирусно-бактериальной пневмонии на сроках от 3 и более суток после инфицирования.
Таким образом, существует острая необходимость поиска и разработки новых эффективных средств лечения гриппа, обладающих широким спектром активности с механизмом, отличным от уже применяемых в клинике средств. Ранее в 2009 году специалистами филиала ФГУ «48 ЦНИИ Минобороны России — ВЦ» была показана эффективность Ингавирина® in vitro в отношении вируса гриппа В [6].
Цель настоящего исследования состояла в изучении активности нового противовирусного препарата Ингавирин® (имидазолилэтанамида пентандиовой кислоты) в отношении экспериментальной инфекции in vivo, вызванной вирусом гриппа В.
Материал и методы
Препараты. В работе использовали препарат Ингавирин® производства ОАО «Валента Фарм», Россия. В качестве препарата сравнения использовали Арбидол® (Фармстандарт, Россия). Препараты растворяли или суспендировали в физиологическом растворе до необходимых концентраций и использовали для перорального введения животным через желудочный зонд.
Вирусы. Вирус гриппа B/Lee/40 был получен из коллекции вирусов НИИ гриппа РАМН и пассирован в аллантоисной полости 10—12-дневных куриных эмбрионов в течение 72 ч при 34°С.
Животные. Работа проведена на белых беспородных мышах (самки) массой 18—22 г, которые были получены из питомника «Рапполово» (Ленинградская обл.) и содержались на стандартном рационе в регламентированных условиях вивария НИИ гриппа РАМН. Подбор животных в группы опыта проводили методом случайной выборки. До начала испытаний животные находились под наблюдением 2 недели.
Экспериментальная гриппозная инфекция. Перед экспериментом 5 мышей были заражены вируссодержащей аллантоисной жидкостью. На 3 сутки после заражения лёгкие заражённых мышей были изолированы, гомогенизированы в 10-кратном объёме стерильного физиологического раствора, после чего инфекционная активность вируса в гомогенате была определена в отдельном эксперименте при помощи титрования по летальности на животных. Титр вируса рассчитывали по методу Рида и Менча [5].
Исследуемые препараты вводили животным перорально в следующих дозах: Ингавирин® — 15 мг/кг, Арбидол® — 130 мг/кг массы. Препараты вводили в объёме 0,2 мл по лечебной схеме (через 24, 48, 72, 96 и 120 ч после заражения). В качестве плацебо контрольной группе животных вводили физиологический фосфатный буфер.
Животных интраназально под лёгким эфирным наркозом инфицировали вирусом гриппа В в дозе 5 LD50. В каждую группу наблюдения брали по 15 мышей. Параллельно формировали такие же группы животных, включающие по 5 мышей, для контроля вирусной репликации в лёгких. На 3-й день после заражения животных из этих групп умерщвляли, вскрывали и изолировали лёгкие для выделения вируса. Лёгкие хранили при -20°С до постановки соответствующих экспериментов.
Наблюдение за оставшимися животными осуществляли в течение 14 дней, то есть срока, в течение которого при экспериментальном гриппе отмечается смертность животных. Фиксировали массу и ежедневную смертность животных в контрольных и опытных группах. На основании полученных показателей смертности в каждой группе рассчитывали процент смертности (M, отношение числа павших за 14 дней животных к общему числу заражённых животных в группе), индекс защиты (IP, отношение разницы процентов смертности в контрольной и опытной группах к проценту смертности в контрольной группе) и среднюю продолжительность жизни животных (MDD) из расчёта 14 дней наблюдения в соответствии со следующими формулами:
MDD=(ΣND)/Nt,
где N — количество животных, проживших D дней, Nt — общее число животных в группе.
M=M/Nt,
где M — число животных в группе, павших в течение 14 дней после заражения.
IP=((Mc-Me)/Mc)X100%,
где Mc и Me — смертность в процентах в контрольной и опытной группах соответственно.
Титрование вируса в лёгочной ткани. Для определения инфекционного титра вируса гриппа в лёгочной ткани животных лёгкие мышей, извлечённые на 3 сутки после инфицирования, гомогенизировали в десятикратном объёме стерильного физиологического фосфатного буфера и готовили из гомогенатов серию десятикратных разведений на том же буфере. Полученными разведениями инфицировали клетки MDCK в 96-луночных планшетах и культивировали в течение 48 часов при 36°С в атмосфере 5% CO2.
Иммуноферментный анализ. По окончании срока инкубации клетки промывали два раза нейтральным фосфатным буфером, фиксировали 10 мин при +4°С 80% ацетоном, промывали 5 мин дистиллированной водой и высушивали на воздухе.
Первичные типоспецифические антитела против вирусов гриппа (OOO ППДП, Санкт- Петербург), распознающие вирусный гемагглютинин, растворяли в фосфатном буфере с добавлением 5% обезжиренного сухого молока (для блокирования сайтов неспецифического связывания антител с белковыми детерминантами) до концентрации 5 мкг/мл и инкубировали с фиксированными клетками в течение 1 ч при 37°С (0,1 мл на лунку). Клетки промывали 3 раза по 0,1 мл/лунку фосфатного буфера и инкубировали с раствором антимышиного иммуноглобулина, меченного пероксидазой (Sigma, Cat.# A2304), в разведении 1:10000 (0,1 мл на лунку) в течение 1 ч при 37°С. Несвязавшиеся антитела отмывали 3 раза по 0,1 мл/лунку фосфатного буфера и проводили цветную реакцию с раствором 3,3, 5,5-тетраметилбензидина с добавлением 0,03% перекиси водорода в ацетатном буфере рН 5,0 (0,1 мл на лунку). Реакцию останавливали 2N серной кислотой (0,1 мл на лунку) и измеряли оптическую плотность в ячейках при длине волны 450 нм на микропланшетном ридере Victor 1420 (Wallac, Финляндия). Реакцию считали положительной, если оптическая плотность в ячейках превышала фоновые значения для интактных клеток вдвое и более.
За инфекционный титр вируса принимали величину, противоположную десятичному логарифму максимального разведения исходного гомогената, способного вызвать положительную реакцию на присутствие вирусных антигенов. О вирусингибирующем действии соединений судили по снижению титра вируса в лёгких.
Статистическая обработка результатов. Статистическую обработку результатов проводили при помощи программы Microsoft Excel. Достоверность отличий между показателями контрольных и опытных групп оценивали при помощи двухвыборочного t-теста с разными дисперсиями (Сервис — Анализ данных — Двухвыборочный t-тест с различными дисперсиями) при p<0,05.
Результаты и обсуждение
В эксперименте не было отмечено неспецифической смертности в контрольной группе интактных животных. Клинические признаки заболевания были типичными для гриппозной инфекции и включали затруднённое дыхание, атаксию, тремор, а также снижение потребления корма и воды.
Данные по действию исследованных препаратов на инфекционный титр вируса гриппа в лёгких животных представлены в табл. 1. Как видно из табл. 1, Ингавирин® статистически достоверно снижал вирусную активность на 1,5 порядка (в 13 раз). При этом активность Арбидола® проявлялась в меньшей степени и также достигала достоверных отличий от контрольных показателей.
Таблица 1.
Активность химиопрепаратов в отношении вируса гриппа B/Lee/40, выделяемого из лёгких животных на 3 сутки после заражения, по результатам иммуноферментного анализа
| Группы животных | Титры вируса в ткани лёгких (lg EID50/20 мг ткани, M±SE) на 3 сутки после инфицирования |
| Ингавирин® | 1,90±0,06* |
| Арбидол® | 2,45±0,13* |
| Контроль | 3,40±0,12 |
Использованный вирус гриппа В вызывал у мышей патологический процесс, заканчивающийся к 15 суткам эксперимента гибелью 80—87% животных. Эффективность Ингавирина® превосходила эффективность Арбидола® (54 против 39% у Арбидола® ) (табл. 2, рисунок).
Таблица 2.
Смертность в ходе патологического процесса при экспериментальной летальной гриппозной инфекции у белых мышей, вызванной вирусом гриппа B/Lee/40 в условиях применения химиопрепаратов
| Группы животных | Количество | Смертность по дням, n | СПЖ, сут. (M±SE) | Смертность, % | Индекс защиты, % | |||||||||||||
| животных | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | ||||
| в группе, n | ||||||||||||||||||
| Ингавирин® | 15 | 1 | 1 | 2 | 1 | 1 | 13,1±0,7* | 40,0 | 53,8 | |||||||||
| Арбидол® | 15 | 2 | 2 | 3 | 1 | 12,5±0,4 | 53,3 | 38,5 | ||||||||||
| Контроль | 15 | 1 | 2 | 2 | 2 | 2 | 3 | 1 | 10,7±0,5 | 86,7 | — | |||||||
Рис. Динамика смертности животных в ходе патологического процесса при экспериментальной летальной гриппозной инфекции, вызванной вирусом гриппа B/Lee, в условиях применения химиопрепаратов. 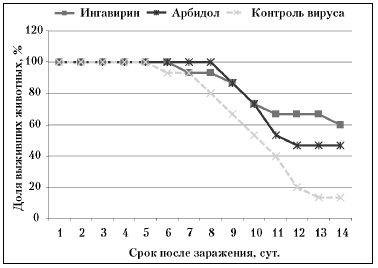
Полученные данные в целом коррелировали с результатами изучения динамики веса животных в ходе патологического процесса (табл. 3).
Таблица 3.
Влияние химиопрепаратов на динамику массы тела животных при экспериментальной летальной гриппозной инфекции, вызванной вирусом гриппа B/Lee/40
| Группы животных | Масса животных, г ( M±SE) на срок после заражения, сут. | ||||||
| 0 | 3 | 5 | 7 | 8 | 10 | 13 | |
| Ингавирин® | 18,7±0,4 | 18,2±0,3* | 17,0±0,3* | 16,2±0,4* | 14,8±0,4* | 14,1±0,3* | 14,4±0,3 |
| Арбидол® | 18,7±0,4 | 17,4±0,5* | 16,0±0,3 | 15,1±0,3 | 14,4±0,3* | 13,5±0,3* | 13,9±0,2 |
| Контроль вируса | 17,8±0,4 | 16,1±0,3 | 15,1±0,4 | 14,4±0,3 | 13,5±0,3 | 12,4±0,3 | 13,2±0,4 |
На основании проведённого исследования следует отметить наличие у Ингавирина® противовирусной активности в отношении вируса гриппа В, против которого не эффективны традиционные препараты адамантанового ряда. Применение Ингавирина® при экспериментальной инфекции приводит к достоверному снижению титров вируса в лёгочной ткани животных, нормализации весовых показателей животных, снижению смертности и увеличению средней продолжительности жизни. Результаты настоящего исследования коррелируют с результатами, полученными in vitro [6].
Таким образом, приведённые данные позволяют рассматривать Ингавирин® как перспективное средство профилактики и лечения гриппозной инфекции у человека.
ЛИТЕРАТУРА 1. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods 1983; 65: 55-63.
2. Scholtissek C, Quack G, Klenk H. D, Webster R. G. How to overcome resistance of influenza A viruses against adamantane derivatives. Antiviral Res 1998; 37: 83-95.
3. Woodhead M, Lavanchy D, Johnston S. et al. Neuraminidase inhibitors: progress in the management of influenza. Int J Clin Pract 2000; 54: 9: 604-610.
4. Reed L. J., Muench H. A simple method of estimating fifty percent end-points. Am J Hyg 1938; 27: 493-497.
5. Логинова С. Я, Борисевич С. В., Семенова И. А. и др. Изучение эффективности Ингавирина® in vitro в отношении возбудителя гриппа В. Антибиотики и химиотер 2009; 7—8: 13—15.
Комментарии
ПРАКТИКА ПЕДИАТРА
