Невропатический болевой синдром при болях в спине
СтатьиОпубликовано в журнале:
«Трудный пациент», 2011, ТОМ 9, № 1, с. 17-23
А.Н.Баринов
Первый Московский Государственный Медицинский Университет им. И.М.Сеченова
По своему биологическому происхождению боль можно расценивать в качестве «парламентера болезни», выдвигающего сознанию ультиматум об опасности и неблагополучии в организме, направленный на мобилизацию защитных процессов, восстановление поврежденной ткани и нормальной жизнедеятельности. Без сохранности восприятия боли существование человека и животных невозможно: боль формирует целый комплекс защитных реакций, направленных на устранение повреждения [1].
Различают острую (длящуюся до 10 дней) и хроническую (продолжающуюся более 3-х месяцев) боль, механизмы развития которых принципиально различаются. Если в основе острых болей лежит, чаще всего, реальное повреждение тканей организма (травма, воспаление, инфекционный процесс), то в генезе хронической боли на первый план выходят изменения в центральной нервной системе, вызванные длительным непрекращающимся потоком болевой импульсации от поврежденного органа. Таким образом, при хронической боли часто наблюдается ситуация, когда реальное повреждение тканей уже отсутствует, а боль продолжается, как бы «оторвавшись» от первоначальной причины болезни, и став самостоятельным заболеванием.
Скелетно-мышечные боли в спине встречаются на том или ином этапе жизни примерно у 90% людей и занимают второе место по распространенности среди острых болевых синдромов после головной боли. В структуре распространенности хронических болевых синдромов скелетно-мышечные боли в спине также занимают второе место (после суставных болей) и встречаются у каждого десятого [3,5,6]. Когда мы говорим о причинах возникновения боли в спине понятие «остеохондроз» совершенно не уместно - остеохондроз это естественный процесс дегенерации (старения) структур позвоночника, и ни в коем случае не синоним боли в спине. Распространенность этого заблуждения в популярной, а иногда даже в медицинской литературе, привела к тому, что «остеохондроз» стал одним из самых частых диагнозов у больных с болями в спине. Однако известно, что выраженность рентгенологических и клинических проявлений остеохондроза позвоночника никак не соотносится с локализацией, характером, интенсивностью и длительностью болевого синдрома, поэтому их наличие не должно определять ни лечебной, ни экспертной тактики. Кроме того, только у 1 из 10 пациентов с рентгенологическими признаками дегенеративного поражения позвоночника имеются клинические проявления заболевания. Таким образом, нельзя отождествлять каждый случай развития эпизода боли в спине с чаще всего имеющимися у больного «дегенеративно-дистрофическими» изменениями позвоночника, ставя «привычный» диагноз «обострение остеохондроза» или просто «остеохондроз» [3,5, 6].
Еще один распространенный клинический миф касается грыжи межпозвоночного диска. Так ли она опасна на самом деле и следует ли ее лечить? Дело в том, что «немые» (то есть никак себя не проявляющие) грыжи межпозвонковых дисков встречаются во много раз чаще тех грыж, которые вызывают боль в спине, а точнее - в спине и конечности (радикулопатию). И размер здесь также не имеет значения! Главный определяющий фактор - это направление, в котором пролабирует грыжа. Если грыжа направлена в тело позвонка (это называется грыжа Шморля) или в центр позвоночного канала (медиальная грыжа) - она будет «молчать» и никакого вреда не принесет. Только латеральные грыжи, механически повреждающие корешки нервов или вызывающие вторичные токсические и дизиммунные процессы, по-настоящему опасны. Заподозрить такую грыжу можно, если боль из спины распространяется в руку или ногу и сопровождается слабостью и чувствительными расстройствами в конечности, симптомами натяжения корешка. Но и такая грыжа не является «приговором к операции». Современные медицинские технологии позволяют проводить лечение таких состояний безоперационно (путем блокад) или, в крайнем случае, малоинвазивными методами (лазерная вапоризация, холодно-плазменная аблация). Часто в своей практике мы сталкиваемся с типичной ситуацией - в результате лечения (или даже без оного) боль в спине исчезает, хотя грыжа остается прежних размеров и на прежнем месте.
В подавляющем большинстве случаев боли в спине могут быть вызваны изменениями суставов и связочного аппарата позвоночника, а также повреждением и заболеваниями мышц (миофасциальные боли, полимиозит и др.), реже - патологией внутренних органов (стенокардия, язвенная болезнь желудка, холецистит, эндометриоз, проктит и т.п.), и, наконец, совсем редко встречаются психогенные боли в спине, обусловленные только психическими расстройствами. В качестве основных источников локальной боли в поясничной области обсуждаются в 70-80% случаев миогенные нарушения (спазм, микротравматизация, ишемизация паравертебральных мышц), дисфункция фасеточных суставов (до 40% случаев) и в 10% - дискогенная боль [3, 6]. При этом отмечается, что данные клинического (невроортопедического) обследования часто остаются маловоспроизводимыми и не специфичными для четкого выделения какого-либо синдрома невроортопедических нарушений - такие болевые синдромы, как фасеточный, миофасциальный и мышечно-тонический нередко являются во многом гомогенными со стороны жалоб и часто имеют «перекрывающиеся» характеристики при невроортопедическом обследовании. При обследовании пациентов с явными ортопедическими дефектами в виде грубого сколиоза, спондилолистеза, нестабильности поясничного отдела позвоночника, разной длинны ног, косого и скрученного таза, патологии тазобедренного сустава, определить источники боли не составляет больших трудностей. А вот у пациентов с хронической болью точное выявление источников болевой импульсации весьма затруднено. По мнению отдельных ведущих исследователей в этой области, без применения инвазивных методов диагностики (дискографии, диагностических блокад) оно возможно не более чем в 15% случаев хронических скелетно-мышечных болевых синдромов. С одной стороны, это отражает сложность строения структур поясничной области и связанную с ней трудность точного определения ноциогенной структуры, с другой - утрату первостепенной роли периферических источников боли при хронизации боли. Соответственно и подход к лечению острых и хронических болей в спине кардинально различается [1].
Традиционно считается, что лечение боли должно в первую очередь воздействовать на этиологические факторы, например, компенсацию разницы длины ног, лечение дегенеративных изменений хряща фасеточных суставов, удаление грыжи межпозвоночного диска и так далее, однако этиотропная терапия часто не прекращает ни острую, ни хроническую боль. Это связано с тем, что в основе острых болей, чаще всего, лежит воспаление, а это значит, что необходимы противовоспалительные препараты для быстрого купирования болевого синдрома. Основой же хронических болей являются изменения в центральной и периферической нервной системе (периферическая и центральная сенситизация, снижение нисходящих ингибирующих влияний антиноцицептивной системы), которые, как бы «отрывают» боль от первопричины заболевания, делая ее самостоятельной болезнью.
В терапии острой боли в спине имеется необходимость максимально быстро избавить пациента от мучительных болей, во избежание хронификации заболевания, вызванной перестройкой периферической и центральной нервной систем, «бомбардируемых» болевыми импульсами от воспаленных мышц, связок, фасеточных суставов и других структур позвоночника [1, 3, 6]. Это достигается применением препаратов для симптоматического лечения боли (прежде всего — нестероидных противовоспалительных препаратов), что попросту недоступно для этиотропной терапии, при которой для этого необходим продолжительный период времени. Для профилактики хронификации острой скелетно-мышечной боли в спине необходимо как можно раньше начать обезболивающую терапию и ограничить нагрузку на пораженный отдел позвоночника путем фиксации специальными ортопедическими пособиями (корсетом, реклинатором, шиной Шанца - в зависимости от пораженного отдела). Микротравмы в процессе реабилитации способны вызвать кинезиофобию (страх движения), а также ускорить процессы хронификации, растормаживая (сенситизируя) потоком афферентной болевой информации соответствующие отделы спинного и головного мозга. В связи с этим, современный подход к лечению острой боли в спине подразумевает максимально раннее назначение препаратов, воздействующих в первую очередь на патофизиологические механизмы боли независимо от этиологической природы их развития [5].
Ключевым направлением в симптоматическом лечении острой боли в спине является применение нестероидных противовоспалительных средств (НСПВС) блокирующих выработку медиаторов воспаления - простагландинов за счет ингибирования фермента циклооксигеназы (ЦОГ). Эти препараты должны назначаться при боли в спине, прежде всего врачами общей практики (терапевтами, врачами ЛФК, хирургами, семейными врачами и даже провизорами аптек), а не только узкими специалистами (неврологами, ортопедами, ревматологами). Следует помнить, что НСПВС особенно эффективны на ранних стадиях развития боли. Именно на этом раннем этапе - этапе острой и подострой боли с помощью традиционных НСПВС возможно воздействовать на периферические компоненты болевого синдрома - соматические (устранение воспаления, отека и др.) и нейрохимические стимуляторы болевых рецепторов. В дальнейшем, когда включаются центральные патофизиологические механизмы боли, монотерапия НСПВС вряд ли будет эффективна [1, 2, 5, 6]. Показано, что в случае возникновении невропатического болевого синдрома, например при дискогенных пояснично-крестцовых радикулопатиях, симптоматическая терапия НСПВС менее эффективна, чем комбинированная терапия, включающая помимо НСПВС комплекс витаминов группы В (Мильгамма® Верваг Фарма ГмбХ и Ко.КГ, Германия), оказывающих патогенетическое действие при поражении периферических нервов [4]. Мильгамма® имеет небольшой объем ампулы (2 мл) и представляет собой сбалансированную комбинацию нейротропных витаминов: тиамина, пиридоксина и цианокобаламина, а также лидокаин, что позволяет делать инъекции безболезненными.
Необходимо отметить, что НСПВС не рекомендуются для применения более 10-14 дней. Если недельный курс приема препарата не купирует болевой синдром, то это должно побудить врача пересмотреть тактику лечения с привлечением невролога, который поможет разобраться в структуре болевого синдрома с целью выявления признаков «серьезной патологии» и выяснить причины неэффективности НСПВС в каждом конкретном случае. А причин такой неэффективности может быть несколько: плохое кровоснабжение в очаге воспаления (тогда противовоспалительный препарат можно ввести адресно прямо в эпицентр боли и воспаления путем блокады с местными анестетиками под ультразвуковым или рентгеноскопическим контролем) или стойкий спазм паравертебральных мышц с формированием порочного круга «боль-спазм-боль». При мышечно-тонических болевых синдромах и при хронификации боли в спине НСПВС становятся не эффективны в качестве монотерапии. Они просто не способны «успокоить» расторможенные отделы нервной системы.
Для воздействия на патогенетические механизмы хронификации боли в спине (прежде всего, на мышечный спазм) так же используют миорелаксанты. Основным механизмом действия миорелаксантов является торможение возбуждения моторного нейрона в ответ на болевые стимулы. Происходит нормализация повышенного мышечного тонуса, что связано с блокированием передачи патологического возбуждения на мотонейроны, при этом общая мышечная сила не снижается (не возникает слабость). Таким образом, миорелаксанты оказывают обезболивающее действие, помогая расторможенным отделам нервной системы вернуться в состояние покоя, то есть, стирая «болевую память». Это не только уменьшает выраженность боли при хроническом болевом синдроме, но и предотвращает усиление острой боли и переход ее в хроническую форму. При недостаточной эффективности НСПВС в сочетании с миорелаксантами возможно кратковременное (7-10 дней) назначение слабых наркотических анальгетиков (трамадол 100 мг/сут). Наркотические аналгетики на время дают облегчение, но к ним возникает привыкание (с каждым разом требуются все большие дозы) и лекарственная зависимость (пациент уже не может обходиться без этих препаратов). Поэтому применение опиатов дольше 10 дней не рекомендуется и допустимо лишь при самых сильных острых болях [1,3, 6].
При отсутствии противопоказаний желательно дополнить лечение немедикаментозной терапией: тепловыми физиопроцедурами, мануальной терапией, вакуумным и ручным массажем [1, 6]. В некоторых случаях релаксации паравертебральных мышц и восстановление микроциркуляции в миофасциальных триггерных зонах удается достичь без дополнительного медикаментозного воздействия при применении вышеуказанных физиотерапевтических методов и ударно-волновой терапии.
Следует отметить, что на первом и втором этапах лечения пациенты с острыми болями в спине не нуждаются в обязательной консультации невролога или ревматолога и представляют контингент больных для врачей общей практики, а затем - врача ЛФК. При острых скелетно-мышечных болях в спине нет необходимости в соблюдении постельного режима даже в первые дни заболевания, а также в использовании опоры при передвижении (трости или костыля). Необходимо убедить пациента, что небольшая физическая нагрузка не опасна, посоветовать поддерживать повседневную активность, а после купирования острого болевого синдрома, как можно скорее приступить к работе, не забывая при этом о лечебной физкультуре, необходимой для предотвращения последующих эпизодов болей в спине [3,6].
Дополнительным и наиболее эффективным консервативным методом терапии скелетно-мышечных болей в спине на любом этапе лечения оказывается локальное инъекционное введение (блокада) кортикостероидов (например, бетаметазона) в очаг воспаления или дегенеративно-дистрофического процесса (рис. 1). Такой способ введения применяется для глюкокортикоидов (эпидурально, фораминально, параартикулярно в фасеточные суставы, в миофасциальные триггерные точки и др.) и местных анестетиков [6, 8]. Однако проведение блокад требует наличия специальных навыков у врача, осуществляющего эту процедуру, а также дорогостоящей аппаратуры, обеспечивающей правильное попадание иглы в пораженную область (рентгенографической установки с электронно-оптическим преобразователем или ультразвукового сканера), поэтому методика блокад пока не распространена повсеместно.
Рис. 1. Блокада фасеточного сустава.
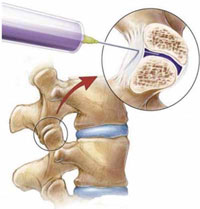
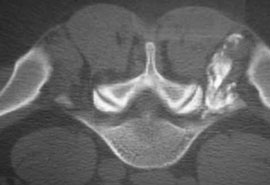
Помимо лечебных целей, в ряде случаев проведение блокад необходимо для диагностики и определения оптимальной стратегии последующего лечения. Так, например, диагностическая блокада фасеточного сустава (см. рис. 1) или крестцово-подвздошного сочленения 2% раствором лидокаина не только позволяет определить источник боли в спине, но и предсказать эффективность малоинвазивной нейрохирургической процедуры - высокочастотной денервации сустава (рис. 2). Понятно, что без кортикостероида длительность действия анестетика составит всего лишь несколько часов, но в случае исчезновения после блокады хотя бы на час болевого синдрома у пациента мы можем уверенно говорить о том, что дорогостоящая процедура денервации будет эффективна [8].
Рис. 2. Денервация фасеточного сустава L4-L5 слева
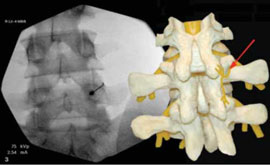
Примечание. Стрелкой показан коагулируемый фасеточный нерв.
Таким же образом определяется прогноз эффективности внутридисковой электротермической аннулопластики (рис. 3), лазерной вапоризации или холодноплазменной аблации межпозвонкового диска при радикулопатии. Если интрафораминальное введение анестетика под контролем компьютерной томографии (рис. 4) устраняет болевой синдром, то проведение вышеуказанных малоинвазивных пункционных нейрохирургических воздействий также будет эффективным [7].
Рис. 3. Внутридисковая радиочастотная электротермическая аннулопластика
Рис. 4. Селективная фораминальная блокада
А. Схема проведения блокады
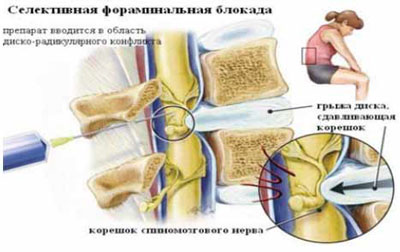
Б. Введение иглы в межпозвонковое отверстие под КТ-контролем
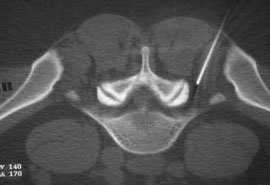
В. Введение раствора анестетика с рентгенконтрастным препаратом (омнипак)
Следует отметить, что в ряде случаев достаточный терапевтический эффект имеет интрафораминальное введение вместе с 2 мл 2% раствора лидокаина 1 мл бетаметазона. Как видно на рис. 4В большая часть инъекционного раствора не попадает в межпозвоночное отверстие, инфильтрируя мягкие ткани по ходу иглы. Именно поэтому нет смысла использовать большой объем раствора анестетика. Обычно, фораминальной блокады бывает достаточно для того, что бы уменьшить выраженность болевых ощущений и чувствительных (а иногда и двигательных) расстройств на 2-4 нед или до следующего обострения радикулопатии. В случае кратковременной эффективности вышеуказанной блокады и/или плохой переносимости глюкокортикоидов и при условии наличия несеквестрированной латеральной (фораминальной) грыжи диска, менее 7 мм, проводится малоинвазивная процедура лазерной вапоризации (или ее модификации - фораминопластики), холодноплазменной аблации или внутридисковой электротермической аннулопластики, которая эффективна у 50-65% пациентов [7]. Если и эта малоинвазивная процедура не приводит к регрессу боли, тогда производится микродискэктомия.
Вопрос о проведении пункционных или открытых нейрохирургических вмешательств при болях в спине ставится в случае неэффективности правильно проводимой консервативной терапии в течение 3 мес [1, 6]. К сожалению, нередко оперативное вмешательство проводится при отсутствии должных показаний (прогрессирующий парез иннервируемых пораженным корешком мышц конечности, тазовые нарушения, перемежающаяся хромота, вызванная стенозом позвоночного канала), что чревато формированием хронического постдискэктомического болевого синдрома, обусловленного множеством факторов (нарушением биомеханики движения в оперированном сегменте позвоночника, спаечным процессом, хроническим эпидуритом и т. п.).
Невропатический болевой синдром встречается у 90% пациентов с пояснично-крестцовой радикулопатией и определяет более тяжелое и длительное течение заболевания, в большей степени дезадаптирует больных и снижает качество жизни. При хроническом течении болевого синдрома, имеющим нейропатический генез, применяются психотропные препараты из разряда антидепрессантов (лекарства для лечения депрессии) и антиконвульсантов (противоэпилептические средства). Антидепрессанты (это относится к трициклическим, например, амитриптилин, а также к селективным ингибиторам обратного захвата серотонина и норадреналина, например, дулоксетин, венлафаксин) повышают активность эндогенной подавляющей боль (антиноцицептивной) системы мозга за счет повышения концентрации ключевого нейромедиатора антиноцицептивной системы - норадреналина. А антиконвульсанты эффективно «успокаивают» расторможенные ноцицептивные структуры головного и спинного мозга при центральной сенситизации, являющейся основным патогенетическим механизмом формирования хронической скелетно-мышечной и невропатической боли [1,2].
Ограничивающим фактором применения антидепрессантов и антиконвульсантов первого поколения (например, карбамазепина) в лечении радикулопатии является наличие выраженных побочных явлений (сонливость, потеря координации движений, повышение артериального давления, задержка мочи и т. д.) и синдрома отмены (возобновление болей, развитие тревоги, психомоторного возбуждения и даже судорожных припадков при резком прекращении приема этих лекарств). К дополнительным недостаткам антидепрессантов можно отнести нелинейность фармакокинетики, т.е. при приеме небольших доз концентрация вещества в плазме может быть больше, чем при приеме больших доз.
В связи с этим возникла необходимость создания новых высокоэффективных препаратов, не имеющих столь выраженных побочных эффектов. В этой связи представляет особый интерес габапентин (антиконвульсант последнего поколения), структурно близкий к гамма-аминомасляной кислоте (ГАМК) - неиротрансмиттеру, участвующему в торможении передачи и модуляции боли. Предполагается, что центральный анальгетический эффект габапентина развивается вследствие взаимодействия со специфическими а252-кальциевыми каналами, что приводит к снижению потенциала действия мембран ноцицепторов - нервные клетки, участвующие в проведении болевого импульса становятся менее возбудимыми. Показано, что габапентин повышает концентрацию ГАМК в нейрональной цитоплазме и увеличивает содержание серотонина в плазме крови. Габапентин не только значимо уменьшает выраженность болевого синдрома при пояснично-крестцовых радикулопатиях, но и улучшает качество жизни больных, так как частота возникновения побочных эффектов минимальна [2].
Появление антиконвульсанта нового поколения -габапентина (Габагамма, Вёрваг Фарма (Германия)) позволило значительно увеличить возможности врачей при лечении синдрома невропатической боли при радикулопатиях, так как при назначении препарата боли купируются у большинства больных, эффект наступает быстро, отсутствуют значительные побочные явления, и при необходимости его можно принимать в течение длительного периода (при необходимости период может достигать нескольких лет).
Продолжительность лечения препаратом Габагамма (габентин) пациентов с радикулопатией нейропатического генеза составляет в среднем 6 нед с последующей медленной отменой препарата. Начальная доза препарата составляет 300 мг/сут с дальнейшим титрованием дозы (табл. 1) до 1800 мг/сут.
Таблица 1. Подбор дозы препарата Габагамма (габапентин) в стандартных случаях
|
Начальное титрование дозы (первая неделя) |
Коррекция дозы | ||||
| Доза | 1-й день | 2-й день | 3-й день | доза | 2-я неделя |
| 900 мг | 300 мг 1 раз в день | 300 мг 2 раза в день | 300 мг З раза в день | 1800 мг | 600 мг З раза в день |
Наличие двух дозировок препарата Габагамма (габепентин) - 300 и 400 мг позволяет более точно титровать дозу с учетом индивидуальных особенностей пациентов: в тех случаях, когда стандартная доза 300 мг, принимаемая на ночь оказывается недостаточной для купирования болевого синдрома на протяжении всей ночи, а 2 капсулы препарата (600 мг) вызывают избыточную сонливость в утренние часы, можно рекомендовать пациентам использовать дозировку 400 мг на ночь, а 300 мг принимать утром и днем. В случаях, когда пациент имеет избыточную массу тела, или имеет рост выше среднего, целесообразно назначение Габагаммы 400 мг с дальнейшим титрованием дозы (табл. 2) до 2400 мг/сут.
Таблица 2. Подбор дозы препарата Габагамма (габапентин) у крупных пациентов
| Начальное титрование дозы (1-я неделя) | Коррекция дозы | ||||
| Доза | 1-й день | 2-й день | 3-й день | доза | 2-я неделя |
| 1200 мг | 400 мг 1 раз в день | 400 мг 2 раза в день | 400 мг З раза в день | 2400 мг | 800 мг З раза в день |
Таким образом, Габагамма (габапентин) обладает большим потенциалом для лечения невропатического болевого синдрома при радикулопатиях в комбинации с другими методами лечения.
Однако не стоит рассчитывать на то, что назначение психотропных препаратов будет достаточно для того, чтобы окончательно перестроить патологическую болевую систему, сформировавшуюся в нейроматриксе пациента за долгие месяцы, а то и годы заболевания. Для воздействия на мотивационную и когнитивную составляющие хронического болевого синдрома требуется изменить у пациента стратегию преодоления боли - максимально активизировать его, заставить двигаться, убедить в том, что пассивное ожидание помощи со стороны никогда не вернет его к полноценной жизни. Поведенческая и когнитивно-поведенческая психотерапия помогают скорректировать неправильные, препятствующие выздоровлению, представления пациента о природе своего заболевания, изменить социальное подкрепление болевого поведения, уменьшить зависимость от анальгетической терапии и увеличить уровень повседневной активности. Эта концепция легла в основу разработки психотерапевтических программ лечения боли - «школ боли». При реализации этих программ результаты в лечении хронической боли наиболее высоки [1,3,5].
Наиболее сложной психотерапевтической задачей является устранение страха, связанного с болью, а также его влияния на поведение (избегание движения - кинезиофобию), когнитивную деятельность (повышенную сосредоточенность на соматических ощущениях) и формирование эмоционального дистресса у пациентов, страдающих хроническими скелетно-мышечными болями. Страх боли связан с более частыми жалобами на боль, нарушением внимания, снижением физической активности и нарастанием инвалидизации [1,10].
Лечение, направленное на уменьшение страха, связанного с болью основано на методе экспозиции - постепенном предъявлении раздражителя (повышении вызывающей боль активности) в безопасной обстановке, например, в тренажерном зале под наблюдением врача ЛФК. Это позволяет улучшить физическую активность и уменьшить интенсивность боли, а также кинезиофобию. Для нормализации психологического состояния пациентов с хроническими болевыми синдромами необходимо использовать комплексный подход, сочетающий в себе методы психотерапии, рефлексотерапии, лечебной физкультуры и фармакотерапии [1]. Стратегия психотерапии должна быть направлена:
- на устранение внутреннего психологического конфликта;
- на мобилизацию естественных возможностей человека, способных изменить ставшее уже привычным «болевое поведение»;
- на обучение пациентов методам саморегуляции, уменьшающих интенсивность болевых ощущений.
В зависимости от характера психопатологической симптоматики, выраженности мотиваций и работоспособности пациента для лечения психогенных болевых синдромов могут быть использованы разные психотерапевтические техники - поддерживающая психотерапия, суггестивные методики (гипноз, аутогенная релаксация), динамическая психотерапия, групповая психотерапия, поведенческая терапия, биологическая обратная связь [10].
Анализ литературных данных, касающихся диагностики и лечения боли, а также наш собственный клинический опыт показывают, что ни один из отдельно применяющихся методов хирургического, фармакологического, физического или психологического лечения хронической боли не может сравниться по своей эффективности с многопрофильным подходом, применяющимся в специализированных клиниках боли, когда все вышеуказанные методы, назначенные вместе в одном комплексе, взаимно усиливают (потенцируют) друг друга. При этом риск возникновения побочных явлений существенно снижается за счет снижения доз и сокращения курса приема аналгетиков.
ЛИТЕРАТУРА
1. Алексеев В.В, БариновА.Н., Кукушкин М.Л., ПодчуфароваЕ.В.. Строков И.А., Яхно Н.Н. Боль: руководство для врачей и студентов/ Под ред. Н.Н.Яхно, М.: «МедПресс», 2009; 302.
2. Данилов А.Б., Жаркова Т.Р. Хроническая радикулопатия: новые возможности терапии. Русский Медицинский Журнал - специальный выпуск «Болевой синдром». 2010; 18: Спец: 15-19.
3. Европейские рекомендации по лечению неспецифической боли в пояснично-крестцовой области в условиях первичной медицинской помощи: реферат под науч. ред. Яхно Н.Н., Подчуфаровой Е.В. М.: Практическая медицина, 2010; 24.
4. Левин О.С, Мосейкин И.А. Комплекс витаминов группы В (Мильгамма) в лечении дискогенной пояснично-крестцовой радикулопатии. Ж. Неврологии и психиатрии им. С.С.Корсакова. 2009: 10:30-35.
5. Неспецифическая боль в нижней части спины: клинические рекомендации под ред. Ш.Ф.Эрдеса. М.: «КомплектСервис», 2008: 70.
6. Павленко С.С. Боли в нижней части спины (эпидемиология, клинико-диагностическая классификация, современные направления в диагностике, лечении и стандартизации медицинской помощи): руководство. Новосибирск: Сибмедиздат НГМУ, 2007; 172.
7. Andersson G.B., Mekhail N.A., Block J.E. Treatment of intractable discogenic low back pain. A systematic review of spinal fusion and intra-discal electrothermal therapy (IDET). Pain Physician. 2006; 9 (3): 237-248.
8. Boswell M.V., Colson J.D., Sehgal N. et al. A systematic review of therapeutic facet joint interventions in chronic spinal pain. Pain Physician. 2007; 10 (1): 229-253.
9. Datta S., Everett C.R., Trescot A.M. et al. An updated systematic review of the diagnostic utility of selective nerve root blocks. Pain Physician. 2007; 10(1): 113-128.
10. Glombiewski J.A., Hartwich-Tersek J., et al: Attrition in Cognitive- behavioral Treatment of Chronic Back Pain. The Clinical Journal of Pain. 2010; 26 (7) 137-144.
