Дегенеративное поражение позвоночника и боль в спине: подходы к терапии
СтатьиОпубликовано в журнале:
«Consilium Medicum», 2013, том 15, №2, с. 37-40 Н.А.Шостак, Н.Г.Правдюк, А.А.Клименко, А.А.Кондрашов, В.А.Егорова, Н.М.Швырева
ГБОУ ВПО Российский национальный исследовательский медицинский университет им. Н.И.Пирогова Минздрава РФ
В последние десятилетия боль в спине (БС), ассоциированная с дегенеративными изменениями в позвоночнике, является объектом пристального внимания исследователей. Разночтения в вопросах роли структурных нарушений в генезе БС и подходах к терапии препятствуют единому представлению о болезни. В ходе проводимой Международной декады (Всемирная организация здравоохранения 2001–2010 гг.), посвященной приоритетным направлениям костно-суставной патологии, накоплены новые данные, позволяющие расширить представления о поражении позвоночника дегенеративной природы.
Известно, что основная часть осевой нагрузки приходится на межпозвонковый диск (МПД), который играет ведущую роль в биомеханике позвоночника. До настоящего времени нет убедительных данных о том, являются ли старение и дегенерация диска, приводящие к появлению БС, взаимозаменяемыми понятиями естественного возрастного процесса с появлением клинических признаков на конечных этапах развития или взаимоисключающими состояниями, рассматривающими дегенерацию МПД как заболевание. Некоторые авторы высказывают предположения об отличиях в происхождении и механизмах развития этих состояний [1, 2].
Установлено, что изменения в МПД, обусловленные старением, появляются у людей старше 30 лет изначально в матриксе пульпозного ядра с появления очагов зернистого распада, гибели части клеток. Эти изменения нарушают однородность и упорядоченность структуры, ведут к потере воды, снижению внутридискового давления и ухудшению функциональных свойств диска [3].
Дегенерация МПД – мультифакториальный процесс. В основе вырождения диска лежит генетический дефект. Идентифицированы несколько генов, ответственных за прочность и качество костно-хрящевых структур – гены синтеза коллагена 9-го типа, аггрекана, рецептора витамина D, металлопротеиназы. Генетическая «поломка» носит системный характер, что подтверждается высокой распространенностью дегенерации МПД у больных остеоартрозом периферических суставов. Пусковым моментом развития дегенеративных изменений в диске служит структурное повреждение фиброзного кольца, приводящее к последующим изменениям в пульпозном ядре и замыкательных пластинах. Структурное повреждение элементов диска приводит к развитию каскада метаболических реакций – активного процесса заживления. C возрастом способность к эффективной репарации ослабевает, что приводит к прогрессированию дегенеративных процессов [4, 5].
Основной причиной хронической БС у лиц среднего и пожилого возраста является спондилез (спондилоартроз), под которым понимают весь спектр изменений дегенеративного характера в МПД и телах позвонков. В основу рентгенологической диагностики заболевания положен принцип классификации изменений при остеоартрозе периферических суставов (позвонково-двигательный сегмент рассматривается как сустав) по Келлгрену – учитываются снижение высоты межпозвонкового пространства и наличие остеофитов на уровне тел позвонков.
Степень тяжести спондилеза оценивается по критериям Minesterium fur Gesundheitswesen, S.Gordon и со-авт. (2003 г.) [6]:
- 0-я стадия – норма, нет снижения высоты МПД;
- I стадия – минимальный спондилез, незначительное снижение высоты МПД и/или малые (максимально 2 мм) единичные передние или боковые остеофиты;
- II стадия – умеренный спондилез, умеренное снижение высоты МПД не менее 50% от высоты одного из смежных незатронутых дисков) и/или остеофиты умеренного размера (3–5 мм передний или боковой, 1–2 мм задний);
- III стадия – тяжелый спондилез, значительное снижение высоты МПД (более 50%) и/или наличие больших остеофитов (более 5 мм – передний или боковой, более 2 мм – задний).
В рамках спондилеза могут развиваться разные варианты болевого синдрома, ассоциированные как с формированием грыжи МПД, так и с поражением фасеточных суставов. Развитию хронического болевого синдрома, закреплению постоянных (рецидивирующих) болевых ощущений способствует формирование рубцово-спаечного эпидурита на фоне поражения МПД, а также развитие реактивного синовита дегенеративно-измененных дугоотростчатых суставов на фоне инклинации суставных отростков позвонков и уменьшении площади межпозвонковых отверстий [7].
Болевой синдром в спине принято классифицировать на первичный и вторичный, неспецифический и специфический. Под первичным (неспецифическим) болевым синдромом понимают мышечно-скелетный (механический) болевой синдром, в том числе обусловленный дегенеративным поражением позвоночника (спондилез, грыжа МПД). Вторичный (специфический) болевой синдром включает спектр заболеваний и состояний, развивающихся при воспалительных спондилопатиях, остеопорозе, соматических заболеваниях и др. [8].
Доказано, что процессы дегенерации хряща в периферических суставах и суставах позвоночника протекают по однотипному сценарию. Симптоммодифицирующие препараты замедленного действия (ранее – хондропротекторы) применяются при остеоартрозе периферических суставов уже в течение 40 лет в Европе и 30 лет в США. Экспертами EULAR (European League Against Rheumatism) рекомендованы для применения следующие препараты – хондроитин, глюкозамин, неомыляемые соединения экстрактов масел бобов сои и авокадо, диацереин, гиалуроновая кислота (для внутрисуставного введения). Положительный клинический эффект от применения некоторых из них продемонстрирован также при БС, ассоциированной со спондилезом.
Лекарственные средства, относящиеся к группе симптоммодифицирующих препаратов замедленного действия, имеют комплексный механизм действия. Обладая тропностью к хрящу, они способны стимулировать синтез хрящевого матрикса, угнетая его деструкцию. Наиболее изученными и широко используемыми являются препараты, содержащие хондроитин и глюкозамин. Так, например, показано, что адекватное количество хондроитина сульфата в хрящевой ткани жизненно необходимо для поддержания нормальной функции суставов и регенерации суставных поверхностей при их повреждении. Являясь естественным гликозаминогликаном, расположенным в экстрацеллюлярном матриксе суставного хряща, хондроитина сульфат ингибирует свободные радикалы, способные вызывать разрушение хряща и коллагена, угнетает активность ферментов, вызывающих поражение хрящевой ткани, участвует в синтезе гликозаминогликанов и увеличивает продукцию внутрисуставной жидкости. Считается, что глюкозамин является предшественником гликозаминогликанов и играет важную роль в синтетических процессах. Совокупность указанных эффектов может способствовать замедлению прогрессирования дегенеративных процессов и способствовать восстановлению структуры хрящевой ткани [9].
Имеются данные, что глюкозамин и хондроитин подавляют экспрессию матриксных металлопротеиназ (ММП), интерлейкина (ИЛ)-1β и ИЛ-8, циклооксигена-зы-2, фактора некроза опухоли α (ФНО-α), оказывая противовоспалительный эффект путем подавления каскада асептического воспаления в структурах сустава [10]. Экспериментальные данные, полученные при пероральном применении хондроитина сульфата у крыс (300 или 900 мг/кг за 14 дней до развития артрита), позволяют высказать предположение о его протективном действии в отношении развития артрита [11].
Сходный асептический воспалительный процесс развивается и на уровне позвонково-двигательного сегмента при неэффективности репаративных процессов в МПД. При дегенерации МПД нарушается регуляция продукции ИЛ-1: увеличивается его синтез и развивается недостаточность рецептора – антагониста ИЛ-1 [12]. ФНО принимает участие в катаболизме матрикса диска [13]. Обсуждается роль семейства трансформирующего фактора роста β (ТФР-β) и, в частности, ТФР- β1 в развитии клеточно-опосредованных нарушений при дегенерации [14]. Высокий уровень экспрессии ММП-3 ассоциируется с ранним развитием дегенерации [15]. При грыже диска смежным генератором боли выступает корешок или нерв. Предполагается, что появление симптомов радикулярной компрессии связано с воспалительным отеком нервного корешка при участии ФНО-α, ИЛ и ММП-3. Воспалительные агенты, продуцируемые клетками грыжевого выпячивания, повышают чувствительность корешка к механическому давлению [16, 17].
Наибольшую эффективность имеют комбинированные симптоммодифицирующие препараты замедленного действия, содержащие глюкозамин и хондроитин. Одним из современных и эффективных средств указанной группы является препарат Артра, содержащий в 1 таблетке 500 мг хондроитина сульфата натрия и 500 мг глюкозамина гидрохлорида. Указанная комбинация является оптимальной в отношении эффективности обеих субстанций.
Высокая эффективность и безопасность препарата подтверждены в лечении гонартроза. Эффект препарата статистически значимо чаще проявлялся через 3–4 мес лечения, нарастал к 6-му месяцу приема и сохранялся еще в течение 3 мес, при этом у большинства больных удалось снизить суточную дозу или отменить прием нестероидных противовоспалительных препаратов (НПВП), что подтверждает наличие обезболивающего и противовоспалительного действия компонентов препарата [18]. Артра назначается по 1 таблетке 2 раза в день в течение 3 первых недель; по 1 таблетке 1 раз в день в течение последующих недель и месяцев. Устойчивый лечебный эффект достигается при приеме препарата не менее 6 мес.
Опыт использования симптоммодифицирующих препаратов замедленного действия при БС в мировой практике имеет давнюю историю. Одной из первых работ по изучению гликозаминогликанов при дегенерации МПД является экспериментальное сравнительное исследование влияния артепарона (сульфатированного полисахарида) на состояние протеогликанов МПД половозрелых гончих, которым артепарон назначали в течение 26 нед. После некропсии были получены данные о выраженном протективном эффекте артепарона, в связи с чем авторы делают вывод, что подобные препараты, возможно, будут незаменимы в управлении дегенеративными заболеваниями позвоночника (T.Cole и соавт., 1988) [19]. Одними из первых работ по изучению клинической эффективности указанной группы препаратов при болях в нижней части спины были исследования K.Christensen, L.Bucci (1989 г.), которые применяли в течение 24 нед хондроитина сульфат. В 1997 г. были опубликованы данные о клинической эффективности препарата Дискат, содержащего глюкозамина сульфат и хондроитина сульфат, в лечении болевого синдрома в нижней части спины в течение 12 нед. В зарубежных литературных источниках имеются данные о регенерации МПД на фоне 2-летнего приема хондроитина сульфата и глюкозамина в дозе 1500 мг/сут у пациента 56 лет, страдающего БС, ассоциированной с дегенеративным поражением позвоночника хронического течения [20]. Однако на современном этапе существует недостаточно данных с доказанной эффективностью о влиянии симптоммодифицирующих препаратов замедленного действия на течение болевого синдрома в спине, ассоциированного с дегенеративными процессами [8].
Кафедра факультетской терапии им. акад. А.И.Нестерова РНИМУ им. Н.И.Пирогова является участником многоцентрового открытого исследования по изучению эффективности применения лекарственного препарата Артра в лечении неспецифических болей пояснично-крестцовой локализации (суставно-мышечных болевых синдромов) в амбулаторной практике. На настоящем этапе мы располагаем предварительными данными по применению исследуемого препарата у 27 больных, завершивших участие в исследовании.
Согласно протоколу в исследование были включены 50 пациентов обоих полов в возрасте от 40 до 65 лет (n=27, средний возраст 57,7±6,7 года, мужчин – 11, женщин – 16) с хроническим неспецифическим (первичным) болевым синдромом в нижней части спины (3 и более баллов по визуальной аналоговой шкале – ВАШ продолжительностью более 12 нед), верифицированным на основании клинических и инструментальных данных. Назначение препарата Артра проводилось в соответствии с инструкцией по применению препарата на фоне терапии БС с использованием НПВП, анальгетиков, миорелаксантов.
Эффективность терапии оценивали по шкале интенсивности болевого синдрома (ВАШ) в покое и при движении, динамике показателей жизнедеятельности пациентов (опросник Освестри), эффективности исследуемого препарата, по мнению врача и пациента (0–5 баллов). Всем больным проводилась комплексная оценка миогенного болевого синдрома (по Ф.А.Хабирову) и неврологического статуса, оценка депрессии (шкала Бека), самооценка тревоги (шкала Спилбергера–Ханина), оценка потребности в приеме НПВП и анальгетиков.
Данные параметры оценивались ежемесячно в течение 3 мес терапии (визиты 1 – до лечения, 2 – через 1 мес терапии, 3 – через 2 мес , 4 – через 3 мес лечения). У всех больных согласно протоколу исследования оценивались физикальные параметры на этапах начала лечения и динамического наблюдения.
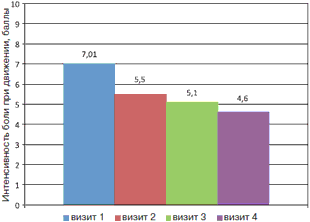
Средние значения интенсивности болевого синдрома в спине в покое и при движении составили 6,3 и 7,01 балла соответственно. На фоне комплексной терапии с использованием препарата Артра наблюдалось статистически значимое уменьшение выраженности болевого синдрома как в покое, так и при движении, в том числе по мере нарастания длительности приема препарата (визит 1 и 4, р=0,005 и р=0,002 соответственно); рис. 1, 2.
Рис. 1. Динамика интенсивности болевого синдрома в спине по ВАШ (баллы) в покое на фоне лечения препаратом Артра.
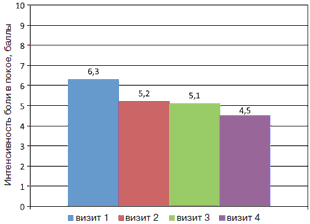
Рис. 2. Динамика интенсивности болевого синдрома в спине по ВАШ (баллы) при движении на фоне лечения препаратом Артра.
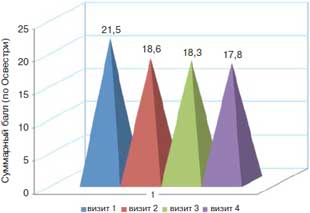
Статистически значимое снижение суммарного балла по Освестри (повышение двигательной активности больных) наблюдалось к 3-му месяцу лечения – 21,5 и 17,8 балла соответственно (р=0,06); рис. 3.
Рис. 3. Динамика средних значений суммарного балла (опросник Освестри) на фоне терапии препаратом Артра.
25 (92%) пациентов на момент включения в исследование принимали НПВП и анальгетики, к 1-му месяцу лечения потребность в анальгетической терапии наблюдалась лишь у 16 (59,3%) больных, к концу лечения – у 4 (14,8%) пациентов. Терапия с использованием препарата Артра, по мнению пациента и врача, в среднем оценена как «хорошая» и соответствовала 3,93 и 4,0 балла. Нежелательных явлений в ходе лечения зарегистрировано не было.
Таким образом, препарат Артра продемонстрировал клиническую эффективность в лечении хронического болевого синдрома в спине в виде снижения интенсивности боли, улучшения качества жизни пациентов, уменьшении потребности в приеме НПВП и анальгетиков, что сочеталось с хорошей переносимостью препарата.
БС продолжает оставаться тяжелым медицинским и социальным бременем, являясь одной из наиболее частых причин обращения к врачу и основной причиной инвалидности. Вопрос использования симптоммодифицирующих препаратов замедленного действия при хронической БС требует дальнейшего изучения. Однако на современном этапе препараты хондроитина и глюкозамина обрели теоретическое и практическое обоснование применения при данной патологии.
ЛИТЕРАТУРА
1. Antoniou J, Steffen T, Nelson F et al. The human lumbar intervertebral disc: evidence for changes in the biosynthesis and denaturation of the extracellular matrix with growth, maturation, ageing, and degeneration. J Clin Invest 1996; 98 (4): 996–1003.
2. Milette PC. The proper terminology for reporting lumbar intervertebral disk disorders. AJNR Am J Neuroradiol 1997; 18: 1859–66.
3. Burke JG, Watson RWG, McCormack D et al. Intervertebral discs which cause low back pain secrete high levels of proinflammatory mediators. J Bone Joint Surg Br 2002; 84 (2): 196–201.
4. Manek NJ, MacGregor AJ. Epidemiology of Back Disorders: prevalence, risk factors, and prognosis. Сurr Opin Rheumatol 2005; 17 (2): 134–40.
5. Martin MD, Boxell CM, Malone DG. Pathophysiology of Lumbar Disc Degeneration: A Review of the Literature. Neurosurgical Focus 2002; 13 (2): www.medscape.com/viewarticle/442440.
6. Fardon DF, Milette PC. Nomenclature and classification of lumbar disk pathology: recommendations of the combined task forces of the North Am Spine Soc, Am Soc Spine Radiol, Am Soc Neuroradiol 2001; 26: 93–113.
7. Хелимский А.М. Хронические дискогенные болевые синдромы шейного и поясничного остеохондроза. Хабаровск: Риотип, 2000.
8. Шостак Н.А. Дорсопатии – совершенствование терапевтических возможностей. Трудный пациент. 2006; 10: 24–30.
9. Jerosch J. Effects of Glucosamine and Chondroitin Sulfate on Cartilage Metabolism in OA: Outlook on Other Nutrient Partners Especially Omega-3 Fatty Acids. Int J Rheumatol 2011: 969 012.
10. Pecchi E, Priam S, Mladenovic Z et al. A potential role of chondroitin su-lfate on bone in osteoarthritis: inhibition of prostaglandin E2 and matrix metalloproteinases synthesis in interleukin-1β-stimulated osteoblasts. Osteoarthritis Cartilage 2012; 20 (2): 127–35.
11. Bauerova K, Ponist S, Kuncirova V et al. Chondroitin sulfate effect on induced arthritis in rats. Osteoarthritis Cartilage 2011; 19 (11): 1373–9.
12. Le Maitre CL, Freemont AJ, Hoyland JA. The role of interleukin-1 in the pathogenesis of human intervertebral disc degeneration. Arthritis Res Ther 2005; 7 (4): R732–45.
13. Hoyland JA, Le Maitre C, Freemont AJ. Investigation of the role of IL-1 and TNF in matrix degradation in the intervertebral disc. Rheumatology 2008; 47 (6): 809–14.
14. Zhang R, Ruan D, Zhang C. Effects of TGF-beta1 and IGF-1 on proliferation of human nucleus pulposus cells in medium with different serum concentrations. J Orthop Surg Res 2006; 26: 1–9.
15. Bachmeier BE, Nerlich A, Mittermaier N et al. Matrix metalloproteina-se expression levels suggest distinct enzyme roles during lumbar disc her-niation and degeneration. Eur Spine J 2009; 18 (11): 1573–86.
16. Ohtori S, Inoue G, Ito T et al. Tumor necrosis factor-immunoreactive cells and PGP 9.5-immunoreactive nerve fibers in vertebral endplates of patients with discogenic low back pain and Modic Type 1 or Type 2 changes on MRI. Spine 2006; 31 (9): 1026–31.
17. Power C, Frank J, Hertzman C et al. Predictors of low back pain onset in a prospective British study. Am J Public Health 2001; 91 (10): 1671–8.
18. Алексеева Л.И., Чичасова Н.В., Мендель О.И. и др. Рациональный выбор базисной терапии при остеоартрозе. Результаты открытого рандомизированного многоцентрового исследования препарата Артра в России. РМЖ. 2005; 13 (24): 1637–40.
19. Cole TC, Ghosh P, Taylor TKF. Arteparon modifies proteoglican turnover in the intervertebral disk. J Bone J Sure 1998; 70B: 166.
20. Blitterswijk WJ, Jos CM van de Nes, Wuisman P. Glucosamine and chondroitin sulfate supplementation to treat symptomatic disc degenera tion: Biochemical rationale and case report. BMC Complement Altern Med 2003; 3: 2.
