Перспективы клинического применения альфа-липоевой кислоты
СтатьиОпубликовано в журнале:
Consilium Medicum »» Том 3/N 11/2001
В.Н. Храмилин, И.Ю. Демидова, А.К. Рагозин
Кабинет "Диабетическая стопа", ГКБ 1 им. Н. И. Пирогова (главный врач О.В.Рутковский), Москва
* NIS - Neuropathy Impairment Score - комбинированная шкала "нейропатических повреждений" (P.Dyck и соавт., 1997 ), представляет собой совокупную бальную оценку неврологического статуса. NIS (LL) представляет собой модифицированную шкалу для нижних конечностей.
Диабетическая нейропатия (ДН) является одним из наиболее распространенных осложнений сахарного диабета (СД). По данным эпидемиологических исследований, частота ДН при СД варьирует от 5 до 100% в зависимости от используемых методов обследования. Различия в частоте встречаемости обусловлены использованием различных критериев диагностики ДН.
Наиболее ранней и частой формой ДН является диабетическая периферическая полинейропатия (ДПН). У 7,5% больных с впервые выявленным СД типа 2 уже имеются клинические и лабораторные проявления ДПН. Клинические проявления ДПН, такие как боль, парестезии, судороги, онемение, снижение чувствительности и т.д., значительно снижают качество жизни больных СД. Присоединение к имеющимся проявлениям ДПН автономного компонента (сухость и истончение кожи нижних конечностей) представляет серьезную угрозу для формирования синдрома диабетической стопы, который в 50-75% является причиной всех нетравматических ампутаций конечностей у больных СД.
Следует отметить тот факт, что обращаемость пациентов к специалистам, обусловленная симптомами нейропатии и связанными с ней осложнениями, превышает совокупную обращаемость по поводу всех других осложнений СД
Современная классификация ДН (Thomas, 1997):
А. Диффузная нейропатия (полинейропатия)
1. Дистальная симметричная сенсомоторная полинейропатия
2. Автономная нейропатия
а) судомоторная
б) кардиальная
в) гастроинтестинальная
г) урогенитальная
3. Симметричная проксимальная моторная нейропатия (амиотрофия)
В. Очаговая нейропатия (мононейропатия)
1. Краниальная нейропатия
2. Радикулопатия / плексопатия
3. Туннельные синдромы
Автономная ДН является серьезным фактором риска внезапной кардиальной смертности больных СД, нарушения функции желудочно-кишечного тракта (ЖКТ) и мочеполовой системы и имеет следующие клинические проявления:
Кардиальная форма:
- синдром денервированного сердца
- аритмии
- безболевая ишемия миокарда
- риск кардиореспираторной остановки сердца при анестезии
- ортостатическая гипотония
Гастроинтестинальная форма:
- гастропарез
- атония толстого кишечника
Урогенитальная форма:
- атония мочевого пузыря
- эректильная дисфункция
Нарушение иннервации зрачка
Нарушение распознавания гликемии
Нарушение потоотделения
Несмотря на множество теорий развития ДН, основным установленным патогенетическим фактором является гипергликемия. Вызванные гипергликемией метаболические нарушения являются пусковым звеном в патогенезе развития ДН (см. рисунок). Первоначальные метаболические изменения, возникающие в нервных волокнах, ведут к нарушению их функции и последующим структурным изменениям в них. В настоящее время модель развития диабетической нейропатии представляет собой многостадийный процесс, включающий целый каскад патогенетических механизмов, таких как:
1. Активация полиолового пути и снижение активности Na+/К+-АТФазы. Персистирующая гипергликемия активизирует полиоловый путь утилизации глюкозы, что приводит к накоплению в нервной ткани сорбитола, фруктозы и активации протеинкиназы С. Механизмы, посредством которых эти вещества могут повреждать нейроны и их отростки, не до конца ясны. Снижение содержания myo-инозитола и активности Na+/K+-АТФазы приводит к ретенции Na+, задержке жидкости, отеку миелиновой оболочки, снижению количества глиальных клеток аксонов и в конечном итоге к дегенерации периферических нервов.
2. Неэнзиматическое гликозилирование белков. Гликозилирование различных молекулярных структур нейронов способствует аксональной атрофии, нарушению аксонального транспорта, демиелинизации нейронов, что ведет к снижению проводимости по нервным волокнам.
3. Нарушение обмена жирных кислот и в первую очередь дигомо-g-линоленовой и арахидоновой кислот ведет к изменениям в циклооксигеназном цикле, снижению продукции вазоактивных субстанций, тем самым вызывая нарушение эндоневрального кровотока.
4. Нарушение нейротрофики. Снижение синтеза нейротрофных факторов и/или их рецепторов.
5. Оксидативный стресс - избыточное образование свободных радикалов с последующим повреждением мембранных структур нейронов, ДНК и как следствие повреждение функций и структур нервных клеток. Помимо прямого повреждающего действия накопление свободных радикалов способствует нарушению энергетического обмена в нейроцитах и развитию эндоневральной гипоксии. Кроме того, активация прооксидантных систем организма сопровождается усилением атерогенеза и, следовательно, увеличением риска развития сердечно-сосудистых заболеваний.
Патогенез ДН, основные механизмы действия a-липоевой кислоты (на сером фоне ).
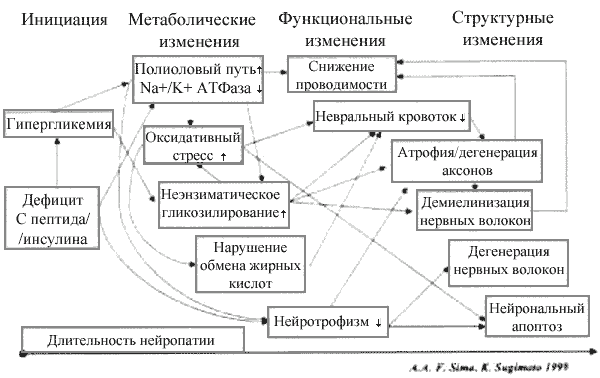
Формирующиеся метаболические нарушения в нейронах ведут к развитию функциональных и структурных изменений в них, а кроме того, способствуют прогрессированию нейронального апоптоза.
Преобладание различных патогенетических механизмов в патогенезе ДН при различных типах СД определяет особенности ее течения у больных сахарным диабетом типа 1 и 2. Так, хорошо известно, что при СД типа 1 нейропатия характеризуется более "агрессивным" течением. Этим же объясняется и неудача клинического применения средств патогенетической терапии у пациентов с различными типами СД. Наиболее наглядным примером является крайне низкая эффективность использования С-пептида при лечении ДН при СД типа 2 в отличие от СД типа 1.
Оценка симптомов по TSS в баллах (боль, жжение, парестезии, онемение)
|
Частота |
Интенсивность |
|||
|
отсутствует |
слабая |
умеренная |
сильная |
|
|
Случайные |
0 |
1,00 |
2,00 |
3,00 |
|
Частые |
0 |
1,33 |
2,33 |
3,33 |
|
Почти постоянные |
0 |
1,66 |
2,66 |
3,66 |
Углубление знаний о преобладающих механизмах патогенеза ДН при СД типа 1 и 2 позволит в дальнейшем более тонко подбирать оптимальную терапию у различных групп больных.
Учитывая роль гипергликемии в патогенезе ДН у больных с обоими типами СД, достижение нормогликемии является основным направлением в профилактике ДПН.
Поддержание нормогликемии в течение длительного времени у больных с выраженными проявлениями ДПН приводит к задержке прогрессирования повреждения периферических нервов, но не способствует быстрой ликвидации ее проявлений. В связи с этим для повышения качества жизни пациентов требуется дополнительное симптоматическое лечение, особенно при наличии болевого синдрома. С этой целью используются различные препараты, такие как антиконвульсанты, мексилетин, капсаицин, антидепрессанты. Воздействуя на отдельные клинические проявления нейропатии, все эти препараты не оказывают влияния на механизмы развития ДПН, т.е. не являются патогенетической терапией. Более того, длительное применение антидепрессантов сопровождается такими нежелательными побочными эффектами, как сонливость, дезориентация, галлюцинации, экстрапирамидные расстройства, ортостатическая гипотензия, сухость во рту, изменение формулы крови, гепатотоксичность. Кроме того, повышается риск смерти вследствие передозировки препарата и его кардиотоксического действия.
В настоящее время список лекарственных средств патогенетической терапии ДН крайне ограничен, а многие из них еще находятся на стадии клинических исследований.
Патогенетическая терапия ДПН допускает использование таких средств, как ингибиторы альдозо-редуктазы, myo-инозитол, аминогуанидин, факторы роста нервной ткани, вазодилататоры, g-линоленовая кислота, ацетил-L-карнитин. К сожалению, судить об эффективности многих из них не представляется возможным, так как они пока использовались лишь в экспериментальных работах.
Выше было отмечено влияние оксидативного стресса на развитие поздних осложнений СД в целом и ДН в частности. В связи с этим терапевтическое применение такого антиоксиданта, как a-липоевая кислота, представляет определенный интерес. На рисунке отображены основные механизмы действия липоевой кислоты, которые включают подавление образования свободных радикалов, улучшение энергетического метаболизма нейронов, восстановление нарушенного эндоневрального кровотока и, как результат, увеличение проводимости по сенсорным и моторным нервным волокнам.
В настоящее время a-липоевая кислота является наиболее эффективным средством в лечении периферической полинейропатии, что подтвердили такие широкомасштабные многоцентровые многолетние исследования, как ALADIN (Alpha-Lipoic Acid in Diabetic Neuropathy) и DEKAN (Deutsche Kardiale Autonome Neuropathie).
Так, в ходе ALADIN Study (1995) была подтверждена высокая клиническая безопасность a-липоевой кислоты и определена эффективная дозировка - 600 мг/сут. В ходе исследования также было отмечено, что кратковременная терапия a-липоевой кислотой внутривенно в дозе 600 мг/сут способствует клиническому регрессу основных проявлений ДПН.
В ходе ALADIN II Study (1999) было показано, что длительная пероральная терапия a-липоевой кислотой статистически достоверно улучшает нейрофизиологические показатели, в частности скорость проведения по сенсорным и моторным нервным волокнам. Эффективность a-липоевой кислоты в терапии и профилактике автономной кардиальной нейропатии была доказана в исследовании DEKAN (1997).
В исследовании ALADIN III (1999) (рандомизированное, плацебо-контролируемое, двойное слепое исследование эффективности курсового применения a-липоевой кислоты в терапии периферической ДПН) участвовали 503 пациента, которые были рандомизированы в 3 группы, идентичные по составу и клиническим характеристикам.
Оценку эффективности терапии полинейропатии в исследовании ALADIN Study (1995) проводили с использованием показателя NSS - шкалы симптомов нейропатии. NSS позволяет дать оценку субъективным ощущениям пациента в баллах.
В ходе исследования ALADIN III (1999) оценку эффективности терапии проводили с использованием показателей TSS. Шкала общих симптомов, NIS и NIS(LL)*. TSS используется для оценки степени выраженности ДПН в баллах по интенсивности наиболее часто встречающихся жалоб (боль, парестезии, онемение, жжение). Показатель TSS может колебаться от 0 (отсутствие симптомов) до 14,64 баллов (все симптомы сильной интенсивности и почти постоянно присутствуют (см. таблицу). Значение показателя TSS ниже 2 баллов является клинически незначимым.
В ходе исследования ALADIN III (1999) не отмечено статистически достоверного изменения показателей TSS между группами больных, получающими липоевую кислоту и плацебо, как после 3-недельного курса внутривенной терапии, так и через 7 мес последующего наблюдения. Одной из вероятных причин подобного явления может быть высокая межцентровая вариабельность в оценке симптомов нейропатии. Однако следует отметить статистически достоверное снижение балльной оценки NIS на фоне внутривенного введения 600 мг липоевой кислоты через 3 нед терапии по сравнению с группой плацебо (р=0,016). Следует подчеркнуть, что NIS представляет собой совокупную бальную оценку неврологического статуса, признанную наиболее удачной в качестве критерия оценки неврологического статуса у пациентов с нейропатиями в клинических исследованиях. В ходе последующего 6-месячного периода пероральной терапии отмечено статистически недостоверное (однако пограничное с ним) снижение показателей NIS в группе пациентов, получавших a-липоевую кислоту, в отличие от группы плацебо на 1,5 балла (р=0,09). Согласно рекомендациям Peripheral Nerve Society получение различий в 2 балла и более в ходе исследования эффективности терапии полинейропатии свидетельствует о клинической эффективности исследуемого препарата. Согласно исследованиям, проведенным Dyck и соавт., продолжительность исследований, посвященных изучению влияния того или иного метода терапии на прогрессирование симптоматики нейропатии, должно составлять как минимум 3 года и включать минимум по 70 пациентов в каждой из исследуемых групп. В этой ситуации различия в 2 балла и более в NIS будут свидетельствовать о достоверной терапевтической эффективности исследуемого метода лечения. В этом контексте становится очевидным тот факт, что в данном кратковременном 7-месячном исследовании полученный результат (различия в 1,5 балла) может рассматриваться как положительный и вполне достоверный.
Помимо применения a-липоевой кислоты в терапии периферической и кардиальной нейропатии появляются данные о возможности использования ее в терапии других осложнений СД. Так, Keegan и соавт. отметили под воздействием a-липоевой кислоты восстановление функции нитрергических сосудорасширяющих нервных волокон, иннервирующих кавернозные тела, определив тем самым, возможность применения a-липоевой кислоты в терапии эректильной дисфункции при СД.
M. Melhem и соавт. выявили протективное действие a-липоевой кислоты в развитии диабетической нефропатии у животных, больных СД.
В последнее время появляются данные о профилактическом применении a-липоевой кислоты при диабетической ретинопатии.
Вероятнее всего, и накопленный клинический опыт это подтверждает, курсовым лечением полностью или на длительный срок подавить оксидативный стресс невозможно. Именно поэтому в последнее время появляется все больше данных о целесообразности длительного применения a-липоевой кислоты с профилактической и лечебной целью.
Суммируя все изложенное, можно определить основные направления терапевтического использования a-липоевой кислоты:
- профилактика и лечение диабетической периферической полинейропатии;
- профилактика и лечение автономной нейропатии;
- профилактика диабетической ретинопатии (?);
- профилактика диабетической нефропатии (?);
- жировая дистрофия печени.
Литература:
1.Apfel SC, Kessler JA, Adornato BT, et al. and the NGF Study Group: Recombinant human nerve growth factor in the treatment of diabetic polyneuropathy. Neurology 51:695-702, 1998
2.Brownlee M. Advanced products of nonenzymatic glycosylation and the pathogenesis of diabetic complications. In: Rifkin H., and Porte D. (Eds.) Diabetes Mellitus: Theory and Practice. New York: Elsevieer Science. - 1990. - 279-291.
3.Capsaicin Study Group: effect of treatment with capsaicin on daily activities of patients with painful diabetic neuropathy. Diabetes Care 15:159-165, 1992.
4.Capsaicin Study Group: Treatment of painful diabetic neuropathy with topical capsaicin. Arch Intern Med 1991.
5.Dejgard A, Petersen P, Kastrup J: Mexiletine for treatment of chronic painful diabetic neuropathy. Lancet 8575-8576, 1988.
6.Diabetes Control and Complication Trial Research Group. Effect of Intensive diabetes treatment on nerve conduction in the Diabetes Control and Complications Trial. // Ann Neurol. - 1995. - 38. - 869-880.
7.Dimpfel W., Spuler M., Pierau F-K., et al. Thioctic acid induces dose-dependent sprouting of neurites in cultured rat neuroblastoma cell. // Dev Pharmacol Ther. - 1990. - 14. - 193 - 199.
8.Dyck P.J, Davies et al. Longitudinal assessment of diabetic polyneuropathy using a composite score in the Rochester Diabetic Neuropathy Study cohort. Neurology July 1997; 49:229-239.
9.Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group. Lancet 1998;352:854-65.
10.Fedele D, Giugliano D: Peripheral diabetic neuropathy: Current recommendations and future prospects for its prevention and management. Drugs 54:414-421, 1997
Henry S.H., Alexander C.A., Sener E.K. Relative mortality from overdose of antidepressants. // BMJ. - 1995. - 310. - 221 - 224.
11.Hounsom L, Horrobin DF, Tritschler H, et al: A lipoic acid-gamma linolenic acid conjugate is effective against multiple indices of experimental diabetic neuropathy. Diabetologia 41:839-843, 1998.
12.Jakobsen J., Christiansen J.S., Kristoffersen I., et al. Autonomic and somatosensory nerve function after 2 years of continuous subcutaneous insulin infusion in Type 1 diabetes. // Diabetes. - 1988. - 37. - 452-455.
13.Kemplay S., Martin P., Wilson S. The effects of thioctic acid on motor nerve terminals in acrylamide-poisoned rats. Neuropathol Appl Neurobiol. - 1988. - 14. - 275 - 288.
14.Low P., Lagerlund T., McManis P. Nerve blood flow and oxygen delivery in normal, diabetic, and ischemic neuropathy. // Int Rev Neurobiol. - 1989. - 31. - 355 - 438.
15.Low P.A., Nickander K.K. Oxygen free radical effects in sciatic nerve in experimental diabetes. // Diabetes. - 1991. - 40. - 873 - 877.
16.Max M.B., Lynch S.A., Muir J., et al. Effects of desipramine, amitriptyline, and fluoxwtine on paine in diabetic neuropathy. // N. Engl. J. Med. - 1992. - 326. - 1250 - 1256.
17.McQuay H, Carroll D, Jadad AR, et al: Anticonvulsant drugs for management of pain: a systematic review. Brit Med J 311:1047-1052, 1995.
18.McQuay HJ, Tramer M, Nye BA, et al: A systematic review of antidepressants in neuropathic pain. Pain 68(2-3):217-227, 1996.
19.Mona F. Melhem, Patricia A. Craven, Frederick R. DeRubertis Effects of Dietary Supplementation of alpha-Lipoic Acid on Early Glomerular Injury in Diabetes Mellitus Journal of the American Society of Nephrology 12 - 1 January 2001
20.Nickander K.K., Schmelzer J.D., Rohwer D.A., et al. Effect of a-tocopherol deficiency on indices of oxidative stress in normal and diabetic peripheral nerve. // J Neurol Sci. - 1994. - 126. - 6. - 14.
21.Obrosova IG, Van Huysen C, Stevens MJ, et al: Evaluation of alpha 1 adrenoceptor antagonist on diabetes-induced changes in nerve function, metabolism, and antioxidative defense [Abstract 0229]. 59th Annual Scientific Sessions of ADA, San Diego, CA, 1999.
22.Oskarsson P, Ljunggren J-G, Lins P-E, the Mexiletine Study Group: Efficacy and safety of mexiletine in the treatment of painful diabetic neuropathy. Diabetes Care 20:1594-1597, 1997.
23.Pfeifer MA, Schumer MP, Gelber DA: Aldose reductase inhibitors: The end of an era or the need for different trial designs. Diabetes 46(Suppl. 2):S82-S89, 1997.
Pirart J. Diabetes mellitus and its degenerative complications: a prospective study of 4,400 patients observed between 1947 and 1973. // Diabetes Care. - 1978. - 1:168-188.
24.Quatraro A., Roca P., Donzella C., Acampora R., et al. Acetyl-L-carnitine for symptomatic diabetic neuropathy. // Diabetologia. - 1995. - 38. - 123.
PRIVATE "TYPE=PICT;ALT=["Reljanovic. Treatment of diabetic polyneuropathy with the antioxidant thioctic acid (alpha-lipoic acid): a two year multicenter randomized double-blind placebo-controlled trial (ALADIN II). Alpha Lipoic Acid in Diabetic Neuropathy. - Free Radic Res - 1999 Sep; 31(3): 171-9
25.Sima, Sugimoto. Experimental diabetic neuropathy: an update. Diabetologia (1999) 42:773-778.
26.Sindrup S.H. Antidepressant in the treatment of deabetic neuropathy symptoms. Pharmacodymanic, -kinetic, and -genetic aspects. // Dan Med Bull. - 1994. - 41. - 66 - 78.
27.Soren H. Sindrup MD, Troels S. Jensen MDPharmacologic treatment of pain in polyneuropathy. Neurology 2000-7
28.Stevens MJ. Effects of DL-alpha-lipoic acid on peripheral nerve conduction, blood flow, energy metabolism, and oxidative stress in experimental diabetic neuropathy. Diabetes - 2000 Jun; 49(6): 1006-15
29.Stracke H, Meyer UE, Schumacher HE, et al: Mexiletine in the treatment of diabetic neuropathy. Diabetes Care. 15:1550-1555, 1992.
30.Thomas P.K., Tomlinson D.R. Diabetic and hypoglycemic neuropathy. In Dyck PJ, Thomas PK, Griffin JW, Low PA, and Poduslo JF. (Eds). Peripheral Neuropathy.W.B. Saunders Co. Philadelphia. - 1993. - 1219-1250.
31.Vinik A.I. Neuropathic Complications. American Diabetes Association's 59th Scientific Sessions. Day 3 - June 21, 1999. - oral presentation.
32.Vinik A.I., Newlon P.G., Lauterio T.J., et al. Nerve survival and regeneration in diabetes. Diabetes Rev. - 1995. - 3. - 139-157.
33.Vinik A.I., Pittenger G.L., Hopkins L.C. Autoimmune mechanisms in the pathogenesis of diabetic neuropathy. In:Eisenbarth G. (Eds) Molecular Mechanism of Endocrine and Organ Specific Autoimmunity. Austin, TX: R.G. Landes Company. - 1998. - 217-251.
34.Vinik AI: Treatment of diabetic polyneuropathy (DPN) with recombinant human nerve growth factor (rhNGF) [Abstract 0232]. 59th Annual Scientific Sessions of ADA, San Diego, CA, 1999.
35.Young M.J., Boulton A.J.M. McLeod A.F. et al. A multicentre study of prevalence of diabetic peripheral neuropathy in UK hospital clinic population. // Diabetlogia. - 1993. - 36. - 150 - 154.
36.Ziegler D. Alpha-lipoic acid in the treatment of diabetic polyneuropathy in Germany: current evidence from clinical trials. - Exp Clin Endocrinol Diabetes - 1999; 107(7): 421-30
37.Ziegler D., Hanefeld M., Ruhnau K.J., et al. Treatment of symptomatic diabetic peripheral neuropathy with the anti-oxidant a-lipoic acid. A 3-week Multicentre randomized conrolled trial (ALADIN study). // Diabetologia. - 1995. - 38. - 1425 - 1433.
38.Ziegler D., Schatz H., Conrad F., et al. Effects of threatment with the antioxidant a-lipoic acid on cardiac autonomic neuropathy in NIDDM patients. A 4-month randomized controlled multicenter trial (DEKAN Study). // D0ab Care. - 1997. - 20. - 3. - 369 - 373.
39.Ziegler, Hanefeld et al. Treatment of Symptomatic Diabetic Polineuropathy With the Antioxidant a-Lipoic Acid (ALADIN III Study). Diabetes Care, 1999. 22-8:12961301
40.Zielgler D., Dannehl K., Wiefels K., et al Differential effects of near-normoglycaemia for 4 years on somatic nerve dysfunction and heart rate variation in type 1 diabetic patients. // Diabet Med. - 1992. - 9. - 622 – 629 Moore A, McQuay H. Что такое NNT? Клиническая Фармакология и терапия. 2000-2:84-86.
