Лечебно-профилактические мероприятия у девочек с маточными кровотечениями пубертатного периода
СтатьиОпубликовано в журнале:
«Доктор.Ру»; № 1(79); 2013; стр. 15-21.
А. Б. Хурасева
Резюме
Цель исследования: изучить особенности клинического течения маточных кровотечений пубертатного периода (МКПП) у девушек, родившихся с малой и большой массой тела, и оптимизировать лечебно-профилактические мероприятия у этих пациенток.
Дизайн: ретроспективное и проспективное исследование.
Материал и методы. Обследованы 530 девочек-подростков в возрасте 13-18 лет, распределенных на три группы: I — 170 девушек, родившихся с малой массой тела (2000-2800 г), II (контрольная) — 182 девушки, родившиеся с нормальной массой тела (3200-3600 г), III — 178 девушек, родившихся с большой массой тела (4000-4800 г). При обследовании применялись общеклинические, гормональные и эхографические методы.
Результаты. Частота МКПП у девушек, родившихся с большой массой тела (39,3%), оказалась выше, чем в других группах. У девушек с малой массой тела при рождении имел место гипоэстрогенный тип кровотечения, а с большой массой тела — гиперэстрогенный тип МКПП. Разработан дифференцированный алгоритм диагностики и лечения МКПП в зависимости от веса при рождении и гормонального профиля. Проведены лечебно-профилактические мероприятия, направленные на предупреждение нарушений репродуктивного здоровья, с учетом выявленных особенностей.
Заключение. Учет конституциональных особенностей девочек-подростков позволяет правильно подобрать гемостатическую терапию и обеспечивает лечебно-профилактический эффект на этапе дальнейшей регуляции менструального цикла. Оптимальным способом коррекции менструального цикла и профилактики рецидивов кровотечений у девочек-подростков является гормональная терапия.
Ключевые слова: нарушения менструального цикла, маточные кровотечения пубертатного периода (МКПП), подростки, профилактика, гормональные контрацептивные средства.
В последние годы прослеживается общая тенденция к увеличению гинекологической заболеваемости у подростков, в структуре которой одно из ведущих мест занимают расстройства менструального цикла [25].
Маточные кровотечения пубертатного периода (МКПП) принадлежат к числу наиболее частых форм нарушения менструальной функции. В структуре гинекологических заболеваний подростков частота МКПП варьирует от 10 до 38% [2, 12, 25]. МКПП являются причиной более 50% всех обращений девушек к гинекологу [23].
Подростковый возраст считается критическим, поскольку в этот период завершается формирование всех морфологических и функциональных структур организма, в результате чего реализуется индивидуальная, генетически детерминированная программа его развития [29, 30].
Большинство авторов сходятся во мнении, что фактором, предрасполагающим к развитию МКПП, является функциональная незрелость основных звеньев регуляции ЦНС, или генетически обусловленная недостаточность стероидогенеза в яичниках [6-8, 17, 19, 24].
В настоящее время МКПП характеризуются затяжным течением с частыми рецидивами и длительной утратой трудоспособности [4]. По мнению Е. В. Уваровой и соавт. (2004), «возможной причиной рецидивов является недоучет инициирующего и основного факторов патогенеза заболевания, так как нередко клиницисты при ведении девочек с маточными кровотечениями останавливаются на этапе достижения гемостаза, тем самым подменяют заболевание всей репродуктивной системы одним из симптомов — маточным кровотечением» [24].
Данный подход объясняет необходимость оценивать функционирование репродуктивной системы с учетом общего развития организма, которое определено наследственными и приобретенными факторами [1].
Вместе с тем своевременная коррекция нарушений регуляции овариально-менструального цикла и профилактика рецидивов МКПП у девочек-подростков позволят предотвратить возможные проблемы на этапе реализации репродуктивной функции.
Цель исследования: изучить особенности клинического течения МКПП у девушек, родившихся с малой и большой массой тела, и оптимизировать лечебно-профилактические мероприятия у данного контингента больных.
Материал и методы
На клинической базе кафедры акушерства и гинекологии лечебного факультета Курского государственного медицинского университета и на базе женской консультации № 7 г. Курска проведено комплексное ретроспективное и проспективное обследование 530 девочек-подростков в возрасте 13-18 лет. Все девочки родились в срок. Основным критерием отбора пациенток служила масса тела при рождении в ее крайних вариантах.
Первую группу (основную) составили 170 девочек, родившихся с малой массой тела (2000-2800 г), вторую (контрольную) — 182 девочки, родившиеся с нормальной массой тела (3200-3600 г), и третью (основную) — 178 крупных при рождении девочек (4000-4800 г). Пациентки были подразделены на три возрастные подгруппы: 13-14, 15-16 и 17-18 лет.
Проводили комплексное обследование, включавшее общеклинические, гормональные и эхографические методы. Анализировали данные анамнеза об особенностях соматической патологии, менструальной функции и о течении полового созревания. УЗИ органов малого таза выполняли на аппаратах с использованием трансабдоминального конвексного датчика частотой 3,5 МГц (с предварительной подготовкой кишечника и при наполненном мочевом пузыре) и трансвагинальных датчиков частотой 7,5 и 5,0 МГц (при наличии половой жизни в анамнезе). Сканирование осуществляли в режиме реального времени на 5-7, 14-16 и 25-27-й дни менструального цикла или на фоне аменореи. Функциональное состояние гипофиза, щитовидной железы, надпочечников и яичников оценивали на 5-7 и 20-23-й дни менструального цикла независимо от наличия овуляции. Концентрации фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, тиреотропного гормона (ТТГ), трийодтиронина, трийодтироксина в плазме крови исследовали с использованием оборудования и тест-систем ИФА «ДИАплюс» (Россия). Уровни кортизола, эстрадиола, прогестерона, тестостерона изучали с помощью оборудования и тест-систем ИФА фирмы Amersham (США).
Статистический анализ результатов исследования проведен с помощью программы многомерного анализа «Статистика 6» с использованием методов вариационной статистики, критерия Фишера — Стьюдента (t). Результаты представлены в виде M ± m (M — средняя величина параметра, m — стандартная ошибка средней величины). За статистически значимые принимали различия при p < 0,05.
Результаты и обсуждение
Пусковой механизм развития МКПП в период физиологической неустойчивости функционирования репродуктивной системы может быть связан с любым неблагоприятным фактором, вызывающим нарушение взаимодействия основных уровней регуляции [8, 24, 30].
Некоторые литературные источники указывают на то, что неблагоприятное течение антенатального периода предрасполагает к развитию эндокринопатий, в том числе МКПП, в постнатальном периоде онтогенеза [5]. Это нашло подтверждение в нашей работе: у девушек, родившихся с большой массой тела, МКПП отмечались в 5 раз чаще, чем у их сверстниц, родившихся с нормальной массой тела (39,3% против 8,2%). У девушек, родившихся с малой массой тела, частота МКПП составляла 12,9%.
Хронические и острые инфекционные заболевания являются неблагоприятным фоном для развития МКПП. В период полового созревания инфекционно-токсическое влияние нарушает функцию гипоталамических структур, регулирующих становление менструальной функции, а такие заболевания, как краснуха и эпидемический паротит, оказывают повреждающее воздействие на фолликулярный аппарат [3, 23].
Наше исследование показало, что, по состоянию общесоматического здоровья только 10,0% девочек первой группы и 12,9% девочек третьей группы были признаны условно здоровыми (табл. 1). Как следует из данных по соматической заболеваемости в группах обследованных (см. табл. 1), в целом частота всех представленных по нозологическим формам инфекционно-воспалительных заболеваний оказалась в 1,4 раза выше у девочек, родившихся с большой массой тела, и в 1,1 раза выше у девочек, родившихся с малой массой тела, по сравнению с их сверстницами, имевшими нормальную массу тела при рождении.
Таблица 1
Сравнительная характеристика групп по структуре соматической заболеваемости
| Параметры |
I группа (n = 170) |
II группа (n = 182) |
III группа (n = 178) | p | |||
| абс. | M ± m, % | абс. | M ± m, % | абс. | M ± m, % | ||
| Не болели | 17 | 10,0 ± 2,3 | 34 | 18,7 ± 2,9 | 23 | 12,9 ± 2,5 | р1-2 < 0,05 |
| Экссудативный диатез | 34 | 20,0 ± 3,1 | 27 | 14,8 ± 2,6 | 31 | 17,4 ± 2,8 | р > 0,05 |
| Корь | 28 | 16,5 ± 2,8 | 16 | 8,8 ± 2,1 | 31 | 17,4 ± 2,8 | р1-2 < 0,05 р2-3 < 0,05 |
| Скарлатина | 23 | 13,5 ± 2,6 | 16 | 8,8 ± 2,1 | 39 | 21,9 ± 3,1 | р2-3 < 0,01 |
| Ветряная оспа | 10 | 5,9 ± 1,8 | 0 | 0 | 39 | 21,9 ± 3,1 | р1-2 < 0,01 p1-3 < 0,001 p2-3< 0,001 |
| Паротит эпидемический | 34 | 20,0 ± 3,1 | 16 | 8,8 ± 2,1 | 23 | 12,9 ± 2,5 | р1-2 < 0,01 |
| Частые ОРВИ | 96 | 56,5 ± 3,8 | 81 | 44,5 ± 3,7 | 124 | 69,7 ± 3,5 | р1-2 < 0,05 p2-3 < 0,001 |
| Грипп | 23 | 13,5 ± 2,6 | 29 | 15,9 ± 2,7 | 46 | 25,8 ± 3,3 | р1-3 < 0,01 р2-3 < 0,05 |
| Ангина | 28 | 16,5 ± 2,8 | 34 | 18,7 ± 2,9 | 54 | 30,3 ± 3,5 | р1-3 < 0,01 р2-3 < 0,05 |
| Бронхит | 28 | 16,5 ± 2,8 | 18 | 9,9 ± 2,2 | 31 | 17,4 ± 2,8 | р2-3 < 0,05 |
| Пневмония | 23 | 13,5 ± 2,6 | 34 | 18,7 ± 2,9 | 46 | 25,8 ± 3,3 | р1-3 < 0,01 |
| Отит | 40 | 23,5 ± 3,3 | 22 | 12,1 ± 2,4 | 46 | 25,8 ± 3,3 | р1-2 < 0,01 p2-3 < 0,01 |
| Гайморит | 4 | 2,4 ± 1,2 | 9 | 4,9 ± 1,6 | 8 | 4,5 ± 1,6 | р > 0,05 |
| Бронхиальная астма | 4 | 2,4 ± 1,2 | 0 | 0 | 8 | 4,5 ± 1,6 | р1-2 < 0,05 p2-3 < 0,05 |
| Аллергические заболевания | 40 | 23,5 ± 3,3 | 27 | 14,8 ± 2,6 | 62 | 34,8 ± 3,6 | р1-2 < 0,05 p2-3 < 0,001 p1-3 < 0,05 |
Одной из причин МКПП является нарушение функции щитовидной железы [15, 28]. По результатам нашего исследования гипотиреоз был диагностирован в 8,4 ± 2,1% случаев, и только у девочек, родившихся с большой массой тела (p1-3 < 0,001 и Р2-3 < 0,001). В группе девочек, имевших при рождении малую массу тела, концентрации ТТГ, трийодтиронина и трийодтироксина колебались в пределах физиологических показателей, что свидетельствовало о нормальной функции щитовидной железы. Напротив, в группе девочек, родившихся с большой массой тела, в системе «гипофиз — щитовидная железа» было выявлено увеличение показателя ТТГ.
Не менее важным фактором в патогенезе МКПП является отклонение массы тела — в сторону как избытка, так и недостатка. При дефиците и при избыточной массе тела у подростков нарушение менструальной функции наблюдается соответственно в 2 и 4 раза чаще, чем у девушек с оптимальной массой тела [5, 11]. Как указывают данные литературы, у девочек-подростков с избыточной массой тела чаще отмечается нарушение ритма менструаций [14].
Это согласуется с полученными нами данными о статистически значимо большей частоте МКПП (39,3%) у девочек, родившихся с большой массой тела, у которых средняя масса тела в пубертатном периоде была на 4 кг больше, чем у сверстниц, родившихся с нормальной массой тела, и на 8 кг больше, чем у девушек, имевших малую массу тела при рождении. Очевидно, что девушки, имевшие при рождении большую массу тела, предрасположены к ожирению в пубертатном периоде, а как известно, в жировой ткани происходит конверсия андростендиона в эстрогены. В данном случае с увеличением массы тела повышается и внегонадный синтез эстрогенов, что также может быть причиной гиперплазии эндометрия и, как следствие, МКПП у пациенток III группы.
Изучение менструального цикла у обследованных пациенток показало, что становление менструальной функции у девушек, родившихся с полярными значениями массы тела, отличалось более поздним возрастом менархе и большей частотой нерегулярного менструального цикла (15,9% в первой группе и 15,7% — в третьей).
МКПП, как правило, возникают через 6-18 месяцев после менархе, обычно на фоне задержки менструации [8]. Одним из главных отличий группы девушек, родившихся с большой массой тела, было то, что у большинства (74,3%) из них МКПП развивались после непродолжительного (до семи месяцев) периода олигоменореи и только у 25,7% пациенток первая менструация осложнилась кровотечением. В то время как у абсолютного большинства (86,4 ± 7,3%) девочек, родившихся с малой массой тела, нарушения появлялись после двухлетнего нормального цикла и только у 13,6 ± 7,3% — после периода олигоменореи.
Для МКПП характерна ановуляция, при которой происходит атрезия фолликулов, не достигших овуляторной стадии зрелости, или персистенция зрелого фолликула. В соответствии с преобладающим влиянием ФСГ или ЛГ в клинической картине МКПП в большей степени проявляется атрезия либо персистенция фолликулов. По данным Е. В. Уваровой, Н. М. Веселовой (2005), у 57,7% девушек с МКПП отмечаются клинические проявления атрезии фолликулов, а у 42,3% — персистенции фолликула. При этом нарушается баланс эстрогенов и прогестерона и, как следствие, развивается абсолютная или относительная гиперэстрогения. В зависимости от уровня эстрогенов МКПП подразделяют на кровотечения гипоэстрогенного и гиперэстрогенного типа [23].
Имеются данные о том, что у 41,3% девушек с МКПП диагностируется гипоэстрогенный, а у 21,2% — гиперэстрогенный тип кровотечения [23]. Наши исследования показали, что у девушек, родившихся с малой массой тела, имеет место гипоэстрогенный тип кровотечения, а у девушек, родившихся с большой массой тела, — гиперэстрогенный тип МКПП. Так, в первой группе концентрация эстрадиола во все возрастные периоды на 5-7 и 20-23-й дни менструального цикла была меньше, чем в других исследуемых группах (табл. 2,3). Тогда как, у девушек, родившихся с большой массой тела, на 20-23-й день менструального цикла в 13-14 и 15-16 лет концентрация эстрадиола статистически значимо превышала этот показатель в других сравниваемых группах, а к 17-18 годам достигала максимальных значений (см. табл. 3).
Таблица 2
Гормональные показатели у девочек сравниваемых групп в возрасте 17-18 лет на 5-7-й день менструального цикла, M ± m
|
Параметры |
I группа (n = 50) | II группа (n = 57) | III группа (n = 59) | p |
| ЛГ, МЕ/л | 4,3 ± 0,5 | 5,7 ± 0,4 | 6,9 ± 0,5 | р1-2 < 0,05 p1-3 < 0,001 |
| ФСГ, МЕ/л | 6,3 ± 0,5 | 2,7 ± 0,5 | 3,9 ± 0,3 | р1-2 < 0,001 p1-3 < 0,001 р2-3 < 0,05 |
| Пролактин, МЕ/л | 249,5 ± 22,0 | 238,1 ± 12,3 | 392,5 ± 22,1 | p1-3 < 0,001 p2-3 < 0,001 |
| ТТГ, мМЕ/л | 1,9 ± 0,8 | 2,9 ± 0,3 | 3,8 ± 0,2 | p1-3 < 0,05 p2-3 < 0,05 |
| Трийодтиронин, нг/мл | 7,7 ± 0,3 | 7,5 ± 0,3 | 8,7 ± 0,2 | p1-3 < 0,05 p2-3 < 0,01 |
| Трийодтироксин, нг/мл | 20,0 ± 3,9 | 19,4 ± 0,4 | 20,4 ± 0,4 | р > 0,05 |
| Кортизол, нмоль/л | 344,1 ± 12,5 | 281,3 ± 16,0 | 335,5 ± 16,4 | р1-2 < 0,01 p2-3 < 0,05 |
| Эстрадиол, нмоль/л | 110,6 ± 22,2 | 182,2 ± 18,8 | 265,0 ± 14,1 | р1-2 < 0,05 p1-3 < 0,01 p2-3 < 0,01 |
| Прогестерон, нмоль/л | 0,9 ± 0,1 | 1,9 ± 0,3 | 0,6 ± 0,2 | р1-2 < 0,01 p2-3 < 0,001 |
| Тестостерон, нмоль/л | 2,2 ± 0,8 | 1,9 ± 0,5 | 4,0 ± 0,7 | р2-3 < 0,05 |
Прогестерон образуется в незначительном количестве. В результате не происходит секреторной трансформации эндометрия, что препятствует его отторжению и способствует длительному кровотечению. Базальный уровень прогестерона у девочек, родившихся с малой и большой массой тела, на протяжении пубертатного периода был ниже возрастных норм. Так, в этих группах в возрасте 17-18 лет уровень прогестерона на 20-23-й день менструального цикла был в 2-2,5 раза ниже, чем у девочек, родившихся с нормальной массой тела (см. табл. 3).
Отдельного обсуждения заслуживает вопрос терапии МКПП и профилактики их рецидивов. Лечение девушек с МКПП должно быть комплексным и патогенетически обоснованным. Как подтвердили данные нашего исследования, девочек, родившихся с полярными значениями массы тела, следует выделять в группу высокого риска по развитию МКПП. Такие девочки должны находиться под диспансерным наблюдением с проведением совместного и согласованного консультирования и лечения педиатрами, неврологами, эндокринологами и гинекологами-ювенологами.
Важным аспектом комплексной терапии МКПП является лечение анемии. Вполне обоснованным и безопасным, что особенно важно при использовании лекарственного средства у детей и подростков, считается применение солей двухвалентного железа, которые усваиваются гораздо лучше, чем соли трехвалентного железа [16, 22].
При выборе антианемических препаратов также следует учитывать, что жидкие формы в меньшей степени повреждают слизистую желудочно-кишечного тракта, по сравнению с твердыми. Вместе с тем за счет жидкой консистенции препарата достигается максимальный контакт с ворсинками кишечника, что обеспечивает наилучшую способность солевого соединения к всасыванию при минимальной его токсичности [9].
Кроме того, необходимо принимать во внимание, что для синтеза гемоглобина наравне с железом требуются такие микроэлементы, как медь и марганец [20].
Всем вышеперечисленным критериям отвечает комплексный антианемический мультиэлементный препарат ТОТЕМА производства французской компании «Лаборатория Иннотек Интернасиональ», который обеспечивает одновременное поступление в организм железа, меди и марганца в сбалансированных количествах [9]. Очень важно, что медь и марганец в составе супероксиддисмутазы обеспечивают адекватную антиоксидантную защиту клеток, поэтому ТОТЕМА в 2-3 раза реже сульфатов вызывает побочные эффекты [21].
Для лечения железодефицитной анемии у девочек с МКПП мы использовали комплексный препарат ТОТЕМА (у детей старше 12 лет — 2-4 ампулы в день, до 12 лет — 5-10 мг/кг в день) в течение трех месяцев. Показатели гемограммы (гемоглобин, эритроциты, цветной показатель, сывороточное железо) исследовали до лечения и ежемесячно на фоне проводимой терапии. В результате лечения уже через месяц статистически значимо повысились уровни гемоглобина и эритроцитов (118,5 ± 3,2 г/л против 100,2 ± 2,3, р < 0,001, и 3,84 ± 0,25 х 1012 /л против 3,12 ± 0,21 х 1012/л, р < 0,005, соответственно).
По результатам комплексного обследования девушек, родившихся с полярными значениями массы тела, нами предложен алгоритм дифференцированного подхода к диагностике и лечению МКПП с учетом индивидуальных особенностей и в зависимости от уровня эстрогенной насыщенности (рис.). На наш взгляд, учет конституциональных особенностей девочек-подростков не только позволяет правильно подобрать гемостатическую терапию, но и обеспечивает необходимый лечебно-профилактический эффект на этапе дальнейшей регуляции менструального цикла.
Важное значение при ведении пациенток с МКПП имеет период реабилитации, который должен сопровождаться восстановлением ритма менструаций и появлением овуляции. В среднем его продолжительность составляет от 6 до 12 месяцев, в течение этого времени устраняются этиологические факторы МКПП, достигается нормализация функции гипоталамо-гипофизарно-яичниковой системы.
Таблица 3
Гормональные показатели у девочек сравниваемых групп в возрасте 17-18 лет на 20-23-й день Wменструального цикла, M ± m
Параметры | I группа (n = 50) | II группа (n = 57) | III группа (n = 59) | p |
| ЛГ, МЕ/л | 8,4 ± 0,4 | 9,8 ± 0,7 | 25,5 ± 1,3 | р1-3 < 0,001 р2-3 < 0,001 |
| ФСГ, МЕ/л | 8,2 ± 1,4 | 4,6 ± 0,5 | 7,7 ± 0,9 | р1-2 < 0,05 р2-3 < 0,01 |
| Пролактин, МЕ/л | 227,9 ± 38,5 | 315,5 ± 22,7 | 399,9 ± 24,3 | р1-2 < 0,05 р1-3 < 0,001 р2-3 < 0,05 |
| ТТГ, мМЕ/л | 2,6 ± 0,7 | 2,7 ± 0,6 | 5,3 ± 0,9 | р1-3 < 0,05 р2-3 < 0,05 |
| Трийодтиронин, нг/мл | 7,9 ± 0,5 | 7,8 ± 0,3 | 8,4 ± 0,4 | p > 0,05 |
| Трийодтироксин, нг/мл | 19,7 ± 1,7 | 20,0 ± 1,4 | 20,2 ± 1,4 | p > 0,05 |
| Кортизол, нмоль/л | 302,5 ± 13,5 | 310,0 ± 12,7 | 344,8 ± 12,2 | р1-3 < 0,05 р2-3 < 0,05 |
| Эстрадиол, нмоль/л | 315,5 ± 27,5 | 435,1 ± 28,2 | 644,2 ± 50,6 | р1-2 < 0,01 р1-3 < 0,01 р2-3 < 0,001 |
| Прогестерон, нмоль/л | 5,6 ± 1,7 | 10,8 ± 1,4 | 4,4 ± 1,7 | р1-2 < 0,05 р2-3 < 0,05 |
| Тестостерон, нмоль/л | 2,5 ± 0,7 | 1,7 ± 0,5 | 4,2 ± 0,9 | р2-3 < 0,05 |
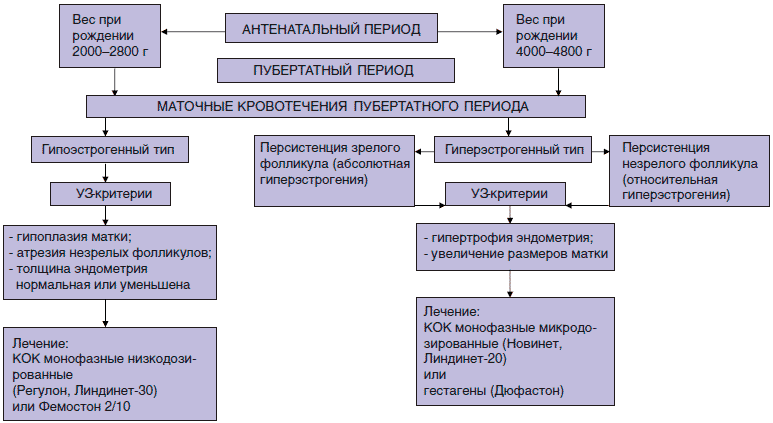
Рис. Алгоритм дифференцированного подхода к диагностике и лечению маточных кровотечений пубертатного периода с учетом патогенеза у девочек, родившихся с полярными значениями массы тела.
На первом этапе всем пациенткам с МКПП в анамнезе мы проводили лечение соматической патологии, санацию очагов хронической инфекции, нормализацию тканевого обмена, повышение резистентности организма. При выявлении гормональных отклонений работы периферических эндокринных желез (щитовидная железа, надпочечники) осуществляли необходимую коррекцию совместно с эндокринологом. Наряду с этим рекомендовали соблюдение режима дня, полноценное питание, нормализацию массы тела при отклонении от нормы. В комплексе лечебно-профилактических мероприятий использовали седативную терапию и циклическую витаминотерапию в течение трех менструальных циклов.
Оптимальным способом коррекции менструального цикла и профилактики рецидивов кровотечений у девочек-подростков является гормональная терапия [10, 13, 17, 18, 23].
Поскольку известно, что гормональные контрацептивы обладают рядом положительных неконтрацептивных эффектов, у девочек 15-18 лет для регуляции ритма менструации использовали монофазные комбинированные эстроген-гестагенные препараты, в состав которых входят прогестагены третьего поколения дезогестрел или гестоден [12, 27]. Выбор препарата проводили с учетом эстрогенной насыщенности. Так как у маловесных при рождении девочек имела место гипоэстрогения, коррекцию у них выполняли низкодозированными КОК (Регулон, Линдинет-30). У девочек, родившихся с большой массой тела, принимая во внимание гиперэстрогению и недостаточность лютеиновой фазы, использовали микродозированные КОК или гестагены во вторую фазу менструального цикла.
Вместе с тем КОК, содержащие прогестагены третьего поколения, не только позволяют осуществлять лечение дисфункциональных расстройств менструального цикла, но и оказываются эффективными в профилактике пролиферативных гормонозависимых заболеваний [26].
Ввиду полученных данных о том, что девушки, родившиеся с большой массой тела, относятся к группе риска по возникновению гиперпластических процессов эндометрия, особое значение имеет профилактика пролиферативных гормонозависимых заболеваний. Учитывая это, при назначении КОК целесообразно выбирать препараты с минимальным содержанием этинилэстрадиола, т. е. микродозированные КОК, которые содержат прогестины, обладающие сильной гестагенной активностью и оказывающие благоприятное влияние на эндометрий, такие как дезогестрел и гестоден.
Контроль эффективности проводимых комплексных лечебно-профилактических мероприятий осуществлялся при динамическом обследовании девушек через каждые 3 месяца.
Заметная стабилизация менструального цикла у девочек 13 лет была отмечена на третьем месяце комплексной терапии (в старших возрастных группах — на 1,5-2 месяца позже) и характеризовалась снижением числа нерегулярных менструальных циклов в 2 раза одновременно с уменьшением явлений гипо- или гиперменструального синдрома, появлением большего числа двухфазных менструальных циклов.
Проведенный комплекс лечебно-профилактических мероприятий способствовал улучшению гормонального статуса. Положительная динамика проявилась нормализацией содержания гонадотропных гормонов. Наблюдалось нарастание уровня прогестерона до 2,4 ± 0,8 нмоль/л, что соответствовало нормативным значениям. В группе девочек, родившихся с малой массой тела, отмечено увеличение содержания эстрадиола в 2 раза, в среднем оно достигло на 5-7-й день менструального цикла 210,7 ± 23,8 нмоль/л.
Заключение
У девушек, родившихся с полярными значениями массы тела, имеет место как незрелость гипоталамо-гипофизарно-яичниковой системы, так и несовершенство рецепторного аппарата яичников. У девушек, имевших малую массу тела при рождении, маточные кровотечения пубертатного периода относятся к гипоэстрогенному типу, а у девушек, имевших большую массу тела, — к гиперэстрогенному типу.
Одним из эффективных методов лечения маточных кровотечений пубертатного периода являются КОК, назначение которых следует проводить с учетом гормонального профиля. Целесообразно учитывать индивидуальные конституциональные особенности девушек-подростков не только на этапе остановки кровотечения, но и при проведении профилактических мероприятий, что позволит снизить частоту рецидивов маточных кровотечений.
ЛИТЕРАТУРА
1. Абабкова Г. М. Нарушение менструальной функции в пубертатном периоде // Здоровье Украины. 2002. № 1. С. 9-14.
2. Айламазян Э. К. Гинекология от пубертата до менопаузы. М.: МЕДпресс-информ, 2006. 496 с.
3. Антипина Н. Н. Состояние репродуктивной системы у девочек и женщин с нарушением менструальной функции на фоне хронического тонзиллита: Автореф. дис. ... докт. мед. наук. М., 2004. 36 с.
4. Веселова Н. М. Сравнительный анализ показателей психологического стресса при маточных кровотечениях и нормальном менструальном цикле // Журн. Рос. общества акушеров-гинекологов. 2004. № 2. С. 41-45.
5. Вихляева Е. М. Руководство по эндокринной гинекологии. М.: МИА, 2002. 596 с.
6. Гоготадзе И.Н. Ювенильные кровотечения: методическое пособие: метод. пособие. СПб., 2003. 20 с.
7. К вопросу о стандартах диагностики и терапии при маточных кровотечениях пубертатного периода/ Е. В. Уварова [и др.] // Рус. мед. журн. 2005. Т. 13. № 1. С. 48-51.
8. Коколина В. Ф. Гинекология детского и подросткового возраста. М.: Медпрактика-М, 2006. 368 с.
9. Коноводова Е. Н. Железодефицитные состояния: Когда и кому назначать Тотему? // Фарматека. 2005. № 6. C. 34-40.
10. Кузнецова И. В. Возрастные аспекты комбинированной оральной контрацепции// Рус. мед. журн. 2009. № 1. С. 20-23.
11. Кузнецова И. В. Распространенность избытка и дефицита массы тела и сопутствующих нарушений менструальной функции у девушек-подростков Москвы / И. В. Кузнецова, Е. Е. Евстигнеева // Материалы VI Всерос. форума «Мать и дитя». М., 2004. С. 390.
12. Кузнецова М. Н. Ювенильные маточные кровотечения // Руководство по эндокринной гинекологии / Под ред. Е. М. Вихляевой. М.: МИА, 2006. С. 274-292.
13. Лукина Н. А. Научное обоснование рационального выбора современных гормональных контрацептивных средств при фармакотерапии различных нарушений менструального цикла у подростков/ Н. А. Лукина, Ю. С. Родина// Репродуктив. здоровье детей и подростков. 2006. № 5. С. 31-35.
14. Межлумян М. Р. Патогенетические звенья развития избыточной массы тела и ее воздействия на репродуктивную систему девочек-подростков (обзор литературы) // Репродуктив. здоровье детей и подростков. 2008. № 3. С. 41-65.
15. Негмаджанова Б. Б. Эффективность двухэтапного лечения маточных кровотечений пубертатного периода на фоне эндемического зоба / Б. Б. Негмаджанова, Г. Э. Рахимова, Д. Р. Худоярова // Репродуктив. здоровье детей и подростков. 2010. № 1. С. 52-56.
16. Ожегов A. M. Оценка эффективности применения комплексного препарата Тотема в лечении детей раннего возраста с железодефицитной анемией / A. M. Ожегов, Е. А. Ожегов // Вопр. гематологии, онкологии и иммунопатологии в педиатрии. 2004. Т. 3. № 4. С. 25-27.
17. Пасман Н. М. Дифференцированный подход к терапии дисфункциональных маточных кровотечений у подростков / Н. М. Пасман, Е. А. Снисаренко, А. Л. Теплицкая // Гинекология. 2003. Т. 5. № 6. С. 244-247.
18. Радзинский В. Е. Контрацепция у подростков // Гинекология. 2002. Т. 4. № 6. С. 255-261.
19. Сметник В. П. Неоперативная гинекология. Изд. 3-е, перераб. и доп. / В. П. Сметник, Л. Г. Тумилович. М.: МИА, 2003. 560 с.
20. Современные принципы профилактики и лечения железодефицитной анемии у беременных // В. Н. Серов [и др.] // Журн. Рос. общества акушеров-гинекологов. 2004. № 4. С. 21-23.
21. Стуклов Н. И. Мета-анализ данных переносимости питьевой формы глюконата железа (II), меди и марганца (препарат Тотема) при лечении железодефицитной анемии у детей и взрослых// Земский врач. 2012. № 4. С. 11-20.
22. Уварова Е. В. Железодефицитная анемия у девочек с маточными кровотечениями пубертатного периода / Е. В. Уварова, Н. М. Веселова// Рус. мед. журн. 2004. Т. 12. № 13. С. 1-6.
23. Уварова Е. В. Маточные кровотечения пубертатного периода (междисциплинарное решение гинекологической проблемы) / Е. В. Уварова, Н. М. Веселова // Репродуктив. здоровье детей и подростков. 2005. № 3. С. 30-38.
24. Уварова Е. В. Маточные кровотечения пубертатного периода / Е. В. Уварова, Н. М. Веселова // Рос. вестн. перинатологии и педиатрии. 2004. Т. 49. № 5. С. 35-39.
25. Уварова Е. В. Медико-социальные аспекты репродуктивного здоровья современных девочек России // Вопр. соврем. педиатрии. 2006. Т. 5. № 5. С. 5-7.
26. Benagiano G. Clinical profile of contraceptive progestins / G. Benagiano, F. M. Primiero, M. Farris// Eur. J. Contracept. Reprod. Health Care. 2004. N 9. P. 182-193.
27. Classification and farmacology of progestins / A. E. Schindler [et al.] // Maturitas. 2003. Vol. 46. Suppl. 1. P. S7-16.
28. Omar H. Management of menstrual problem in adolescents with special health care needs // J. Pediatr. Adolesc. Gynecol. 2003. Vol. 16. N 1. P. 51.
29. Slap G. B. Menstrual disorders in adolescence / G.B. Slap // Best Pract. Res. Clin. Obstet. Gynaecol. 2003. Vol. 17. N1. P. 75-93.
30. Strickland J. L. Abnormal uterine bleeding in adolescents / J. L. Strickland, J. W. Wall // Obstet. Gynecol. Clin. North. Am. 2003. Vol. 30. N 2. P. 321-335.
