Эндокринные аспекты применения амиодарона в клинической практике
СтатьиОпубликовано:
Российский кардиологический журнал 2012, 2 (94) (Алгоритм наблюдения и лечения функциональных расстройств щитовидной железы)
Свириденко Н.Ю.1, Платонова Н. М.1, Молашенко Н.В.1, Голицин С. П.2, Бакалов С. А.2, Сердюк С. Е.3
ФГБУ Эндокринологический научный центр Минздравсоцразвития, Москва Россия1, Институт клинической кардиологии им. А. Л. Мясникова РКНПК МЗ РФ, Москва, Россия2, Государственный научно-исследовательский центр профилактической медицины3 В представленной обзорной статье обобщены данные мировых исследований и результаты работы, проведенной сотрудниками Института клинической кардиологии им А. Л. Мясникова и Эндокринологического научного центра по изучению влияния амиодарона на функциональное состояние щитовидной железы, даны рекомендации по диагностике, лечению развившихся функциональных нарушений щитовидной железы и наблюдению за пациентами, получающими терапию амиодароном.
Ключевые слова:амиодарон, щитовидная железа, тиреотоксикоз, гипотиреоз
АТ 1 типа – амиодарон-ассоциированный тиреотоксикоз 1 типа, АТ 2 типа – амиодарон-ассоциированный тиреотоксикоз 2 типа, ГК – глюкокортикоиды, ЖТ – желудочковая тахикардия, ЖЭ – желудочковые экстрасистолы, свТ3 – свободная фракция Т3, свТ4 – свободная фракция Т4, Т3 – трийодтиронин, Т4 – тироксин, ТГ – тиреоглобулин, ТПО – тиропероксидаза, ТТГ – тиреотропный гормон гипофиза, ЩЖ – щитовидная железа, 131I – радиоактивный йод, 99mTc – технеций-99m-пертехнетат, I – йод.
Endocrine aspects of amiodarone therapy in clinical practice (follow-up and treatment algorithm for patients with thyroid dysfunction).
Sviridenko N.Yu.1, Platonova N. M.1, Molashenko N. V.1, Golitsyn S. P.2, Bakalov S. A.2, Serdyuk S. E.3
Endocrinology Research Centre, Moscow, Russia1, A.L. Myasnikov Research Institute of Clinical Cardiology, Russian Cardiology Scientific and Clinical Complex, Moscow, Russia2, State Research Centre for Preventive Medicine3, Moscow, Russia. This review discusses the effects of amiodarone on thyroid function and summarises the results of international studies and the evidence obtained by the researchers from the A.L. Myasnikov Research Institute of Clinical Cardiology and Endocrinology Research Centre. The guidelines on thyroid dysfunction diagnostics and therapy, as well as the follow-up of amiodarone-treated patients, are presented.
Key words: Amiodarone, thyroid gland, thyrotoxicosis, hypothyreosis.
Амиодарон (кордарон) – антиаритмический препарат III класса был синтезирован в начале 60-х годов в лаборатории Labaz (Бельгия) и с тех пор широко используется в кардиологической практике. Частота его применения среди других антиаритмических препаратов составляет 24%. Препарат обладает фармакологическими свойствами, характерными для всех четырех классов антиаритмических препаратов. Он способен неконкурентно ингибировать α- и β-адренорецепторы, инактивировать калиевые каналы, быстрые натриевые каналы в мембране кардиомиоцитов, обладает свойствами антагонистов кальция и периферических вазодилататоров. Совокупность этих свойств делает его применение эффективным при лечении больных с желудочковыми и наджелудочковыми нарушениями ритма сердца, резистентными к назначению других препаратов [1].
Мета-анализ рандомизированных исследований, проведенных к середине 90-х годов, показал, что амиодарон достоверно снижает общую смертность на 13%, а аритмическую смертность – на 29% [2]. Эффективность препарата в подавлении желудочковой экстрасистолии приближается к 90%. Длительное применение препарата после электрической кардиоверсии у больных с мерцательной аритмией позволяет сохранить синусовый ритм почти в 80% случаев. Эффективность использования препарата у больных со злокачественными нарушениями ритма сердца равняется 41%.
Помимо своего антиаритмического действия, у ряда больных препарат оказывает влияние на функцию щитовидной железы [3, 4]. Несмотря на то, что у большинства больных, принимающих амиодарон, сохраняется эутиреоидное состояние, у некоторых пациентов может развиться гипотиреоз или тиреотоксикоз. В течение ряда лет изменения функциональной активности щитовидной железы являлись одной из причин отмены препарата или отказа от его применения. Продолжающиеся исследования в этом направлении позволили изменить взгляд на проблему и разработать новые подходы к диагностике и лечению этих нарушений.
Фармакокинетика амиодарона
Амиодарон является йодсодержащим жирорастворимым лекарственным веществом бензофуранового ряда, 37% его веса составляет йод. В таблетке (200 мг) амиодарона содержится 75 мг йода и примерно 7,5 мг неорганического йода освобождается ежедневно в процессе метаболизма препарата. Таким образом, из каждых 200–600 мг препарата высвобождается 7–21 мг неорганического йода, что во много раз превышает суточную потребность в элементе, составляющую, по рекомендациям ВОЗ, 0,15–0,2 мг. Амиодарон метаболизируется в печени, где он превращается, главным образом, в дизэтиламиодарон. Амиодарон и его метаболит дизэтиламиодарон обладают липофильностью, благодаря которой они в больших количествах накапливаются в печени, легких, коже, жировой ткани, щитовидной железе и других органах. Концентрация амиодарона в миокарде в 10–50 раз выше, чем в плазме крови. Анализ распределения препарата в тканях показал, что концентрация амиодарона и его метаболита дизэтиламиодарона в щитовидной железе составила 14 мг/кг и 64 мг/кг по-сравнению с 316 мг/кг и 76 мг/кг в жировой ткани и 391 мг/кг и 2354 мг/кг в печени. Выведение препарата осуществляется через желудочно-кишечный тракт, а его основной метаболит дизэтиламиодарон и йод-содержащие метаболиты экскретируются с мочой в виде йодистых солей. Важно помнить, что период полувыведения амиодарона составляет от 30 дней до 5 месяцев, это объясняет тот факт, что амиодарон-индуцированные нарушения функции щитовидной железы могут развиться и после отмены препарата. R. Rao et al. [5] изучали кинетику йода на фоне 6-месячного приема препарата. За это время экскреция йода с мочой возросла с 0,25 до 7 мкмоль/ммоль креатинина. Клиренс элемента в ЩЖ снизился с 5,93 до 0,25 мл/мин, в то время как уровень неорганического йода в плазме вырос в 40 раз. Захват йода щитовидной железой снизился в 3 раза по сравнению с исходным значением (рис. 1).
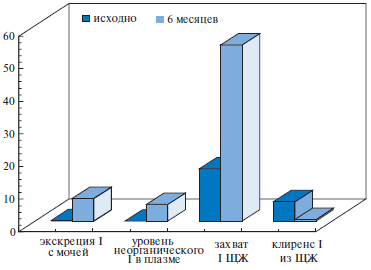
Рис. 1.Фармакокинетика амиодарона [R. Rao и соавт., 1986 г.] (I – йод, ЩЖ – щитовидная железа).
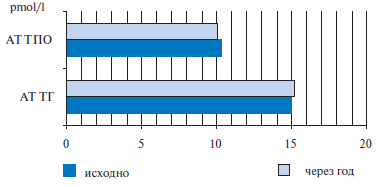
Рис. 1.Фармакокинетика амиодарона [R. Rao и соавт., 1986 г.] (I – йод, ЩЖ – щитовидная железа).
Влияние амиодарона на сердечно-сосудистую систему
Амиодарон, принадлежащий к III классу по классификации Вогана-Вильямса, практически обладает свойствами всех классов антиаритмиков. Он способен неконкурентно ингибировать α- и β-адренорецепторы, инактивировать калиевые каналы, быстрые натриевые каналы в мембране кардиомиоцитов, обладает свойствами антагонистов кальция и периферических вазодилататоров.
Электрофизиологические эффекты препарата проявляются удлинением трансмембранного потенциала действия кардиомиоцитов за счет блокады калиевых каналов и, соответственно, увеличением эффективного рефрактерного периода предсердий, желудочков, атриовентрикулярного узла, проводящей системы Гиса-Пуркинье и аномальных проводящих путей. Другое свойство препарата – влияние на автоматизм сердца за счет торможения медленной (диастолической) деполяризации синусового узла и других водителей ритма. При длительном приеме амиодарона изменяется максимальная скорость быстрой деполяризации (фаза 0 трансмембранного потенциала действия) за счет селективной блокады натриевых каналов.
Антиадренергическое действие амиодарона отличается от такового бета-блокаторов. Он не связывается с адренорецепторами. Их блокада развивается либо за счет ингибирования соединения с регуляторной единицей аденилатциклазы, либо за счет постепенного уменьшения количества рецепторов на поверхности кардиомицитов. Причем антиадренергическое действие амиодарона ограничено только сердцем и не распространяется на другие органы.
В литературе обсуждается возможность дополнительного антиаритмического механизма действия амиодарона, обусловленного содержанием йода и структурным сходством с тиреоидными гормонами [6]. Электрофизиологические изменения сердечно-сосудистой системы, развивающиеся при длительном приеме амиодарона аналогичны таковым при гипотиреозе (брадикардия, замедление реполяризации и т. д.). Эти влияния могут быть обусловлены конкурентным связыванием амиодарона с рецепторами тиреоидных гормонов, что приводит к ослаблению действия Т3 на кардиомиоциты.
Влияние амиодарона на щитовидную железу
Влияние амиодарона на метаболизм тиреоидных гормонов и тиреотропного гормона гипофиза (ТТГ). Большинство пациентов, принимающих амиодарон, имеют легкие изменения уровня гормонов щитовидной железы, которые частично объясняют его эффекты на синтез тиреоидных гормонов и их метаболизм [7]. Подавляя активность 5’ дейодиназы I типа в периферических тканях, особенно в печени, амиодарон уменьшает конверсию Т4 в Т3, вызывает уменьшение сывороточного уровня Т3 и повышение реверсивного Т3, что часто сочетается с повышением уровня общего Т4 и свободного Т4 в связи с уменьшением клиренса последних. Подавление активности 5’ дейодиназы может сохраняться на протяжении нескольких месяцев после отмены препарата. Кроме того, препарат снижает проникновение тиреоидных гормонов в клетки периферических тканей. В конечном итоге оба механизма способствуют развитию эутиреоидной гипертироксинемии, сопровождающейся повышением уровня общего и свободного Т4, реверсивного Т3, нормальным или субнормальным Т3, которую имеют практически 1/3 пациентов, получающих амиодарон [8]. Эти нарушения не требуют коррекции, а диагноз амиодарон – индуцированного тиреотоксикоза не должен основываться на одном только обнаружении повышенного уровня тироксина.
Применение амиодарона может привести к изменению концентрации ТТГ в сыворотке крови. Повышение концентрации ТТГ у клинически эутиреоидных пациентов зависит как от дозы, так и длительности приема препарата. Так, при ежедневном приеме 200–400 мг амиодарона, уровень ТТГ обычно находится в пределах нормы. При более высокой дозе препарата, увеличение концентрации ТТГ в сыворотке может произойти в первые месяцы приема с последующим возращением к норме.
Кроме того, амиодарон, как и другие йодсодержащие соединения, подавляет активность 5’ дейодиназы II типа, что приводит к уменьшению образования Т3 в гипофизе, и, таким образом, к небольшому повышению уровня ТТГ в сыворотке.
Таким образом, функциональные тесты, оценивающие состояние щитовидной железы у пациентов, принимающих амиодарон, имеют другой диапазон нормальных значений, чем у эутиреоидных лиц, не принимающих препарат.
Взаимодействие амиодарона и его метаболитов с адренорецепторами и с рецепторами тиреоидных гормонов. На клеточном уровне амиодарон действует как антагонист тиреоидных гормонов за счет структурного сходства [9] (рис. 2).
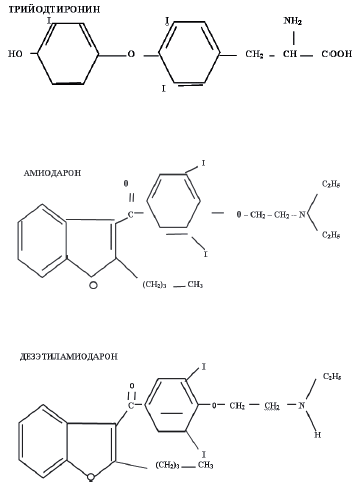
Рис. 2. Химическая структура трийодтиронина, амиодарона и его метаболита дезэтиламиодарона [Singh N. B., 1989].
Наиболее активный метаболит амиодарона дизэтиламиодарон действует как конкурентный ингибитор присоединения Т3 к a-1-ТЗ-рецептору и как неконкурентный ингибитор β-1-ТЗ-рецептора. Действие дизэтиламиодарона зависит от его концентрации в различных тканях. При низкой концентрации дизэтиламиодарон может выступать как агонист действия ТЗ и только при больших концентрациях – как антагонист ТЗ. Известно, что α-1-ТЗ-рецепторы находятся, в основном, в сердечной и скелетной мускулатуре, тогда как в печени, почках и мозге преобладают β-1-ТЗ-рецепторы. Следовательно, при достаточной концентрации амиодарон действует как конкурентный ингибитор Т3, обуславливая развитие “местного” гипотиреоза в сердечной мышце. Снижение проникновения Т3 в кардиомиоциты оказывает антиаритмический эффект за счет изменения экспрессии генов ионных каналов и других функциональных белков.
Длительное введение амиодарона (в эксперименте) приводит к значительному снижению плотности β-адренергических рецепторов и урежению ЧСС, при этом плотность α-адренергических рецепторов и содержание в сыворотке ТЗ не меняются.
Амиодарон оказывает прямое действие на ионные каналы вне зависимости от его эффектов на тиреоидные гормоны. В эксперименте амиодарон способен ингибировать Nа-К-АТФ-азу. Препарат блокирует несколько ионных токов на мембране кардиомиоцита: выход ионов К во время фаз реполяризации, а также вход ионов Na и Ca.
Цитотоксическое действие амиодарона на щитовидную железу
Кроме вышеописанных эффектов, амиодарон и его метаболит дизэтиламиодарон оказывают цитотоксическое действие на щитовидную железу. Экспериментальными исследованиями установлено, что амиодарон и его метаболит вызывают лизис клеток линии человеческих тиреоцитов, а также нетиреоидной ткани.
Амиодарон оказывает самостоятельный токсический эффект, усиливаемый содержанием йода в молекуле, при этом его активный метаболит дизэтиламиодарон обладает большей цитотоксичностью и его интратиреоидная концентрация выше, чем самого препарата. Токсическое действие амиодарона на тиреоциты нормальных и аутоиммунных моделей животных отличается от изменений, вызванных избыточной концентрацией йода. О прямом цитотоксическом влиянии амиодарона или его метаболитов на тиреоциты свидетельствует нарушение нормальной архитектоники тиреоидной ткани, некроз и апоптоз, наличие включений, отложение липофусцина и расширение эндоплазматической сети [10]. Избыточные дозы йода сами по себе не приводят к подобным изменениям. Отмечается только повышение числа лизосом и небольшое расширение эндоплазматической сети.
Йод, содержащийся в препарате, приводит к повышению йодирования ТГ. Расширение эндоплазматической сети в комбинации с другими внутриклеточными изменениями приводит к нарушению процессов синтеза и транспорта ТГ. Кроме того, обладая амфифильными свойствами, амиодарон связывается с интрализосомальными фосфолипидами, делая их резистентными к действию фосфолипаз внутри лизосом и, тем самым, способствуя внутриклеточным изменениям.
Влияние амиодарона на аутоиммунные процессы в щитовидной железе. Влияние амиодарона на течение аутоиммунных процессов в щитовидной железе – один из спорных вопросов, обсуждаемых в литературе. Предполагается, что избыток йода, высвобождаемый из амиодарона, может приводить к индукции или манифестации аутоиммунных изменений в щитовидной железе.
Аутоиммунные заболевания щитовидной железы возникают, когда иммунная система организма продуцирует антитела против собственных белков щитовидной железы. Эти антитела повреждают ткань щитовидной железы, что отрицательно влияет на ее структуру и функцию. Классическими маркерами аутоиммунного процесса являются антитела к ТГ и ТПО. Тиреоидная ТПО – это связанный с апикальной мембраной белок щитовидной железы. ТПО участвует в процессах окисления и органификации йода. ТГ представляет собой очень крупный белок, на поверхности которого происходит синтез T3 и T4. Тестирование антител к TPO и ТГ играет важную роль для определения аутоиммунного процесса в щитовидной железе.
У ряда пациентов антитела к ТПО регистрируются как на ранних этапах лечения, так и в течение 6 месяцев после отмены препарата. По мнению ряда исследователей, этот феномен объясняется ранним токсическим эффектом амиодарона на щитовидную железу, приводящим к высвобождению аутоантигенов и последующему запуску иммунных реакций.
Проведенные исследования показали малую вероятность появления de novo антител к ткани щитовидной железы у пациентов, принимающих амиодарон (рис. 3). У лиц с сопутствующим аутоиммунным тиреоидитом на фоне лечения препаратом может развиться гипотиреоз, требующий заместительной терапии [11].

Рис. 3. Динамика уровня антител к ТПО и ТГ на фоне приема амиодарона.
Функциональное состояние щитовидной железы в процессе лечения амиодароном. У большинства больных, принимающих амиодарон, сохраняется эутиреоидное состояние. Тем не менее, у некоторых пациентов может развиться гипотиреоз или тиреотоксикоз. Частота нарушений функции щитовидной железы, по данным зарубежных авторов, колеблется от 1% до 23%, в большинстве случаев – от 14% до 18% [12]. Тиреотоксикоз на фоне приема амиодарона часто наблюдается в районах с недостаточным поступлением йода, в то время как гипотиреоз наиболее распространен в регионах, обеспеченных йодом [13].
По нашим данным, у лиц старшей возрастной группы (средний возраст 60 лет), проживающих в районе легкого и умеренного йодного дефицита, наиболее часто на фоне приема амиодарона выявлялся субклинический гипотиреоз (18%) и манифестный тиреотоксикоз (15,8%), реже – явный гипотиреоз (1.5%) и субклинический тиреотоксикоз (1.5%) [14]. При этом у пациентов с исходной сопутствующей патологией щитовидной железы общая частота тиреотоксикоза и гипотиреоза, развившихся на фоне приема амиодарона, была значительно выше и составляла 49%, нежели у пациентов без патологии щитовидной железы – 25% (рис. 4).
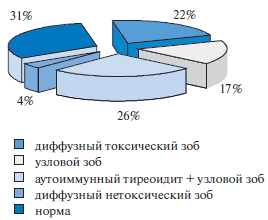
Рис. 4.Функциональное состояние щитовидной железы у пациентов, принимающих амиодарон в течение 12–164 месяцев.
По нашим данным, у лиц, получающих амиодарон, сопутствующая патология щитовидной железы выявлялась в 51.2% случаев, причем большую часть составляли пациенты с узловым и многоузловым зобом [15] (рис. 5).
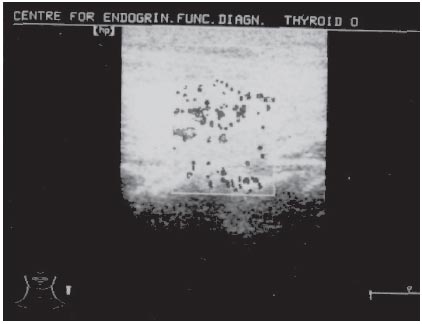
Рис. 5. Структура патологии щитовидной железы у лиц с тиреотоксикозом, развившимся на фоне приема амиодарона.
Эутиреоидная гипертироксинемия наблюдалась у 15% пациентов. В настоящее время эутиреоидная гипертироксинемия рассматривается как лабораторный феномен, развивающийся на фоне приема амиодарона. Это состояние не приводит к утрате амиодароном антиаритмической эффективности и рецидивам предшествующих нарушений сердечного ритма, не требует медикаментозной коррекции. Пациенты должны оставаться под динамическим наблюдением за функциональным состоянием щитовидной железы [16].
Тиреотоксикоз может развиться как в первые месяцы, так и через несколько лет лечения. Благодаря накоплению препарата и его метаболита в тканях, а также их медленному выведению из организма (период полужизни амиодарона составляет 50–100 дней), тиреотоксикоз может развиться даже через несколько месяцев после отмены препарата. На сегодняшний день нет четких критериев, позволяющих предсказать развитие тиреотоксикоза у пациентов. Наличие сопутствующей патологии щитовидной железы – узлового зоба с накоплением радиоактивного изотопа в зоне узла – может являться фактором риска развития тиреотоксикоза.
Считается, что в основе патогенеза тиреотоксикоза на фоне приема амиодарона лежат два основных механизма, согласно которым выделяют два типа амиодарон-ассоциированного тиреотоксикоза [17]:
- Амиодарон-ассоциированный тиреотоксикоз 1 типа развивается в основном у лиц с исходной патологией в щитовидной железе, включая узловой зоб, функциональную автономию или субклинический вариант диффузного токсического зоба. Йод, высвобождаемый из препарата, приводит к повышению синтеза тиреоидных гормонов в существующих зонах автономии в железе.
- Амиодарон-ассоциированный тиреотоксикоз 2 типа описан у пациентов без предшествующих или сопутствующих заболеваний щитовидной железы и связан он с развитием деструктивных процессов в железе, причиной которых является действие самого амиодарона, а не только йода (т. е. форма лекарственного тиреоидита), и выходом ранее синтезированных гормонов в кровоток.
Тиреотоксикоз смешанного типа, сочетающий черты АТ I и АТ 2 типов, как правило, диагностируется ретроспективно, в ходе исследования послеоперационного материала ткани щитовидной железы или исходя из клиники заболевания (тяжесть тиреотоксикоза, отсутствие эффекта от приема тиреостатиков или преднизолона) [18].
Особенности клинической картины амиодарон-ассоциированного тиреотоксикоза. Особенностью клинической картины амиодарон-ассоциированного тиреотоксикоза является то, что классические симптомы тиреотоксикоза – зоб, потливость, тремор рук, потеря веса – могут быть выражены незначительно или вовсе отсутствовать. В клинической картине, как правило, доминируют сердечно-сосудистые расстройства. Больные предъявляют жалобы на учащенное сердцебиение, перебои, одышку при физической нагрузке, утомляемость.
Рецидивирование нарушений ритма сердца у пациентов, принимающих амиодарон, является показанием для обследования функционального состояния щитовидной железы с целью исключения тиреотоксикоза, единственным проявлением которого они могут являться [19].
Дифференциальная диагностика амиодарон – ассоциированного тиреотоксикоза 1 и 2 типов. Для клинициста важно дифференцировать две формы АТ для выбора правильной тактики ведения пациентов. АТ I типа развивается на фоне существующих или предшествующих заболеваний щитовидной железы. Помимо повышения уровня свТ4 и свТ3, снижения уровня ТТГ и определения повышенного уровня антител к рецептору ТТГ (в случаях манифестации диффузного токсического зоба), АТ 1 типа характеризуется нормальным или повышенным захватом 99mTc. При УЗИ с допплерографией выявляются признаки сопутствующей патологии: узлового зоба или изменения эхоструктуры щитовидной железы с нормальным или повышенным кровотоком [20] (рис. 6 а).
АТ 2 типа развивается при отсутствии заболеваний щитовидной железы. Главная клиническая особенность этой формы – тяжесть тиреотоксикоза, в том числе развитие болевых форм, клинически похожих на подострый тиреоидит. При исследовании с 99mTc отмечается снижение накопления препарата в железе. При УЗИ с доплерографией часто наблюдается отсутствие или снижение кровотока в щитовидной железе (рис. 6 б). Уровень антител к рецептору ТТГ не превышает нормальных значений.
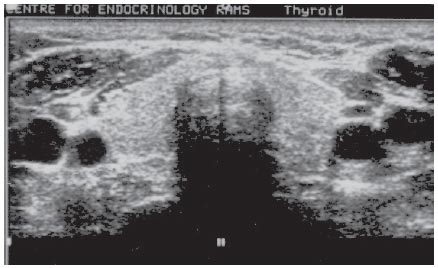
Рис. 6 а. Эхограмма пациентки П., 50 лет с АТ 1 типа. Выявлено: снижение эхогенности и повышение кровотока в щитовидной железе (выделено рамкой)
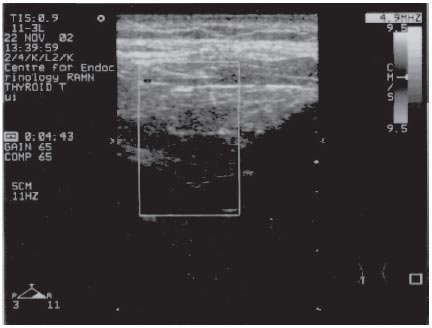
Рис. 6 б.Эхограмма пациента И., 55 лет с АТ 2 типа. Выявлено: нормальная структура щитовидной железы и отсутствие кровотока (выделено рамкой).
Сводные данные об отличии двух форм представлены в таблице 1. Таблица 1
Особенности амиодарон-ассоциированного тиреотоксикоза 1 и 2 типов
| АТ 1 типа | АТ 2 типа | |
| Исходная патология ЩЖ | Есть | Нет |
| Пальпация ЩЖ | Узловой или диффузный зоб | Норма или небольшой зоб, чувствительный при пальпации |
| Цветовое допплеровское картирование при УЗИ ЩЖ | Кровоток выражен умеренно | Кровоток отсутствует |
| Патогенетический механизм | Йод, высвобождаемый из препарата, приводит к чрезмерному синтезу и секреции тиреоидных гормонов, аналогичен феномену йод-Базедов | Чрезмерное высвобождение тиреоидных гормонов вследствие деструкции ткани щитовидной железы. |
| Лабораторные показатели | Выраженное повышение уровней свТ4 и свТ3,антитела к рецептору ТТГ при диффузном токсическом зобе | Преимущественное повышение свТ4 |
| Терапия | Тиреостатики | ГК как монотерапия или в комбинации с тиреостатиками |
| Влияние избытка йода после тиреотоксической фазы | Вероятен йод-индуцированный тиреотоксикоз | Вероятен йод-индуцированный гипотиреоз |
Компенсация тиреотоксикоза, развившегося на фоне приема амиодарона, сопряжена с многими трудностями и требует индивидуального подхода в каждом случае [21]. Для лечения тиреотоксикоза применяют тионамиды, глюкокортикоиды, плазмаферез, радий-йодотерапию, оперативное лечение, за рубежом – блокатор поступления йода в щитовидную железу – перхлорат калия [22]. Для подавления синтеза тиреоидных гормонов рекомендуется применение больших доз антитиреоидных препаратов (тиамазол, метимзол 40–80 мг или пропилтиоурацил 400–800 мг). Сроки медикаментозной компенсации удлиняются. Эутиреоз, как правило, восстанавливается через 6–12 недель. Доза тиреостатика должна снижаться после лабораторной компенсации тиреотоксикоза (нормализация уровня свТ4 и свТ3).
Пациентам с АТ 2 или смешанного типа назначается преднизолон в дозе 40–50 мг/сутки. Курс лечения может продолжаться до 3-х месяцев, так как описаны случаи возобновления симптомов тиреотоксикоза при попытке снизить дозу препарата.
При тяжелом течении АТ (обычно при сочетании 2-х форм) используют комбинацию тионамида и глюкокортикоида. В случае, когда невозможно дифференцировать две формы тиреотоксикоза рекомендуется назначить 40 мг тирозола (400 мг пропицила) и 40 мг преднизолона и через две недели исследовать уровень свТ3.Если уровень свТ3 снизился на 50% (деструктивный тиреотоксикоз), следует отменить тирозол и продолжить прием преднизолона, если Т3 снизился менее, чем на 50% (повышенный синтез тиреоидных гормонов) или не изменился – отменить преднизолон, продолжить прием тирозола (пропицила).
В случае развития гипотиреоза у пациентов, перенесших АТ 2 типа, к лечению добавляется левотироксин.
У некоторых пациентов комбинированная лекарственная терапия может быть неэффективна, что требует хирургического вмешательства. Оперативное лечение обычно проводится в случае невозможности достижения компенсации заболевания после длительного (около 6 месяцев) курса медикаментозной терапии или при сочетании амиодарон – ассоциированного тиреотоксикоза с узловым токсическим зобом. Опыт лечения таких больных показал, что предельно субтотальная резекция щитовидной железы или тиреоидэктомия позволяют быстро добиться ремиссии тиреотоксикоза и продолжить антиаритмическую терапию. При крайне тяжелом состоянии или с целью подготовки к оперативному лечению используют плазмаферез.
В районах с пограничным йодным дефицитом пациентам с диффузным или узловым зобом, имеющим нормальное или повышенное поглощение радио изотопа, при отсутствии эффекта от консервативной терапии показано лечение радиоактивным йодом.
В лечебной практике в случае невозможности прекращения приема антиаритмика компенсацию тиреотоксикоза проводят на фоне продолжающейся терапии амиодароном (рис. 7).
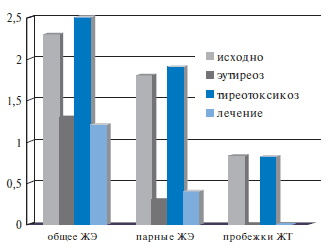
Рис. 7. Наиболее ранним проявлением амиодарон-ассоциированного тиреотоксикоза является потеря антиаритмической эффективности амиодарона, которая восстанавливается на фоне лечения тиреотоксикоза.
Развитие гипотиреоза не сопровождается потерей антиаритмической эффективности амиодарона и не является показанием к его отмене. Проведение заместительной гормональной терапии левотироксином не приводит к возобновлению нарушений ритма сердца [23].
Рекомендуется начинать заместительную терапию левотироксином с минимальных доз 12,5–25 мкг в сутки с постепенным повышением с интервалом 4–6 недель до эффективных, под контролем ТТГ, ЭКГ или мониторирования ЭКГ по Holter, не допуская при этом декомпенсации кардиальной патологии или развития аритмии.
Мониторинг тиреоидной функции (рис. 8). Всем пациентам, которым планируется назначение амиодарона, необходимо провести исследование функционального состояния щитовидной железы и ее структуры. Это позволяет не только выявить наличие тиреоидной патологии, но прогнозировать возможное развитие тиреотоксикоза или гипотиреоза после начала терапии.
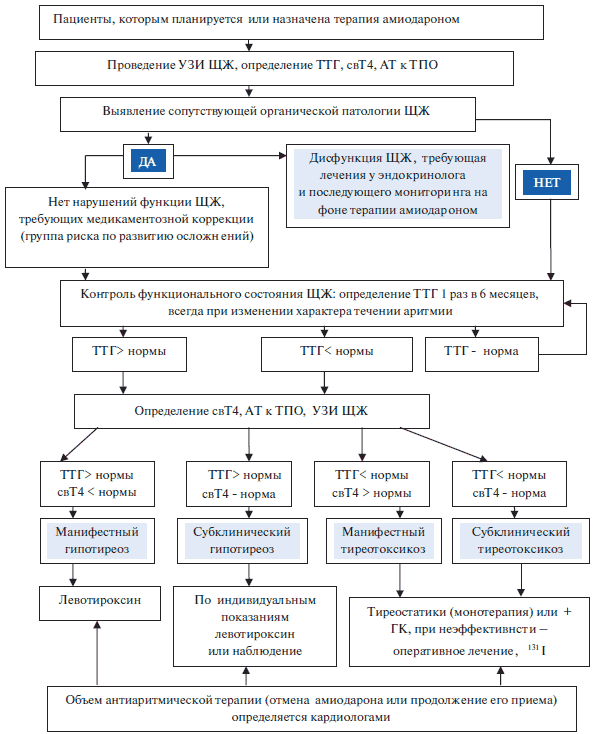
Рис. 8. Мониторинг тиреоидной функции.
План обследования щитовидной железы до назначения препарата должен включать:
- определение ТТГ,
- определение свТ4 при измененном уровне ТТГ;
- УЗИ щитовидной железы;
- определение уровня антител к ТПО;
- сцинтиграфию щитовидной железы – при подозрении на автономию (снижение уровня ТТГ, наличие узлового/многоузлового зоба);
- пункционную биопсию щитовидной железы (при наличии узлов, подозрении на новообразование).
Присутствие антител к ТПО увеличивает риск развития амиодарон-ассоциированного гипотиреоза у пациентов с аутоиммунным тиреоидитом, особенно во время первого года лечения. Повторное определение уровня ТТГ нужно повторить через 3 месяца от начала терапии, а затем каждые 6 месяцев. При нормальных показателях мониторинг осуществляется по уровню ТТГ 1–2 раза в год, особенно у пациентов с измененной щитовидной железой. В случае наличия патологии щитовидной железы до лечения или развитие ее на фоне приема препарата проводится лечение по вышеуказанным рекомендациям. Напомним, что появление рефрактерности к антиаритмической терапии может быть ранним признаком манифестации амиодарон-ассоциированного тиреотоксикоза.
В тех случаях, когда амиодарон назначается для первичной или вторичной профилактики фатальных желудочковых нарушений ритма сердца или когда отмена препарата невозможна по иным причинам (любые формы аритмий, протекающих с тяжелой клинической симптоматикой, которые не удается устранить другими средствами антиаритмической терапии), компенсацию тиреотоксикоза и заместительную терапию при гипотиреозе проводят на фоне продолжения приема амиодарона.
Вопрос об отмене или продолжении лечения амиодароном должен решаться индивидуально для каждого пациента совместно кардиологом и эндокринологом. Клинический опыт показывает, что в большинстве случаев выбор делается в пользу продолжения лечения.
Литература
Комментарии
ПРАКТИКА ПЕДИАТРА
