Цистон - комбинированный препарат растительного происхождения - ингибирует адгезию уропатогенной E. Coli и снижает Н2О2 – индуцированную токсичность NRK-52E клеток
СтатьиОпубликовано:
Журнал экспериментальной фармакологии
(Journal of Experimental Pharmacology)
Сатиакумар Видиашанкар1
Путтанарассаиах Махешкумар2
Пралхад С. Патки3
1 Отделение Клеточной биологии и Биохимии,
2 Отделение Микробиологии,
3 Медицинские услуги и Клинические исследования, Научно-исследовательский отдел, Хималайя Драг Ко, Бангалор, Индия Аннотация: антибиотик Гентамицин широко используется при лечении инфекций мочевыводящих путей (ИМП), но может спровоцировать нефротоксичность уроэпителиальных клеток. Безопасный препарат растительного происхождения может компенсировать подобные токсические эффекты. На начальных этапах ИМП происходит бактериальная адгезия к уроэпителиальным клеткам, которая индуцирует различные иммуногенные реакции, что приводит к образованию активных форм кислорода, которые в свою очередь препятствуют выживаемости клеток. Считается, что аюрведический комбинированный препарат Цистон способен ингибировать бактериальную адгезию к эпителиальным клеткам мочевыводящих путей, тем самым предотвращая ИМП. В настоящем исследовании рассматривается влияние Цистона на адгезию патогенных [2-14C]- ацетат Escherichia coli (MTCC – 729) к NRK-52E клеткам. Далее исследуется антиоксидантное действие Цистона, используя перекись водорода (400 μМ) в качестве прооксиданта у NRK-52E клеток. В результате проведенного исследования выяснилось, что Цистон значительно замедлил адгезию E. Coli к NRK-52E клеткам. Исследование также показало, что при использовании Цистона происходило ингибирование липидной пероксидации у клеток на 36% по сравнению с Н2О2 – индуцированными клетками (Цитопротекторный эффект). Активность каталазы и глютатиона – антиоксидантных ферментов – выросло на 53% и 68% соответственно, а активность супероксиддизмутазы увеличилась троекратно. Содержание глютатиона в NRK-52E клетках из группы, принимавшей Цистон, выросло в 2,4 раза по сравнению с показателями крыс из контрольной Н2О2 группы. Полученные данные позволяют предположить, что Цистон способен ингибировать бактериальную адгезию к NRK-52E клеткам и ослаблять токсичность, вызванную перекисью водорода NRK-52E клеток посредством липидной пероксидации и увеличением защитных механизмов действия антиоксидантов.
Ключевые слова: бактериальная адгезия, липидная пероксидация, антиоксидантные энзимы, перекись водорода, инфекции мочевыводящих путей.
Введение
Способность бактерий адгезировать к эпителиальным клеткам считается важным фактором инфекционной вирулентности к слизистым поверхностям, включая желудочно-кишечный, дыхательный и мочеполовой тракты1-4. Инфекция мочевыводящих путей является одним из самых часто встречаемых заболеваний. Ее распространенность обусловлена половыми и возрастными признаками. Чаще всего ИМП подвержены молодые девушки; половина взрослых женщин подтверждают, что у них был хотя бы один эпизод ИМП4, и около 20-50% женщин в настоящий момент имеют ИМП5. Частота возникновения ИМП увеличивается с возрастом у мужчин вследствие обструкции выходного отверстия мочевого пузыря, вызванного в большинстве случаев заболеваниями предстательной железы.
В норме мочевые пути стерильны. Уропатогенные бактерии возникают вследствие переноса фекальной флоры из паховой области6. В случае если микроорганизмы преодолевают защитный барьер мочевого пузыря, инфекция проникает в нижние мочевыводящие пути. Бактериальная вирулентность и восприимчивость человека определяют дальнейший сценарий развития событий7.
Бактрия Escherichia Coli относится к доминантным патогенным микроорганизмам при ИМП. Уропатогенные бактерии E. Coli представляют колонию клонов, которые обладают различной вирулентностью в мочеполовом тракте. Вирулентность ИМП обусловлена бактериальной адгезией к слизистым поверхностям. Штаммы фекальных изолятов, цистита и пиелонефрита различаются в адгезивной способности к уроэпителиальным клеткам и клеткам вагинального эпителия8. Изучение внутренних механизмов адгезивной способности показало, что E.Coli обладает разными типами адгезии (Dr и AFA, S фимбрии и тип-1 фимбрии), которой присущи разные типы связующей способности с рецепторами или с рецепторными антигенными доминантами, которые имеются в уроэпителии9. Фимбрии – это тонкие выросты, длиной до 2 μм. На одну бактерию приходится около 100-400 фимбрий. Некоторые бактерии E. Coli могут образовывать от 3 до 4 различных фимбрий, а некоторые бактерии производят всего одну фимбрию. В некоторых штаммах бактерий фимбрии не образуются10. Большинство адгезивных факторов, кроме типа I и P, хорошо изучены, и их возможная роль в качестве вирулентных детерминант была наглядно доказана. С другой стороны, контакт с чужеродными патогенными микроорганизмами оказывает влияние на различные иммуногенные реакции и вызывает образование активных форм кислорода (АФК)11. Образование АФК зависит от возраста и различных хронических заболеваний таких, как: сердечно-сосудистые заболевания, рак, диабет, неврологическая и почечная недостаточность. АФК выступает в качестве посредника при почечной недостаточности во время диабетической нефропатии, рабдомиолиза, нефропатии, обусловленной затруднением оттока мочи, гиперлипидемии, мочекаменной болезни и ИМП12-15. Излишек полиненасыщенных жирных кислот ведет к тому, что почки становятся уязвимее вследствие образования активных форм кислорода. Кроме этого, почки участвуют в выведении из организма токсинов, вследствие чего клетки почечного эпителия оказываются подвержены воздействию многочисленных токсинов12. Продукты окисления также были найдены в моче, что свидетельствует о процессе местного и общего окислительного стресса16. Содержание малонового диальдегида в моче увеличивается при альфа-талассемиии, почечной недостаточности и заболеваниях поджелудочной железы17-19. Однако всего несколько исследований показывают прямую связь между ИМП и окислительным стрессом.
Для лечения бактериальных инфекций зачастую используется гентамицин, аминогликозид, а также такие антибиотики, как фторхинон, бета-лактамные антибиотики, а также комбинации из двух или более вышеперечисленных антибиотиков. Однако при длительном использовании у данных лекарственных средств обнаруживается серьезный побочный эффект – нефротоксичность, что ведет к ограничению их применения. У 20% пациентов лечение гентамицином заканчивается острой почечной недостаточностью с острым канальцевым некрозом20. Для лечений инфекций мочевыводящих путей и для ослабления вирулентности патогенных микроорганизмов, которые вызывают образование свободных форм кислорода можно использовать альтернативное, безопасное, традиционное средство растительного происхождения. Для лечения урологических расстройств используются разнообразные средства растительного происхождения, среди них наибольшей популярностью пользуются: китайские травы, экстракты зеленого чая, пальма сереноа, пчелиная пыльца и клюквенный сок21-23.
Уже на протяжении долгого времени (более 70 лет) Цистон, многокомпонентный препарат растительного происхождения, основанный на принципах Аюрведы, используется для лечения инфекций мочевыводящих путей и нефролитиазы. Исследования показывают, что Цистон обладает антиоксидантным свойством и эффективно предотвращает перенасыщение веществами, которые способствуют образованию конкрементов24,25. На начальных этапах ИМП происходит адгезия E. Coli к уроэпителиальным клеткам, поэтому мы предположили, что Цистон может сыграть значительную роль при облегчении симптомов ИМП посредством ингибирования бактериальной адгезии к уроэпителиальным клеткам и образования активных форм кислорода в искусственных условиях.
В настоящем исследовании мы рассмотрели эффективность Цистона при бактериальной адгезии в отношении NRK-52E клеток. Для определения роли Цистона при сопутствующем осложнении инфекций мочевыводящих путей мы также рассмотрели нефропротекторный эффект Цистона при токсичности, вызванной перекисью водорода, с использованием NRK-52Е клеток.
Материалы и методы
Реактивы
Реагент Бредфорда, цитохром-с, моцифицированная по способу Дульбекко среда Игла, хлорид железа безводный, эмбриональная (фетальная) бычья сыворотка, глутатион, перекись водорода, МТТ (3-(4,5 диметилтиазол-2-ил)-2,5-дифенилтетразолий бромида), НАДФН (восстановленный никотинамидадениндинуклеотидфосфат), тиобарбитуровая кислота, ксантин, ксантиноксидаза были приобретены у компании Сигма-Алдич (Singma-Aldrich) (Сент-Луис, Миссури, США). Все реагенты аналитической степени чистоты.
Состав Цистона
Цистон является аюрведическим сресдтвом, одобренным Лицензионным отделом по лекарственным средствам, Управлением по вопросам аюрведы, йоги и натуропатии, юнани, сиддха и гомеопатии, Министерством здравоохранения и охраны семьи, Правительством Индии. Пять миллилитров Цистона содержат экстракты следующих лекарственных трав в кратном отношении: Якорцы стелющиеся 91 мг, Берхавия раскидистая 67 мг, Камнеломка язычковая 53 мг, Сыть круглая 42 мг, Спаржа кистевидная 21 мг, Конские бобы 21 мг, Ветиверия цицаниевидная 21 мг и Куркума зедоария 14 мг. Все растения выращивали в соответствии с добросовестной сельскохозяйственной практикой (GAP). Ботаник определил и подтвердил все растения; контрольные образцы каждого растения хранятся в гербариуме Научно-исследовательского отдела Компании «Хималайя Драг Ко», Бангалор, Индия.
Клеточные культуры
Клеточные культуры (линии проксимальных тубулярных клеток почек крыс), полученные из Национального центра исследования клеток, Пьюн, Индия, находились в полистирольных колбах (Тарсонс) на площади 25см2 в модифицированной по способу Дульбекко среде Игла с содержанием 10% эмбриональной бычьей сыворотки, 1% антибиотического-антимикозного раствора и 3,7 г/л гидрокарбоната натрия, при следующих условиях: 5% углекислого газа, 37°С и влажности в 95%.
Цитотоксичность
NRK-52E клетки выращивались в 96-многолуночном культуральном планшете, 1х105 клеток на лунку. Для изучения цитотоксичности перекиси водорода, Цистона и гентамицина, сменили среду, в которой находились клетки, и поместили их в среду с содержанием 200, 400, 600, 800 и 1000 μМ перекиси водорода, 1%, 2%, 3%, 4%, 5% Цитона и 15,5, 31,2, 62,5, 125, 250 и 500 μг/мл гентамицина. Во время проведения МТТ анализа в разное время оценивалась жизнеспособность клеток26.
Оценка антибактериальной активности
Антибактериальная активность исследуемых составов определялась с помощью диско-диффузного метода Кирби-Бауэра с некоторыми изменениями. Посевной материал готовили, доводя культуру бактерий (которая стояла 24 часа) до минимума в 1х105 кое/мл в среде Мюллера-Хинтона с использованием нефелометра МаксФарланда. В чаши Петри налили стерильный агар Мюллера-Хинтона № 2 (20 мл) и дали остыть в асептических условиях. 100 μл исследуемого состава равномерно распределили по чашам и сделали углубления 5 мм в диаметре с использованием стерильного бура. Приготовили различные концентрации Цистона и гентамицина со стерильной дистиллированной водой. 50 μл каждого разведения поместили в углубления вместе с контрольным разведением лекарственного средства и контрольными растворителями. Затем все чаши Петри в течение 60 минут замораживали при температуре в 4°С для диффузии лекарственного средства. После этого чаши инкубировали в течение 24 часов при температуре в 37°С. Далее определили минимальную ингибирующую дозу вышеуказанных соединений, посредством метода растворения жидкой среды, описанным выше. За минимальную ингибирующую дозу было взято минимальное количество Цистона и гентамицина, которое смогло ингибировать рост бактерий.
Бактериальная культура и мечение радиоактивными изотопами
Для проведения исследования уропатогенную E. Coli (МТСС 729), характерную для фимбрии F7, и уропатогенную клеточную адгезию получили из микробиологической коллекции типовых культур (МТСС), Института Микробиологических Технологий, Чандигарх, Индия. Перед проведением исследования бактерии выращивались в среде Мюллера-Хинтона (как описано выше). Подсчет количества колоний производилось в агаре Мюллер-Хинтона. 1,0% инокулята засеяли в среду Мюллера-Хинтона и инкубировали на протяжении ночи при температуре в 37°С. Утром 2,5% (объемное содержание) инокулята поместили в 10 мл свежей жидкой среды с содержанием 10μКи [2-14C]-помеченного ацетат натрия/мл (БАРК, Мумбаи, Индия). За ростом культур наблюдали с помощью нефелометра МакФарланда. Затем культуру поместили в центрифугу на 10 минут с вращением 3000 х гр до образования осадка из бактерий. Образовавшийся осадок тщательно промыли, а затем ресуспендировали в натрий-фосфатном буфере с рН 6,4. После этого с помощью сцинтилляционного счетчика Пакарда определили радиоактивность для подтверждения бактериального [2-14C]- ацетат включения. Помеченную бактериальную взвесь суспендировали в натрий-фосфатном буфере и добавили к NRK-52E клеткам28.
Взаимодействие NRK-52E клеток и бактерий
Инкубировали 1х105/мл NRK-52E клетки с или без нецитотоксичных концентраций Цистона и гентамицина с тем же самым количеством [2-14C]- ацетат меченных E. Coli. Инкубация происходила в течение 30 минут в двух повторностях при температуре 37°С. После инкубационного периода супернатат слили и промыли клеточный монослой в натрий-фосфатном буфере. Затем клетки лизировали в 2мМоль гидроксида натрия. С помощью сцинтилляционного счетчика Пакарда произвели подсчет меченых клеток29.
Влияние Цистона на липидную переоксидацию, уровень глютатиона и антиокисдантных ферментов в NRK-52E клетках
NRK-52E клетки высеяли на чаши по 7,5 х 105 клеток на ячейку. Спустя 24 часа после высевания, среду слили и добавили новую с содержанием 400μМ перекиси водорода и 1% Цистона. Спустя 24 часа собрали клеточную среду и клеточный соскоб, которые потом хранили при температуре - 80°С для количественного определения некоторых параметров. После того, как клеточные соскобы промыли в натрий-фосфатном буфере (рН 7,4), их хранили в лизирующем буфере (25мМоль КН2РО4, 2 мМоль MgCl2, 5 мМоль KCL, 1 мМоль Этилендиаминтетрауксусной кислоты, 1 мМоль Этиленгликольтетрауксусной кислоты, 100 μМоль фенилметилсульфонилфторида (рН 7,5).
Биохимический анализ
Липидная пероксидация
Степень липидной пероксидации определяли, измеряя уровень малонового диальдегида в качестве реактивного соединения тиобарбитуровой кислоты при 535 нм30. Результаты выражаются в нмоль/мг белка с коэффициентом поглощения 1,56 х 105 мкМоль-1.
Определение неферментных антиоксидантов
Клетки гомогенезировали в трихлоруксусной кислоте (5% масса/объем), затем безбелковый супернатат использовался для определения общего количества глутатиона. Уровень глютатиона у клеточного гомогената определяли с помощью 5,5’- дитио – бис (2-нитробензойная кислота) – глутатион дисульфид редуктазы рециклинга, как описано выше31 с несколькими изменениями. Результаты выражаются в нМоль глутатион/мг белка.
Определение ферментных антиоксидантов
Активность ферментных антиоксидантов, таких как супероксиддисмутаза (СОД), каталаза и глутатионпероксидаза (ГП) определялась в 1000 х гр супернатат клеточных гомогенатов. Активность супероксиддисмутазы определяли посредством наблюдения за ингибированием уменьшения феррицитохрома с при 550 нм, используя систему ксантинксантин оксидаза в качестве источника супероксида. За одну единицу супероксиддисмутазы принимается такое количество энзима, которое необходимо для ингибирования скорости восстановления цитохрома C на 50%32. Активность каталазы определяли посредством измерения уровня поглощения перекиси водорода с помощью спектрофотометра при 240 нм; полученное значение выражается в μМоль Н2О2 окисленный/мин/мг белок33. Активность глутатионпероксидазы определяли оксислением НАДФН (восстановленного никотинамидадениндинуклеотидфосфата) при 340 нм34.
Статистический анализ
Представлены средние значения ± стандартная погрешность. Статистическая значимость определяли с помощью программы GraphPad Prism 4 (Graphpad Software Inc., Калифорния, США). Результаты считаются значимыми при условии, что Р<0,01.
Результаты
Цитотоксичность
Результаты цитотоксичности препаратов, рассматриваемых в настоящем исследовании, отображены на Рисунке 1. При исследовании цитотоксичного эффекта Цистона на NRK-52E клетки было обнаружено, что цитотоксичность значительно увеличилась при воздействии Цистона > 1% (Рис. 1А). Как результат 1% Цистона использовали во всех исследованиях. Гентамицин увеличил цитотоксичность на 50% при концентрации 125 μг/мл, поэтому во всех исследованиях использовалась подлетальная концентрация Гентамицина (Рис. 1Б). Цитотоксичность NRK-52E клеток, вызванная перекисью водорода и взаимодействие перекиси водорода увеличивается вместе с увеличением концентрации перекиси водорода (Рис. 1В).
Рисунок 1А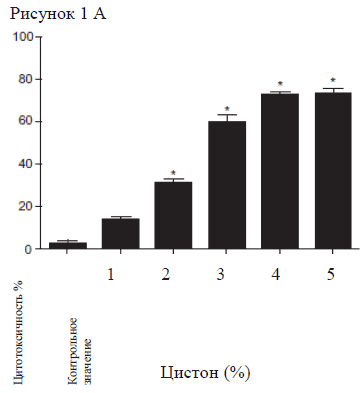
Рисунок 1Б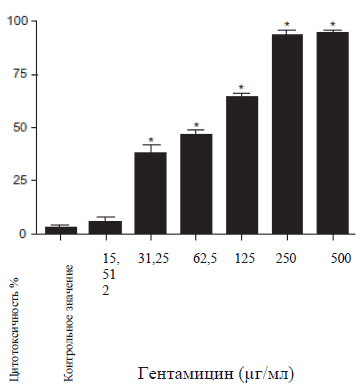
Рисунок 1В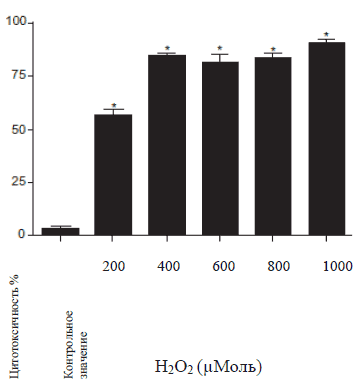
Рисунок 1А, 1Б, 1С: зависимый от дозы эффект Цистона (1 А), Гентамицина (1 Б) и перекиси водорода (1 В) на жизнеспособность NRK-52E клеток. NRK-52E клетки подвергались воздействию исследуемых веществ в различных концентрациях, а затем с помощью МТТ анализа определялась жизнеспособность клеток.
Примечания: на рисунках представлены средние значения ± стандартная погрешность 18 образцов, взятых из трех различных экспериментов.
* статистическая разница при Р
Определение антибактериальной активности Антибактериальный эффект Цистона и гентамицина определяли с помощью иммунодиффузионного метода в агаре. Исследовались различные концентрации Цистона и гентамицина. Результаты исследования показывают, что в сравнении с гентамицином (при концентрациях, используемых в исследовании) Цистон умеренно ингибирует рост E. Coli. С другой стороны, гентамицин во всех концентрациях ингибировал рост E. Coli. Результаты антибактериальной активности представлены в Таблице 1. Минимальная ингибирующая доза гентамицина составила 3,12 μп/мл
Таблица 1. Антибактериальная активность гентамицина и Цистона к уропатогенной бактерии E. Coli (MTCC 729)
| Исследуемое средство | Концентрация | Зона ингибирования (мм) |
| Гентамицин (μг/мл) | 500 | 45±3,20 |
| 200 | 43±2,40 | |
| 100 | 40±2,20 | |
| 50 | 39±1,50 | |
| 25 | 37±1,20 | |
| 12,5 | 35±1,40 | |
| 6,25 | 34±1,50 | |
| 3,12 | 22,12±2,31 | |
| 1,56 | 10,23±3,21 | |
| Цистон (%) | 1 | 5,63±0,96 |
| 2 | 6,35±0,26 | |
| 3 | 6,89±0,85 | |
| 4 | 7,12±0,52 | |
| 5 | 6,59±0,69 |
погрешность 18 образцов,взятых из трех различных экспериментов.
В контрольном образце зона ингибирования составила 0,00.
[2-14C]- ацетат мечение E. Coli и влияние Цистона на бактериальную адгезию
Инкубация бактерий с [2-14C]- ацетатом привела к включению радиоактивной метки к бактерии. Результаты (Рисунок 2А) свидетельствуют о том, что количество включений радиоактивных меток к бактериям значительно возросло, когда время инкубирования приблизилось к 30 минутам. Затем включение меток замедлилось, и примерно через 8 часов было зафиксировано максимальное количество включений.
Адгезия E. Coli. к NRK-52E клеткам определяли посредством определения количества меченых бактерий E. Coli, которые адгезировали к NRK-52E клеткам после их совместной инкубации в течение 30 минут. При проведении контрольного исследования пред контрольным заражением, выяснилось, что меченные бактерии адгезировали к NRK-52E клеткам. После инкубации с минимальной ингибирующей дозой гентамицина (которая была установлена во время иммунодиффузионного метода в агаре) бактериальная адгезия была полностью ингибирована. При инкубации с 1% Цистона бактериальная адгезия значительно уменьшилась по сравнению с контролем (Рисунок 2 Б). При воздействии субингибированной концентрации гентамицина бактериальная адгезия значительно сократилась по сравнению с контролем (Рисунок 2 В). Аналогично, при инкубации Цистона с концентрацией Рисунок 2А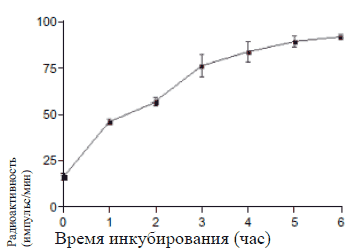
Рисунок 2Б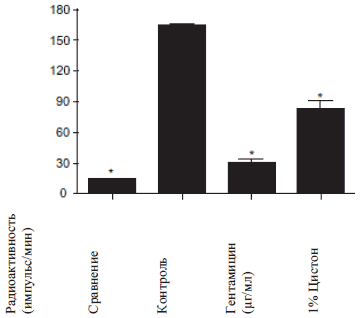
Рисунок 2В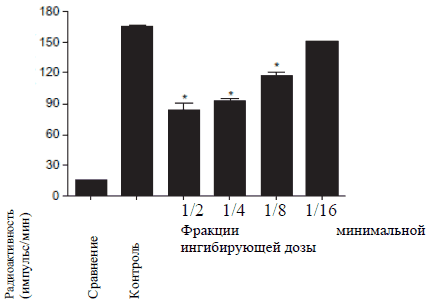
Рисунок 2Г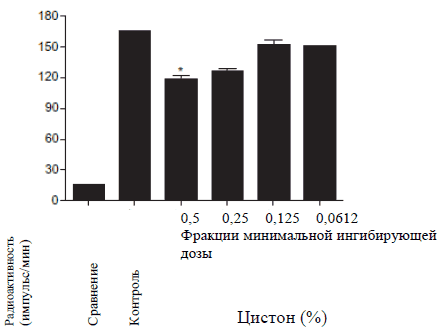
Рисунок 2: влияние гентамицина и Цистона на адгезию E. Coli. к NRK-52E клеткам. (А) Время включения [2-14C]- ацетат к E. Coli. (Б) Гентамицин и Цистон ингибируют бактериальную адгезию к NRK-52E клеткам. (В) Влияние субингибированной концентрации гентамицина и (Г) Цистона. Меченые E. Coli. клетки (1 х 105 E. Coli/мл) были инкубированы с 1 х 105 NRK-52E клетками в течение 30 минут с или без гентамицина/Цистона. Результаты представлены в Исследовании.
Примечания: на рисунках представлены средние значения ± стандартная погрешность 18 образцов, взятых из трех различных экспериментов.
* статистическая разница при Р
Цитопротекция, липидная пероксидация и содержание глютатиона
Цитотоксичность NRK-52E клеток, вызванная перекисью водорода при концентрации в 400 μМоль представлено на Рисуноке 3А. При совместной инкубации с 1% Цистоном, цитотоксичность уменьшилась на 73,5%, что показывает цитопротекторный эффект Цистона к NRK-52E клеткам. Похожий эффект наблюдался и при совместном ингибировании клеток с витамином С. С другой стороны Цистон при концентрации в 1% не смог справиться с токсичностью в клетках, вызванной гентамицином.
Добавление перекиси водорода привело к 4,15 среднекратному увеличению липидной пероксидации у NRK-52E клеток (Рисунок 3 Б). По сравнению с токсичной группой Цистон ингибировал липидную пероксидацию на 36%. Уровень глютатиона значительно уменьшился на 63% после добавления перекиси водорода. Цистон смог в значительной степени ингибировать снижение уровня глютатиона в клетках и увеличить его концентрацию на 136% по сравнению с клетками, на которые воздействовали перекисью водорода (Рисунок 3В). Витамин С использовали для проведения контрольного опыты для обоих исследований, в результате которых было выявлено, что он обладает сильным антиоксидантным действием к NRK-52E клеткам.
Рисунок 3А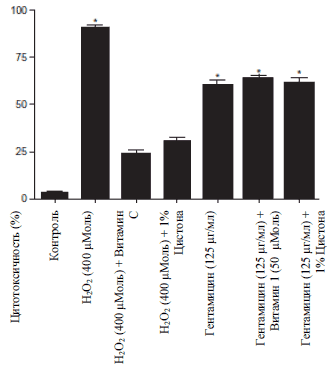
Рисунок 3Б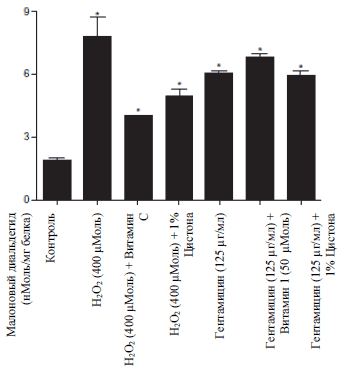
Рисунок 3В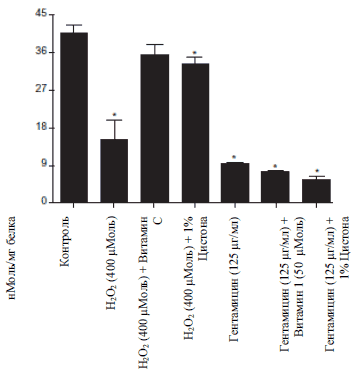
Рисунок 3: Цитопротекторный и антиоксидантный эффект Цистона у NRK-52E клеток. (А) на NRK-52E клетки воздействовали или не воздейстовавали 1% Цистоном вместе с 400 μМоль перекиси водорода и Гентамицина (125 μМоль/мл). Жизнеспособность клеток определяли с помощью МТТ метода. Определяли липидную пероксидацию (Б) и содержание глютатиона (В) у NRK-52E клеток.
Примечания: на рисунках представлены средние значения ± стандартная погрешность 18 образцов, взятых из трех различных экспериментов.
* статистическая разница при Р
Антиоксидантные ферменты
Оценивалось влияние Цистона на клетки, подвергшиеся воздействию перекиси водорода; результаты представлены в Таблице 2. В таких клетках активность каталазы, глутатионпероксидазы и супероксиддисмутазы повысилась на 22%, 46% и 29% соответственно. По сравнению с клетками, подвергшимися воздействию перекиси водорода, Цистон увеличил активность каталазы и глутатионпероксидазы на 53% и 68% соответственно. Аналогично Цистон, по сравнению с клетками, подвергшимися воздействию перекиси водорода, в три раза увеличил активность супероксиддисмутазы. Витамин С оказался эффективным против токсичности, вызванной перекисью водорода, и смог значительно повысить активность антиоксидантных ферментов так же как и Цистон. Гентамицин снизил активность антиоксидантных ферментов и ни Цистон, ни витамин С не смогли восстановить их активность.
Таблица 2. Влияние Цистона на активность антиокисдантных ферментов при токсичности NRK-52E клеток, вызванной перекисью водорода и гентамицином.
| Группы | Каталаза1 | ГП2 | СОД3 |
| Контрольная | 0,36±0,11 | 11,54±0,74 | 7,32±0,60 |
| 1% Цистона | 0,44±0,33а | 14,37±1,14 | 11,0±1,54а |
| Н2О2 | 0,60±0,23а | 13,18±1,10 | 32,44±9,29а |
| Н2О2 (400 μМоль) + Витамин С (50 μМоль) | 0,48±0,06а | 15,37±1,33 | 19,35±2,54б |
| Н2О2 (400 μМоль) + 1% Цистона | 0,55±0,13 | 19,44±1,64б | 22,16±2,82б |
| Гентамицин (125 μг/мл) | 0,24±0,03а | 4,37±1,14а | 11,0±1,54а |
| Гентамицин (125 μг/мл) + Витамин С (50 μМоль) | 0,30±0,23 | 5,63±1,10 | 6,44±9,29в |
| Гентамицин (125 μг/мл) + 1% Цистона | 0,18±0,06в | 2,37±1,33 | 4,52±2,54в |
Обсуждение
Диагностика и лечение повторяющихся ИМП усложнилась в связи с растущим числом антибиотикоустойчивых штаммов E.Coli. Вследствие чего возникла необходимость в новых лекарственных средствах, действие которых направлено на снижение бактериальной восприимчивости и увеличение защитных механизмов против ИМП, вместо использования антибактериальной терапии. Во время ИМП многочисленные иммуногенные и клеточные реакции определяют бактериальную патогенность и прочие вторичные проявления. Также считается, что вирулентность бактерий, которые заражают слизистые поверхности, зависит от способности микроорганизмов адгезировать к эпителиальным тканям организма1-4. Из настоящего исследования видно, что меченые клетки E. Coli адгезировали к почечным тубулярным эпителиальным клеткам после их совместного инкубирования. Также исследование показало, что подлетальная концентрация Гентамицина в NRK-52E клетках снизила адгезивную способность меченых клеток E. Coli, что свидетельствует о том, что гентамицин ингибирует бактериальную адгезию к почечным тубулярным эпителиальным клеткам. При совместной инкубации Цистона и NRK-52E клеток адгезия меченых бактерий к NRK-52E клеткам снизилась на 50%, что говорит о том, что Цистон ингибирует бактериальную адгезию к NRK-52E клеткам. В результате настоящего исследования выяснилось, что и Цистон и Гентамицин при высоких концентрациях токсичны к NRK-52E клеткам, поэтому в исследовании использовались нетоксичные концентрации данных препаратов. Проведенные ранее лабораторные исследования показывали, что колонизация уропатогенных бактерий в мочевыводящих путях зависит от бактериальной адгезии к эпителиальным клеткам, а так же, что бактериальная адгезия повышается у женщин, склонных к циститу35. Другие исследования показывают, что адгезия E. Coli типа О4 к клеткам вагинального эпителия не отличалась у контрольной группы и у группы женщин, склонных к циститу (ни при рН 6,4 ни при 4,0)29. Ранее уже было показано преимущество использования метода мечения радиоактивными изотопами над стандартным микроскопическим исследованием при изучении бактериальной адгезии29. Так, например, в настоящем исследовании при изучении бактериальной адгезии использовался метод мечения с [2-14C]- ацетатом E. Coli. В ходе данного исследования выяснилось, что вышеобозначенный метод зависит от времени (увеличение со временем).
По сравнению с гентамицином Цистон обладает умеренной бактериальной активностью. Гентамицин, в свою очередь, при любых концентрациях обладает значительной бактериальной активностью. Гентамицин при концентрации в 3,12 μМоль/мл и Цистон при концентрации в 1% ингибировали адгезию меченых радиоактивными изотопами E. Coli к NRK-52E клеткам. Также в результате исследования выяснилось, что Цистон способен ингибировать бактериальную адгезию и при меньших концентрациях (36. В тоже время считается, что благоприятное действие Цистона обусловлено изменением клеточных и иммунологических реакций, которые в свою очередь могут ингибировать бактериальную адгезию. Однако основополагающие процессы, упомянутые выше, не рассматриваются в настоящем исследовании.
Широко известно, что благодаря использованию ингибирующих сахаров удалось блокировать бактериальную адгезию, что позволило предотвратить инфекции мочевыводящих путей у мышей и приматов, которые вызывает E. Coli37,38. Следовательно, можно предположить, что, употребляя в пищу продукты, содержащие ингибиторы бактериальной адгезии, можно повлиять на инфекционный процесс. Несмотря на то, что клюквенный морс не обладает бактериальной активностью, он эффективно ингибировал бактериальную адгезию39. Цистон благодаря умеренной бактерицидной активности может предотвратить адгезию E. Coli к NRK-52E клеткам. Другое исследование показывает, что клюквенный морс имеет отношение к уромодулину, обнаруженному в моче, который оказывает влияние на бактериальную адгезию к клеткам слизистых оболочек40.
При лечении инфекций мочевыводящих путей обычно используют антибиотики широкого спектра, например, Гентамицин, или другой класс антибиотиков, которые могут нанести серьезный вред организму (в первую очередь почечным тубулярным клеткам животных и людей) и вызвать нефротоксичность20. В настоящем исследовании выяснилось, что Гентамицин цитотоксичен при концентрации > 1000, что выше минимальной ингибирующей дозы к E. Coli. В связи с этим предполагается, что при длительном применении в больших дозах Гентамицин оказывает токсичное воздействие на тубулярные клетки почек при отсутствии эффективного процесса метаболизма ксенобиотиков. Данные полученные ранее свидетельствуют о том, что Гентамицин вызывает апоптосис при формировании АФК20. При взаимодействии с патогенными микроорганизмами происходят различные иммуногенные реакции в результате которых образуется АФК, которые в свою очередь стимулируют возникновение воспалительных реакций11. В составе Цистона имеется большое количество полифенолов, которые являются источником антиоксидантов24-25. Для изучения цитопротекторного и антиоксидантного действия 1% Цистона на NRK-52E клетки использовали перекись водорода (400 μМоль). В результате проведенного исследования выяснилось, что Цистон восстановил жизнеспособность NRK-52E клеток, которые подверглись воздействию перекиси водорода. Из ранее проведенных исследований становится ясно, что Цистон также эффективен против цитотоксичности у грызунов, вызванной циспласином24-25.
Как известно, инфекции мочевыводящих путей вызывают окислительный стресс и повышают уровень липидного пероксида, что ведет к недостатку антиокислительных ферментов11. В настоящем исследовании NRK-52E клетки подвергли воздействию перекиси водорода, что привело к увеличению числа липидных пероксидов в 4,15 раз и снижению активности антиоксидантных ферментов. Цистон эффективно справился с данными биохимическими нарушениями, ингибируя липидную пероксидацию в NRK-52E клетках, вызванную перекисью водорода. Похожие наблюдения были отмечены и в других исследованиях фенольных соединений в различных окислительных моделях41. Цистон не только снизил липидную пероксидацию, но и эффективно снизил токсичность, вызванную перекисью водорода, посредством повышения активности антиоксидантных ферментов. Активность супероксиддисмутазы была увеличена в 3 раза по сравнению с контрольной группой с перекисью водорода. Цистон также увеличил активность глутатионпероксидазы и каталазы на 68% и 53% соответственно. Несколько исследований также содержат информацию о том, что фенольные соединения, увеличивая активность супероксиддисмутазы, глутатионпероксидазы и каталазы, удаляют свободные радикалы кислорода42. Кроме того, глутатион является основным антиоксидантом, который определяет жизнеспособность клеток. Результаты настоящего исследования показывают, что Цистон восстановил уровень глутатиона в клетках, которые подверглись воздействию перекиси водорода.
В заключении можно сказать, что лабораторные исследования показывают, что Цистон эффективно ингибирует бактериальную адгезию к NRK-52E клеткам, а также устранил токсичный эффект перекиси водорода на NRK-52E клетки посредством ингибирования липидных пероксидов и повышением антиоксидантных защитных механизмов. Следовательно, можно сделать вывод, что при лечении инфекций мочевыводящих путей с помощью традиционных антибактериальных средств, Цистон может оказывать благоприятный лечебный эффект.
Благодарность
Нам хотелось бы выразить свою искреннюю признательность Господину Рамешу Сурианараянана, директору научно-исследовательского отдела компании «Хималайя Драг Ко», Бангалор за его постоянную поддержку в течение всего времени исследования.
Публикуемые сведения
Автор не сообщает о конфликте интересов относительно настоящего исследования.
Библиография
