Макролиды в современной терапии бактериальных инфекций. Особенности спектра действия, фармакологические свойства
СтатьиОпубликовано в журнале:
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ »» 2003, 48; 11
С. В. БУДАНОВ, А. Н. ВАСИЛЬЕВ, Л. Б. СМИРНОВА
Научный центр экспертизы средств медицинского применения Минздрава России, Государственный научный центр по антибиотикам, Москва
Макролиды — большая группа антибиотиков (природных и полусинтетических), основу химической структуры которых составляет макроциклическое лактонное кольцо с одним или несколькими углеводными остатками. В зависимости от числа атомов углерода в кольце макролиды подразделяются на 14-членные (эритромицин, кларитромицин, рокситромицин), 15-членные (азитромицин) и 16-членные (джозамицин, мидекамицин, спирамицин).
Первый представитель этой группы — эритромицин был открыт и внедрен в клинику в начале 50-х годов прошлого столетия, широко применяется и в настоящее время при лечении респираторных инфекций, болезней кожи и мягких тканей, а также в последние годы в круг его показаний вошли инфекции, вызываемые внутриклеточными «атипичными» бактериями.
По спектру и степени антибактериальной активности представители этой группы близки, исключение составляют новые полусинтетические макролиды (азитромицин и кларитромицин), которые проявляют большую активность в отношении многих внутриклеточных бактерий, некоторых возбудителей опасных инфекций (бруцеллы, риккетсии), грамположительных и грамотрицательных неспорообразующих анаэробов и др. По механизму действия макролиды являются ингибиторами синтеза белка. Как правило, макролиды оказывают бактериостатическое действие, но в некоторых условиях: при изменении рН среды, снижении плотности инокулума, высоких концентрациях в среде могут действовать бактерицидно [1].
Большинство клинически значимых представителей макролидов относится к 14- или 16-членным макролидам. Азитромицин является полусинтетическим производным эритромицина А, в котором метильная группа замещена атомом азота, образуя новую 15-членную структуру, выделенную в новую подгруппу, получившую название азалиды. По ряду свойств (большая активность против некоторых грамотрицательных бактерий, наибольшая пролонгированность действия, клеточная направленность фармакокинетики и др.) азитромицин отличается от своих предшественников [2].
На фармацевтическом рынке России азитромицин широко представлен препаратом фирмы «Плива», который выпускается под торговым названием Сумамед.
Спектр антимикробного действия
Спектр действия базового антибиотика группы макролидов эритромицина во многом соответствует спектру других представителей этой группы. Эритромицин обладает преимущественной активностью против грамположительных кокков: он активен против стрептококков групп А, В, С, G, Streptococcus pneumoniae. Штаммы последних, устойчивые к бензилпенициллину, устойчивы и к макролидам. Штаммы Staphylococcus aureus обычно чувствительны к макролидам, однако возросшая их устойчивость к беталактамам не позволяет рекомендовать макролиды при стафилококковой инфекции как альтернативную группу антибиотиков без данных лабораторного исследования. Эритромицин активен против коринебактерий, сибиреязвенного микроба, клостридий, листерий, внутриклеточных бактерий (хламидий, микоплазм, легионелл) и атипичных микобактерий туберкулеза. К нему чувствительны некоторые спорообразующие грамположительные и грамотрицательные неспорообразующие анаэробы (табл. 1) [2].
Химическая трансформация ядра молекулы эритромицина, завершившаяся получением азитромицина, привела к существенным изменениям свойств по сравнению с эритромицином: повышению активности в отношении H.influenzae, высокой активности против Moraxella catarrhalis, боррелий (МПК — 0,015 мг/л) и спирохет [3]. Среди полусинтетических макролидов наиболее широко известны азитромицин и кларитромицин; зарегистрированные в России, они применяются по широкому кругу показаний, особенно первый [4]. Оба препарата активны против Mycobacteriumfortuitum, M.avium complex, M.chelonae [5, 6]. Длительно и эффективно применяются с целью профилактики и лечения микобактериозов, являющихся частым осложнением у ВИЧ-инфицированных больных, в комбинациях с другими антибиотиками и химиотерапевтическими средствами.
Таблица 1.
Антимикробный спектр эритромицина [1]
|
Микроорганизм |
Минимальная подавляющая концентрация, мг/л |
|
|
пределы колебаний |
МПК5о |
|
|
Staphylococcus aureus |
0,05->50 |
0,5 |
|
Метициллино-/оксацшшинорезистентные S.aureus |
>128 |
>128 |
|
Streptococcus pyogenes (гр. А) (чувствительные к бензилпенициллину) |
0,005-0,2 |
0,05 |
|
Streptococcus pneumoniae (чувствительные к бензилпенициллину) |
0,001-0,2 |
0,05 |
|
Streptococcus agalactiae (гр. В) |
0,03-0,25 |
0,1 |
|
Streptococcus bovis |
0,03-0,5 |
0,1 |
|
Streptococcus гр D (Enterococcus) |
0,1->100 |
1,0 |
|
Streptococcus viridans |
0,02-1,6 |
0,05 |
|
Corynebacterium diphtheriae |
0,005-1,6 |
0,01 |
|
Clostridium perfringens |
0,1-4 |
0,8 |
|
Listeria monocytogenes |
0,1-0,3 |
0,2 |
|
Neisseria gonorrhoeae |
0,005-0,4 |
0,1 |
|
Neisseria meningitidis |
0,1-1,6 |
0,4 |
|
Haemophilus influenzae |
0,1-5,2 |
3,1 |
|
Campylobacter spp. |
0,05-> 50 |
0,2 |
|
Bacteroidesfragilis |
0,1-> 100 |
<0,25 |
|
Legionella pneumoniae |
0,06-0,5 |
0,1 |
|
Mycoplasma pneumoniae |
0,001-0,2 |
0,05 |
|
Chlamydia trachomatis |
0,1-0,5 |
0,1 |
Таблица 2.
Сравнительная эффективность макролидов и других антибиотиков при ВВП, вызываемой типичными и «атипичными» возбудителями ([7] модифицированная)
Возбудители | Макролиды* | Пенициллины | Ингибиторозащищенные беталактамы | Тетрациклины |
Streptococcus pneumoniae | + | + | + | + |
Haemophilus influenzae | + | + | + | + |
Moraxella catarrhalis | + | — | + | + |
Chlamydia pneumoniae | + | — | — | + |
Mycoplasma pneumoniae | + | — | — | + |
Legionella spp. | + | — | — | + |
Примечание. * Среди макролидов азитромицин обладает наибольшей эффективностью в отношении частых возбудителей респираторных инфекций, таких как H.influenzae, M.catarrhalis, С.pneumoniae, M.pneumoniae.
Отличительным свойством азитромицина является активность в отношении многих энтеробактерий (Salmonella spp., Shigella spp., Escherichia coli). Значение МПК азитромицина для них колеблется в пределах 2—16 мг/л [7].
Азитромицин и кларитромицин активны в отношении практически всех возбудителей респираторных инфекций, что выдвинуло эту группу антибиотиков на первый план при лечении инфекций верхних и нижних дыхательных путей. Особенно часто они применяются в эмпирической терапии среднего отита, фарингита, острого и обострения хронического бронхита, внебольничной пневмонии (ВВП). В случае последней эти макролиды проявляют высокую эффективность как при типичной ВВП, так и при вызываемой «атипичными» возбудителями (Chlamydia, Mycoplasma, Legionella и др.) (табл. 2) [8]. Гарантировать эффективное применение макролидов при эмпирической терапии респираторных инфекций и особенно ВВП возможно только при условии постоянного контроля резистентности возбудителей к антибиотикам на региональном и локальном уровнях, поскольку эти возбудители часто характеризуются мультирезистентностью, включающей большинство групп антибиотиков, используемых при бронхолегочной патологии.
Современные макролиды (особенно полусинтетические) по широте и особенностям спектра действия превосходят антибиотики других групп. В пределах терапевтических концентраций они активны в отношении практически всех групп возбудителей внебольничных инфекций дыхательных путей (при необходимости — в комбинации с антибиотиками широкого спектра действия) [9]. Они высокоэффективны при внутрибольничных инфекциях, вызываемых многими грамотрицательными бактериями (табл. 3). В спектр их действия входят многие внутриклеточные возбудители таких тяжелых инфекций, как боррелиоз, риккетсиозы; а также микобактериозы, вызываемые атипичными микобактериями. Азитромицин активен в отношении энтеробактерий in vitro и в клинике при заболеваниях ими вызываемых; наряду с кларитромицином эффективно применяется при лечении геликобактериоза, кампилобактериоза. Азитромицин, эффективен при острых и хронических инфекциях, передаваемых половым путем (C.trachomatis, Ureaplasma urealyticum); при гонококковом уретрите и цервиците в сочетании с фторхинолонами. Азитромицин и кларитромицин широко применяются и являются основными средствами профилактики и лечения (в сочетании с другими химиотерапевтическим средствами) микобактериозов при ВИЧ-инфекции [10].
Таблица 3.
Активность новых макролидов в отношении основных респираторных патогенов [9]
Микроорганизм | Минимальная подавляющая концентрация, мг/л | |||
азитромицин | кларитромицин | рокситромицин | эритромицин | |
Streptococcus pneumoniae (частота выделения 20—50%) | 0,02 | 0,015 | 0,03 | 0,03 |
Streptococcus pyogenes | 0,12 | 0,015 | 0,06 | 0,03 |
Haemophilus influenzae | 0,25 | 4,0 | 4,0 | 4,0 |
Moraxella catarrhalis | 0,03 | 0,03 | 0,25 | 0,12 |
Chlamydia pneumoniae | 0,06 | 0,06 | 0,05 | 0,1 |
Mycoplasma pneumoniae | 0,01 | 0,01 | 0,03 | 0,01 |
Legionella pneumoniae | 1,0 | 0,5 | 0,25 | 1,0 |
Таблица 4.
Рекомендации по эмпирической терапии ВВП, разработанные научными сообществами стран Европы, США и Канады ([модифицированная])
|
Страна-разработчик рекомендации |
Контингент больных, степень тяжести заболевания |
Препараты выбора для эмпирической терапии |
|
Северная Америка (Infectious Diseases Society of America) |
Амбулаторные больные Госпитальные больные (тяжелые формы ВВП) |
Макролиды, фторхинолоны или доксициклин Беталактамы + макролиды или фторхинолоны |
|
США (American Thoracic Society) |
Амбулаторные больные |
Макролиды или тетрациклины, беталактамы или ко-тримоксазол + макролиды |
|
Амбулаторные больные |
Беталактамы или ко-тримоксазол + |
|
|
с сопутствующими заболеваниями |
макролиды |
|
|
Тяжелое течение ВВП |
Беталактамы + макролиды; имипенем или фторхинолоны |
|
|
Канада (Canadian Consensus Conference Group) |
Больные ВВП без сопутствующих заболеваний |
Макролиды или тетрациклины (доксициклин) |
|
Больные ВВП с сопутствующими заболеваниями |
Беталактамы, ко-тримоксазол + фторхинолоны |
|
|
Больные с тяжелым течением ВВП (ОРИТ) |
Беталактамы + макролиды/фторхинолоны; фторхинолоны + беталактамы |
|
|
Германия |
ВВП средней тяжести |
Беталактамы (амоксициллин) или макролиды |
|
Тяжелое течение ВВП |
Макролиды + беталактамы |
|
|
Франция |
ВВП средней тяжести |
Макролиды или аминопенициллины |
|
Тяжелое течение ВВП |
Макролиды или фторхинолоны + беталактамы |
|
|
Испания |
ВВП средней тяжести |
Аминопенициллины, ко-амоксиклав |
|
Тяжелое течение ВВП |
Макролиды + беталактамы |
При профилактике ревматической лихорадки в случаях аллергии к беталактамам азитромицин является средством выбора, что обусловлено бактерицидностью его действия и эффективностью коротких курсов применения (1 раз в сутки в течение 5 дней) [3].
Проблема резистентности и возможности макролидов
Практикуемое, наряду с макролидами, применение антибиотиков широкого спектра действия, в том числе и современных (беталактамы, карбапенемы, аминогликозиды, фторхинолоны и др.), при лечении тяжелых форм грамположительной инфекции способствовало повышению уровня их потребления и соответственно селекции и распространению множественной антибиотикорезистентности среди различных групп микроорганизмов. В течение последних 10—15 лет во многих регионах Европы, Северной Америки, Канады получили распространение устойчивые к бензилпенициллину пневмококки (PRSP). В серьезную проблему превратились диагностика и терапия ВВП, вызываемой «атипичными» возбудителями (C.pneumoniae, M.pneumoniae, Legionella spp.) [9, 10]. Характерно, что выделяемые при ВВП пневмококки были устойчивы не только к бензилпенициллину, но и к антибиотикам других групп, в том числе и к макролидам.
Несмотря на это научными сообществами многих стран (США, Канада, Германия, Франция и др.) были разработаны рекомендации по эмпирической терапии ВВП, основу которых составили макролиды в монотерапии, в сочетании с беталактамами, тетрациклинами, фторхинолонами в зависимости от формы и тяжести заболевания (табл. 4) [10—12]. Все рекомендации включают макролиды как препараты первоочередного выбора при лечении ВВП у больных < 60 лет без сопутствующих заболеваний.
В последние годы полусинтетические макролиды (азитромицин, кларитромицин, рокситромицин) прочно вошли в практику лечения респираторных инфекций и инфекционно-воспалительных заболеваний другой локализации. Они превосходят природные макролиды по спектру и степени антибактериальной активности, по фармакокинетическим свойствам и другим параметрам [13]. Тем не менее имеются публикации о выделении пневмококков, устойчивых и к новым макролидам. Однако к этим сообщениям следует относиться критически, так как они основаны на данных определения чувствительности к эритромицину. Описанные вспышки инфекций, вызываемых множественноустойчивыми штаммами S.pneumoniae (DRSP), охватывающие крупные медицинские центры или отделения больниц, чаще относятся к середине 90-х годов прошлого столетия (наблюдались в странах Западной и Центральной Европы, где средняя частота выделения DRSA составляла 20—25%) [14—15]. В России устойчивые к новым макролидам штаммы S.pneumoniae выделяются редко, уровень резистентное™ в целом не превышает 3—7% [16].
В настоящее время в большинстве регионов мира резистентность к макролидам сохраняется на низком уровне (обычно не превышает 25%). Следует отметить, что в большинстве случаев распространение устойчивости пневмококков к макролидам было связано с их неоправданно частым назначением, без достаточных показаний. Ограничение применения эритромицина лишь строгими показаниями сопровождается снижением уровня резистентности к применяемому препарату и к новым макролидам. Следует отметить, что по спектру действия и степени активности в отношении большинства видов микроорганизмов in vitro макролиды — природные и полусинтетические — отличаются мало. Различия в химиотера-певтической эффективности новых макролидов in vivo и в клинике обусловлены, в основном, особенностями фармакокинетики и связанными с нею фармакодинамическими показателями.
Фармакокинетика и фармакодинамика макролидов
Если оптимизация схем лечения эритромицином осуществляется на основе оценки времени (Т), в течение которого уровень концентрации антибиотика в крови превышает значение его МПК для выделенного патогена (т. е. Т > МПК), то такой подход неприемлем для азитромицина. Это обусловлено тем, что клиническая эффективность азитромицина определяется в основном соотношением площади под фармакокинетической кривой AUC и чувствительностью возбудителя к нему в значениях МПК антибиотика (т. е. AUC/МПК). В связи с низкими концентрациями азитромицина в крови (Стах 0,4—0,7 мг/л, в зависимости от дозы), показатель Т > МПК не может служить мерой измерения его эффективности in vivo (т. е. быть предиктором эффективности). Для кларитромицина оцениваемым показателем, как и в случае эритромицина, остается Т > МПК. Значения Сmax кларитромицина в зависимости от величины принимаемой дозы — 250 и 500 мг колебались от 0,6—1 мг/л до 2—3 мг/л соответственно, превышая значения МПК90 для основных возбудителей ВВП (S.pneumoniae, H.infleuenzae, M.catarrhalis) при условии двухкратного введения препарата в сутки (каждые 12 часов) [17, 18].
Сопоставление результатов клинической эффективности азитромицина с данными in vivo (при экспериментальных инфекциях) показывает, что они являются более значимыми, чем получаемые при определении чувствительности выделенного возбудителя in vitro. Наиболее важную роль при прогнозе эффективности азитромицина (в меньшей степени кларитромицина, рокситромицина) играет продолжительность экспозиции возбудителя с высокими внутриклеточными концентрациями антибиотика в очаге инфекции, в нейтрофилах, моноцитах периферической крови. Причем концентрации антибиотика в тканях значительно превышают значение его МПК90 практически для всех возбудителей ВВП в течение 8 дней и более после однократного приема внутрь в сутки в стандартном режиме дозирования [19].
Высокий уровень тканевого проникновения новых макролидов, особенно азитромицина, и длительное их пребывание в очаге инфекции позволяют оптимизировать режимы их применения на основе фармакодинамических показателей [20].
Тканевая и клеточная кинетика макролидов
Современные полусинтетические макролиды (азитромицин, кларитромицин, рокситромицин) обладают принципиальными преимуществами по сравнению с природными макролидами: расширенным спектром и активностью в отношении большинства «легочных» патогенов, активностью не только против грамположительных, но и многих грамотрицательных бактерий (H.influenzae, M.catarrhalis, «атипичных» возбудителей), антианаэробной активностью, а также высоким клеточным и тканевым проникновением. Это является основанием для их широкого применения при инфекциях верхних и нижних дыхательных путей и других инфекционно-воспалительных заболеваний. Отмеченное быстрое возрастание устойчивости пневмококков к макролидам in vitro не всегда сопровождается снижением эффективности препаратов в клинике [21, 22]. Это обусловлено тем, что в реализации клинического эффекта азитромицина, и в меньшей степени других макролидов, большее значение имеют их фармакокинетические (Ф/К) и фармакодинамические (Ф/Д) свойства, которые существенно отличаются от характерных для других групп антибиотиков [13, 21].
Таблица 5.
Отличительные характеристики азалидов и макролидов [24]
|
Азалиды |
Макролиды |
|
15-членное кольцо содержит азот, кислород и углерод Двухосновное соединение |
Химические свойства 14 и 16-членные кольца содержат углерод и кислород Одноосновные соединения |
|
Интенсивное внутриклеточное проникновение Пролонгированный период полувыведения (однократное введение в сутки) |
Фармакокинетика Слабая или умеренная тканевая и клеточная пенетрация T1/2 средней продолжительности (2-кратное введение в сутки) |
|
Грамположительные микроорганизмы и некоторые грамотрицательные аэробы Атипичные бактерии Анаэробы |
Антимикробный спектр Грамположительные аэробы «Атипичные» бактерии Анаэробы |
Рис. 1.
Концентрация макролидов в сыворотке крови.
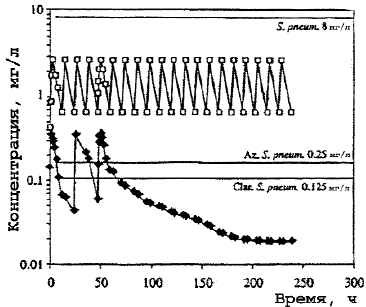
Здесь и на рис. 2, 3: — азитромицин (Az), — кларитромицин (Clar).
Рис. 2. Концентрация макролидов в гранулоцитах.
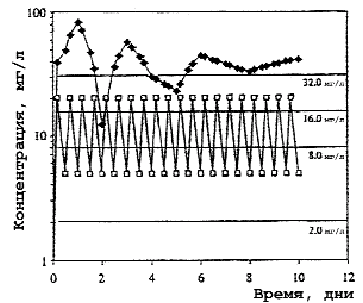
Рис. 3.
Концентрация макролидов в моноцитах.
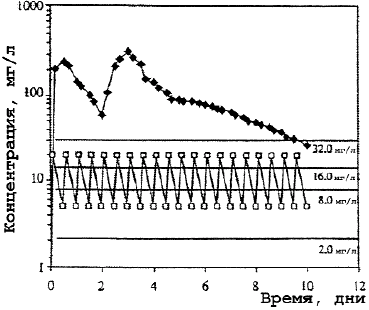
В противоположность кларитромицину концентрация азитромицина в крови редко превышала средние значения его МПК даже в отношении чувствительных к антибиотику штаммов S.pneumoniae, что приводило к выводу о его недостаточной клинической эффективности при пневмококковой инфекции. Однако, в связи с определяющей ролью высоких клеточных концентраций новых макролидов в реализации клинического эффекта, становится понятным отсутствие корреляции между выявляемой резистентностью S.pneumoniae к макролидам in vitro и проявлением их клинической эффективности. Несмотря на низкие значения концентраций азитромицина в крови, обнаруживаемые после завершения введения, резистентность возбудителей к нему не развивается. Больной полностью излечивается клинически и бактериологически при полной эрадикации возбудителя благодаря бактерицидному действию высоких внутриклеточных концентраций антибиотика (рис. 1—3) [23].
В противоположность низким уровням азитромицина и умеренным кларитромицина в сыворотке крови, содержание их в гранулоцитах, моноцитах, лимфоцитах и фибробластах обнаруживается в концентрациях, многократно превышающих значения МПК антибиотиков для многих микроорганизмов.
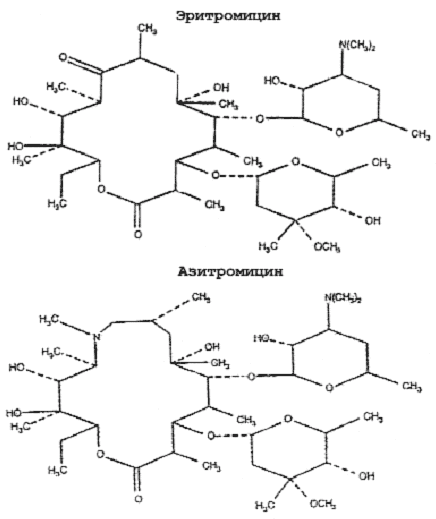
Макролиды проникают и концентрируются в кислых органеллах фагоцитов, причем азитромицин в наиболее высоких концентрациях. Более высокие уровни азитромицина в клетках обусловлены особенностями его химической структуры — наличием в его 15-членном кольце, наряду с кислородом и углеродом, атома азота, отсутствующего в 14- и 16-членных макролидах (рис. 4). В результате модификации молекулы азитромицин ведет себя как двухосновное соединение в отличие от моноосновных макролидов (табл. 5) [13]. Для него характерна продолжительная задержка в клетках в высоких концентрациях в течение 7—10 и более дней после окончания лечения и пролонгированный Т1/2 (68 ч). Более высокие внутриклеточные концентрации азитромицина по сравнению с 14- и 16-членными макролидами обусловлены его прочной связью с кислыми органеллами клеток [24]. При этом клеточная кинетика имитирует подъемы и падение концентраций в крови перед каждым повторным введением, как это имеет место при лечении кларитромицином [25].
Рис. 4.
Структура макролидов.
Низкие концентрации современных азалидов, обнаруживаемые в сыворотке крови, являются причиной опасений неудач при лечении бактериемии. Однако все макролиды, особенно азитромицин, присутствуют в высоких концентрациях в очаге инфекции, в циркулярующих ПМЯЛ, которые фагоцитируют и освобождают организм от возбудителя при его контакте с высокими бактерицидными концентрациями антибиотика в клетке. Высокие концентрации азитромицина в ПМЯЛ обеспечивают его присутствие в них в высоких концентрациях в течение нескольких дней после завершения курса лечения [24]. С точки зрения активности азитромицина в очаге инфекции важными являются данные о зависимости накопления его от наличия воспаления в тканях. Сравнительное изучение интерстициальной жидкости очага воспаления на модели инфицированного или интактного блистеров у волонтеров показало, что концентрация азитромицина в инфицированном блистере значительно выше, чем в неинфицированном (рис. 5) [26]. Показано также, что концентрация азитромицина в ткани легких при воспалении в 5—10 раз выше, чем обнаруживаемая при биопсии здоровой легочной ткани в диагностических целях.
Рис. 5.
Значения AUC 0- 24 азитромицина в сыворотке крови и блистере при воспалении и его отсутствии.
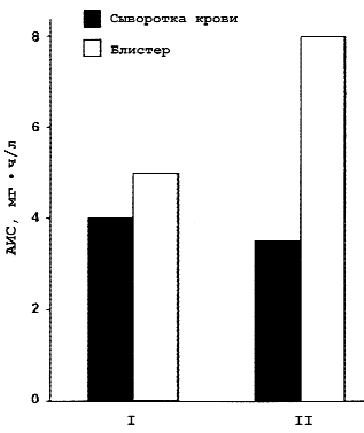
В отсутствие воспаления — I, при воспалении — II.
Длительное сохранение в высоких концентрациях азитромицина внутриклеточно в воспаленных тканях важно с клинической точки зрения, поскольку позволяет оптимизировать его активность в очаге инфекции за счет максимальных показателей AUC/МПК и Т > МПК.
ПМЯЛ, другие клетки крови и тканей участвуют в клиренсе бактерий из очагов инфекции или крови. Лизосомы с накопленным в них антибиотиком и фагосомы с фагоцитированными бактериями формируют в клетке фаголизосомы, где происходит контакт возбудителя с очень высокими концентрациями препарата (см. рис. 2, 3). Здесь активность азитромицина максимальная не только в отношении чувствительных патогенов, но и умеренно чувствительных, МПК антибиотика для которых составляет 32 мг/л. Высокий пиковый уровень азитромицина в ПМЯЛ (> 80 мг/л), в моноцитах (100 мг/л) и длительное его сохранение (> 12 дней) на уровне 16— 32 мг/л обеспечивают быстрое освобождение клеток от возбудителей. В пределах этих концентраций возможна оптимизация режимов применения антибиотика по фармакодинамическим критериям AUC/МПК и Т > МПК.
Максимальные внутриклеточные концентрации кларитромицина значительно ниже, обнаруживаемых при приеме азитромицина, его пиковые концентрации составляют 20—25 мг/л, снижаясь до 5 мг/л перед повторным введением (через 8—12 ч). При значениях МПК этого антибиотика до 4—8 мг/л в отношении S.pneumoniae фармакодинамические показатели могут быть неблагоприятными и сопровождаться клиническими неудачами.
Анализ фармакодинамических критериев устойчивости к макролидам и азитромицину свидетельствует о наибольшем значении в реализации клинического эффекта концентраций этих антибиотиков в ПМЯЛ и других клетках. Ошибки и просчеты при лечении макролидами наблюдаются при низких внутриклеточных концентрациях таких препаратов, как эритромицин и другие природные макролиды, причем применение первого из них с наибольшей частотой сопровождается развитием резистентности. Наиболее благоприятными Ф/К и Ф/Д показателями характеризуется азитромицин, который обладает наилучшим внутриклеточным проникновением, наибольшим временем сохранения в клетке в высоких концентрациях, что обусловливает быстрый клиренс возбудителя из организма больного, и предупреждает развитие резистентности. То есть тканевая и клеточная направленность фармакокинетики макролидов и аза л ид ов является важным отличием их от других групп антибиотиков. Если для беталактамов основным параметром, определяющим их клиническую эффективность, является степень чувствительности бактерий к их действию (выраженная в значениях МПК), то для новых макролидов предиктором эффективности являются Ф/Д показатели: время (Т) и площадь под фармакокинетической кривой (AUC), превышающие значения МПК антибиотиков для выделенных возбудителей (Т > МПК и AUC/МПК). Простое определение степени превышения МПК в отношении возбудителя и сопоставление ее значения с концентрацией антибиотика в крови, как это имеет место для беталактамов и аминогликозидов, в случае макролидов является недостаточным. Для них необходимо рассчитывать Ф/Д критерии с учетом концентраций препаратов в иммунокомпетентных клетках, обнаруживаемых при стандартных режимах применения, позволяющие гарантировать клиническую эффективность или положительную клиническую динамику заболевания и эрадикацию возбудителя [25].
При анализе литературы за 10 лет применения азитромицина и предшествующего ему 40-летнего опыта лечения природными макролидами не было обнаружено сообщений о возникновении случаев бактериемии, связанных с макролидами, и о риске возникновения сепсиса Возрастание резистентности — это общебиологическая проблема, касающаяся всех групп антибактериальных препаратов и всех видов возбудителей, однако она еще не коснулась вплотную азитромицина, что обусловлено особенностями его химического строения, прочной связью с органеллами клетки, созданием в ПМЯЛ и других иммунокомпетентных клетках высоких концентраций антибиотика [27]. Быстрый киллинг и клиренс возбудителей из очага воспаления, высокие клеточные концентрации азитромицина при стандартных режимах лечения препятствуют формированию и распространению устойчивости к его действию, о чем свидетельствует низкая частота выделения устойчивых S.pneumoniae по сравнению с устойчивостью к пенициллинам. Наблюдения о возрастании устойчивости к макролидам относится чаще всего к старым природным антибиотикам этой группы, характеризующимся низким значением Т1/2 и быстрым выведением из организма [28]. Опасения относительно недостаточной эффективности старых макролидов и опасности развития осложнений, в том числе бактериемии, при длительном применении этой группы антибиотиков, не лишены оснований, что обусловливает ограничения показаний к их назначению инфекциями средней тяжести и короткими курсами.
Выводы
1. Современные полусинтетические макролиды (азитромицин, кларитромицин, рокситромицин, зарегистрированные в России) характеризуются сверхшироким спектром действия: они активны против большинства грамположительных микроорганизмов, многих грамотрицательных бактерий, «атипичных» внутриклеточных возбудителей респираторных инфекций; в спектр их действия входят также атипичные микобактерии, возбудители ряда опасных инфекционных заболеваний (риккетсий, бруцеллы, боррелий и др.) и некоторые простейшие. Они превосходят природные макролиды не только по широте спектра и степени антибактериальной активности, но и по бактерицидному действию на многие возбудители.
2. Новые макролиды (особенно азитромицин) обладают улучшенными фармакокинетическими свойствами: пролонгированной фармакокинетикой (Т1/2 азитромицина, в зависимости от дозы, составляет 48—60 часов), способностью накапливаться и длительно задерживаться в иммунокомпетентных клетках в течение 8—12 суток после завершения 3—5-дневных курсов приема внутрь в стандартной дозе.
3. Тканевая и клеточная направленность кинетики, пролонгированное действие новых макролидов, возможность их эффективного применения короткими курсами без опасности развития серьезных побочных реакций обусловливают невысокий риск развития и распространения антибиотикоустойчивости.
4. Полусинтетические макролиды характеризуются высокой комплаентностью, улучшенными показателями стоимость эффективность (меньшая стоимость койко-дня, меньшие затраты на лекарственное и лабораторное обеспечение, на зарплату персонала и др.)
ЛИТЕРАТУРА
1. Anti-infective therapy /Mandell G. L., Douglas R. G., Bennett J. E. eds. New York; Edinburgh, London, Melbourne, 1985; 197-218.
2. Antimicrobial Chemotherapy/ Greenwood D. ed. 4 th ed. Oxford 1995; 43-49.
3. A practical approach to infectious diseases. Antibiotic Use. / Reese R. E., Belts R. F. eds. 4 th ed. Boston, New York; Toronto, 1996; 1461.
4. Eisenberg E., Barza M. Azithromycin and clarithromycin. Curr Clin Top Infect Dos 1994; 14: 52-67.
5. Noirby S. R. New macrolides and azalides. Any better that ery-thromycin? Infect Dis Clin Prac 1994; 3: 405—412.
6. Zuckerman J. M., Kaye К. М. The newer macrolides: Azithromycin and clarithromycin. Infect Dis Clin North Am 1995; 9: 731—738.
7. Dautzenberg B. Activity of clarithromycin against Mycobacterium avium infection in patients with acquired immunodificiency syndrome. Am Rev Respir Dis; 1991: 144: 564-603.
8. Retsema J., Fu W. Macrolides structure and microbial targets. Intern J Antimicrob Agents 2001; 18: 1-10.
9. O'Grady F., Lampert H. P., Finch R. G. Antibiotic and chemotherapy antiinfective agents and their use in therapy. 4th eds. Singapure. 1997;
377-393.
10. Pechere J. C. New perspective on macrolide antibiotics. Intern J Antimicrob Agents 2001; 18: Suppl 1: 92-98.
11. WiedemanM. S.,BassJ.B., Camplett G. D. et al. Guidelines for the initial management of adults with community-acquired pneumonia: diagnose, assessment of severity and initial antimicrobial therapy. Am Rev Respir Dis 1993; 148: 1418-1426.
12. HettelfingesD., DowellS. E., YougenserJ. H. etal. Management of community-acquired pneumonia in the era of pneumococcal resistance: a report from drug resistance S.pneumoniae. Therapeutic Working Group Arch Intern Med 2000; 160: 1399-1408.
13. Amsden G. W. Advanced-generation macrolides tissue-directed antibiotics. Intern J Antimicrob Agents 2001; 18: Suppl 1: 11—15.
14. Baguero F. Trends an antibiotic resistance of respiratory patogens: an analisis and commentary of collaboratore surveillence study. J Antimicrob Chemother 1996; 38: Suppl A: 117—132.
15. Tomas A. Antibiotic resistance in Streptococcus pneumoniae. Clin Infect Dis 1997; 24: Suppl 1:55-88.
5. Возможность создания новых полусинтетических соединений в группе макролидов с новой направленностью биологических эффектов (противовоспалительное, антипаразитарное действие и др.) путем трансформации молекулы позволяет рассматривать макролиды как одну из наиболее важных и перспективных групп антибиотиков в последующие десятилетия.
16. Практическое руководство по антиинфекционной химиотерапии. Под ред. Страчунского Л. С., Белоусова Ю. Б., Козлова С. Н. М.: 2002; 384.
17. Conte J. E., Golden J., Duncan S. et al. Single dose intrapulmonare pharmacokinetics of azithromycin, clarithromycin, ciprofloxacin and cefuroxime in volonteer subjects. Antimicrob Agents Chemother 1996; 40:617-622.
18. Clarithromycin product information. Abbott 1997.
19. Amsden G. W. Erythromycin, clarithromycin and azithromycin are the differences real? Clinical Therapeutics 1996; 16: 56—72.
20. Carcon C. Clinical relevance of intracellulare and extracellular macrolide. Infection 1995; 25: Suppl 1: 10—14.
21. Drusano G. L., Craig W. A. Relevance of pharmacokinetics and phar-macodynamics in the selection of antibiotics for respiratory tract infe-tions. J Chemother 1997; 9: Suppl 3: 38—44.
22. Peters D. H., Friedel H. A., McTavish D. Azithromycin. A review of antimicrobial activity, pharmacokinetic properties and clinical efficacy. Drugs 1990; 44: 750-799.
23. Van Bambeke F., Tulkens P. M. Macrolides: pharmacokinetics and pharmacodynamics. Intern J Antimicrob Agents 2001; 18: 17—23.
24. Amsden G. W. Pharmacological consideration in the emergence of resistance. Ibid; 1999; Supppl 11: 7-14.
25. Craig W. A. Choosing an antibiotic on the basis of pharmacodynamics. Ear Nose Throgt 1998; 77: Suppl 6: 7-12.
26. Freemen C. D. Quintiliani C. H., Nicolan SD. P. Intracellulare and extracellular penetration of azithromycin into inflammatory and noinflam-matory blister fluid. Antimicrob Agents Chemother 1994; 38: 2449— 2451.
27. Cambridge Med Publication 1998; 10. 3. Advisory panel on macrolide pharmacology and efficacy Meeting Brussels, 1998.
28. Retsema J. A., GirardA. K., Brennan L. A. etal. Lack of emergence of significant resistant in vitro and in vivo to the new azalide antibiotic azithromycin. Eur J Clin Microbiol Infect Dis J 1991; 10: 843-846.
Комментарии
ПРАКТИКА ПЕДИАТРА
