Обладает фунгистатическим и фунгицидным действием в терапевтических дозах
Новое поколение антимикотических препаратов
Широкий спектр действия, превосходящий классические имидазолы
Высокая активность против резистентных к классическим препаратам форм
Отличная переносимость
Эффективность сертаконазола в комплексной терапии атопического дерматита
СтатьиОпубликовано в журнале:
«Российский аллергологический журнал», 2013, №2, с. 65-72
О.Г. Елисютина, Е.С. Феденко, О.В. Штырбул
ФГБУ «ГНЦ институт иммунологии ФМБА» России, г. Москва
Ключевые слова: атопический дерматит, Malassezia, Candida, противогрибковая терапия, сертаконазол, антигистаминная терапия, левоцетиризин
В статье обсуждается роль грибковой инфекции, в частности грибов рода Malassezia, Candida, в патогенезе атопического дерматита (АтД), а также данные о целесообразности применения противогрибковой терапии при данном заболевании. приведены результаты собственных наблюдений об эффективности применения крема сертаконазола в комплексной терапии АтД.
Sertaconazole in treatment of atopic dermatitis patients
Elisyutina O.G., Fedenko E.S., Shtirbul O.V.
Institute of Immunology, Moscow, Russia
Key words: atopic dermatitis, Malassezia, Candida, antifungal treatment, sertaconazole, antihistamine therapy, levocetirizine
The role of Malassezia and Candida infection in pathogenesis of atopic dermatitis, as well as the results of Sert-aconazole cream efficiency in atopic dermatitis are given in the article.
Атопический дерматит (АтД) – многофакторное заболевание, имеющее в своей основе генетическую предрасположенность к аллергии, сложные иммунные механизмы развития аллергического воспаления в органе-мишени коже. Согласно современным представлениям, одним из главных предрасполагающих факторов к формированию сенсибилизации и к развитию АтД является нарушение функций и повреждение эпидермального барьера. Указанные изменения обусловлены генетически детерминированным нарушением соотношения липидов в коже, активности протеаз и протеазных ингибиторов, что сопровождается повышением трансэпидермальной потери влаги и нарушением функций кератиноцитов [1, 2]. Активность экзогенных протеаз способствует повреждению эпидермального барьера и создает условия для проникновения токсинов, аллергенов и антигенов в глубокие слои кожи, где возможно их непосредственное взаимодействие с кератиноцитами, антиген-презентирующими и эффекторными клетками, результатом которого является развитие сложного иммунного ответа и хронического воспаления [3, 4]. Данные патологические изменения приводят к благоприятным условиям для роста и развития бактериальной и грибковой микрофлоры. Микробиоценоз кожи больных АтД по сравнению со здоровыми лицами характеризуется повышением общего числа микроорганизмов с преобладанием стафилококков (преимущественно S. aureus) и уменьшением других представителей нормальной микрофлоры (пропионибактерий, стрептококков, грамотрицательных микроорганизмов). Наиболее существенную роль при АтД играют S. aureus, грибы рода Malassezia и Candida [5, 6]. Присоединение вторичной инфекции при АтД изменяет клиническую картину, утяжеляет течение заболевания и нередко приводит к диагностическим ошибкам и назначению неадекватной терапии.
По данным разных авторов, присоединение грибковой инфекции отмечается у 40–90% больных АтД [6]. Наиболее важными грибковыми антигенами, участвующими в развитии АтД, являются грибы рода Malassezia и Candida.
Роль грибов рода Malassezia
Malassezia относится к классу базидиомицет и является липофильным дрожжеподобным грибом. Ранее возбудитель называли Pityrosporum orbiculare или Pitirosporum ovale. Грибы Malassezia обитают на коже человека и теплокровных животных. Считается, что не менее 90% населения являются носителями Malassezia. На коже человека наибольшая плотность колонизации кожи отмечается в наиболее богатых сальными железами участках: в области волосистой части кожи головы, на лице, на коже воротниковой зоны, а также в области гениталий. Степень колонизации в этих участках составляет не менее 1х104 КОЕ/мл. По данным различных авторов, на коже здоровых лиц преобладают M. symbodialis и М. globosa. Грибы рода Malassezia – несовершенные дрожжевые грибы. Уникальным свойством Malassezia является их липофильность. Патогенные свойства Malassezia связывают также с диморфизмом, т.е. со способностью переходить в мицелиальную (плесневую) форму. На коже здоровых людей Malassezia присутствуют преимущественно в дрожжевой фазе [7]. У больных АтД с локализацией на коже головы, шеи и верхних отделов туловища обнаруживаются M. globosa и M. restricta в 90% случаев, а M. furfur и M. sympodialis – в 40% [8].
В настоящее время к собственно инфекциям, вызываемым Malassezia, относят разноцветный лишай, фолликулит, неонатальный пустулез, отит. В отдельную группу выделяют так называемые Malassezia-ассоциированные дерматозы: себорейный дерматит и перхоть и синдром Гужеро–Карто. АтД не является заболеванием, ассоциированным с грибами рода Malassezia, однако некоторые авторы выделяют отдельную форму АтДс локализацией на голове и шее, ассоциированную с Malassezia [9].
Присоединение инфекции Malassezia при АтД изменяет его клиническую картину, для которой характерны следующие признаки:
- особенности локализации высыпаний: в области богатых сальными железами участков кожи лица, воротниковой зоны, а также волосистой части головы и шеи;
- желтовато-красные, коричневатые шелушащиеся пятна и папулы различного размера, начинающиеся от устьев волосяных фолликулов, постепенно увеличивающиеся в размерах, сливающиеся между собой;
- участки гипопигментации, чередующиеся с гиперпигментацией.
Помимо собственно грибковой инфекции Malassezia в поддержании воспаления при АтД может иметь место сенсибилизация и развитие IgE-зависимой аллергической реакции к антигенам данного микроорганизма. Антигены Malassezia являются протеинами и углеводами с молекулярной массой от 9 до 67 кДа и способны инициировать IgE-опосредованный иммунный ответ, поддерживая аллергическое воспаление в коже [10]. Грибы Malassezia обладают высокой иммуногенной активностью, существенно превышающей таковую у Candida albicans. В настоящее время описано большинство известных антигенов основных видов рода Malassezia, исследована их биохимическая структура, способность к индукции антител изотипа IgE в крови больных АтД, а также получены основные рекомбинантные аллергены. В нескольких фундаментальных биохимических исследованиях выявлена высокая перекрестная реактивность между антигенами грибов Malassezia spp. и другими дрожжеподобными грибами, такими как Candida albicans, Rhodotorula rubra, Cryptococcus albidus и Saccharomyces spp. Она обусловлена гомологией антигенных детерминант высокомолекулярных маннанпротеинов, выделенных из этих грибов. Считается, что первичную сенсибилизацию вызывают грибы Malassezia spp. [11].
По данным различных авторов, IgE к Malassezia furfur были выявлены в 35–67% случаев АтД [12, 13]. При этом показано, что IgE к Malassezia furfur определяются у больных АтД, но не определяются у больных себорейным дерматитом, разноцветным лишаем и у здоровых лиц. Наличие сенсибилизации к Malassezia furfur также подтверждено постановкой кожных тестов с данным аллергеном. Так, положительный patch-тест на антиген этого гриба обнаруживается у 64% больных АтД и у 3% здоровых лиц, а положительный prick-тест – у 71% больных АтД и отсутствует у здоровых [14].
Значение Malassezia furfur в патогенезе АтД подтверждают работы, посвященные эффективности противогрибковых препаратов в комплексном лечении АтД. Так, в работах Back и соавторов показано, что при лечении кетоконазолом отмечается снижение уровня аллерген-специфических IgE, сопровождаемое уменьшением степени тяжести АтД. При этом уровень IgE к Malassezia furfur коррелировал с тяжестью АтД, локализующегося именно на лице и шее [15]. В основном исследователи рекомендуют применение длительных курсов итраконазола или кетоконазола или флуконазола [15, 16]. В исследованиях, проведенных японскими учеными, показано, что применение 2% крема кетоконазола приводило к клиническому улучшению состояния больных АтД с локализацией высыпаний на коже лица и шеи в 70% случаев и к элиминации Malassezia в 90% случаев [17].
Роль грибов рода Candida
Дрожжеподобные грибы рода Candida часто служат причиной грибковых инфекций кожи у больных АтД [7]. Главным возбудителем кандидоза кожи является C. albicans. Данный вид обнаруживается приблизительно у 60% здоровых взрослых. На втором месте после C. albicans обычно находится C. glabrata. Виды Candida, являющиеся комменсалами человека и обитающие на коже человека, такие как С. parapsilosis, C. guillermondi или C. kefyr, крайне редко вызывают клинические проявления кандидоза кожи. Грибы рода Candida – это дрожжевые грибы, существующие преимущественно в форме почкующихся клеток, при этом многие виды образуют псевдомицелий – вытянутые, а не округлые видоизмененные дрожжевые клетки. От настоящего мицелия они отличаются тем, что не имеют истинных перегородок. По наличию факторов патогенности C. albicans превосходит все остальные виды. К основным факторам патогенности относятся изменчивость и значительная лабильность морфофизиологических свойств клетки, рецепторы адгезии и литические ферменты. C. albicans – единственный в своем роде вид, существующий в диплоидном состоянии. В зависимости от условий среды данный микроорганизм может переходить от дрожжевой формы к плесневой и обратно, меняет общий фенотип или структуру поверхности, т. е. рецепторы и антигены [18].
Присоединение инфекции, вызванной грибами C. аlbicans, приводит к изменению клинической картины АтД, для которой характерны следующие проявления:
- тяжелое, непрерывное рецидивирующее течение АтД, сопровождающееся мокнутием и интенсивным зудом, несмотря на адекватно назначенную противовоспалительную терапию;
- отсутствие улучшения в летнее время года, особенно при повышенной влажности;
- связь обострений с использованием в питании продуктов, содержащих дрожжеподобные грибы и легкоусвояемую углеводистую пищу, дрожжи, сахар;
- поражение крупных складок кожи, межпальцевых складок, гладкой кожи, фолликулита, баланита и баланопостита;
- эритематозно-отечные участки с везикулами, папулами, пустулами, экссудативные элементы быстро вскрываются с образованием эрозий, имеющих белесоватый налет;
- трещины в углах рта – заеды, или ангулярный хейлит, гиперемия.
Проводились работы, в которых было доказано участие грибов рода Candida в патогенезе АтД, в том числе и по IgE-зависимому типу аллергических реакций. В частности, известно, что положительный prick-тест с аллергенами гриба рода Candida достоверно чаще отмечается у больных АтД по сравнению со здоровым лицами. Рост грибов рода Candida нередко выявляется на коже здоровых, но число колоний всегда выше у больных АтД [7, 16].
Для подтверждения грибковой инфекции при АтД в настоящее время возможно использование ряда методов лабораторной диагностики. Наиболее часто используют микроскопические методы (KOH-тест, окраска калькофлюором), бактериологические и культуральные исследования с использованием специальных сред и иммунологические методы. Следует отметить, что определение уровня антител изотипа IgG к Malassezia и Candida в сыворотке крови неинформативно, и использование данного метода в рутинной клинической практике нередко приводит к ошибкам в постановке диагноза. Для выявления сенсибилизации к грибковым антигенам целесообразно определение антител изотипа IgE к антигенам Candida и Malassezia с помощью лабораторных методов диагностики. Также в литературе описаны методы постановки кожных скарификационных, внутрикожных и аппликационных тестов с грибковыми аллергенами, однако в нашей стране в настоящее время данные диагностические аллергены недоступны.
Таким образом, присоединение грибковой инфекции при АтД может не только ухудшать течение АтД, но также вызывать и поддерживать аллергическое воспаление кожи по IgE-зависимому типу аллергических реакций.
Основными препаратами, применяемыми для лечения АтД, являются топические глюкокортикостероиды (ТГКС), которые обладают выраженным противовоспалительным действием. Однако при осложненных формах АтД применение ТГКС является недостаточно эффективным. В таких случаях показано применение ТГКС в сочетании с противогрибковыми препаратами. Противогрибковая терапия не включена в стандартные схемы лечения АтД по ряду причин. С одной стороны, элиминация резидентной дрожжевой флоры значительно увеличивает риск заражения патогенными микроорганизмами и формирование резистентности грибковой флоры к антимикотикам. С другой стороны, нежелательные побочные эффекты при длительном системном применении антимикотиков также ограничивают их широкое использование при АтД. Поэтому необходимым условием назначения противогрибковой терапии при АтД являются клинические проявления присоединения грибковой инфекции, а целью применения противогрибковой терапии при АтД является не полная элиминация грибковой микрофлоры с кожи, а достижение симбиотического баланса.
В настоящее время широко используются наружные препараты, обладающие противогрибковым действием, которые можно разделить на специфические и неспецифические. К специфическим противогрибковым средствам относят те вещества, которые действуют на самого возбудителя заболевания – клетку гриба, причем их действие является избирательным (только на грибы). К неспецифическим препаратам относят наружные антисептики с противогрибковым действием.
По химической структуре и механизмам действия наружные средства с противогрибковым действием можно разделить на следующие группы (табл. 1):
- Препараты группы азолов.
- Препараты группы аллиламинов.
- Противогрибковые антибиотики.
- Прочие препараты.
- Цинк-содержащие препараты.
Также широко используются комбинированные препараты, которые имеют в своем составе противогрибковый, антибактериальный компоненты и ГКС.
Таблица 1. Наружные средства с противогрибковым действием
| Группа | Действующее вещество | Торговое название |
| Препараты группы азолов | Бифоназол Клотримазол Эконазол Изоконазол Кетоконазол Миконазол Оксиконазол Сертаконазол |
Бифосин Микоспор Амиколон Кандибене Кандид Канестен Клотримазол Экалин Экодакс Ифенек Травоген Микозорал Низорал Дактарин Мифунгар Залаин |
| Препараты группы аллиламинов | Нафтифин Тербинафин |
Экзодерил Ламизил Тербизил Фунготербин Экзифин Тербинокс |
| Противогрибковые антибиотики | Натамицин Нистатин Леворин Амфотерицин В |
Пимафуцин Нистатиновая мазь Левориновая мазь Амфотерицин В |
| Прочие препараты | Аморолфин Нитрофунгин Циклопирокс |
Лоцерил Батрафен |
| Цинк-содержащие препараты | Пиритион цинк Цинка оксид |
Скин–кап Деситин |
Большинство случаев осложненных грибковой инфекцией форм АтД поддаются рационально подобранной наружной терапии. Однако при наличии хронического многолетнего течения заболевания, сочетанного поражения кожи, ногтей, слизистых, а также в случаях недостаточной эффективности местной терапии целесообразным является назначение системных противогрибковых препаратов. Преимуществами наружной терапии является минимальный риск развития побочных реакций, ограниченное число противопоказаний, низкая фармакологическая нагрузка на организм, а также простота и удобство использования.
К сожалению, известные препараты с выраженным фунгистатическим действием имеют ряд недостатков. Наиболее существенным из них является значительный процент рецидивов грибковой инфекции, а также появление штаммов грибов, резистентных ко многим препаратам. Поэтому в настоящее время продолжается разработка новых противогрибковых средств, которые должны обладать широким спектром действия, фунгицидной активностью как in vitro, так и in vivo, минимальной токсичностью, удобством применения. С учетом этих требований были разработаны соединения, содержащие 1-(2-арил-двузамещенную – этил) азоловую группировку с выраженным противогрибковым действием и бензо [b] тиофеновую группу, которая наряду с противогрибковым действием обладает высокой липофильностью, усиливающей местное действие подобных веществ. Одним из представителей этой группы является сертаконазол, который обладает широким спектром действия в отношении микроорганизмов, вызывающих грибковые поражения кожи и слизистых оболочек. Сертаконазол является представителем абсолютно нового поколения антимикотических препаратов и представляет собой производное имидазола и бензотиофена, химическая структура которого обеспечивает тройной механизм действия: фунгицидный, фунгистатический и препятствует переходу непатогенной формы в патогенную (для С. albicans).
Сертаконазол активен в отношении патогенных грибов Candida spp. и Malassezia spp., дерматофитов (Trichophyton, Microsporum, Epidermophyton), а также грамположительных бактерий (стафилококки и стрептококки) и различных видов трихомонад. Сертаконазол является противогрибковым средством для местного применения, обладающим в терапевтических дозах как фунгистатическим, так и фунгицидным действием. Фармакологические и фармакокинетические свойства сертаконазола подтверждают высокую клиническую эффективность и низкое число побочных эффектов. Фунгицидная активность является следствием прямого взаимодействия сертаконазола с плазматической мембраной грибов, приводящего к образованию в ней воронок и пор и вызывающего массивный выход цитоплазмы и АТФ. Структурное сходство бензотиофена и триптофана облегчает проникновение сертаконазола в плазматическую мембрану грибов. Фунгистатический механизм действия, обусловленный наличием азоловой группировки, связан с подавлением биосинтеза эргостерола. Сертаконазол в низких концентрациях обладает выраженной фунгицидной активностью, что отличает препарат от других противогрибковых средств. Механизм действия сертаконазола обеспечивает его активность в отношении грибов, имеющих перекрестную резистентность к производным имидазола, а также для лечения торпидных к терапии возбудителей (Trichophyton rubrum и др.). Сертаконазол выпускается в виде крема залаин (производитель Феррер Интернасионал А.О., Испания, для фармацевтического завода ЭГИС А.О., Венгрия). 1 г крема залаин содержит 20 мг сертаконазола нитрата. Высокая эффективность данного препарата в отношении различных грибковых инфекций, минимум побочных эффектов обосновывают целесообразность его применения для лечения больных АтД, осложненным вторичной грибковой инфекцей. Крем залаин наносят на пораженные участки кожного покрова равномерным тонким слоем дважды в день, захватывая по периметру 1 см здоровой кожи. Продолжительность курса зависит от тяжести и локализации процесса, рекомендуемая длительность курса лечения составляет 4 нед. В недавно опубликованном исследовании Jowkar и соавторов показана эффективность сертаконазола 2% крема в сравнении с гидрокортзоном 2% в лечении 55 больных АтД. Исследование проводили двойным слепым методом, при этом больные наносили на пораженные участки тела с одной стороны сертаконазол 2% крем, а на противоположные места поражения гидрокортизоновую мазь 1% 2 раза в день в течение 1 мес. В результате было показано уменьшение основных симптомов АтД как на фоне лечения гидрокортизоновой мазью, так и на фоне лечения сертаконазолом, однако при общей оценке симптомов более выраженное улучшение отмечено на тех участках кожи, которые лечили сертаконазолом 2% кремом [17].
Мы имеем собственный опыт применения сертаконазола в комплексной терапии АтД, осложненного вторичной грибковой инфекцией. Ниже приведены результаты наблюдения за 25 пациентами с АтД, осложненным вторичной грибковой инфекцией, которые находились под наблюдением в отделении аллергии и иммунопатологии кожи ГНЦ Института иммунологии в 2012 году, которым мы назначили в комплексной терапии крем сертаконазол 2%.
Клиническая характеристика группы больных. Под наблюдением находились 25 пациентов с АтД, осложненным вторичной грибковой инфекцией, в возрасте от 12 до 38 лет (средний возраст составил – 24,5±8,2 года), из них 17 женщин, 8 мужчин. Диагноз АтД был установлен в соответствии с критериями Hanifin, Rajka [21]. Тяжесть течения АтД оценивали в баллах с определением индекса SCORAD [22] до и после окончания курса лечения. При величине индекса SCORAD от 0 до 20 течение АтД рассматривали как легкое, от 20 до 40 баллов – как среднетяжелое, более 40 баллов – как тяжелое. У 14 пациентов, в том числе у подростков в возрасте от 12 до 16 лет, было отмечено присоединение вторичной инфекции, обусловленной Malassezia, а у 11 больных – обусловленной Candida. У всех пациентов на момент назначения наружной терапии отмечалось обострение АтД. Присоединение вторичной грибковой инфекции было установлено на основании данных анамнеза, клинической картины заболевания, а также подтверждено с помощью осмотра под лампой Вуда и выявлением мицелия грибов при микроскопическом исследовании. У 15 из 25 больных с АтД было проведено аллергологическое обследование с целью выявления сенсибилизации к грибковым антигенам Malassezia и Candida (Phadia Unicap). Клиническая характеристика группы больных представлена в табл. 2.
Таблица 2. Клиническая характеристика больных c АтД перед началом лечения (n=25)
| Показатель | АтД, осложненный Malassezia (n=14) | АтД, осложненный Candida (n=11) |
| Возраст, M±sd | 22,3±8,2 | 28,3±8,2 |
|
Пол (число пациентов) |
||
| Мужской | 2 (8%) | 6 (24%) |
| Женский | 12 (48%) | 5 (20%) |
|
Степень тяжести АтД (число пациентов) |
||
| Легкая степень (SCORAD <20) | 2 (8%) | 1 (4%) |
| Средняя степень (SCORAD 20–40) | 8 (32%) | 6 (24%) |
| Тяжелая степень (SCORAD >40) | 4 (16%) | 4 (16%) |
| Средняя частота рецидивов заболевания в год, M±m | 6,9±2,1 | 7,1±1,9 |
|
Клинические проявления присоединения вторичной грибковой инфекции (число пациентов) |
||
| Локализация поражения на коже лица, шеи, волосистой части головы и шеи | 14 (56%) | 2 (8%) |
| Поражение крупных, межпальцевых складок, гладкой кожи | 2 (8%) | 11 (44%) |
| Фолликулит | 3 (12%) | 0 |
| Поражение слизистых оболочек, хейлит | 2 (8%) | 5 (20%) |
| Тяжелое, непрерывное рецидивирующее течение АтД | 8 (32%) | 8 (32%) |
| Связь обострений с использованием в питании продуктов, содержащих дрожжеподобные грибы и легкоусвояемую углеводистую пищу, дрожжи, сахар | 7 (28%) | 9 (36%) |
| Неэффективность ТГКС 3 (12%) 1 (4%) | 3 (12%) | 1 (4%) |
|
Результаты аллергологического обследования |
||
| Общий IgE [Ме, q1, q3], МЕд/мл | 1560 [800; 2400] | 1900 [1000; 3200] |
| Сенсибилизация к грибковым аллергенам Candida, n=15 | 5 (33,3%) | 5 (33,3%) |
| Сенсибилизация к грибковым аллергенам Malassezia, n=15 | 6 (40%) | 4 (26,6%) |
С целью определения эффективности комбинированной терапии наружную терапию назначали в 2 этапа.
Этап 1. Всем пациентам наносили на различные участки тела ТГКС и ТГКС в сочетании с сертаконазолом 2% кремом. Одному и тому же пациенту на пораженные участки кожи, сходные по локализации, площади и тяжести поражения, с правой стороны наносили только ТГКС (мазь гидрокортизона 17 бутират 0,1%) 1 раз в день, а на участки кожи с левой стороны наносили ТГКС (мазь гидрокортизона 17 бутират 0,1%) 1 раз в день и крем сертаканозол 2% 2 раза в день. Через 10 дней оценивали разницу эффективности наружной терапии относительно исследуемых участков кожи. Эффективность лечения оценивали на основании индекса «Исследовательской Глобальной Оценки» (ИГО) по отношению к пораженным участкам правой и левой стороны кожи.
ИГО (баллы):
0 – чистая кожа (нет признаков воспаления);
1 – почти чистая кожа (едва определяемая эритема, едва определяемые признаки инфильтрации/ образование папул);
2 – легкий АтД (слабая эритема, слабая инфильтрация/слабо выраженные папулы;
3 – среднетяжелый АтД (умеренная эритема, умеренная инфильтрация/умеренно выраженные папулы);
4 – тяжелый АтД (сильная эритема, тяжелая инфильтрация/сильно выраженные папулы);
5 – очень тяжелый АтД (сильная эритема, тяжелая инфильтрация/сильно выраженные папулы с выделениями/образование корочек).
Этап 2. Из общей группы больных, находившихся под наблюдением, были отобраны 18 пациентов, у которых был отмечен достоверно более выраженный клинический эффект по отношению к тем участкам кожи, на которые наносили гидрокортизона 17 бутират в сочетании с кремом сертаконазол 2%.
Данной группе больных была продолжена наружная терапия: крем сертаконазол 2% 2 раза в день в течение 3 нед и мазь гидрокортизона 17 бутират 0,1% 1 раз в день до достижения клинической ремиссии АтД.
Применение ТГКС других групп, наружных противогрибковых и антисептических средств, системных противогрибковых препаратов, системных ГКС не допускалось.
Все пациенты, включенные в исследование, помимо наружной терапии получали левоцетиризин 5 мг (супрастинекс) по 1 таблетке 1 раз в сут как на первом, так и на втором этапах лечения. Клиническую оценку проводили до начала (0 день), на 10-, 20- и 31-й дни лечения.
Результаты наблюдения и обсуждение. На 1-м этапе лечения у большинства обследованных пациентов тенденция к уменьшению основных симптомов заболевания, таких как зуд, сухость кожи, уменьшение площади и количества эритематозно-сквамозных высыпаний было отмечено к 7–10-му дню лечения. При этом у 18 из 25 пациентов было выявлено более выраженное уменьшение основных симптомов заболевания на участках кожи слева. 5 пациентов не отметили разницы между различными участками тела, а 2 не отметили существенного улучшения состояния кожи ни с левой, ни с правой стороны. Следует отметить, что обе эти пациентки страдали АтД, осложненным грибковой инфекцией Candida, и ранее неоднократно получали как ТГКС, так и различные наружные и системные противогрибковые препараты. Вероятнее всего, развитие резистентности к терапии данных больных было связано с резистентностью к гидрокортизону 17 бутирату, так как в дальнейшем им был назначен мометазона фуроат и системная противогрибковая терапия кетоконазолом, что дало хороший лечебный эффект. Таким образом, комбинированная терапия ТГКС + сертаконазол оказалась более эффективной по сравнению с монотерапией ТГКС на фоне применения антигистаминной терапии левоцетиризином 5 мг в сут в 72% случаев. В табл. 3 приведены медианы и квартили ИГО до начала лечения и через 10 дней от начала лечения.
Таблица 3. Эффективность наружной терапии на 1-м этапе лечения – динамика индекса ИГО в исследуемой группе больных (n=25)
| Дни лечения | АтД, осложненный Malassezia (n=14) | АтД, осложненный инфекцией Candida (n=11) | ||
| ИГО | правая сторона | левая сторона | правая сторона | левая сторона |
| 0 день | 3 [2; 3] | 3 [2; 3] | 3 [2; 4] | 3 [2; 3] |
| 10 день | 2 [2; 3] | 1 [1; 3] | 1 [1; 3] | 1 [1; 3] |
На 2-м этапе исследования, как описано выше, пациентам с достоверно более выраженным клиническим эффектом комбинированной терапии была продолжена наружная терапия: крем сертаконазол 2% 2 раза в день в течение 3 нед и мазь гидрокортизона 17 бутират 0,1% 1 раз в день до достижения клинической ремиссии АтД. Как и на 1-м этапе, больные продолжили принимать левоцетиризин 5 мг в сут до купирования кожного зуда. У 12 из 18 наблюдаемых пациентов гидрокортизон 17 бутират был отменен к 14-му дню лечения, к 20-му дню от начала лечения потребность в ТГКС сохранялась лишь у 1 пациента. Потребность в антигистаминной терапии к 14-му дню лечения сохранялась у 6 из 18 пациентов, еще 4 пациентам левоцетиризин был отменен к 20-му дню лечения, и только 2 больных продолжили прием препарата до 31-го дня наблюдения.
У всех пациентов продолжалась тенденция к уменьшению основных симптомов заболевания, таких как зуд, сухость кожи, уменьшение площади и количества эритематозно-сквамозных и пустулезных высыпаний. Так, до начала лечения медиана индекса SCORAD в группе больных с Malassezia составила 34 [Q1=21; Q3=52], а в группе больных с АтД, осложненным Candida, – 28 [Q1=19; Q3=43]. К 10-му дню наружной терапии на 1-м этапе лечения данные значения составляли 26 [Q1=18; Q3=40] и 22 [Q1=10; Q3=30]. Далее тем больным, которые продолжили получать комбинированную терапию, проводили оценку индекса SCORAD на 20- и 31-й дни лечения. К 20-му дню лечения было отмечено достоверное уменьшение данного индекса по сравнению с показателями до лечения в обеих группах (pРисунок. Клиническая эффективность применения комбинированной терапии (гидрокортизона = бутират + сертаконазол) у больных АтД, осложненным вторичной грибковой инфекцией.
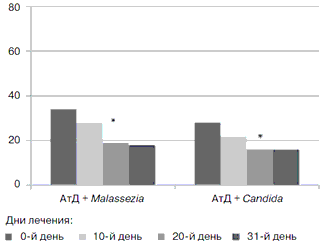
По оси ординат – медианы индекса SCORAD, * p
В целом, как по отношению к проявлениям АтД, так и по отношению к симптомам вторичной грибковой инфекции, отличный эффект был достигнут у 11 из 18 пациентов (61%), которые в течение 4 нед получали комбинированную наружную терапию. Хороший эффект был отмечен у 4 пациентов (22%), а удовлетворительный эффект – у 3 пациентов (17%). Признаки вторичной грибковой инфекции регрессировали полностью у всех пациентов. Мы также регистрировали частоту возникновения нежелательных побочных эффектов, к которым относили случаи чувства зуда, жжения, покраснения в месте нанесения препарата. В течение периода применения крема сертаконазол 2% нежелательных явлений не было зарегистрировано ни в одном из наблюдаемых случаев. Помимо этого оценивали частоту возникновения нежелательных явлений, связанных с приемом левоцетиризина. Ни у оного из наблюдаемых пациентов не отмечено сонливости, головной боли, а также каких-либо других симптомов, имеющих связь с приемом препарата.
Таким образом, роль грибковой инфекции в развитии АтД является предметом дальнейших научных исследований. Помимо собственно грибковых инфекций, осложняющих течение АтД, в поддержании воспаления при АтД может иметь место развитие IgE-опосредованной аллергической реакции к антигенам грибов. Включение в комплексную терапию больных АтД, осложненного грибковой инфекцией, современных противогрибковых препаратов для наружного применения позволяет не только достичь контроля над заболеванием и улучшить качество жизни больных, но и снижает вероятность развития сенсибилизации к антигенам грибов.
ЛИТЕРАТУРА
1. Cork M.J., Danby S.G., Vasilopoulos Y. et al. Epidermal barrier dysfunction in atopic dermatitis. J. Invest. Dermatol. 2009, v. 129, p. 1892-1908.
2. Voegeli R., Rawlings A.V., Breternitz M. et al. Increased stratum corneum serine protease activity in acute eczematous atopic skin. Br. J. Dermatol. 2009, v. 161, p. 70-77.
3. Beck L.A. Atopic dermatitis: a disease caused by innate immune defects? J. Invest. Dermatol. 2009, v. 129, p. 14-30.
4. Werfel T. The role of leukocytes, keratinocytes, and allergen-specific IgE in the development of atopic dermatitis. J. Invest. Dermatol. 2009, v. 129, p. 1878-1891.
5. Baker B.S. The role of microorganisms in atopic dermatitis. Clin. Exp. Immunol. 2006, v. 144, p. 1-9.
6. Faergemann J. Atopic dermatitis and fungi. Clin. Microbiol. Rev. 2002, v. 15, p. 545-563.
7. Savolainen J., Lammintausta K., Kalimo K., Viander M. Candida albicans and atopic dermatitis. Clin. Exp. Allergy.1993, v. 23, p. 332-339.
8. Darabi K., Hostetler S.G., Bechtel M.A. et al. The role of Malassezia in atopic dermatitis affecting the head and neck of adults. J. Am. Acad. Dermatol. 2009, v. 60, p. 125.
9. Travers J.B., Norris D.A. Johansson C. et al. Atopy patch test reactions to Malassezia allergens differentiate subgroups of atopic dermatitis patients. Br. J. Dermatol. 2003, v. 148, p. 479-488.
10. Gaitanis G., Magiatis P. , Hantschke M. et al. The Malassezia genus in skin and systemic diseases. Clin. Microbiol. Rev. 2012, v. 25, p. 106-141.
11. Chang F.Y., Lee J.H., Yang Y.H. et al. Analysis of the serum levels of fungi-specific immunoglobulin E in patients with allergic diseases. Int. Arch. Allergy Immunol. 2011, v. 154, p. 49-56.
12. Mayser P. , Gross A. IgE antibodies to Malassezia furfur, Malas-sezia symbodialis and Pityrosporum orbiculare in patients with atopic dermatitis, seborreic eczema orpitiriasis ver-sicolor. Acta Derm. Venerol. 2000, v. 80, p. 357-361.
13. Casagrande B.F., Fluckiger S., Linder M.T. et al. Sensitization to the yeast Malassezia sympodialis is specific for extrinsic and intrinsicatopic eczema. J. Invest. Dermatol. 2006, v. 126, p. 2414-2421.
14. Rokeyo M., Tagami H., Usuba Y., Tomita Y. Contact sensitivity to Pityrpsporum ovale in patients with atopic dermatitis. Arch. Dermatol. 1990, v. 126, p. 627-632.
15. Back O., Schagneus A., Johansson S.G. Ketoconazole in atopic dermatitis: therapeutic response is correlated with decrease in serum IgE. Arch. Dermatol. Reserch. 1995, v. 287, p. 448-451.
16. Kolmer H.L., Taketomi E.A., Hazen K.C. et al. Effect of combined antibakterial and antifun gal treatment in severe atopic dermatitis. J. Allergy Clin. Lmmunol. 1996, v. 98.
17. Tajima M. Malassezia species in patients with seborrheic dermatitis and atopic dermatitis. Nippon Ishinkin Gakkai Zasshi. 2005, v. 46 (3), p. 163-167.
18. Сергеев А.Ю., Сергеев А.В. Грибковые инфекции. М., Бином. 2004, с. 188-189.
19. Jowkar F. , Saki N., Alyasin S. Comparison of sertaconazol 2% cream versus hydrocortison 1% ointment in the treatment of atopic dermatitis. J. Dermatilog. Treat. 2013, Mar 8 [Epub aheard of priat].
20. Hanifin J.M., Rajka G. Diagnostic features of atopic dermatitis. Acta Derm. Venerol. 1980, v. 92, p. 44-47.
21. Europian Task Force on Atopic Dermatitis. Severity scoring of atopic dermatitis: the SCORAD index. Dermatology. 1993, v. 186, p. 23-31.
Статья поступила 01.04.2013 г., принята к печати 04.04.2013 г.
Рекомендована к публикации Федосковой Т.Г.
