Применение эноксапарина при сердечнососудистых заболеваниях: как сделать лечение наиболее эффективным и безопасным
Статьи Опубликовано в:«Кардиоваскулярная терапия и профилактика» »» 2011; 10(6)
И.С. Явелов
ГОУ ВПО Российский государственный медицинский университет. Москва, Россия
Enoxaparin in cardiovascular disease: how to improve effectiveness and safety?
I.S. Yavelov
Russian State Medical University. Moscow, Russia
В обзоре анализируются особенности использования эноксапарина при наиболее распространенных сердечно-сосудистых заболеваниях (острый коронарный синдром, венозные тромбоэмболические осложнения, фибрилляция предсердий). Представлены основания для принятия решения в сложных и нестандартных клинических ситуациях (нарушенная функция почек, пожилой возраст, смена препарата гепарина в процессе лечения, необычная масса тела), когда для обеспечения наилучшего соотношения эффективности и безопасности может потребоваться изменение стандартного подхода к применению препарата.
Ключевые слова: острый коронарный синдром, венозные тромбоэмболические осложнения, фибрилляция предсердий, эноксапарин.
The review analyses the specifics of enoxaparin therapy in the most prevalent cardiovascular diseases, such as acute coronary syndrome, venous thromboembolism, and atrial fibrillation. The decision strategy is presented for difficult and non-standard clinical situations (renal dysfunction, elderly age, heparin medication change, or abnormal body weight), when the optimal balance between effectiveness and safety requires modifying the standard treatment protocols.
Key words: Acute coronary syndrome, venous thromboembolism, atrial fibrillation, enoxaparin.
Низкомолекулярный гепарин (НМГ) эноксапарин натрия - один из наиболее часто применяемых антикоагулянтов, эффективность которого хорошо изучена при современных подходах к профилактике и лечению распространенных сердечнососудистых заболеваний (ССЗ) (таблица 1) [1-20]. Вместе с тем, любое медикаментозное вмешательство, направленное на ограничение тромбообразования, способно спровоцировать кровотечение. Соответственно, при выборе способов лечения конкретного больного каждый раз необходимо соотносить ожидаемую пользу и возможный вред, сопряженный с применением того или иного антитромботического лекарственного средства. В данном сообщении будут рассмотрены практические подходы, призванные способствовать извлечению максимальной пользы из применения эноксапарина в различных клинических ситуациях за счет обеспечения наилучшего соотношения эффективности и безопасности.
Общие подходы
Необходимость лабораторного контроля. В настоящее время индивидуальная оценка действия НМГ на систему свертывания крови (на практике оценивается по достигнутому уровню анти-Ха активности) при введении стандартных доз НМГ, включая эноксапарин (Клексан®, СНОФИ-АВЕНТИС ГРУП, Франция), не рекомендуется [21]. Причина широкого распространения подобной точки зрения - достаточная предсказуемость эффекта, а также противоречивые сведения о возможности улучшить эффективность и/или безопасность профилактики и лечения за счет применения лабораторного контроля. Крупные клинические исследования, определившие роль эноксапарина в профилактике и лечении тромбоэмболических осложнений (ТЭО), не предполагали осуществления коагулологического контроля. Соответственно, их результаты показывают, каких результатов можно добиться в случаях, когда антикоагулянтное действие эноксапарина не контролируется и используется заранее оговоренные дозы препарата. Из-за недостаточного изучения до конца не ясно, каких значений лабораторных показателей стоит добиваться на фоне введения НМГ. При этом следует учитывать, что определение анти-Ха активности характеризует только один из многочисленных аспектов воздействия этих лекарственных средств на систему гемостаза и в основном дает информацию о содержании действующего вещества в крови. Однако не исключено, что в будущем, при появлении новых фактов, а также при большей доступности определения анти-Ха активности в крови суждение о целесообразности коагулологического контроля при использовании эноксапарина может быть пересмотрено.
На целесообразность коагулологического контроля при применении эноксапарина обычно указывают у больных с серьезной почечной недостаточностью (ПН), выраженным ожирением (ОЖ) - масса тела МТ) > 150 кг, индекс МТ > 50 кг/м2, а также при применении лечебных доз у беременных [22]. При этом при ПН из-за возможности постепенного накопления препарата в крови (кумуляция) оправдано повторное определение анти-Ха активности в крови на максимуме действия НМГ (для эноксапарина - через 4 ч после подкожной (п/к) инъекции), в то время как при выраженном Ож можно ограничиться однократной оценкой. У беременных с одной стороны МТ растет в основном за счет развивающегося плода, с другой - во втором триместре увеличивается скорость клубочковой фильтрации (СКФ), что способствует более выраженному выведению НМГ. Целесообразность контроля анти-Ха активности при беременности дискутируется. Согласно одной точке зрения, НМГ в этой ситуации можно дозировать, ориентируясь на МТ, и применять стандартные фиксированные дозы при профилактике венозных ТЭО. Другие специалисты предлагают периодически оценивать уровень анти-Ха активности в крови (по разным источникам от 1 раза в месс. до 1 раза в 3 мес.) [3,23]. Не исключено, что последний подход может быть полезен на поздних сроках беременности, а также у женщин с наиболее высоким риском ТЭО (в частности, при механических протезах клапанов сердца) [23,24]. В настоящее время у беременных изучается целесообразность подбора профилактической дозы эноксапарина с учетом достигнутой анти-Ха активности в крови (http:// clinicaltrials.gov/ct2/show/study/NCT01068795).
Отсутствие необходимости в обязательном коагулологическом контроле не означает, что при использовании эноксапарина лабораторный контроль не нужен вовсе. Поскольку любой антикоагулянт способен спровоцировать кровотечение, во время введения препарата необходимо регулярно оценивать гемоглобин (Hb), гематокрит (Ht) и активно искать признаки кровотечения. Внутреннее кровотечение следует подозревать при любом неожиданном изменении состояния больного, в особенности при возникновении артериальной гипотонии. В этих случаях целесообразно срочно определить содержание Hb в крови и определить Ht. Поскольку при применении любого препарата гепарина возможно возникновение иммунной тромбоцитопении, до начала лечения и, как минимум, в ближайшие 2 нед. необходимо регулярно оценивать содержание тромбоцитов в крови [25]. Если больному в ближайшие 3,5 мес. вводились препараты гепарина, число тромбоцитов следует определить через 24 ч или в срочном порядке раньше при непредвиденном ухудшении состояния. Наконец, поскольку функция почек играет важнейшую роль в определении противопоказаний к применению НМГ и выбору их дозы, исходно следует определить креатинин (Кр) и в обязательном порядке рассчитать клиренс Кр (ККР) или СКФ. Если применение эноксапарина продолжается на протяжении длительного времени, целесообразно контролировать функцию почек, в особенности, если возможно ее существенное изменение (таблица 2). Вместе с тем, очевидно, что при необходимости срочного начала лечения при отсутствии явных противопоказаний следует ввести первую стандартную дозу эноксапарина, а затем корригировать подход к использованию антикоагулянта в зависимости от результатов лабораторного обследования.
Нарушенная функция почек. Эноксапарин, как и другие НМГ, выводится почками. Соответственно, при ПН происходит постепенное накопление препарата в крови, что сопровождается ростом частоты кровотечений. Отмечают, что однократная инъекция эноксапарина у больных с нарушенной функцией почек, в частности, перед выполнением чрескожного коронарного вмешательства (ЧКВ), достаточно безопасна, и проблемы ожидаются только при продолжении использования препарата. Определенной пороговой величины здесь не существует, однако известно, что концентрация эноксапарина в крови (измеренная по уровню анти-Ха активности) и риск крупных кровотечений особенно сильно возрастают при снижении ККР (или СКФ) < 30 мл/мин (или мл/мин/1,73 м2, соответственно) [21]. Поэтому у данной категории больных рекомендуется уменьшить дозу эноксапарина наполовину. В частности, стандартную лечебную дозу 1 мг/кг вводить п/к не 2, а 1 раз в сут., вместо однократного введения 1,5 мг/кг при лечении венозных ТЭО вводить 1 мг/кг. Профилактическую суточную дозу 40 мг предлагают уменьшить до 20 мг, а кратность введения профилактической дозы 30 мг уменьшить с 2 до 1 раза в сут. Подобное изменение лечебной дозы предусматривалось протоколами многих клинических исследований эноксапарина. Вместе с тем целесообразность уменьшения профилактической дозы мало изучена. Отмечают, что ожидаемое повышение содержания препарата в крови здесь может быть не столь существенным, как при использовании более высоких лечебных доз, и в итоге после повторного п/к введения стандартных профилактических доз анти-Ха активность способна достичь нижней границы, рекомендуемой для лечебных доз эноксапарина. Последнее может оказаться достаточно безопасным, если только у больного нет дополнительных факторов риска (ФР) возникновения кровотечений.
Таблица 1. Показания к использованию антикоагулянтов для парентерального введения, зарегистрированных в РФ, при наиболее распространенных ССЗ
| НФГ | Далтепарин | Надропарин | Эноксапарин | Фондапаринукс | Бивалирудин | |
| Профилактика | + | + | +* | + | + | - |
| ВТЭО | ||||||
| Лечение ВТЭО | + | + | + | + | + | - |
| Лечение ОКС без ↑ ST: не инвазивный подход | + | + | + | +** | - | |
| Лечение ОКС без ↑ ST: инвазивный подход | + | - | - | + | + | + |
| Лечение ОКС с ↑ ST: первичное ЧКВ | + | - | - | ± | - | + |
| Лечение ОКС с ↑ ST: стрептокиназа | + | - | - | + | + | - |
| Лечение ОКС с t ST: алтеплаза, тенектеплаза,ретеплаза | + | - | - | + | - | - |
| Лечение ОКС с ↑ ST: без реперфузионного лечения | + | - | - | ± | + | - |
| Плановое ЧКВ | + | - | - | ± | - | + |
| Подготовка к КВ при ФП | + | ± | ± | ± | - | - |
Таблица 2. Лабораторные показатели, которые необходимо контролировать при парентеральном введении эноксапарина
| Показатель | Исходно * | Во время лечения | При ухудшении состояния (необъяснимое снижение АД, кровотечение) |
| Hb | + | + ** | + |
| Ht | + | + ** | + |
| Число тромбоцитов в крови | + | + | - |
| ККр или СКФ | + | ± *** | - |
* у острых больных забор крови на анализ следует осуществить при первой возможности (желательно до начала лечения), однако введение первой дозы препарата не следует откладывать до получения результатов (особенно если период ожидания затягивается);
** при введении лечебных доз - ежедневно или хотя бы через день как минимум на 4-14 сут. или до более ранней отмены эноксапарина;
*** при достаточно длительном введении, если возможно заметное изменение функции почек.
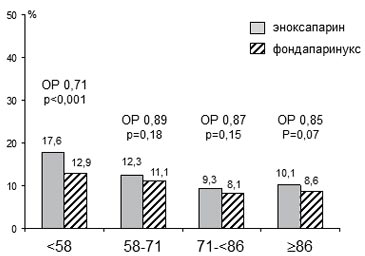
Вместе с тем по данным ретроспективного анализа результатов исследования OASIS-5 (Fifth Organization to Assess Strategies in acute Ischemic Syndromes) применение эноксапарина в стандартной дозе 1 мг/кг 2 раза в сут. на протяжении в среднем 5 сут. при остром коронарном синдроме (ОКС) без стойких подъемов сегмента ST (ОКС↓Х) на ЭКГ сопровождалось заметным ростом частоты крупных кровотечений уже при СКФ < 60 мл/ мин/1,73 м2 и опасность геморрагических осложнений существенно возрастала по мере утяжеления ПН (рисунок 1) [26]. При этом по показателю, характеризующему итоговый эффект лечения с учетом его воздействие на частоту ишемических осложнений и крупные кровотечения, эноксапарин в дозе 1 мг/кг 2 раза в сут. достоверно не отличался от более безопасного подхода (п/к введение фондапаринукса натрия в дозе 2,5 мг в сут.) у больных со СКФ>58 мл/мин/1,73 м2. Вместе с тем при более низкой СКФ эноксапарин в дозе 1 мг/кг 2 раза в сут. по совокупному эффекту заметно уступал фондапаринуксу, скорее всего за счет более частого возникновения крупных кровотечений (рисунок 2).
Рис. 1 Частота крупных кровотечений в течение 9 сут. при длительном введении эноксапарина и фондапаринукса у больных с различным ККр в исследовании OASIS-5 [26].
 |
| Скорость клубочковой фильтрации (мл/мин/1,73 м2) |
Рис. 2 Сумма случаев смерти, рецидива ИМ, рефрактерной ишемии миокарда или крупного кровотечения за 30 сут. при использовании эноксапарина и НФГ у больных с различной СКФ в исследовании OASIS-5 [26].
 |
| Скорость клубочковой фильтрации, мл/мин на 1,73 м2 |
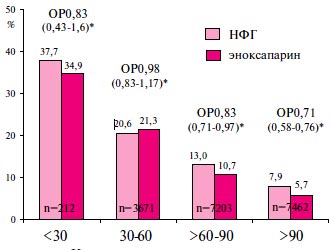
Аналогичная закономерность была отмечена и при ретроспективном анализе результатов исследования ExTRACT-TIMI 25 (Enoxaparin and Thrombolysis Reperfusion for Acute myocardial infarction Treatment - Thrombolysis In Myocardial Infarction 25) при сопоставлении 1-недельных п/к инъекций эноксапарина и 48-часовой внутривенной (в/в) инфузии нефракционированного гепарина (НФГ) при тромболитической терапии (ТЛТ) у больных с ОКС со стойкими подъемами сегмента ST (ОК↑Т) на ЭКГ [27]. При учете исходных различий между больными с разным исходным ККр, преимущество эноксапарина перед НФГ по влиянию на сумму случаев смерти, не смертельного рецидива инфаркта миокарда (ИМ) и не смертельного крупного кровотечения отмечалось только при значениях этого показателя, >60 мл/мин (рисунок 3). При этом тенденция к преимуществу эноксапарина отмечалась и у больных с ККр<30 мл/ мин, когда протоколом этого клинического испытания предписывалось уменьшить дозу эноксапарина до 1 мг/кг 1 раз в сут. Однако в последнем случае число наблюдений оказалось слишком мало, чтобы продемонстрировать статистическую значимость имевшихся различий (всего n=212). Частота крупных кровотечений при нормальной функции почек (ККр>90 мл/мин) у больных, получавших эноксапарин и НФГ, была практически одинаковой. Однако по мере снижения ККр рост частоты геморрагических осложнений на эноксапарине оказался более выраженным.
Рис. 3 Сумма случаев смерти, не смертельного рецидива ИМ и не смертельного крупного кровотечения за 30 сут. при использовании эноксапарина и НФГ у больных с различным ККр в исследовании ExTRACT-TIMI 25 [27].
 |
| Клиренс креатинина, мл/мин |
Эти факты позволяют предполагать, что уменьшение дозы эноксапарина может быть оправданным и у больных с ККр (или СКФ) от 30 до 60 мл/мин (или мл/мин/1,73 м2 соответственно). Однако эффективность и безопасность подобного подхода никогда не изучалась в рамках специально спланированных проспективных ("доказательных") клинических испытаний.
Известно, что кардиологическое общество Франции в 2006-2010 гг. у больных с ОКС↓Т на ЭКГ проводило небольшое открытое исследование VALIDE (Validation of Enoxaparin Dose Adaptation in Patients With Moderate Renal Failure Hospitalized for an Acute Coronary Syndrome) (www.clinicaltrials. gov/ct2/show/NCT00412802). В нем изучался уровень анти-Ха активности в крови при снижении стандартной дозы эноксапарина на 25 % в случаях, когда ККр составлял 30-50 мл/мин, и применении стандартной дозы эноксапарина у больных с ККр>50 мл/мин. К сожалению, найти результаты этого исследования не удалось. Однако в любом случае очевидно, что полученная в нем информация не дает возможности оценить клиническую целесообразность применения уменьшенных доз эноксапарина при нетяжелой ПН (возможности обеспечить большую безопасность без существенного снижения эффективности лечения).
Смена препарата гепарина в процессе лечения. В ходе изучения эноксапарина при ОКС↓Т оказалось, что одним из факторов, влияющим на эффективность и безопасность терапии, является смена антикоагулянта в процессе лечения (переход с эноксапарина на НФГ и наоборот).
Первоначально это стало очевидным при анализе результатов крупного контролируемого исследования SYNERGY (Superior Yield of the New strategy of Enoxaparin, Revascularization and Glycoprotein IIb/IIIa inhibitors) [28]. В нем при инвазивном подходе к ведению 10027 больных с ОКС↓Т и высоким риском неблагоприятного исхода, не имевших тяжелой ПН, сравнивали эффективность и безопасность в/в инфузии НФГ и п/к инъекций эноксапарина в дозе 1 мг/кг 2 раза в сут. В целом при сопоставимой эффективности эноксапарин провоцировал больше крупных кровотечений, оцененных по критериям TIMI. Вместе с тем, при дальнейшем анализе оказалось, что в ~ 75 % случаев лечение антикоагулянтами было начато до включения в данное клиническое испытание и, соответственно, у части больных после рандомизации производился переход с НФГ на эноксапарин или наоборот. В подгруппе из 6138 больных без смены антикоагулянта в начале лечения эноксапарин способствовал достоверному снижению суммы случаев смерти или ИМ в ближайшие 30 сут. на 18 %. В последующем наличие этой закономерности подтвердилось при более детальном анализе [29]. В случаях, когда антикоагулянт меняли в более поздние сроки заболевания, отмечалось удвоение частоты кровотечений, требующих переливания крови.
Осознание значимости данного фактора стало поводом к повторному анализу результатов других исследований эноксапарина при OKC^ST. Оказалось, что смена препарата в начале лечения имела место во многих из них и нередко затрагивала существенное число больных. При мета-анализе 6 крупных, рандомизированных, контролируемых исследований эноксапарина при данной форме ОКС: ESSENCE (Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q-wave Coronary Events), TIMI 11B (Thrombolysis In Myocardial Infarction (Phase 11B)), ACUTE II (Antithrombotic Combination Using Tirofiban and Enoxaparin II), INTERACT (Integrilin and Enoxaparin Randomized Assessment of acute Coronary syndrome Treatment), A to Z (Aggrastat to Zocor), SYNERGY, включавших в совокупности 21946 больных, эноксапарин способствовал достоверному снижению риска смерти или не смертельного ИМ за 30 сут. всего на 5 % [30]. Однако при включении в анализ только 9836 случаев, когда антитромботического лечения до включения в исследования не проводилось и, соответственно, не было смены препарата в начале лечения, польза от эноксапарина оказалась заметно больше (снижение риска составило уже 19 %). При этом увеличение частоты крупных кровотечений или потребность в переливании крови на эноксапарине отсутствовали. У более широкого контингента больных с ОКС^Х вошедших в регистр GRACE (Global Registry of Acute Coronary Events), смена препарата гепарина в первые сут. лечения была сопряжена с наиболее высокой частотой неблагоприятных исходов во время госпитализации (сумма случаев смерти, ИМ или возобновления ишемии миокарда) [31].
Рис. 4 Результат в/в введения болюса НФГ у больных, получающих лечебную дозу эноксапарина: исследование STAKENOX [32].
| Возраст 40-60 лет + клиренс креатинина >50 3-й сутки введения эноксапарина в дозе 1 мг/мг 2 раза в сутки |
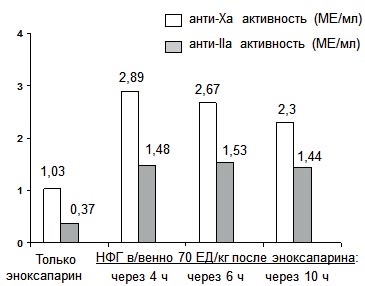 |
Таким образом, есть основания полагать, что переход с эноксапарина на НФГ или, наоборот, в процессе лечения нежелателен, поскольку с одной стороны может уменьшить эффективность лечения: способствовать возникновению тромботических осложнений, с другой - неблагоприятно отразиться на его безопасности, спровоцировать кровотечение. Очевидно, причина заключается, прежде всего, в том, что приемлемых, проверенных на практике, схем перехода с одного препарата на другой не разработано. В итоге у одних больных в период смены препаратов уровень антикоагуляции может оказаться недостаточным, в то время как у других - избыточным. Так, в рандомизированном исследовании STAKENOX (STACK-on to ENOXaparin study) на 3-и сут. регулярного использования стандартной лечебной дозы эноксапарина у 72 здоровых лиц в возрасте 40-60 лет был изучен эффект дополнительного использования НФГ. Оказалось, что в/в введение НФГ в дозе 70 ЕД/кг через 4, 6 и даже 10 ч после п/к инъекции эноксапарина в дозе 1 мг/кг приводит к существенному увеличению анти-Ха и анти-IIa активности в крови, которая оказалась намного выше принятых терапевтических границ (рисунок 4) [32]. Особенно тревожным представляется тот факт, что подобный эффект сохранялся, как минимум, на протяжении 2 ч.
К сожалению, важность указанного фактора стала очевидной только в ходе анализа результатов многочисленных, крупных, клинических испытаний эноксапарина, и в дальнейшем не была проверена в специально спланированных проспективных исследованиях. Тем не менее, наличие подобной закономерности признается всеми группами экспертов, и смена препарата гепарина в процессе лечения считается крайне нежелательной.
Схемы перехода с НФГ на эноксапарин или наоборот, рекомендовавшиеся в крупных, контролируемых, клинических исследованиях, представлены в таблице 4. Однако следует учитывать, что именно при применении этих схем были получены представленные выше факты о нежелательности смены препарата гепарина в процессе лечения.
Порядок перехода с эноксапарина на другие препараты НМГ, фондапаринукс натрия, бивалирудин, также как и перехода с них на эноксапарин, не известен.
Другие особенности.
МТ. Лечебные дозы эноксапарина выбираются с учетом МТ. Соображения о роли коагулологического контроля у больных с патологическим Ож приведены выше. Однако основная проблема на практике - ошибки в выборе дозы эноксапарина, связанные с незнанием реальной МТ или неверном расчете необходимого количества препарата. По данным регистра CRUSADE (Can Rapid risk stratification of Unstable angina patients Suppress Adverse outcomes with Early implementation of the ACC/AHA Guidelines), среди 1378 больных с ОКС^Т, получавших НМГ, чрезмерная доза была введена в 13,8 % случаев [33]. Риск крупных кровотечений при этом достоверно увеличился на 39 %. Наиболее существенная опасность (увеличение риска крупных кровотечений на 66 %) отмечалась при выраженном превышении дозы НМГ (>1,2 мг/ кг для эноксапарина). Эти данные соответствуют результатам проведенного ранее клинического исследования TIMI-11A по подбору дозы эноксапарина у больных с ОКС↓Т [34]. Согласно полученным данным применение более высокой дозы эноксапарина (1,25 вместо 1 мг/кг 2 раза в сут.) сопровождалось более высокой частотой кровотечений во время госпитализации - 6,5 % и 1,9 % соответственно. Интересно, что введение недостаточной дозы препарата ( Таким образом, представляется, что, по меньшей мере, безопасность эноксапарина тесно связана с правильностью выбора дозы, поскольку ее увеличение на ~ 20 % сопряжено с заметным ростом частоты крупных кровотечений. Поэтому в случаях, когда точная МТ не известна (в частности, фиксировалась со слов больного), перед следующей инъекцией эноксапарина следует обязательно взвесить пациента и при необходимости скорригировать дозу.
Роль очень низкой или слишком высокой МТ обычно обсуждается, когда для профилактики венозных ТЭО применяется фиксированная доза эноксапарина. В этих случаях привлекают внимание к возможной чрезмерной анти-Ха активности в крови у больных с низкой МТ, в частности, <45 кг у женщин и 57 кг у мужчин, с одной стороны, и недостаточно высокому содержанию действующего вещества в крови у больных с избыточной МТ - с другой. Соответственно, в первом случае иногда предлагают снижать профилактическую дозу эноксапарина, в частности, с 40 мг 1 раз в сут. до 30 или 20 мг, во втором - увеличивать ее на 25 %. Вместе с тем следует учитывать, что эти подходы, оправданные с фармакологической точки зрения, не проверены в надлежащих клинических исследованиях.
Пожилой возраст. С возрастом обычно происходит снижение функции почек и возрастает риск кровотечений. Однако должен ли возраст в обязательном порядке служить основанием для изменения (уменьшения) дозы эноксапарина, не известно.
В исследовании ExTRACT-TIMI 25 при ТЛТ в первые 6 ч ОКС↑Т у больных >75 лет первоначальный болюс эноксапарина не вводили, и доза препарата для п/к введения была уменьшена до 0,75 мг/кг 2 раза в сут. [35]. При этом величина первых двух доз не должны была превышать 75 мг. В итоге частота крупных кровотечений при длительном (1-недельном) введении эноксапарина по сравнению с 48-часовой инфузией НФГ у больных <75 лет, получавших стандартные лечебные дозы препарата, повышалась в большей степени, чем в возрасте >75 лет (достоверное увеличение риска на 67 % и 15 %, соответственно). Увеличения риска внутричерепных кровотечений в обеих группах не отмечалось. По-видимому, такой результат был во многом связан с применением уменьшенной дозы препарата у больных >75 лет. Так, в исследованиях ASSENT-3 (Assessment of the Safety and Efficacy of a New Thrombolytic - 3) и ASSENT-3 PLUS (Assessment of the Safety and Efficacy of a New Thrombolytic agent), где подобной коррекции дозы не проводилось, у больных >75 лет на эноксапарине отмечалось более частое возникновение крупных и внутричерепных кровотечений, чем на НФГ [36,37]. В пользу этой гипотезы свидетельствуют результаты фармакокинетического исследования, выполненного в подгруппе из 73 больных. Оно показало, что накопление анти-Ха активности у пожилых происходило в меньшей степени, чем у больных <75 лет. Важно, что снижение дозы эноксапарина у пожилых в исследовании ExTRACT-TIMI 25, способствовавшее повышению безопасности лечения, не привело к потере его эффективности. Соответственно, необходимость коррекции (уменьшения) дозы эноксапарина у больных >75 лет при проведении ТЛТ очевидна.
В рекомендациях Европейского кардиологического общества по реваскуляризации, появившихся в 2010г, содержится предписание уменьшить дозу эноксапарина до 0,75 мг/кг 2 раза в сут. у больных >75 лет при ОКС↓Т [16]. Однако следует учитывать, что эффективность и безопасность такого подхода в данной клинической ситуации в достаточно крупных ("доказательных"), клинических исследованиях не проверялась.
Таблица 3. Рандомизированные контролируемые исследования по сопоставлению эноксапарина и НФГ у больных с ОKС↓ST
| Исследование | Число больных | Применение блокатора ГП IIb/IIIa тромбоцитов |
Коронарная ангиография ± ангиопластика/стент по время введения препарата |
| ESSENCE [39] | 3201 | Нет | Очень редко |
| TIMI 11B [40] | 3910 | Нет | Редко |
| INTERACT [41] | 746 | У всех (эптифибатид) | Редко |
| ACUTE-2 [42] | 525 | У всех (тирофибан) | 30% |
| A to Z [43] | 3987 | У всех (тирофибан) | 60% |
| SYNERGY [28] | 10027 | 57% (по решению врача) | 92% |
Таблица 4. Схемы перехода с НФГ на эноксапарин или наоборот, рекомендовавшиеся в крупных, контролируемых, клинических исследованиях
| Уже введено | Переход на |
| НФГ | Эноксапарин: ввести эноксапарин вне зависимости от АЧТВ не использовать болюс, если больной получил >4000 ЕД НФГ <3 ч назад |
| Эноксапарин | НФГ: в пределах 8 ч после п/к инъекции эноксапарина начать инфузию 12 ЕД/кг/ч (максимально 1000 ЕД/ч) в пределах 8-12 ч после п/к инъекции эноксапарина перед началом инфузии ввести болюс 30 ЕД/кг (максимум 5000 ЕД) |
Очень высокий риск кровотечений. В клинические испытания эноксапарина не включали больных с крайне высоким риском кровотечений, у которых соотношение пользы и риска при использовании эноксапарина может быть иным, чем представлено ниже. В случаях, когда опасность клинически значимых кровотечений представляется достаточно высокой, но нет формальных противопоказаний к использованию антикоагулянтов, может быть принято решение пожертвовать дополнительной эффективностью и/или удобством в пользу безопасности. При этом речь идет о предпочтении в/в инфузии НФГ (как более управляемого способа антикоагуляции) или ограничении сроков введения эноксапарина.
Биологические аналоги эноксапарина. Гепарин - лекарственное средство биологического происхождения, содержащее в качестве активной субстанции химические соединения, выделенные из живых организмов с помощью биотехнологии. Состав НМГ более сложен, чем состав нефракционированного гепарина (НФГ), поскольку даже при сопоставимой длине молекулы особенности процесса деполимеризации неповторимо изменяет структуру полисахаридных цепей. Из-за сложности состава действующего вещества создание точной копии препаратов такого рода невозможно. Поэтому при разработке генериков речь идет о похожих по ряду свойств, но не абсолютно идентичных лекарственных средствах. При современном уровне знаний нет уверенности в том, что сходство по некоторым физико-химическим свойствам и отдельным параметрам, характеризующим биологическую активность оригинального препарата НМГ и его аналога (анти-Ха и анти-IIa активность в крови, их соотношение, уровень ингибитора пути тканевого фактора и другие), обеспечивает равную клиническую эффективность и безопасность. Выяснить это можно только в ходе специально спланированных, проспективных исследований по оценке клинической эквивалентности. Соответственно, пока не появятся результаты подобных исследований, с врачебной точки зрения говорить о взаимозаменяемости оригинальных препаратов НМГ (в частности, эноксапарина) и их биологических аналогов преждевременно [38].
Особенности применения эноксапарина при отдельных заболеваниях
ОКС↓ST. Целесообразность использования эноксапарина установлена в крупных, контролируемых, клинических исследованиях при различных современных подходах к лечению этой формы ОКС (таблица 3). Стандартный способ применения препарата заключается в п/к инъекциях 1 мг/кг 2 раза в сут. При этом непосредственно перед первой п/к инъекцией возможно в/в введение 30 мг эноксапарина. Целесообразность в/в болюса не ясна; такой режим дозирования препарата практиковали в исследовании TIMI 11B, давшем положительный результат [40], однако в большинстве клинических исследований с аналогичным результатом болюс эноксапарина не вводили. Возможный аргумент в пользу болюса - более быстрое начало действия, хотя клиническая значимость этого фактора не определена. У больных с ККр (СКФ)<30, дозу эноксапарина рекомендуют уменьшить на 50 % и вводить 1 мг/кг 1 раз в сут. Рекомендуемая длительность введения эноксапарина при ОKС↓ST 2-8 сут., и в этих рамках определяется суждением врача о сроках наступления клинической стабилизации. Подобный подход обеспечивает достаточную гибкость. С одной стороны при отсутствии осложнений лечение может быть продолжено вплоть до 1 нед. (или выписки из стационара, если она произошла ранее этого срока), с другой - у стабильных больных с особенно высоким риском кровотечений может быть оправданным краткосрочное введение препарата.
Таблица 5. Рандомизированные контролируемые исследования эноксапарина при ТЛТ у больных ОКС↑Т
| Исследование | Число больных | Фибринолитик | Группа сравнения |
| A.Glick и соавт. [48] | 103 | Стрептокиназа | Плацебо |
| AMI-CK [49] | 496 | Стрептокиназа | Плацебо |
| ASENOX [50] | 312 | Стрептокиназа | НФГ |
| S.Baird и соавт. [51] | 300 | Стрептокиназа | НФГ |
| ENTIRE-TIMI 23 [52] | 456 | Стрептокиназа/алтеплаза | НФГ |
| HART II [53] | 400 | Алтеплаза | НФГ |
| ASSENT-3 [36] | 4078 | Тенектеплаза | НФГ |
| ASSENT-3 PLUS [37] | 1639 | Тенектеплаза | НФГ |
| ExTRACT−TIMI 25 [54] | 20506 | Стрептокиназа, алтеплаза, тенектеплаза, ретеплаза | НФГ |
Переход в процессе лечения с эноксапарина на НФГ или наоборот настоятельно не рекомендуется. Если на фоне продолжающегося введения эноксапарина планируется ЧКВ, его можно выполнять, не прерывая лечение эноксапарином. При этом если после последней п/к инъекции препарата прошло не более 8 ч, дополнительного введения антикоагулянта во время процедуры не требуется. В случаях, когда после последней п/к инъекции прошло 8-12 ч, непосредственно перед вмешательством рекомендуется ввести в/в болюс эноксапарина 0,3 мг/кг. Первоначально данная схема использования эноксапарина при ЧКВ была проверена в ряде клинических испытаний [44], затем стала применяться во всех крупных исследованиях с участием этого препарата и в настоящее время является общепризнанной. В рекомендациях Европейского кардиологического общества по реваскуляризации, появившихся в 2010г, предусматривается возможность выполнения вмешательства на эноксапарине и в случаях, когда после последней п/к инъекции прошло >12 ч. В подобной ситуации непосредственно перед вмешательством рекомендуется ввести в/в болюс эноксапарина 0,75 мг/кг [16]. Эта рекомендация основана в основном на результатах проспективного, рандомизированного, открытого исследования STEEPLE (Safety and Efficacy of Enoxaparin in Percutaneous Coronary Intervention Patients), включавшего 3528 больных и продемонстрировавшего сопоставимую эффективность и безопасность процедуры (в основном коронарное стентирование) после введения указанной дозы эноксапарина и при стандартном подходе к использованию НФГ. При этом в отличие от НФГ эноксапарин в большинстве случаев обеспечивал желаемый уровень анти-Ха активности в крови [45]. Результаты данного исследования не исключают возможности введения эноксапарина и в более низкой дозе (0,5 мг/кг), к достоинствам которой относят большую безопасность, а также возможность удаления интродьюссера сразу после ЧКВ в отличие от дозы 0,75 мг/кг, когда интродьюссер рекомендуется извлекать через 4-6 ч. Однако поскольку более низкая доза эноксапарина реже обеспечивала желаемый уровень антикоагуляции, и при ее применении в первый месяц отмечалась тенденция к более высокой смертности, высказываются сомнения в целесообразности использования подобного подхода на практике (по крайней мере, до появления новых фактов) [46].
Убедительных свидетельств пользы продолжения введения антикоагулянта после успешного ЧКВ нет, поэтому подобный подход для широкого применения не рекомендуется.
ОКC↑SТ.
ТЛТ. Эноксапарин - наиболее изученный НМГ при ТЛТ у больных с ОКС↑ST (таблица 5) [47]. Накопленные факты суммированы в мета-анализе 6 наиболее крупных, сравнительных исследований эноксапарина и НФГ при ТЛТ, включавших в совокупности 27131 больного [55]. Согласно его результатам подход, предусматривающий 4-8-суточные п/к инъекции эноксапарина, по сравнению с 2-3-суточной в/в инфузией НФГ обеспечивает уменьшение частоты наиболее важных неблагоприятных исходов, объединяющих как эффективность, так и безопасность лечения (сумма случаев смерти, рецидива ИМ и крупных кровотечений) с 12,9 % до 11,1 % в ближайшие 30 сут., что соответствует достоверному уменьшению риска на 16 % (р=0,018). При этом смертность у получавших НФГ и эноксапарин составляла 7,1 % и 6,6 % (р=0,097), частота рецидивов ИМ 5,1 % и 3,4 % (снижение риска на 46 %; р=0,001), сумма этих событий - 11,7 % и 9,6 % (снижение риска на 22 %; р=0,002), соответственно. И хотя частота крупных кровотечений оказалась несколько выше в группах эноксапарина - 1,8 % и 2,5 %, соответственно (увеличение риска на 45 %; р=0,001), это не устранило положительное воздействие вмешательства на исходы заболевания, которое, как представляется, в основном связано с предотвращением рецидива ИМ [47].
Польза от 1-недельного применения эноксапарина распространяется как на больных, получавших стрептокиназу, так и на случаи введения алтеплазы или тенектеплазы, а также как на больных, получающих монотерапию ацетилсалициловой кислотой (АСК), так и ее сочетание с клопидогрелом [56,57]. При этом наибольший положительный эффект ожидается именно от продленного введения препарата. В исследовании ExTRACT-TIMI 25 риск смерти или ИМ при использовании эноксапарина в первые 2 сут. оказался на 10 % ниже, чем при в/в инфузии НФГ. При продолжении введения антикоагулянта вплоть до 8 дня степень снижения риска возрастала до 23 % [54]. В абсолютном выражении это соответствовало предотвращению 5 и 21 неблагоприятных исходов на каждую 1 тыс. леченных больных, соответственно. При этом частота крупных кровотечений при продленном введении эноксапарина существенно не увеличивалась - 4 и 7 дополнительных случаев на каждую 1 тыс. леченных в первые 48 ч и за 30 сут., соответственно.
При использовании эноксапарина у больных, получающих ТЛТ, рекомендуется придерживаться доз, использовавшихся в крупнейшем, рандомизированном, контролируемом исследовании ExTRACT-TIMI 25, результаты которого стали основанием для регистрации препарата по этому показанию [54]. В нем эноксапарин следовало ввести в промежуток времени от 15 мин до и 30 мин после начала ТЛТ. Доза эноксапарина подбиралась с учетом возраста и функции почек. У больных <75 лет первоначально вводили болюс 30 мг. Через 15 мин начинали п/к введения 1 мг/кг (2 раза в сутки), причем первые две дозы не должны были превышать 100 мг. У больных >75 лет болюс не применялся, и доза препарата для п/к введения была уменьшена до 0,75 мг/кг каждые 2 раза в сут., причем величина первых двух доз не должны была превышать 75 мг. В случаях, когда значение ККр составляло <30 мл/мин, доза препарата уменьшалась до 1 мг/кг 1 раз в сут. Если до включения в исследование больной в ближайшие 3 ч уже получил >4000 ЕД НФГ, болюс эноксапарина не вводился. Длительность использования эноксапарина или плацебо должна была составлять 8 сут. или до выписки, если она наступала ранее.
В исследовании ExTRACT-TIMI 25 не включали больных с повышенным уровнем Кр в крови (>220 мкмоль/л у мужчин и >177 мкмоль/л у женщин) и указанные значения Кр перечислены среди противопоказаний для использования эноксапарина в сочетании с фибринолитиком. Однако с другой стороны из исследования не исключались больные с ККр <30 мл/мин, что свидетельствует о возможности подобного подхода и в случаях выраженной ПН (при надлежащей коррекции дозы эноксапарина, позволяющей добиться приемлемого соотношения эффективности и безопасности у данной категории больных) [27]. Таким образом, очевидно, что здесь имеется явное противоречие. С одной стороны применение эноксапарина считается противопоказанным уже при сравнительно небольшом повышении уровня Кр в крови, с другой - после соответствующей коррекции дозы препарат можно вводить даже больным с тяжелой ПН. Тем не менее, маловероятно, что эта ситуация когда-либо изменится, поскольку исследований эноксапарина при ТЛТ у больных с ОКС↑ST сопоставимых по масштабу с ExTRACT-TIMI 25, не ожидается.
В исследовании ExTRACT-TIMI 25 при ЧКВ в первые 8 сут. лечения рекомендовалось продолжать вводить тот антикоагулянт, который больной уже получал в рамках данного клинического испытания (была предусмотрена процедура, позволяющая не нарушать принцип маскировки) [54,58]. В группе эноксапарина в случаях, когда после последней п/к инъекции препарата прошло не более 8 ч, дополнительное введение антикоагулянтов не практиковалось. Если после последней п/к инъекции препарата прошло 8-12 ч, следовало ввести в/в дополнительную дозу эноксапарина 0,3 мг/кг. После успешного ЧКВ антикоагулянты можно было отменить. В итоге в период введения исследуемых препаратов при соблюдении принципов двойного слепого исследования эта процедура была выполнена у 2178 больных [59]. В этой подгруппе при использовании эноксапарина по сравнению с НФГ отмечалось достоверное уменьшение риска суммы случаев смерти и не смертельного рецидива ИМ, аналогичное исследованию в целом, притом, что частота крупных кровотечений не увеличилась. Подобный эффект был обусловлен меньшей частотой не смертельных рецидивов ИМ у получавших эноксапарин. Таким образом, очевидно, что если на фоне продолжающегося введения эноксапарина после ТЛТ у больных с ОKС↑ST возникнет необходимость в ЧКВ, процедуру можно выполнять на фоне продолжающегося использования эноксапарина, без введения других антикоагулянтов. Очевидно также, что после успешного инвазивного вмешательства необходимость в продолжении использования эноксапарина пропадает.
Первичное ЧКВ. Традиционно при ЧКВ используются в/в болюсы НФГ. Вместе с тем, результаты исследования ATOLL (Acute STEMI Treated With Primary Angioplasty and Intravenous 0.5 mg/kg Lovenox or Unfractionated Heparin to Lower Ischemic and Bleeding Events) не исключают, что такая процедура может выполняться под защитой эноксапарина [60]. В этом рандомизированном, клиническом испытании, выполненном на 850 больных, в условиях современного лечения заболевания (частое догоспитальное начало лечения, широкое применение нагрузочных доз клопидогрела и блокаторов гликопротеинов IIb/IIIa тромбоцитов, частое использование тромбэктомии и лучевого доступа) выполнение процедуры после в/в введения эноксапарина в дозе 0,5 мг/кг, по меньшей мере, не уступало стандартному подходу с использованием НФГ и имело сопоставимую безопасность. Вместе с тем, следует учитывать, что результаты этого исследования пока не опубликованы, и подобный подход не проходил процедур одобрения в контролирующих инстанциях.
Отсутствие реперфузионного лечения. Достаточно крупных ("доказательных") плацебо-контролируемых исследований эноксапарина в случаях, когда при ОKС↑ST больные остались без реперфузионного лечения, не проводилось. В единственном, небольшом, рандомизированном, клиническом испытании на этом контингенте больных введение эноксапарина (в/в болюс 30 мг, затем п/к 1 мг/кг 2 раза в сут.) на протяжении 2-8 (медиана - ~ 2,5) сут. не уступало по эффективности и безопасности в/в инфузии НФГ [61]. Вместе с тем в рекомендациях Европейского кардиологического общества по ведению больных ИМ↑ST в случаях, когда не доступен фондапаринукс натрия, предусматривается возможность 1-недельного введения эноксапарина, как это делается при ТЛТ [13]. Очевидно, в основе подобного суждения лежат убежденность в целесообразности введения антикоагулянтов больным, оставшимся без реперфузионного лечения, а также наибольшая близость эноксапарина по изученности к препарату, обладающему наилучшей доказательной базой.
Профилактика и лечение венозных ТЭО
Хирургические больные. Профилактика венозных ТЭО в периоперационном периоде - одно из показаний, при котором целесообразность применения эноксапарина наиболее хорошо документировано. Доказательства получены на широком круге больных при выполнении абдоминальных, торакальных, гинекологических, урологических, ортопедических, нейрохирургических операций, тяжелой травме [6274]. При этом речь идет о профилактическом п/к введении 3 фиксированных режимов дозирования препарата: 20 мг 1 раз в сут. у некоторых категорий больных с умеренным риском венозных ТЭО; 40 мг 1 раз в сут. у больных более высокого риска; 30 мг 2 раза в сутки. Первые два способа профилактики распространены в Европе (включая Российскую Федерацию), последний используется в США. В большинстве клинических исследований первая профилактическая доза 20-40 мг вводилась за 2 ч до операции в общей хирургии и за 12 ч до крупной ортопедической операции (протезирование тазобедренного или коленного суставов). Вместе с тем, опираясь на результаты отдельных клинических испытаний и накопленный опыт практического использования эноксапарина, некоторые группы экспертов предлагают вводить первую дозу эноксапарина 40 мг за 12 ч до любых хирургических вмешательств и указывают на возможность начала профилактики дозой 40 мг через 12-24 ч после операции [5,68,70,7476]. Обоснованием служит стремление уменьшить частоту кровотечений в периоперационном периоде.
Стандартная изученная длительность профилактики после операции составляет 7-14 сут. или до выписки в более ранние сроки. Однако у отдельных категорий больных высокого риска: крупные операции на брюшной полости и в полости малого таза по поводу рака, протезирование тазобедренного и, возможно, коленного суставов, операции при переломе бедренной кости, есть свидетельства в пользу продления профилактики до 28-35 сут. [1,5]. Доказательства, полученные с помощью эноксапарина, распространяются на крупные полостные операции по поводу рака, а также протезирование тазобедренного сустава [77,78].
Нехирургические больные. Эноксапарин в фиксированной дозе 40 мг 1 раз в сут. п/к существенно снижает риск венозных ТЭО у различных категорий нехирургических больных, включая больных высокого риска, и, по крайней мере, в последнем случае по эффективности превосходит НФГ [79-87]. Стандартная (изученная) длительность профилактики составляет 6-14 сут. Вместе с тем эноксапарин - единственный НМГ, для которого изучена целесообразность более длительного введения у больных с сохраняющимися ФР [88]. В плацебо-контролируемом исследовании EXCLAIM (Extended Prophylaxis for Vnous ThromboEmbolism in Acutely Ill Medical Patients With Prolonged Immobilization), выполненном на 6085 больных >40 лет с различными нехирургическими заболеваниями и существенным ограничением двигательного режима изучалась целесообразность продления введения стандартной профилактической дозы эноксапарина на 1 мес. после обязательного 1-2 недельного введения препарата. Его результаты оказались не однозначными: с одной стороны продленное использование антикоагулянта способствовало снижению опасности венозных ТЭО, с другой - сопровождалось увеличением частоты крупных кровотечений. И хотя в целом польза превосходила риск геморрагических осложнений, из-за большой разнородности больных, участвовавших в данном клиническом испытании, остается неясным, кто конкретно нуждается в длительной профилактике и имеет приемлемое соотношение эффективности и безопасности. Результаты ретроспективного анализа дают основания предполагать, что продление профилактики может быть оправдано как минимум у лиц с сохраняющимся выраженным ограничением двигательной активности постели, больных >70 лет, а также у женщин.
Характерно, что при изучении фондапаринукса натрия и новых назначаемых антикоагулянтов per os в профилактике венозных ТЭО (апиксабан, дабигатран, ривароксабан) именно эноксапарин был выбран в качестве препарата сравнения, поскольку во многих странах его применение представляется эталонным и наиболее распространенным в данной клинической ситуации.
Лечение венозных тромбоэмболических осложнений
Эноксапарин, как минимум, не уступает в/в инфузии НФГ в лечении тромбоза глубоких вен и/ или не массивной тромбоэмболии легочной артерии (ТЭЛА). В сравнительных, клинических исследованиях изучали применение препарата в дозе 1 мг/кг 2 раза в сут. и 1,5 мг/кг 1 раз в сут. [62,89-91]. Соответственно, именно такие режимы дозирования рекомендуются для широкого клинического применения.
Подготовка к кардиоверсии при фибрилляции предсердий
Результаты двух рандомизированных, клинических испытаний указывают на возможность применения эноксапарина при подготовке к кардиоверсии (КВ) больных с затянувшимся пароксизмом фибрилляции предсердий (ФП). В случаях, когда тактика ведения определялась с использованием чреспищеводной эхокардиографии (ЧП ЭхоКГ), начало лечения с эноксапарина в дозе 1 мг/кг и переходом на варфарин, была сопоставима со стандартным подходом, предполагающим в/в инфузию НФГ до подбора дозы антагониста витамина К [92]. При электрической КВ у 496 больных с неклапанной ФП п/к введение эноксапарина в дозе 1 мг/кг на протяжении 2-8 сут. с переходом на 40 мг или 60 мг 2 раза в сут. (для пациентов с МТ <65 кг и >60 мг соответственно) оказалось эквивалентным в/в инфузии НФГ с переходом на фенпрокумон [93]. Эноксапарин начинали вводить до КВ и продолжали использовать 28 сут. после нее, а в случаях, когда ЧП ЭхоКГ не проводилась или был выявлен тромб в левом предсердии, эноксапарин вводили также в течение 21 сут. до КВ. Хотя данное показание отсутствует в списке одобренных регулирующими инстанциями, на возможность использования НМГ вместо НФГ при КВ у больных с ФП указывают современные клинические рекомендации [18,20].
Список использованной литературы
Комментарии
ПРАКТИКА ПЕДИАТРА
