Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
Новое комбинированное топическое лекарственное средство для лечения хронического вульвовагинита
Статьи Опубликовано в журнале:
« Врач » сентябрь, 2015г. И. Сарвилина, доктор медицинских наук, Н. Кузьмина
Медицинский центр «Новомедицина», Ростов-на-Дону
Клиника «Скандинавия», Санкт-Петербург
Оценены эффективность и безопасность лечения хронической вульвовагинальной инфекции новым топическим лекарственным средством, содержащим метронидазол и миконазол (Метромикон-Неo®, вагинальные свечи, Авексима, Россия) с анализом различных клинических и лабораторных показателей, чувствительности к антимикробным средствам и оценкой качества жизни пациенток по опроснику SF-36.
Ключевые слова: хронический вульвовагинит, метронидазол, миконазол.
Самой частой причиной обращения пациенток к акушерам-гинекологам является вульвовагинальная инфекция. Удельный вес инфекционных вульвовагинитов (ВВГ) значительно увеличился, что связано с повышением качества лабораторной диагностики.
Наиболее распространены бактериальный вагиноз (до 50%), кандидозный ВВГ (20–25%), трихомонадный вагинит (15–20%) [3, 4]. Большую опасность представляют гонорейные и вирусные ВВГ в связи с хроническим рецидивирующим течением, вовлечением в процесс матки и ее придатков, развитием экстрагенитальных очагов инфекции и угрозы бесплодия [1].
Вульвовагинальная инфекция включает специфическую микрофлору (Trichomonas vaginalis, Treponema pallidum, Neisseria gonorrhoeae, Gardnerella vaginalis, Haemophilus ducreyi, Mycobacterium tuberculosis, Chlamydia trachomatis, различные вирусы), а также может развиваться вследствие дисбаланса нормальной микрофлоры, нарушаемой грибами, кишечной палочкой, другими энтеробактериями; β-гемолитическими стрептококками серогруппы В, энтерококками, анаэробами, урогенитальными микоплазмами. Бактериальные вагинозы связаны с выраженным ростом G. vaginalis, облигатных анаэробов, снижением числа влагалищных лактобактерий [6].
ВВГ часто рецидивирует. По данным международного исследования [4], включавшего 6000 женщин, распространенность кандидозного ВВГ составила 29–49%, рецидивы отмечались у каждой 5-й пациентки.
В проводимых исследованиях изучали возможности применения при вульвовагинальной инфекции ВВГ более высоких доз существующих лекарственных средств, а также осуществляется поиск новых комбинаций лекарственных веществ, путей их введения в организм и разработка улучшенных фармацевтических носителей активных веществ.
Лекарственные средства группы нитроимидазола являются синтетическими антимикробными препаратами с высокой активностью в отношении большинства облигатных грамположительных и грамотрицательных анаэробов, спорообразующих и неспорообразующих, включая анаэробные кокки; к чувствительны простейшие, Helicobacter pylori. По действию на анаэробные бактерии нитроимидазолы сопоставимы с клиндамицином, защищенными (3-лактамами, несколько уступают карбапенемам и некоторым фторхинолонам.
У микроорганизмов может вырабатываться устойчивость к нитроимидазолам в связи со снижением активности нитро-зоредуктаз микробной клетки и степени внутриклеточной трансформации лекарства, нарушением в работе транспортных систем клетки. Приобретенная резистентность микроорганизмов к нитроимидазолам может быть преодолена увеличением разовой дозы препарата при сохранении уровня безопасности и применением нового носителя активного нитроимидазола в лекарственной форме.
Рост расходов на медицинскую помощь пациенткам с ВВГ при ограниченных возможностях финансирования требует рационализации медицинских расходов при сохранении качества медицинской помощи. Отсутствует объективная сравнительная оценка препаратов по показателям фармакоэкономического анализа, на основе которой принимается решение об их включении в стандарты и протоколы ведения пациенток с ВВГ.
Нами оценена эффективность лечения хронической вульвовагинальной инфекции новым топическим лекарственным средством, содержащим метронидазол и миконазол (Метромикон-Неo®, вагинальные свечи, Авексима, Россия) на новом активном носителе (суппоцир АМ).
Исследование являлось пострегистрационным проспективным с параллельным дизайном и проводилось в соответствии с существующими в РФ правилами, а также принципами Декларации Хельсинки / Токио / Венеция / Гонконг / Вашингтон / Эдинбург / Сеул (1964–2008).
В исследование были включены 90 пациенток с диагнозом: хронический ВВГ, составившие с учетом схемы лечения 3 клинические группы; в контрольную группу вошли 20 пациенток с ВВГ, не получавшие терапию.
Критерии включения в исследование: амбулаторные больные в возрасте 18–45 лет; диагноз подострого и хронического ВВГ; отсутствие патологии печени, почек, нервной системы; соблюдение указаний врача; добровольное информированное согласие.
Критерии исключения из исследования: печеночная и почечная недостаточность; органические поражения центральной нервной системы (в том числе эпилепсия), лейкопения, беременность или кормление грудью; повышенная чувствительность или индивидуальная непереносимость компонентов препарата; психическое заболевание, активный туберкулез, алкоголизм и наркомания; злокачественное новообразование любой локализации; участие в другом клиническом исследовании в последние 3 мес; параллельное участие в другом аналогичном исследовании.
Проведено компьютерное формирование рандомизированных групп пациенток и определена схема лечения: 1-я группа (n=30) – пациентки с ВВГ, получавшие по 1 свече Метромикон-Неo® (метронидазол 500 мг + миконазол 100 мг) интравагинально, на ночь, в течение 10 дней; 2-я группа (n=30) – пациентки с ВВГ, получавшие Нео-Пенотран®, суппозитории (метронидазол 500 мг, миконазол 100 мг), по 1 свече интравагинально, на ночь, в течение 10 дней; 3-я группа (n=30) – пациентки с ВВГ, получавшие Тержинан®, вагинальные таблетки тернидалоз – 0,2 г, неомицина сульфат – 0,1 г или 65 000 МЕ, нистатин – 100 000 МЕ, преднизолона натрия метасульфобензоат – 0,0047 г, эквивалентно преднизолону – 0,003 г), интравагинально по 1 таблетке на ночь, в течение 10 дней. Исследование длилось 15 дней, наблюдение после исследования – 3 мес.
Клинико-анамнестическая характеристика пациентов включала оценку жалоб и анамнеза заболевания (длительность текущего рецидива, давность заболевания, средняя частота рецидивов ВВГ в год, длительность рецидива), результаты физикальных методов исследования, катамнестического наблюдения, данные о средней продолжительности межрецидивного периода, наличии сопутствующих заболеваний других органов и систем, сопутствующей терапии.
Применялись следующие методы исследования: общий анализ крови (анализаторы Advia 120 Bayer Diagnostics, Германия) и мочи (Clinitek Advantus, Siemens, США); рН-метрия вагинального секрета («Биосенсор АН», Россия); аминный тест; микроскопия; комплексное исследование вагинального секрета методом полимеразной цепной реакции – ПЦР (амплификатор «DT-96», Россия; детектор «Джин-4», Россия), культуральный и микологический методы, дискодиффузионный метод определения чувствительности для антибиотиков и антимикотических средств (по Keurby–Bauer); протеомный анализ вагинального секрета. Молекулярное фенотипирование вагинального секрета выполнялось в ходе центрифугирования (ацетон: HCl 10:1), фракционирования низкомолекулярных белков и пептидов (система MicroFlow MF10, Австралия) и идентификации белков и пептидов методом масс-спектрометрического анализа на основе MALDI-TOF-МС (прибор Autoflex III, Bruker, США). Применяли программное обеспечение для протеомики и масс-спектрометрии (Flex Control, Flex Analysis 2.x с функцией Auto Xecute, ClinProTools 1.0., Biotools 3.0.) и идентификацию пептидного фингерпринта молекулярных маркеров в интегрированной базе данных Mascot Search (v 2.1, Matrix Science, Великобритания).
Результаты исследования представлены в виде молекулярного профиля вагинального секрета – пептиды и белки с указанием молекулярной массы (Mr) белков (Да). Условием для включения пептида и белка в диагностический профиль являлся показатель «покрытия сиквенса» при анализе масс-спектрограмм >15%. Биоинформационный анализ межмолекулярных взаимодействий пептидов и белков проведен на основе программы String 9.1.
Мониторинг безопасности терапии включал оценку частоты, характера, выраженности, длительности возникающих неблагоприятных побочных реакций и их связи с приемом препарата. Критериями эффективности терапии являлись оценка пациенткой течения заболевания: значительное улучшение – сокращение длительности рецидива и (или) увеличение длительности ремиссии в >2 раза; улучшение – сокращение длительности рецидива и (или) увеличение длительности ремиссии в Определение затрат на ведение больных предполагало оценку прямых затрат на лечение ВВГ, включавших затраты на 10-дневную терапию препаратами Метромикон-Неo® (стоимость 1 упаковки – 316 руб.), Нео-Пенотран® (стоимость 1 упаковки – 644 руб.), Тержинан® (стоимость 1 упаковки – 492 руб.) и амбулаторное обслуживание (прием врача, осмотр, рН-метрия, аминотест, микроскопия, общий анализ крови и мочи, исследование флоры методами ПЦР, бактериологии и микологии; всего 6820 руб.) 2 раза за исследование, затраты на дополнительную диагностику и лечение в случае неэффективности терапии. Косвенные медицинские затраты пациентов были одинаковыми. Для определения затрат на медицинские услуги использовались тарифы на поликлинические медицинские услуги ТФОМС РО (2015) для пациенток с ВВГ. Для оценки затрат на лекарства использованы данные о ценах на лекарства Реестра лекарственных средств РФ. Выполнен анализ минимизации затрат при использовании препаратов-производных нитроимидазола и антимикотика у пациенток.
Расчеты соотношения затраты/ эффективность для каждого из вариантов лечения ВВГ проводили по формуле:
Кэ=C/Эф, где Кэ – коэффициент затратной эффективности, C – стоимость всех медицинских затрат при лечении конкретным препаратом; Эф – количественное выражение эффективности лекарств.
Статистическую обработку проводили c применением пакета программ Statistica 12.0.
При включении в исследование у всех участвующих в нем больных верифицировали диагноз ВВГ (на основе жалоб и анамнеза заболевания, физикального осмотра, характера влагалищного секрета, рН-метрии, аминного теста, микроскопии).
Клинико-анамнестическая характеристика пациентов контрольной и 3 исследуемых групп представлена в табл. 1.
Таблица 1.
Клинико-анамнестическая и лабораторная характеристика обследованных в сроки от 0 до 15-го дня (M±SD)
| Показатель | 1-я группа | 2-я группа | 3-я группа | Контроль |
|---|---|---|---|---|
| 0–15-й день | ||||
| Анамнестические данные* | ||||
| Возраст, годы | 34,8±2,5 | 34,5±2,3 | 34,7±2,4 | 34,5±2,3 |
| Масса тела, кг | 64,5±4,1 | 65,3±4,3 | 64,8±4,2 | 65,1±4,0 |
| Рост, см | 166,7±2,5 | 169,2±2,2 | 168,4±2,3 | 167,5±2,5 |
| Давность заболевания, годы | 3,7±1,0 | 3,6±0,9 | 3,8±1,0 | 3,6±0,8 |
| Средняя частота рецидивов ВВГ в год | 3,7+1,3 | 3,5±1,1 | 3,6±1,2 | 3,7+1,5 |
| Длительность рецидива ВВГ, дни | 11,0+1,5 | 10,5+1,3 | 12,2+1,6 | 11,5+1,7 |
| Средняя продолжительность межрецидивного периода, мес | 4,1±1,3 | 3,9±1,1 | 4,2±1,2 | 4,0±1,1 |
| рН-метрия, аминотест, микроскопия; день исследования | ||||||||
| 0-й | 15-й | 0-й | 15-й | 0-й | 15-й | 0-й | 15-й | |
| рН-метрия вагинального секрета рН>4,5, % | 100 | 0 | 100 | 3,3 | 100 | 10 | 100 | 100 |
| Положительный аминотест 10% КОН, % | 96,7 | 0 | 93,3 | 3,3 | 96,7 | 10 | 100 | 100 |
| Смешанная микрофлора, отсутствие лейкоцитов, наличие «ключевых клеток», % | 63,3 | 0 | 66,7 | 3,3 | 63,3 | 10 | 75 | 75 |
| Нормальная микрофлора, наличие бластопор и нитей мицелия, отсутствие «ключевых» клеток, % | 26,7 | 0 | 30 | 0 | 30 | 3,3 | 30 | 30 |
| Множество лейкоцитов, подвижные трихомонады (70%), отсутствие «ключевых» клеток, % | 16,7 | 0 | 13,3 | 0 | 16,7 | 0 | 15 | 15 |
| Примечание. * – Во всех случаях в разделе «Анамнестические данные» различия в 1–3-й группах по сравнению с контролем недостоверны. | ||||||||
Была выявлена высокая средняя частота рецидивов и большая их длительность при коротких межрецидивных периодах ВВГ (см. табл. 1).
До лечения (0-й день) были зарегистрированы клинические симптомы ВВГ: у большинства – наличие патологических белей, зуда вульвы, жжения (у всех), неприятного запаха (у 56,7% в 1-й, 60% – во 2-й, 3-й, контрольной группах), гиперемии и отечности слизистых (у всех), умеренного, гомогенного или негомогенного, белого, серого, пенистого, с запахом влагалищного секрета (у 56,7% – в 1-й и 3-й группах, 60% – во 2-й и контрольной группах), с творожистыми включениями (у 26,7% – в 1-й и 3-й группах, 33,3% – во 2-й группе, 30% – в контроле), реже выявляли болезненность при мочеиспускании (у 60% – в 1-й, 3-й и контрольной группах, 53,3% – во 2-й группе), диспареунию (у 50% – в 1-й группе, 40% – во 2-й, 3-й группах, 45% – в контроле), общее недомогание (у 36,7% – в 1-й и 3-й группах, 33,3% – во 2-й группе, 30% – в контроле), расчесы с изъязвлениями и гноевидным налетом (у 6,7% – в 1-й и 2-й группах, 3,3% – в 3-й группе, 5% – в контроле), бели желто-зеленого цвета (у 33,3% – в 1-й группе, 36,7% – во 2-й группе, 30% – в 3-й группе, 35% – в контроле), эндоцервицит и желтоватые гноевидные выделения на шейке матки (у 30% – в 1-й и 3-й группах, 36,7% – во 2-й группе, 35% – в контроле). У большинства пациенток обнаружены: pH>4,5, положительный аминотест, при микроскопии – смешанная микрофлора, отсутствие лейкоцитов, наличие «ключевых» клеток, часто в сочетании с бластопорами и нитями мицелия, у меньшего числа пациенток – множество лейкоцитов, подвижные трихомонады до 70%, отсутствие «ключевых» клеток (см. табл. 1).
В 0-й день у большинства пациенток выявляли умеренный дисбиоз, реже – выраженный. Данные бактериологического и микологического исследований показали рост Staphylococcus aureus, Enterococcus faecalis, Candida albicans в соскобе из влагалища и влагалищном секрете, реже – Escherichia coli, Proteus vulgaris, микоплазмы. Патогенные микроорганизмы были представлены Т. vaginalis (табл. 2).
Наибольшая чувствительность бактериальных возбудителей ВВГ отмечена к антибиотикам пенициллинового ряда с ингибиторами (3-лактамаз (76,7– 100%), цефалоспоринам и фторхинолонам (83,3–90,0%), С. albicans – к антимикотическим препаратам имидазолового (миконазол, итраконазол, кетоконазол) (100%) и триазолового ряда (флуконазол) (100%), за исключением клотримазола, чувствительность к которому была ниже при кандидозном или смешанном ВВГ (86,4%). Чувствительность Т. vaginalis оказалась наиболее высокой к производным нитроимидазола (100%), меньшей – к нифурателу (68,4%).
На 10-й день у пациенток 1-й группы отсутствовали симптомы ВВГ, а также его проявления при физикальном осмотре, по данным рН-метрии, аминотеста, микроскопии. У пациенток 2-й и 3-й групп на 10-й день выявлены патологические бели, зуд вульвы и жжение, гиперемия слизистых оболочек, умеренные, гомогенные, белые/серые, пенистые с запахом выделения, pH>4,5, положительный аминотест, при микроскопии – смешанная микрофлора, отсутствие лейкоцитов, наличие «ключевых» клеток (частота каждого признака: 3,3% во 2-й и 10% – в 3-й группе). В 3-й группе на 10-й день сохранялись болезненность при мочеиспускании (6,7%), гиперемия и отек слизистой влагалища (10%), негомогенные выделения с творожистыми включениями и наличие бластоспор и нитей мицелия во влагалищном секрете (3,3%).
На 10-й день показано уменьшение доли пациенток с умеренным дисбиозом влагалища во всех исследуемых группах по сравнению с контролем при отсутствии пациенток с выраженным дисбиозом влагалища в 1-й группе и наличии их во 2-й и 3-й группах. При этом нормоценоз влагалища на фоне применения препарата Метромикон-Неo® регистрировался чаще, чем при использовании препаратов Нео-Пенотран® и Тержинан® (см. табл. 2).
Таблица 2.
Динамика показателей ПЦР, бактериологического и микологического исследования вагинального секрета при ВВГ
| Показатель | 1-я группа | 2-я группа | 3-я группа | Контроль | ||||
|---|---|---|---|---|---|---|---|---|
| День исследования | ||||||||
| 0-й | 15-й | 0-й | 15-й | 0-й | 15-й | 0-й | 15-й | |
| Биоценоз влагалища | ||||||||
| Нормоценоз, % | 3,3 | 63,3 | 3,3 | 53,3 | 3,3 | 46,7 | 0 | 0 |
| Умеренный дисбиоз, % | 66,7 | 36,7 | 63,3 | 30 | 66,7 | 33,3 | 75 | 70 |
| Выраженный дисбиоз, % | 30 | 0 | 33,4 | 16,7 | 30 | 20 | 25 | 30 |
| Факультативно-облигатно-анаэробные микроорганизмы | ||||||||
| Не обнаружены,% | 0 | 100 | 0 | 93,3 | 0 | 90 | 0 | 0 |
| Е. coll, % | 13,3 | 0 | 16,7 | 6,7 | 13,3 | 10 | 15 | 45 |
| S. aureus, % | 43,3 | 0 | 53,3 | 10 | 46,7 | 13,3 | 50 | 45 |
| P. vulgaris, % | 13,3 | 0 | 16,7 | 0 | 16,7 | 0 | 15 | 20 |
| Е. faecalis, % | 33,3 | 0 | 36,7 | 10 | 36,7 | 10 | 15 | 15 |
| Микоплазмы | ||||||||
| Не обнаружены, % | 80 | 100 | 86,7 | 100 | 80 | 93,3 | 80 | 80 |
| 5 ГЭ/образец, % | 10 | 0 | 6,7 | 0 | 10 | 6,7 | 10 | 10 |
| >105 ГЭ/образец, % | 10 | 0 | 6,6 | 0 | 10 | 0 | 10 | 10 |
| Дрожжеподобные грибы | ||||||||
| 3 ГЭ/образец, % | 66,7 | 100 | 70 | 86,7 | 63,3 | 83,3 | 75 | 75 |
| 103 -104 ГЭ/образец, % | 23,3 | 0 | 23,3 | 6,7 | 26,7 | 16,7 | 15 | 15 |
| >104 ГЭ/образец, % | 10 | 0 | 6,7 | 6,6 | 10 | 0 | 10 | 10 |
| Патогенные микроорганизмы | ||||||||
| Не выявлены, % | 63,3 | 100 | 70 | 93,3 | 66,7 | 93,3 | 65 | 65 |
| Т. vaginalis, % | 36,7 | 0 | 30 | 6,7 | 33,3 | 6,7 | 35 | 35 |
| Примечание. ГЭ – геном-эквивалент. | ||||||||
Динамика молекулярных иммуновоспалительных процессов в вагинальном секрете, определяющих механизм эффективности топической формы метронидазола и миконазола при ВВГ, представлена в табл. 3: на фоне использования суппозиториев Метромикон-Неo® зарегистрировано наиболее значительное уменьшение числа пациенток с высокой экспрессией (3-амилоида 42, белка F, ренина, транскрипционного фактора SP1, мегалина, субъединицы В тромбоцитарного фактора роста и увеличение – с высокой экспрессией фактора C1q-комплемента и молекулы 3, ингибирующей Fas-опосредованный апоптоз в вагинальном секрете по сравнению с контролем; во 2-й и 3-й группах динамика экспрессии маркеров иммуновоспалительных процессов в вагинальном секрете была менее выраженной.
Таблица 3.
Динамка протеомного профиля вагинального секрета у пациенток с ВВГ; %
| Белок | Mr, Да | 1-я группа | 2-я группа | 3-я группа | Контроль | ||||
|---|---|---|---|---|---|---|---|---|---|
| День исследования | |||||||||
| 0-й | 15-й | 0-й | 15-й | 0-й | 15-й | 0-й | 15-й | ||
| β-амилоид | 4286 | 943 | 100 | 83,3 | 100 | 93,3 | 100 93,3 | 100 | 100 |
| Фактор C1q-комплемента | 26 017 | 70 | 96,7 | 73,3 | 83,3 | 73,3 | 80 | 85 | 85 |
| Молекула 3, ингибирующая Fas-опосредованный апоптоз | 43 146 | 76,7 | 93,3 | 80 | 96,7 | 80 | 93,3 | 85 | 85 |
| Белок F | 32 586 | 100 | 73,3 | 100 | 76,7 | 100 | 80 | 80 | 80 |
| Ренин | 45 057 | 96,7 | 66,7 | 96,7 | 80 | 93,3 | 80 | 90 | 90 |
| Транскрипционный фактор SP1 | 80 693 | 93,3 | 63,3 | 93,3 | 80 | 96,7 | 76,7 | 80 | 80 |
| Мегалин | 530 166 | 100 | 63,3 | 96,7 | 83,3 | 100 | 93,3 | 90 | 90 |
| β-Субъединица тромбоцитарного фактора роста | 27 283 | 40 | 96,7 | 53,3 | 100 | 60 | 96,7 | 95 | 95 |
| Примечание. % – доля пациенток с экспрессией белка/пептида. | |||||||||
При оценке КЖ с помощью опросника SF-36 показано значимое улучшение у пациенток 1-й группы по сравнению с остальными (табл. 4) по шкалам: GH (общее состояние здоровья); VT (жизненная активность); MH (психическое здоровье) при высоких исходных показателях шкал SF (социальное функционирование); RE (ролевое функционирование, обусловленное эмоциональным состоянием); MH (психическое здоровье); P (интенсивность боли); RP (ролевое функционирование, обусловленное физическим состоянием); PF (физическое функционирование); RP (ролевое функционирование, обусловленное физическим состоянием). Зарегистрировано выраженное увеличение значений общих показателей физического и психического компонентов здоровья в группе пациенток, применявших Метромикон-Неo®.
Таблица 4.
Динамика показателей КЖ по опроснику SF-36 Health status survey у обследованных (M±SD); баллы
| Шкала | 1-я группа (n=30) | 2-я группа | 3-я группа | Контроль | ||||
|---|---|---|---|---|---|---|---|---|
| 0–15-й день | ||||||||
| PF | 30±0,5Н | 29,5±0,1 | 29,9±0,3Н | 29,3±0,3 | 29,9±0,4Н | 29,6±0,5 | 29,9±0,3Н | 29,9±0,3 |
| RP | 8±0,4Н | 7,4±0,1 | 7,5±0,1Н | 7,8±0,2 | 8,0±0,4Н | 7,6±0,3 | 7,9±0,4Н | 7,9±0,2 |
| Р | 100 | 100 | 100 | 100Н | 100Н | 100Н | 100й | 100 |
| GH | 13,6±0,9 | 19,5±1,3*** | 13,8+0,8 | 16,4±1,0** | 13,2±0,6 | 14,6±0,9Н | 13,4+0,4 | 13,8±0,5Н |
| VT | 12,5+1,5 | 19,5±0,7*** | 12,7+1,7 | 16,5±0,9** | 12,3+1,3 | 15,7+1,1* | 12,8+1,4 | 13,1+1,5Н |
| SF | 9,6±0,9 | 9,8±0,9Н | 9,5±0,7 | 9,7±0,9Н | 9,6±0,7 | 9,8±0,9Н | 9,5±0,9 | 9,6±0,8Н |
| RE | 6,0±0,3 | 6,0±0,3Н | 5,9±0,2 | 6,0±0,3Н | 6,0±0,3 | 6,0±0,3Н | 5,8±0,2 | 5,9±0,3Н |
| МН | 16,4+1,6 | 25,2±1,5*** | 15,9+1,5 | 22,4±1,8** | 16,2+1,4 | 19,3+1,7Н | 15,8+1,4 | 16,1+1,5Н |
| РН | 55,8±0,7 | 58,9±0,9** | 56,3+1,1 | 57,2±1,2Н | 55,9±0,7 | 56,5±1,2Н | 55,5±0,9 | 57,3±1,0Н |
| МН, | 43,9±4,1 | 56,6±4,4*** | 44,5±4,3 | 52,4±4,6Н | 43,8±3,8 | 47,7±4,1Н | 44,1±4,0 | 45,2±4,2Н |
| Примечание. РН - физический компонент здоровья; МН1 - психический компонент здоровья. Достоверность различий: * -р | ||||||||
Зарегистрированы неблагоприятные побочные реакции при применении топической формы тернидазола и нистатина в препарате Тержинан® (чувство жжения и раздражение слизистой оболочки – у 2 пациенток), верифицированные как легкая степень тяжести.
Лечение пациенток с ВВГ препаратом Метромикон-Неo® в течение 10 дней оказалось наиболее эффективным: значительное улучшение состояния здоровья и отсутствие рецидива ВВГ в ближайшие 3 мес отметили все пациентки 1-й группы; 26 (86,7%) женщин 2-й группы и 20 (66,7%) – 3-й.
Выполненный анализ минимизации затрат при использовании топических форм производных нитроимидазола и антимикотика продемонстрировал разную стоимость единицы активного вещества (стоимость 1 ед Метромикон-Неo® меньше, чем стоимость 1 ед препаратов Нео-Пенотран® и Тержинан®) и увеличение стоимости курса лечения ВВГ при применении препаратов Нео-Пенотран® и Тержинан®.
Суммарные прямые затраты на 10-дневную терапию ВВГ представлены в табл. 5: стоимость амбулаторного ведения пациенток во 2-й и 3-й группах оказалась выше, чем в 1-й. Наибольшая эффективность и наименьший коэффициент затратной эффективности показаны для терапии ВВГ для Метромикон-Неo® по сравнению с терапией препаратами Нео-Пенотран® и Тержинан® (см. табл. 5).
Таблица 5.
Фармакоэкономический анализ при использовании топических форм нитроимидазола и антимикотиков у пациенток с ВВГ
| Показатель | Метромикон-Неo® (Авексима, Россия) | Нео-Пенотран® (Йенафарм, Германия) | Тержинан® (Лаборатории Бушара, Франция) |
|---|---|---|---|
| Анализ минимизации затрат | |||
| Содержание активного вещества (метронидазол/тернидазол) в 1 капсуле, мг | 500 | 500 | 200 |
| Число единиц, содержащее целевую суточную дозу | 1 | 1 | 2,5 |
| Цена упаковки, руб. | 316 | 644 | 492 |
| Цена 1 ед, руб. | 22,57 | 46 | 49,2 |
| Число единиц в упаковке | 14 | 14 | 10 |
| Стоимость курса лечения ВВГ для 1 пациентки (10 дней), руб. | 225,7 | 460 | 1230 |
| Полная стоимость болезни | |||
| Амбулаторное ведение пациента (10 дней), в том числе затраты: на лекарства на медицинское обслуживание (прием врача+осмотр + лабораторные анализы) | 7045,7 | 7280 | 8050 |
| Среднезатратная эффективность | |||
| Эффективность, % | 100 | 96,7 | 90 |
| Кэ, усл. ед. | 68,2 | 70,5 | 75,8 |
| Примечание. Кэ - коэффициент затратной эффективности. | |||
В основе обнаруженных нами различий в динамике у обследованных с ВВГ на фоне приема препаратов Метромикон-Неo®, Нео-Пенотран® и Тержинан® лежат молекулярные пути реализации эффектов и влияние дозы лекарства на молекулярные механизмы развития ВВГ. Эффективная доза производного нитроимидазола и антимико-тического средства также определяется фармацевтическими характеристиками лекарственной формы и фармакокинетикой препарата.
Рассмотрим возможные молекулярные механизмы эффективности применения вагинальных топических форм производных нитроимидазола и антимикотика. В ходе исследования в вагинальном секрете у женщин с ВВГ нами выявлены следующие функциональные группы пептидов и белков: белки врожденного иммунного ответа и активации комплемента, острофазового ответа, свертывающей системы крови, развития эпидермиса и кератинизации, клеточной адгезии, участники оксидативного стресса и его ингибиторы, метаболических процессов и транспорта, структурные белки цитоскелета.
Наибольшее увеличение экспрессии фактора C1q-комплемента в вагинальном секрете у пациенток 1-й группы свидетельствует о механизме его ингибирующего действия на синтез интерферона 1-го типа и развитие аутоиммунных реакций, синтез интерлейкинов-6, -8, фактора некроза опухоли-а (ФНОа) при применении препарата Метромикон-Неo®.
Уменьшение числа пациенток с высокой экспрессией β-амилоида-42 в вагинальном секрете при ВВГ, наиболее выраженное на фоне применения препарата Метромикон-Неo®, связано с увеличением экспрессии фактора C1q-комплемента и сопровождается снижением фибриллярных агрегатов в вагинальном секрете, антимикробной активностью β-амилоида-42 при нормальной экспрессии, активацией киназ и защитой от оксидативного стресса при воздействии инфекции. Снижение экспрессии β-амилоида-42 в вагинальном секрете приводит к уменьшению его транскрипционной активности и снижению экспрессии транскрипционного фактора Sp1 в вагинальном секрете пациенток с ВВГ, наиболее выраженному в 1-й группе. Фактор Sp1 регулирует активность универсальных путей (SMARCA4/BRG1; TERT/ TERC; ARNTL/BMAL) клеточного роста, апоптоза, диффе-ренцировки, иммунного ответа.
Увеличение числа пациенток с высокой экспрессией молекулы 3, ингибирующей Fas-опосредованный апоптоз, в вагинальном секрете при ВВГ, особенно на фоне приема Метромикон-Неo®, отражает защиту клеток слизистой оболочки влагалища от FAS-, ФНОа- и FADD-индуцированного апоптоза в условиях инфекционного воспаления.
Зарегистрированное уменьшение числа пациенток с ВВГ с высокой экспрессией белка F в вагинальном секрете, наиболее выраженное в 1-й группе, демонстрирует наличие в механизме действия активных веществ блокады взаимодействия белка F с гепаран-сульфатом на уровне клеточной мембраны, что приводит к устранению маскировки бактериальных возбудителей ВВГ
Повышение уровня ренина в слизистой оболочке влагалища и влагалищном секрете при ВВГ, видимо, связано с увеличением его локального захвата, что может сопровождаться нарушением местного кровоснабжения, водного и электролитного обмена при воздействии инфекции. Уменьшение числа пациенток с экспрессией ренина в вагинальном секрете на фоне терапии свидетельствует о восстановлении локального кровотока, водного и электролитного обмена в клетках слизистой влагалища.
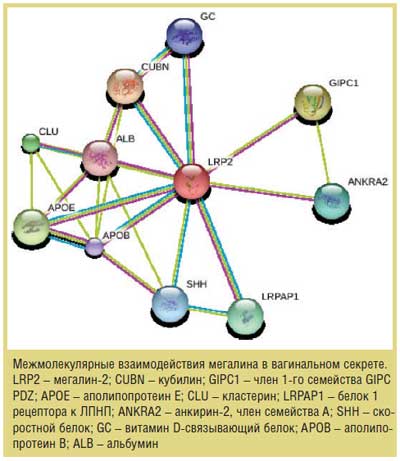
Нами обнаружено уменьшение числа пациенток с высокой экспрессией трансмембранного белка мегалина в вагинальном секрете, особенно в 1-й группе, что приводит к снижению взаимодействия с мегалином таких лигандов, как лактоферрин, липопротеин-липаза и аполипопротеин J на уровне клеточной мембраны, а также прекращению кальций-зависимых сигнальных функций лигандов. На рисунке представлен пример межмолекулярных взаимодействий белка ме-галина.
Повышение уровня экспрессии субъединицы В тромбоцитарного фактора роста во влагалищном секрете пациенток с ВВГ на фоне приема метронидазола и миконазола в топической форме способствует выполнению главных клеточных функций: пролиферации, миграции, выживанию, хемотаксису и особенно росту и развитию гладкомышечных клеток сосудов.
Таким образом, исследование молекулярных звеньев механизмов действия производных нитроимидазола и антимикотика, представленных в топической лекарственной форме в 3 препаратах, при ВВГ продемонстрировало многогранность молекулярных путей и межмолекулярных взаимодействий в их реализации. Эффективность функционирования молекулярного механизма определяется дозой активного вещества в лекарственной форме с носителем (суппоцир АМ представлен в Метромикон-Неo®), который обеспечивает высокие биоадгезивные и мукоадгезивные свойства активных веществ.
Литература
1. Малова И.О., Скворцова Р.Г., Кузьмина Н.И. Клинико-микробиологическая характеристика вульвовагинитов у девочек // Вестн. дерматол. и венерол. – 1998; 1: 27–31.
2. Меньшикова Н.С. Петрова М.С. Петров И.А. Современное лечение неспецифического вульвовагинита // Сибирский мед. жур. – 2010. – Т. 25; 4–2; 125–127.
3. Прилепская В.Н. Клиника, диагностика и лечение вульвовагинального кандидоза (клиническая лекция) // Гинекология. – 2001; 3 (6): 201–5.
4. Яковлев В.П., Яковлев С.В. и др. Рациональная антимикробная фармакотерапия: Рук. для практикующих врачей. Под общ. ред. В.П. Яковлева, С.В. Яковлева / М.: Литтера, 2003; 1008 с.
5. Foxman, B., Muraglia, R., Dietz, J. et al. Prevalence of recurrent vulvovaginal candidiasis in 5 European countries and the United States: results from an internet panel survey // J. Low Genit. Tract. Dis. – 2013; 17 (3): 340–5.
6. Schmid G. Trichomoniasis treatment in women: RHL commentary (last revised: 28 July 2003). The WHO Reproductive Health Library; Geneva: World Health Organization.
