Фитоэстрогены в лечении климактерических расстройств
СтатьиОпубликовано в журнале:
«Гинекология», том 14, №6, с. 20-23
И.В.Кузнецова
ГБОУ ВПО Первый МГМУ им. И.М.Сеченова Минздрава РФ
Резюме
В периоде менопаузального перехода на фоне общих возрастных изменений доминируют инволюционные процессы в репродуктивной системе, связанные с выключением овариальной функции. В настоящее время ведущим методом коррекции климактерического синдрома признается заместительная гормональная терапия, но не все женщины с патологическим течением климакса могут и хотят принимать гормональные препараты. Альтернативный метод купирования менопаузальных расстройств состоит в назначении фито-эстрогенов, что облегчает приливы жара и улучшает общее самочувствие женщин. Однако фитоэстрогены не способны полностью удовлетворить все потребности организма по предотвращению болезней старения, поэтому привлекательно выглядят комплексные препараты, в состав которых вводятся антиоксиданты (например, ресвератрол), полезные для сердечно-сосудистой системы, витамины, предотвращающие развитие остеопороза (витамины D и К). Применение подобных препаратов должно способствовать не только улучшению качества жизни женщин, но и снижению риска кардиометаболических заболеваний и остеопороза. Ключевые слова: менопауза, приливы жара, качество жизни, остеопороз, фитоэстрогены, генистеин, ресвератрол, витамин D.
Phytoestrogens in treatment of menopausal disorders
I.V.Kuznetsova
Summary
In perimenopusal period for which general age-related changes are typical, involutive processes prevail in reproductive system which are related to ovarian deprivation. Currently, the leading method for management of menopausal syndrome is hormonal replacement therapy, but not all women with pathological climax period can and would like to take hormonal products. The alternative method for management of menopausal disorders is to prescribe phytoestrogens which relieves hot flashes and improves general health status in women. But phytoestrogens are not able to meet all body needs in prevention of age-related diseases, therefore complex drug products which contain antioxidants are attractive (for exampleр, resveratrol), useful for cardiovascular disease, vitamins which prevent osteoporosis (vitamins D and К). The use of such drugs should also improve quality of life in women, but reduce risk of cardio-metabolic diseases and osteoporosis. Key words: menopause, hot flashes, quality of life, osteoporosis, phytoestrogens, henistein, resveratrol, vitamin D.
Сведения об авторе
Кузнецова Ирина Всеволодовна – д-р мед. наук, проф., гл. науч. сотр. НИО женского здоровья НОКЦ ГБОУ ВПО Первый МГМУ им. И.М.Сеченова
Начиная с 35, а по некоторым биологическим показателям с 30 лет, в организме инициируется процесс старения – прогрессирующее, необратимое угнетение биологических функций, сопровождающееся снижением фертильности и увеличением смертности. Причиной угасания репродуктивной и менструальной функции в контексте старения становится истощение фолликулярного аппарата яичников и снижение в них гормонального биосинтеза.
Климактерий – физиологический период жизни женщины, в течение которого на фоне возрастных изменений доминируют инволюционные процессы в репродуктивной системе. Несовершенная адаптация организма к физиологическому выключению функции яичников в период менопаузального перехода приводит к развитию климактерического синдрома у 35–80% женщин, который выражается комплексом симптомов нервно-психического, вегетососудистого и обменно-трофического характера [1]. Наиболее типичными представителями климактерического симптомокомплекса являются приливы жара, хотя по частоте возникновения они уступают другим вазомоторным и психовегетативным жалобам. В порядке убывания частоты эти жалобы располагаются следующим образом: раздражительность, вялость, утомляемость, депрессия, головные боли, приливы жара, нарушение памяти, прибавка массы тела, бессонница, суставные боли, сердцебиение, истерические припадки, дизурия, снижение либидо. Примерно у 10% женщин тяжелые и среднетяжелые симптомы климактерического синдрома сохраняются свыше 15 лет после наступления менопаузы. По времени возникновения климактерические (менопаузальные) расстройства делят на ранние, средневременные и поздние симптомы. К ранним проявлениям климактерического синдрома относят эмоционально-психические (раздражительность, сонливость, слабость, беспокойство, депрессия, забывчивость, невнимательность, снижение либидо) и вазомоторные (приливы жара, ознобы, потливость, головные боли, гипотония, гипертония, нарушения сердечного ритма) жалобы. Средневременные симптомы включают проблемы с кожей и ее придатками (сухость, ломкость ногтей, морщины, сухость и выпадение волос), а также урогенитальные расстройства (сухость влагалища, диспареуния, зуд и жжение, уретральный синдром, цисталгия, недержание мочи). Наконец, поздние менопаузальные нарушения представлены повышенным риском кардиоваскулярной патологии, остеопорозом и болезнью Альцгеймера [2]: у женщин в постменопаузе частота ишемической болезни сердца повышается в 3 раза, инсульта в 7 раз, а частота постменопаузального остеопороза составляет 85% всех случаев первичного остеопороза.
Одной из составляющих современной стратегии лечения климактерического синдрома является эффективная коррекция ранних климактерических расстройств (эмоционально-психических и вазомоторных), развивающихся в течение менопаузального перехода и первых лет менопаузы, и одновременно предотвращение метаболических нарушений, ведущих к поздним осложнениям климактерического периода – остеопорозу и атеросклерозу.
В настоящее время ведущим методом коррекции климактерического синдрома признана заместительная гормональная терапия (ЗГТ), применение которой уменьшает выраженность вазомоторных и депрессивно-тревожных расстройств, снижает риск развития остеопороза, ишемической болезни сердца и других болезней, ассоциированных со старением. Вместе с тем существуют риски, связанные с ее использованием, такие как тромбоэмболические осложнения и рак молочной железы [3]. Страх развития рака, не всегда оправданный, является основной причиной отказа женщин от ЗГТ.
При наличии противопоказаний к ЗГТ или категорическом отказе женщины от приема гормональных препаратов для коррекции климактерического синдрома могут применяться средства растительного происхождения и биологически активные добавки (БАД), оказывающие положительный терапевтический эффект при отсутствии свойственных гормональной терапии рисков [4, 5].
На протяжении столетий растительные экстракты используются для лечения женских заболеваний, в том числе уменьшения жалоб, ассоциированных с менструальным циклом, обеспечения нормального течения беременности и рождения здорового ребенка, облегчения симптомов климакса. Женщины старшего возраста особенно активно стали применять БАД на протяжении двух последних десятилетий [6], и удовлетворенность эффектом такой терапии достигает 60–70%.
Основными действующими веществами растительных препаратов и БАД, применяемых в климактерическом периоде, являются фитоэстрогены, по структуре близкие к эндогенным эстрогенам и представляющие собой нестероидные вещества класса полифенольных соединений. Эпидемиологические данные свидетельствуют о значительной разнице частоты приливов жара в популяциях с высоким и низким потреблением фитоэстрогенов. Так, в Японии, где уровень потребления фитоэстрогенов составляет 20–150 мг/сут, приливы жара отмечают только 5–10% женщин по сравнению с 70–80% женщин Европы, где содержание фитоэстрогенов в суточном рационе не превышает 5 мг. Кроме того, в Японии значительно меньше распространены сердечно-сосудистые заболевания (ССЗ) и остеопороз.
Рандомизированные плацебо-контролируемые исследования эффективности фитоэстрогенов дают противоречивые результаты [7, 8]. В большинстве из них сообщается об облегчении приливов жара после добавления в пищу фитоэстрогенов, но статистическая разница по сравнению с плацебо достигается редко. По другим данным, фитоэстрогены в виде БАД способны снизить выраженность и количество проявлений климактерического синдрома, в том числе приливы жара, нарушения сна, головные боли, ночную потливость [9], причем существует сильная негативная корреляция уровня экскреции изофлавонов с мочой и частотой приливов жара. В то же время метаанализ исследований эффективности изофлавонов красного клевера не выявил достоверного снижения частоты приливов жара на фоне лечения, аналогичный анализ эффективности изофлавонов сои дал противоречивые результаты.
Данные о положительном влиянии фитоэстрогенов на уровень липопротеидов, функцию эндотелия и артериальное давление [10] предполагают возможность их использования в качестве средства первичной и вторичной профилактики ССЗ. В США Управление по контролю пищевых продуктов и лекарств в США (FDA) одобрило применение пищевых продуктов и пищевых субстанций с высоким содержанием соевого белка для снижения риска ССЗ.
Несмотря на разноречивые свидетельства наблюдательных и рандомизированных контролируемых исследований, международные эксперты в настоящее время полагают, что «фитоэстрогены в больших количествах, особенно в соевых продуктах, снижают частоту заболеваний сердечно-сосудистой системы, рака молочной железы и матки, а также уменьшают выраженность климактерических симптомов по сравнению с женщинами, находящимися на стандартной диете» [11]. В Европе и Северной Америке в профилактических целях использование фитоэстрогенов приветствуется гинекологами при нерезко выраженных климактерических жалобах или здоровыми женщинами [12].
К фитоэстрогенам относятся следующие классы химических соединений: флавоны, изофлавоны (генистеин, дайдзеин, биоханин, формононетин), лигнаны (энтеролактон, энтеродиол), куместаны (куместрол). Изофлавоны в большом количестве содержатся в соевых бобах, горохе, других бобовых культурах, клевере, лигнаны обнаруживаются в масличных семенах (например, семенах льна), отрубях, цельных зернах, овощах, бобовых и фруктах, куместаны содержатся в клевере и люцерне. Наиболее близки по структуре и оказываемому действию к эстрогенам изофлавоны, особенно генистеин и дайдзеин [13].
Изофлавоны присутствуют в растениях, в основном в виде гликозидов – соединений с сахарами. В нативной форме фитоэстрогены не обладают биологическим действием, но после орального приема в кишечнике под действием микрофлоры гликозиды гидролизируются и распадаются на сахаристую часть и несахаристый компонент, так называемый агликон, проявляющий эстрогенную активность [14]. Будучи намного слабее натурального эстрадиола, изофлавоны в некоторых тканях вызывают проэстрогенный ответ, в других подавляют эстрогенные эффекты. Отчасти это объясняется разным сродством к двум подтипам рецепторов эстрогенов (РЭ). Если аффинность эстрадиола к РЭ принять за 100%, то аффинность генистеина к РЭ-a составит 5%, к РЭ-b 36%, то есть в отношении РЭ-b гинестеин проявляет активность, сравнимую с активностью эстрона. Исходя из этого, становится понятным, почему фитоэстрогены безопасны с точки зрения избыточной пролиферации и не требуют прогестагенного прикрытия: низкое сродство к РЭ-a не позволяет фитоэстрогенам осуществить ростовые функции.
Кроме того, фитоэстрогены стимулируют в печени продукцию половые стероиды связывающего глобулина, что приводит к снижению биологической доступности не только эстрогенов, но и андрогенов, чей относительный избыток в постменопаузе неблагоприятен с позиций кардиометаболического риска. Наконец, связываясь с РЭ, фитоэстрогены блокируют взаимодействие с рецептором эндогенного эстрадиола, поэтому, будучи намного слабее эстрадиола, фитоэстрогены оказывают антиэстрогенное или эстрогенное действие в условиях, соответственно, высокой или низкой эстрогенной насыщенности (см. рисунок), и это позволяет относить их к разряду природных селективных модуляторов РЭ [15].
Действие фитоэстрогенов в условиях избыточного (а) и недостаточного (б) количества эндогенных эстрогенов.
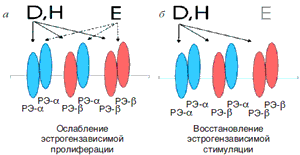
Примечание: D – дайдзеин, H – генистеин, E – эстрадиол.
Из-за такого селективного эстрогенного/антиэстрогенного действия в зависимости от условий эстрогенной насыщенности изофлавоны не только не оказывают пролиферативного действия, но также обладают протективным эффектом в отношении эстрогензависимой, в том числе злокачественной, клеточной пролиферации. Ингибирующее влияние фитоэстрогенов на ангиогенез также является основанием для предположения их противоопухолевой активности. Антиэстрогенное действие изофлавонов в условиях высокой эстрогенной насыщенности подтверждается в эксперименте: экстракты соевых бобов влияют на внутриутробное развитие самок крыс, уменьшая массу матки и яичников.
Механизм действия фитоэстрогенов на вазомоторную симптоматику климактерического синдрома до конца не ясен, наиболее вероятным объяснением является их воздействие на РЭ структур головного мозга. Эффективность в отношении приливов достигается при использовании суточной дозы изофлавонов – 60 мг.
Доклинические и клинические исследования продемонстрировали улучшение липидного профиля плазмы на фоне приема фитоэстрогенов, а также подавление процесса окисления липопротеидов низкой плотности. Редукция уровня холестерола происходит при использовании 30–40 мг изофлавонов в сутки. Было также показано, что изофлавоны нормализуют реактивность сосудистой ткани у приматов с дефицитом эстрогенов. В экспериментальных исследованиях активность фитоэстрогенов в отношении РЭ-b позволила подавить пролиферацию и миграцию гладкомышечных клеток сосудов сопоставимо с эффектом 17b-эстрадиола. Продемонстрировано уменьшение ригидности артериальной стенки при лечении изофлавонами женщин в постменопаузальном периоде. В экспериментальных работах на коронарных артериях генистеин и дайдзеин проявили свойства антагонистов кальция. Помимо положительного действия на климактерические симптомы и сосудистую стенку фитоэстрогены имеют благоприятный эффект на минеральную плотность костной ткани.
Несмотря на то что исследования по долговременному отслеживанию вероятных побочных реакций приема растительных препаратов проводятся редко [16], токсических эффектов не наблюдалось и фитотерапия считается относительно безопасным методом лечения. Однако исследования долговременного влияния фитоэстрогенов на эндометрий продемонстрировали, что пятилетнее использование изофлавонов сои приводит к достоверному увеличению частоты гиперплазии эндометрия по сравнению с плацебо [17]. Такой исход свойственен приему обогащенных пищевых продуктов, в которых сложно учесть количество вводимых в организм фитоэстрогенов. Следовательно, более безопасным вариантом является применение не обогащенных продуктов, а готовых лекарственных форм и БАД, в которых количество фитоэстрогенов строго регламентировано, либо синтетических препаратов.
Исходя из имеющихся на сегодняшний день сведений, можно заключить, что одним из наиболее привлекательных методов негормональной терапии климактерических расстройств с точки зрения изученности положительных и отсутствия негативных эффектов является терапия, основанная на применении растительных экстрактов или синтетических препаратов, содержащих изофлавоны (гинестеин, дайдзеин).
Среди препаратов, содержащих изофлавоны, представлен Менорил, в состав которого входит генистеин (30 мг в одной капсуле с режимом дозирования 1–2 раза в день). К преимуществам Менорила можно отнести то, что он производится не из растительного сырья, не является соевым продуктом, следовательно, не может содержать генно-модифицированные вещества и аллергены, пестициды и гербициды. Агликолевая форма генистеина не требует метаболизма в кишечнике, следовательно, эффект Менорила не зависит от качественного и количественного состава микробиоты кишечника и является предсказуемым.
Очевидно, что только фитоэстрогены не способны полностью удовлетворить все направления лечения симптомов, ассоциированных с менопаузой и старением, поэтому при выборе метода негормональной коррекции возрастных проблем встает вопрос о назначении комплекса препаратов или комплексного препарата, составные части которого дополняют друг друга.
Выраженное антистрессовое действие в отношении многих органов и функциональных систем оказывают антиоксиданты. В ряду антиоксидантов заслуженным вниманием пользуется ресвератрол, фитоалексин – растительный антибиотик, который в природе синтезируется некоторыми растениями [18]. Впервые реcвератрол был выделен в 1940 г. из чемерицы белой, но впоследствии список растений – источников ресвератрола пополнился арахисом, ягодами шелковицы и проросшими бобами, кожурой и семенами красного винограда. Именно из-за этого ингредиента виноградное красное вино обладает терапевтическим эффектом на сердечно-сосудистую систему. Благодаря ресвератролу миру известен так называемый французский парадокс: несмотря на обилие углеводов и красного мяса в диете французов, Франция занимает одно из последних мест по смертности от ССЗ.
Ресвератрол является одним из самых мощных природных антиоксидантов, превосходя по своему действию b-каротин в 5, витамин Е в 50, витамин С в 20, коэнзим Q10 в 17раз. Ресвератрол увеличивает продолжительность жизни клеток в экспериментальных моделях старения, замедляет процессы фотостарения кожи, уменьшает разрушение коллагена, что способствует повышению тонуса и эластичности кожи, уменьшению выраженности морщин. Ресвератрол обладает антипролиферативным действием на гиперпластические процессы, препятствует окислению липо-протеидов низкой плотности, укрепляет костную ткань, обладает нейропротективным, антивоспалительным, антиатерогенным эффектом [19]. На фоне снижения синтеза эстрогенов при менопаузе ресвератрол выступает как фитоэстроген, защищая прежде всего сердечно-сосудистую систему. Как фитоэстроген ресвератрол уступает по активности генистеину, но компенсирует этот недостаток своими антиоксидантными свойствами.
Несмотря на то что фитоэстрогены обладают положительным влиянием на минеральную плотность кости, их профилактический эффект в отношении остеопоретических переломов невелик. Усилить этот эффект возможно введением дополнительных средств, улучшающих костный метаболизм, и прежде всего витамина D. Витамин D необходим для функционирования паращитовидных желез, кишечника, почек, костной системы, играет важную роль в абсорбции кальция и фосфатов в кишечнике, транспорте минеральных солей и процессе кальцификации костей, регулирует выведение кальция и фосфатов почками. Витамин D3 – естественная форма витамина D, которая образуется у животных и людей. Контролируемые клинические испытания установили, что у лиц пожилого возраста адекватное суточное потребление кальция и витамина D позволяет уменьшить потерю костной ткани и снижает риск переломов позвоночника и проксимального отдела бедра. Прием витамина D снижает частоту падений и переломов на 15–20%, если сопровождается повышением уровня 25-гид-роксивитамина D (25(OH)D) до 60 нмоль/л и более, что обычно достижимо при использовании 400 МЕ витамина D в пременопаузе и 800 МЕ женщинами старше 50 лет.
К группам особо высокого риска по дефициту витамина D относятся лица, не бывающие на солнце, имеющие темную кожу, регулярно пользующиеся солнцезащитными средствами, больные ожирением и синдромом мальабсорбции. При наличии факторов риска у женщин старше 50 лет целесообразно определение 25(ОН)D в крови для уточнения необходимой дозы [20].
Дополнительную роль в формировании и восстановлении костной ткани играет витамин К, обеспечивающий синтез остеокальцина – белка костной ткани, на котором кристаллизируется кальций. В организм витамин К поступает в основном с пищей (преимущественно растительной), частично образуется микроорганизмами кишечника, является жирорастворимым витамином, вследствие чего требует для оптимального всасывания присутствие жиров в пище.
Наконец, для сохранения минеральной плотности кости необходимо достаточное поступление кальция. Если состав пищевых продуктов не удовлетворяет суточную потребность организма в кальции, рекомендуется его дополнительный прием в виде самостоятельного препарата или в составе комплексных средств. Рекомендуемое суточное потребление кальция для женщин старше 50 лет составляет 1200–1500 мг.
Одно из важных направлений сохранения женского здоровья – профилактика кардиоваскулярной патологии – также требует восполнения дефицита кальция и витамина D, который в настоящее время рассматривается как средство снижения уровня смертности вследствие ССЗ. Действительно, смертность вследствие ССЗ снижается на 58% при уровне витамина D в сыворотке крови выше 40 нг/мл по сравнению с уровнем менее 10 нг/мл [21]. Среднее систолическое и диастолическое артериальное давление снижается на 3 и 1,6 мм рт. ст. соответственно при уровне 25(OH)D в сыворотке крови ≥85,7 нмоль/л по сравнению с 40 нмоль/л и менее [22]. Относительный риск артериальной гипертензии составляет 2,67 для женщин при показателях 25(OH)D в плазме менее 15 нг/мл по сравнению с уровнем более 30 нг/мл [23].
Выбирая фитопрепарат или БАД для лечения климактерических симптомов, следует руководствоваться не только сиюминутными целями улучшения самочувствия, но и долгосрочными перспективами сохранения здоровья и проведения профилактики ССЗ и остеопороза. В связи с этим комплексные препараты, содержащие фитоэстрогены, витамины и другие биологически активные субстанции, имеют преимущества по сравнению с монопрепаратами фитоэстрогенов.
Один из таких комплексных препаратов (БАД) Менорил плюс содержит в одной капсуле: генистеин 15 мг, ресвератрол 15 мг, витамины D и К по 0,01 мг (рекомендованный режим дозирования 2 капсулы в день). Менорил плюс имеет эстрогеноподобное действие, обусловленное генистеином и ресвератролом, мощное антиоксидантное действие (ресвератрол) с позитивным влиянием на кожу, сердечно-сосудистую систему (ресвератрол, витамин D), дополнительный протективный эффект в отношении костной ткани (витамины D и К). При приеме препарата не требуется дополнительного потребления витаминов D и К, поскольку в двух капсулах содержится рекомендуемая суточная дозировка (при возрасте женщины до 50 лет).
Таким образом, планируя профилактику и коррекцию менопаузальных расстройств, следует думать о многоплановом и безопасном воздействии на организм, направленном не только на уменьшение вегетативных жалоб, но и на все составляющие процесса старения. Фитотерапия часто позволяет добиться такого многопланового воздействия при правильном подборе ее компонентов. Безусловно, ресурс травяных экстрактов в профилактике и лечении заболеваний/состояний, ассоциированных со старением, далеко не исчерпан, и дальнейшие исследования должны привести к созданию алгоритмов и схем их назначения, максимально учитывающих индивидуальные потребности пациента.
ЛИТЕРАТУРА
1. Genazzani AR, Gambacciani M, Simoncini T. Menopause and aging, quality of life and sexuality. IMS Statement following 6th IMS Workshop, Pisa, December 2006. Climacteric 2007; 10: 88–96.
2. Сметник В.П., Ильина Л.М. Роль половых гормонов в развитии метаболических расстройств у женщин в пери- и ранней постменопаузе. Климактерий. 2009; 1: 8–13.
3. Naftolin F, Schneider HP, Sturdee DW et al. Executive Committee of the International Menopause Society. Guidelines for hormone treatment of women in the menopausal transition and beyond. Climacteric 2004; 7: 333–7.
4. Cronenberg F, Fugh-Berman A. Complementary and alternative medicine for menopausal symptoms: a review of randomized, controlled trials. Ann Intern Med 2002; 137: 805–13.
5. Wuttke W, Jarry H, Westphalen S et al. Phytoestrogens for hormone replacement therapy? J Steroid Bichem Mol Biol 2002; 83: 133–47.
6. Albertazzi P, Steel SA, Clifford E et al. Attitudes towards and use of dietary supplementation in a sample of postmenopausal women. Climacteric 2002; 5: 374–82.
7. Krebs EE, Ensrud KE, MacDonald R et al. Phytoestrogens for treatment of menopausal symptoms: a systematic review. Obstet Gynecol 2004; 104: 824–36.
8. Geller SE, Studee L. Botanical and dietary supplements for menopausal symptoms: what works, what does not. J Womens Health (Larchmt) 2005; 14: 634–49.
9. Philp HA. Hot flashes a review of the literature on alternative and complementary treatment approaches. Alter Med Rev 2003; 8: 284–302.
10. Blumenthal M. Herbal Medicine: Expanded Commision E Monographs. Newton, MA: Integrative Medicine Communications, 2003.
11. Здоровье женщин и менопауза. Пер. с англ. М.: ГЭОТАР-МЕД, 2004.
12. Genazzani A.R. Non hormonal treatment of hot flushes. Congr book 7th Congr Eur Soc Gynecol, Paris 2007; p. 49.
13. Carrati B, Sanzini E. Biologically-active phytochemicals in vegetable food. Ann Ist Super Sanita 2005; 41: 7–16.
14. Munro IC, Harwood M, Hlywka JJ et al. Soy isoflavons: a safety review. Nutr Rev 2003; 61: 1–33.
15. Ohmichi M, Tasaka K et al. Molecular mechanism of action of Selective Estrogen Receptor Modulator in target tissues. J Endocr 2005; 52 (2): 161–7.
16. Roemheld-Hamm B. Chastberry. Am Fam Physician 2005; 72: 821–4.
17. Unfer V, Casini ML, Costabile L et al. Endometrial effects of long-term treatment with phytoestrogens: a randomized, double-blind, placebo-controlled study. Fertil Steril 2004; 82: 145–8.
18. Pervaiz S. Resveratrol: from grapevines to mammalian biology. FASEB J 2003; 17: 1975–85.
19. Belleri M, Ribatti D, Savio M et al. αvβ3 Integrin-dependent antiagiogenic activity of resveratrol stereoisomers. Mol Cancer Ther 2008; 7: 3761–70.
20. Dawson-Huges B. Vitamin D, calcium and bone – what`s the latest? Osteoporosis Int 2011; 22 (5): S684–S685.
21. Ginde AA, Scragg R, Schwartz RS, Camargo CA. Prospective study of serum 25-hydroxyvitamin D level, cardiovascular disease mortality, and all cause mortality in older U.S. adults. J Am Geriatr Soc 2009; 57 (9): 1595–603.
22. Scragg R, Sowers M, Bell C. Serum 25-hydroxyvitamin D, ethnicity, and blood pressure in the Third National Health and Nutrition Examination Survey. Am J Hypertens 2007; 20 (7): 713–9.
23. Forman JP, Bischoff-Ferrari HA, Willett WC et al. Vitamin D intake and risk of incident hypertension: results from three large prospective cohort studies. Hypertension 2005; 46 (4): 676–2.
