Превосходство агомелатина (25 и 50 мг) по показателям половой переносимости в сравнении с пароксетином (20 мг) у здоровых добровольцев мужского пола. 8-недельное, плацебо-контролируемое исследование с применением шкалы PRSEXDQ-SALSEX
Статьи Better sexual acceptability of agomelatine (25 and 50 mg) compared with paroxetine (20 mg) in healthy male volunteers. An 8-week, placebo-controlled study using the PRSEXDQ-SALSEX scale
Montejo A, Prieto N, Terleira A, Matias J, Alonso S, Paniagua G, Naval S, Parra D, Gabriel C, Mocaer E, Portoles A.
J Psychopharmacol 2009;24(1):111-120
Резюме
Половая дисфункция (ПД) является типичным и игнорируемым побочным эффектом антидепрессантов. Здоровые добровольцы представляются наиболее адекватной группой для изучения этого нежелательного явления, позволяющей исключить влияние самой депрессии. Исследована половая переносимость агомелатина (мелатонинергический агонист и 5HT2C антагонист), пароксетина и плацебо с применением Вопросник для оценки связанных с психотропными средствами половой дисфункции Salamanca (PRSEXDQ-SALSEX; Psychotropic-Related Sexual Дисфункция Salamanca Sex Questionnaire). 92 здоровых добровольца мужского пола было рандомизировано для терапии агомелатином (25 или 50 мг), пароксетином 20 мг или плацебо в течение 8 недель. ПД, определяемая как минимум одно нарушение половой функции по одному из следующих пунктов PRSEXDQ-SALSEX (снижение либидо, задержка оргазма/эякуляции, аноргазмия/отсутствие эякуляции и эректильная дисфункция), оценивалась исходно, затем через 2, 4 и 8 недель. При финальной послестартовой оценке ПД была достоверно ниже в каждой группе агомелатина (22.7% на дозе 25 мг и 4.8% на дозе 50 мг), чем в группе пароксетина (85.7%; p < 0.0001). В группе плацебо ПЛ отмечали 8.7% добровольцев. Процент добровольцев с умеренной или тяжелой ПД составил 4.5% для агомелатина 25 мг, 4.8% для агомелатина 50 мг, 61.9% для пароксетина 20 мг и 0% в группе плацебо (p < 0.0001 агомелатин в сравнении с пароксетином). Установлено, что у здоровых добровольцев мужского пола риск развития ПД при терапии агомелатином значительно ниже, чем при использовании пароксетина, что подтверждает более благоприятный профиль половой переносимости агомелатина в сравнении с СИОЗС.
Ключевые слова: агомелатин; антидепрессант; PRSexDQ; шкалы; половая дисфункция; СИОЗС
Введение
Большинство используемых в современной практике антидепрессантов вызывает половую дисфункцию (ПД) у мужчин и женщин (Rosen et al., 1999; Montejo et al., 2001; Clayton et al., 2002; Delgado, etai, 2005; Kennedy et al., 2006; Clayton et al., 2007) и влияет на все фазы половой активности, включая снижение влечения, возбуждения, оргазма и эякуляции. Такие побочные эффекты негативно влияют на качество жизни пациента, могут приводить к нарушению комплаентности и часто препятствуют выздоровлению от депрессивного эпизода (Roose, 1999; Rothschild, 2000; Zajecka, 2000; Montejo et al., 2001).
Частота ПД значительно зависит от используемого антидепрессанта (Clayton и Montejo, 2006). Более высоккая частота ПД (от 50 до 70%) выявляется при назначении антидепрессантов с выраженными свойствами блокаторов обратного захвата 5-HT, таких как селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы моноаминоксидазы (ИМАО), трициклические антидепрессанты и ИОЗСН. Препараты, усиливающие обратный захват преимущественно норадреналина и дофамина, а также блокаторы 5-HT2 рецепторов, напротив, не оказывают выраженного неблагоприятного влияния на половую функцию (Clayton et al., 2002; Montejo et al., 1999).
Агомелатин является антидепрессантом со свойствами мелатонинергического агониста и 5-HT2c антагониста с подтвержденной эффективностью (Loo et al., 2002; Kennedy и Emsley, 2006; Olie и Rasper, 2007), как минимум сопоставимый с доступными сегодня антидепрессантами в терапии пациентов с большим депрессивным расстройством (БДР) (Lemoine et al., 2007; Kasper et al., 2008; Kennedy et al., 2008). В ходе всей программы развития не зафиксировано никаких признаков неблагоприятного влияния агомелатина на половую функцию. Частота связанных с терапией половых нежелательных явлений была низкой и одинаковой у пациентов, получавших терапию агомелатином и плацебо. В исследованиях эффективности при кратковременной терапии использовались шкалы для оценки половой функции (ASEX, SexFX), измерения по которым подтвердили хорошую половую переносимость терапии у пациентов, принимавших агомелатин (Kennedy, 2005).
Однако как в случае агомелатина, так и при изучении других антидепрессантов, в большинстве исследований, предусматривавших оценку влияния антидепрессанта на половую функцию, участвовали пациенты, страдающие депрессией, т.е. состоянием, при котором терапевтический эффект препаратов на настроение может частично маскировать сопутствующие негативные эффекты на половую функцию, связанные с фармакологическим действием. Однако, депрессия также может быть причиной развития нарушений половой функции еще до назначения антидепрессант, что значительно затрудняет дифференциацию ПД, связанных с антидепрессантами, если не отбирать для оценки только пациентов без ПД доя терапии. Waldinger et al. (1994) выполнили аккуратные измерения задержки эякуляции на фоне терапии СИОЗС и другие антидепрессанты у мужчин без депрессии, страдавших на протяжении жизни преждевременной эякуляцией. Авторы измеряли время интравагинальной латентности эякуляции (IELT) с помощью секундомера и установили, что СИОЗС, преимущественно пароксетин, вызывает выраженную задержку эякуляции (Waldinger et al., 2004). Нафазодон и миртазапин, напротив, не вызывали задержки эякуляции (Waldinger et al., 2001a, 2003), поскольку являются антагонистами 5-ИТ2С рецепторов. На сегодня выполнены лишь единичные исследования эффектов терапии антидепрессантами у людей, не страдающих депрессивными симптомами (Kennedy et al., 1996; Nafziger et al., 1999). В то же время очевидна потребность в дальнейших исследованиях с участием мужчин и женщин без депрессии для получения достоверных данных по половым побочным эффектам, обусловленным этими препаратами. Соответственно настоящее двойное-слепое сравнительное плацебо-контролируемое исследование было направлено на 1) оценку половой переносимости агомелатина (дозы 25 и 50 мг) в сравнении с пароксетином (20 мг) при терапии в течение 8 недель у здоровых добровольцев мужского пола, с применением плацебо для определения чувствительности оценок (в сравнении с пароксетином) и 2) подтверждения того, что агомелатин не вызывает гормональных изменений, и получения данных по безопасности. В отличие от исследований, выполненных Waldinger et al. (1997), в данном исследовании не предусматривалось оценивать эффекты агомелатина на преждевременную эякуляцию.
В целях данного исследования использовались валидизированные инструменты: Вопросник для оценки связанных с психотропными средствами половой дисфункции Salamanca (PRSEXDQ-SALSEX; Psychotropic-Related Sexual Disfunction Salamanca Sex Questionnaire) (Montejo et al., 2000, 2008) и Международный индекс эректильной дисфункции (IIEF; International Index of Erectile Function) (Rosen et al., 1997). Чувствительность исследования оценивалась с помощью группы плацебо, в качестве препарата сравнения использовался СИОЗС пароксетин (20 мг), антидепрессант с хорошо известным негативным влиянием на половую функцию у пациентов с депрессией (Montejo et al., 1996, 2001; Rosen et al., 1999).
Методы
Данное исследование фазы I проводилось как рандомизированное, двойное-слепое, с 4-мя параллельными группами (агомелатин 25 и 50 мг, пароксетин 20 мг и плацебо) исследование у здоровых добровольцев мужского пола в 2-х клинических центрах в Испании в соответствии с принципами Качественной клинической практики и Хельсинской декларации. Исследование было одобрено соответствующим местными Этическими комитетами. Все добровольцы дали свободное письменное информированное согласие до их включения в исследование.
Добровольцы
В исследование включались здоровые добровольцы мужского пола в возрасте 18 - 30 лет, не курящие или умеренно курящие (<10 сигарет в день) с индексом массы тела от 20.0 до 30.0, стабильными отношениями с партнером в течение минимум 6 месяцев и регулярной (минимум 1 раз в неделю) половой активностью. Для включения также требовалось 0 баллов по шкале PRSEXDQ-SALSEX (балл варьирует от 0 до 15, где 0 = отсутствие ПД, а 15 = максимальная ПД), суммарный балл IIEF > 60, а также < 7 баллов для тревоги и депрессии по Госпитальной шкале тревоги и депрессии (Hospital Anxiety Depression Scale). Условия включения также предусматривали негативный лекарственный скрининг (амфетамин, бензодиазепины, кокаин, опиаты, каннабис) и негативный дыхательный тест на алкоголь. Все седативные гипнотики, включая бензодиазепины, Золпидем или зопиклон должны были отменяться минимум за 14 дней до включения в исследование. Прием всех других психотропных средств, включая антидепрессанты и антипсихотики, прекращался минимум за 1 месяц до включения.
Критерием исключения была прогнозируемая потребность в применении препаратов, известных как индукторы или ингибиторы CYP 1A2, CYP 2C9 и 2C19 (флувоксамин, циметидин, флуоксетин, пароксетин, сертралин, фенитоин, барбитураты, рифампицин, лидокаин, фенацетин, мексилетин, кинолоны, флуконазол, флавоноиды, омепразол, лансопразол, панторазол), а также применение эти препаратов в пределах 1 месяца до включения. Также исключалась терапия лекарственными средствами, которые могут влиять на половые гормоны (гормональная терапия, дофаминергические агонисты и антагонисты, кодеин и опиоидные анальгетики), или препаратами, способными помешать половому акту (ß-блокаторы, гипотензивные, гипохолестеринемические и психотропные средства).
В ходе исследования не разрешалось никакой сопутствующей фармакотерапии, за исключением парацетамола (1 г/сут) при необходимости.
Терапия
В исследовании изучались две дозы агомелатина, 25 и 50 мг, в сравнении с пароксетином 20 мг (10 мг в течение первой недели терапии), а также плацебо, которое использовалось в качестве валидатора в рамках сравнения пароксетин-плацебо. В ходе исследования терапия назначалась 2 раза в сутки внутрь: 1 красная капсула (содержащая плацебо или пароксетин) утром во время завтрака и 1 желтая капсула вечером (в 20:00), содержащая плацебо или агомелатин 25 или 50 мг (т.т.,одну или две таблетки агомелатина 25 мг).
Для оценки комплаентности к фармакотерапии в ходе исследования измерялись концентрации агомелатина в слюне и моче методом HPLC MS/MS. Результаты всех анализов были переданы в базу данных до ее закрытия.
Все препараты исследования имели идентичный внешний вид (независимо от группы терапии и дозы) для гарантии слепого метода исследования. В ходе исследования не было ни одного случая вскрытия слепого метода терапии. Терапевтические коды были скрыты после закрытия базы данных исследования.
Дизайн исследования
Добровольцы сначала проходили 2-4-недельный период отбора, во время которого они не получали терапии, а затем рандомизировались в одну из четырех терапевтических групп: агомелатин 25 мг, агомелатин 50 мг, пароксетин 20 мг или плацебо. Рандомизационный список составлялся вслепую по схеме перестановки блоков (permuted-block) (т.е. не адаптивно) без стратификации. Завершенные перестановочные блоки отправлялись в каждый центр. На визите включения исследователь присваивал каждому добровольцу номер терапевтической единицы в хронологическом порядке включения в данном центре.
Визиты проводились при отборе и включении, затем еженедельно между Н1 и Н8 в периоде двойной-слепой терапии. Катамнестический визит проводился через 7 дней после завершения терапии.
Главным критерием переносимости была ПД по показателям шкалы PRSEXDQ-SALSEX (Montejo et al., 2000). Шкала PRSEXDQ-SALSEX состоит из 7 пунктов для оценки ПД. Первый пункт предназначен для скрининговой оценки с целью выявления любых ПД. Второй пункт оценивает, сообщал ли пациент самостоятельно о каких либо ПД своему врачу. Пункты 3 -7 оценивают пять категорий ПД в соответствии с тяжестью и частотой: утрата либидо (0 = нет, 1 = легкая, 2 = умеренная, 3 = тяжелая), задержка оргазма или эякуляции (0 = нет, 1 = легкая, 2 = умеренная, 3 = тяжелая), аноргазмия или отсутствие эякуляции (0 = никогда, 1 = иногда, 2 = часто, 3 = всегда), эректильная дисфункция у мужчин/дисфункция вагинальной любрикации у женщин (0 = никогда, 1 = иногда 2 = часто, 3 = всегда) и переносимость пациентом возникших ПД (0 = нет ПД, 1 = хорошая, 2 = умеренная, 3 = плохая). для расчета суммарного балла шкалы PRSEXDQ-SALSEX используются только пункты 3-7 (суммарный балл варьирует от 0 до 15). ПД определялась как минимум одно нарушение половой функции по одному из следующих четырех пунктов PRSEXDQ-SALSEX: снижение либидо (пункт 3), задержка оргазма/эякуляции (пункт 4), аноргазмия/отсутствие эякуляции (пункт 5) и эректильная дисфункция (пункт 6). Нарушением половой функции считалась оценка > 1 балла по пунктам 4, 5, 6 или >2 баллов по пункту 3.
Дополнительные критерии половой переносимости включали умеренную или тяжелую ПД, определяемую как минимум умеренное или тяжелое нарушение половой функции по одному из 3-6 пунктов шкалы PRSEXDQ-SALSEX, т.е. балл = 3 по пункту 3 или балл > 2 по пунктам 4, 5 или 6. Дополнительные критерии половой переносимости также включали следующие показатели: стойкая ПД, определяемая как дисфункция, которая возникает и персистирует до окончания исследования; дисфункция по каждому отдельному пункту шкалы PRSEXDQ-SALSEX и суммарному баллу шкалы PRSEXDQ-SALSEX (сумма баллов по пунктам 3, 4, 5, 6 и 7). Дополнительные критерии переносимости также включали суммарный балл 15-пунктово вопросника для самооценки IIEF (Rosen et al., 1997), предназначенного для измерения эректильной функции.
Главные и дополнительные критерии переносимости оценивались на визитах отбора, включения, Н2, Н4, Н8 и в случае преждевременного исключения.
Оценки безопасности включали регистрацию нежелательных явлений, измерения артериального давления и частоты сердечных сокращений на всех визитах. Для определения любой возможной связи между биологическими параметрами и ПД предусматривались измерения концентрации кортизола, пролактина и тестостерона (общий и свободный) в плазме на на визитах отбора, включения, Н2, Н4, Н8 и в случае преждевременного исключения. Биологические анализы выполнялись на визитах отбора и катамнеза. Для каждого нежелательного явления учитывалась временная связь с терапией (развитие нового явления или ухудшение имевшегося явления на фоне терапии исследования), интенсивность (т.е., легкая, умеренная, тяжелая), серьезность (серьезное или не серьезное) и причинная связь (связано или не связано с терапией).
Статистический анализ
Статистические анализы выполнялись с помощью программного пакета SAS® версии 8.2 (SAS INSTITUTE, SAS Institute Inc. 100 SAS Campus Drive Cary, NC 27513-2414 USA).
Процентные доли добровольцев с ПД сравнивались в группах обеих доз агомелатина и пароксетина (один тип ошибки 5%) по финальным послестартовым значениям с применением теста Cochran-Mantel-Haenszel (CMH) с поправкой на центр (главный анализ) и теста хи-квадрат (анализ чувствительности). Сравнения также выполнялись на каждом визите с применением теста CMH. Сходные анализы использовались для сравнения пароксетина и плацебо с целью определения чувствительности.
Сходные адаптированные анализы проводились для умеренной или тяжелой ПД, а также ПД по каждому отдельному пункту PRSEXDQ-SALSEX (по финальным послестартовым значениям и показателям на каждом визите) и стойких ПД (до окончания исследования). Сравнения выполнялись с применением теста CMH.
Более того, также было выполнено сравнение между каждой дозой агомелатина и плацебо по показателям ПД и стойкой ПД с применением скорректированного теста CMH. Проводилось сравнение агомелатина в каждой дозе с пароксетином и плацебо и сравнение пароксетина с плацебо по средним суммарным баллам PRSEXDQ-SALSEX на каждом визите и финальной послестартовой оценке, а также средним изменениям стартовых баллов IIEF на момент финальной послестартовой оценки с применением двустороннего теста Student.
Результаты
Всего в двух центрах в Испании было отобрано 94 добровольца, из них 92 были включены в исследование и рандомизированы в одну из 4-х терапевтических групп (по 23 добровольцы в группе). 88 добровольцев завершили исследование, 4 преждевременно выбыли из исследования (один доброволец в группе агомелатина 25 мг по причине низкой комплаентности, три добровольцы в группе пароксетина, включая один случай фаринготонзиллита, не связанного с препаратом исследования, и два случая выбывания по личным причинам). Демографические показатели рандомизированных добровольцем были одинаковыми во всех терапевтических группах, средний ± стандартное отклонение возраст составил 25.0 ± 3.5, 24.9 ± 2.4, 24.7 ± 2.3 и 23.8 ± 2.7 лет в группах агомелатина 25 и 50 мг, пароксетина и плацебо, соответственно. Стартовые показатели половой переносимости и гормональные профили также были сопоставимыми во всех терапевтических группах. Клинически значимых различий между группами по средней длительности терапии (54.9 ± 9.2 дней) не отмечалось. Комплаентность была очень высокой: у 90 из 92 добровольцев уровень комплаентности составил > 70%.
Половая переносимость
Половая переносимость анализировалась по данным выборки половой переносимости, которую сформировали все включенные добровольцы с оценкой ПД через минимум 2 недели, комплаентные к терапии (в соответствии с анализами образов слюны и мочи в терапевтических группах активных препаратов).Выборку составили 87 добровольцев (94.6% от включенных добровольцев). Пять добровольцев были исключены из этой выборки из-за отсутствия оценок ПД через 2 недели (2 добровольца в группе пароксетина и 1 в группе агомелатина 25 мг) или низкой комплаентности в соответствии с низким содержанием препарата в слюне (2 добровольца в группе агомелатина 50 мг). Процент добровольцев с ПД был достоверно ниже в обеих группах агомелатина в сравнении с группой пароксетина на каждом визите на каждом визите с Н2 до Н8 (Рисунок 1). Сходным образом, в соответствии с финальными послестартовыми измерения 5 из 22 добровольцев в группе агомелатина 25 мг (22.7%) и 1 из 21 добровольцев в группе агомелатина 50 мг (4.8%) против 18 из 21 добровольцев в группе пароксетина (85.7%) обнаруживали ПД в соответствии с показателями PRSEXDQ-SALSEX (p<0.0001 для каждого сравнения, скорректированный CMH тест). В сравнении с пароксетином скорректированный риск ПД на момент финальной оценки достоверно снижался на 74% в группе агомелатина 25 мг (RR = 0.26, 95% CI [0.12; 0.58]), и на 94% в группе агомелатина 50 мг (RR = 0.06, 95%CI [0.01; 0.38]). Более того, процент добровольцев с ПД на момент финальной оценки был достоверно выше в группе пароксетина, чем в группе плацебо (2 из 23 добровольцев, 8.7%) (p < 0.0001), что подтверждает чувствительность метода исследования. В сравнении с плацебо скорректированный риск ПД был достоверно выше на 9.4 (RR = 9.4, 95%CI [2.6 34.4]) при финальной послестартовой оценке. Все приведенные результаты были подтверждены нескорректированным анализом. Превосходство агомелатина также отмечалось на каждом визите, начиная с Н2, реализуясь в достоверном (скорректированной) снижении риска ПД на 85% на Н2, на 78% на Н4, и на 74% на Н8 для агомелатина 25 мг и на 92% на Н2 и на 94% на Н4 и Н8 для агомелатина 50 мг.
Статистически достоверные различия между каждой дозой агомелатина и группой плацебо сохранялись как при финальной послестартовой оценке, так и на каждом визите, начиная с Н2. Скорректированный относительный риск для агомелатина в сравнении с плацебо на момент финальной оценки составил 2.59 для агомелатина 25 мг (95% CI [0.52; 12.96]) и 0.54 для агомелатина 50 мг (95% CI [0.05; 5.44]).
Рисунок 1. Процент добровольцев с половой дисфункцией (ПД). Динамика показателей по визитам.
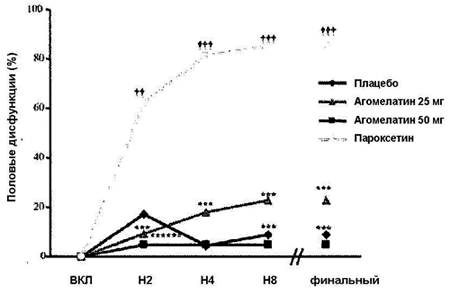
На каждом визите, начиная с Н2 и до Н8, у добровольцев, получавших пароксетин, отмечалось достоверно больше ПД, чем у добровольцев в группе плацебо. Напротив у добровольцев, получавших любую дозу агомелатина, выявлялось достоверно меньше ПД, чем у добровольцев в группе пароксетина. Тест CMH с поправкой на центр: ***p < 0.001 (агомелатин 25 или 50 мг в сравнении с пароксетином), †† p < 0.01; ††† p < 0.001 (пароксетин в сравнении с плацебо).
Умеренная или тяжелая ПД
Результаты сравнения процентных долей добровольцев с умеренными или тяжелыми ПД в группах каждой дозы агомелатина и пароксетина на каждом этапе измерения и при финальной послестартовой оценке приведены на Рисунке 2. На момент финальной оценки только у одного добровольца (4.5%) в группе агомелатина 25 мг и одного добровольца (4.8%) в группе агомелатина 50 мг отмечалась умеренная или тяжелая ПД. В группе пароксетина у 13 добровольцев (61.9%) выявлялась минимум одна умеренная или тяжелая дисфункция. При сравнении с пароксетином, скорректированный риск развития умеренной или тяжелой ПД на фоне терапии агомелатином достоверно редуцировался на 93% в группе агомелатина 25 мг на момент финальной оценки (RR = 0.07, 95% CI [0.01; 0.51], p < 0.0001) и на 92% в группе агомелатина 50 мг (RR = 0.08, 95% CI [0.01; 0.54], p = 0.0001). В группе плацебо не зафиксировано ни одного случая умеренной или тяжелой ПД (0/23). Частота умеренной или тяжелой ПД была достоверно выше при терапии пароксетином в сравнении с плацебо (p < 0.0001). Процентные доли добровольцев с умеренной или тяжелой ПД не обнаруживали значимых различий при сравнениях между каждой дозой агомелатин и плацебо. Сходные результаты были получены на каждом визите, начиная с Н2.
Стойкие ПД
В течение всего периода исследования ПД стойко сохранялись у 5-ти добровольцев (22.7%) в группе агомелатина 25 мг и одного добровольца (4.8%) в группе агомелатина 50 мг, тогда как в группе пароксетина у 17 добровольцев (81.0%) отмечались ПД на каждом следующем визите после первого. В сравнении с пароксетином скорректированный риск развития стойкой ПД при терапии агомелатином был достоверно ниже - на 72% при назначении дозы 25 мг (RR =0.28, 95% CI [0.12; 0.63], p = 0.0002) и на 94% при использовании дозы 50 мг (RR = 0.06, 95% CI [0.01; 0.40], p < 0.0001). За весь период исследования процент добровольцев со стойкими ПД в группе плацебо составил 4.3% (1/23). В сравнении с плацебо скорректированный риск развития стойкой ПД при терапии пароксетином достоверно повышался на 17.7 (p < 0.0001). Скорректированный относительный риск стойкой ПД при терапии агомелатином в сравнении с плацебо составил 5.17 для агомелатина 25 мг (95% CI [0.63; 42.66]) и 1.07 для агомелатина 50 мг (95% CI [0.07; 15.54]). В результате скорректированного CMH теста не обнаружено статистически достоверных различий при сравнении каждой дозы агомелатина с плацебо.
5-пунктовый суммарный балл шкалы PRSEXDQ-SALSEX
Средний ± стандартное отклонение суммарный балл (варьирует от 0 = отсутствие ПД до 15 = максимальная ПД) был достоверно ниже в обеих группах агомелатина в сравнении с пароксетином на каждом визите и на момент финальной оценки (0.9 ± 2.0 для агомелатина 25 мг, 0.2 ± 0.9 для агомелатина 50 мг, в сравнении с 5.2 ± 3.6 для пароксетина, p < 0.0001, двусторонний t-тест Student). 5-пунктовый суммарный балл шкалы PRSEXDQ-SALSEX в группе плацебо составил 0.5 ± 1.2 - значение, близкое к показателю в группе агомелатина. В группе пароксетина средний суммарный балл был достоверно выше, чем в группе плацебо (p < 0.0001 двусторонний t-тест Student) (Рисунок 3).
11 Рисунок 2. Процент добровольцев с умеренной или тяжелой половой дисфункцией (ПД). Динамика показателей по визитам.
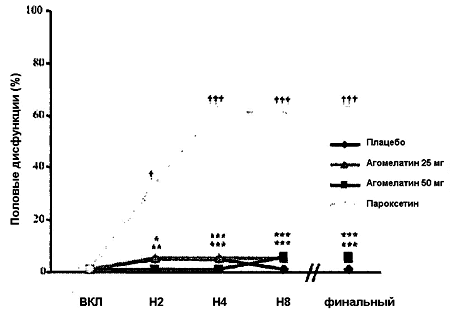
На каждом визите частота умеренной или тяжелой ПД у добровольцев в группе пароксетина была достоверно выше, чем у добровольцев, получавших плацебо. Напротив доли добровольцев с одной умеренной или тяжелой половой дисфункцией были одинаковыми в обеих группах агомелатина и группе плацебо. Скорректированный CMH тест: *p < 0.05; **p < 0.01; ***p < 0.001 (агомелатин 25 или 50 мг в сравнении с пароксетином) † p Рисунок 3. 5-пунктовы суммарный балл шкалы PRSEXDQ-SALSEX. Динамика показателей по визитам.
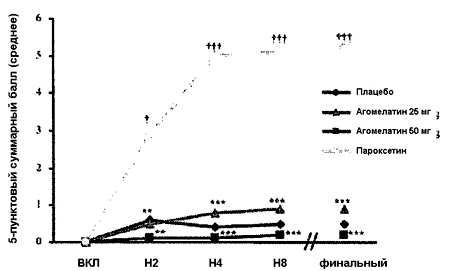
На каждом визите средний суммарный балл PRSEXDQ-SALSEX был достоверно выше в группе пароксетина в сравнении с плацебо. Напротив суммарный балл был ниже в обеих группах агомелатина в сравнении с пароксетином. Двусторонний t-тест Student: **p < 12 0.01; ***p < 0.001 (агомелатин 25 или 50 мг в сравнении с пароксетином), † p < 0.05; ††† p < 0.001 (пароксетин в сравнении с плацебо).
RSEXDQ-SALSEX: дисфункция по каждому отдельному пункту
Результаты финальных измерений по всем пунктам PRSEXDQ-SALSEX подтверждают статистически достоверное превосходство агомелатина в обеих дозах в сравнении с группой пароксетина, за исключением пункта «снижение либидо» для агомелатина в дозе 25 мг (Рисунок 4). Наибольшее различие в пользу агомелатина зафиксировано по пункту «задержка оргазма/эякуляции» - этот побочный эффект отмечался у 2 (9.1%) и 1 (4.8%) добровольцев в группах агомелатина 25 и 50 мг, соответственно, против 17 (81.0%) в группе пароксетина (p < 0.0001 для каждого сравнения, скорректированный CMH тест). Один случай данной дисфункции (4.3%) наблюдался в группе плацебо - показатель, близкий к группе агомелатина. В группе пароксетина при финальной оценке частота добровольцев с ПД по каждому пункту была статистически достоверно выше, чем в группе плацебо, за исключением эректильной дисфункции. Вопросник IIEF
При финальной послестартовой оценке средние изменения стартовых суммарных баллов IIEF приближались к нулю у добровольцев, получавших агомелатин (обе дозы) или плацебо, тогда как в группе пароксетина средний суммарный балл IIEF снизился на 7.8 ± 8.8. Различия между каждой дозой агомелатина и пароксетином, а также между пароксетином и плацебо были статистически достоверными (p = 0.002 и p < 0.001 в группах агомелатина 25 и 50 мг, соответственно, и p = 0.002 для сравнения между плацебо и пароксетином).
Рисунок 4. Половые дисфункции по каждому из пунктов PRSEXDQ-SALSEX: задержка оргазма/эякуляции (A), аноргазмия/отсутствие эякуляции (B), снижение либидо (C) и эректильная дисфункция (D).
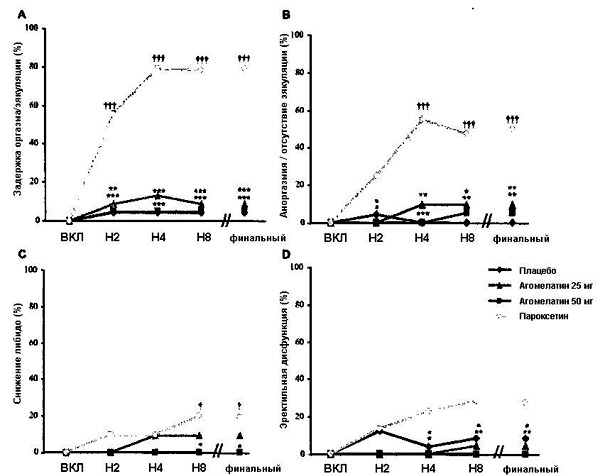
При финальной оценке частота дисфункций по всем пунктам PRSEXDQ-SALSEX была статистически достоверно ниже в обеих группах агомелатина, чем в группе пароксетина, за исключением пункта «снижение либидо» для агомелатина в дозе 25 мг. Наибольшее различие в пользу агомелатина зафиксировано по показателям дисфункции «задержка оргазма/эякуляции». В группе пароксетина частота половых дисфункций по всем пунктам шкалы была статистически достоверно выше, чем в группе плацебо, за исключением эректильной дисфункции. Скорректированный CMH тест: *p < 0.05; **p < 0.01; ***p < 0.001 (агомелатин 25 или 50 мг в сравнении с пароксетином) † p < 0.05; ††† p < 0.001 (пароксетин в сравнении с плацебо).
Безопасность
В выборке безопасности (N = 92), состоящей из всех включенных добровольцев, принявших минмум одну дозу терапии исследования, у 91.3% добровольцев в группе агомелатина 25 мг (21 из 23), 65.2% добровольцев в группе агомелатина 50 мг (15 из 23), 91.3% добровольцев в группе пароксетина (21 из 23) и 73.9% в группе плацебо (17 из 23) зафиксировано минимум одно нежелательное явление (Таблица 1). Отмена терапии потребовалась одному добровольцу в группе пароксетина по причине нежелательного явления (фаринготонзиллит), не связанного с приемом препарата.
Наиболее типичным из связанных с терапией нежелательных явлений в группе агомелатина была сонливость, которую испытывали 10 добровольцев (43.5%), получавших агомелатин 25 мг, 11 добровольцев (47.8%), получавших агомелатин 50 мг, в сравнении с 5 добровольцами (21.7%), получавшими пароксетин, и 6 добровольцами (26.1%) в группе плацебо. Добровольцы из группы пароксетина преимущественно отмечали половая расстройства, возникавшие чаще, чем в группах плацебо и агомелатина. На катамнестическом визите через 7 дней после завершения терапии не зафиксировано никаких нежелательных явлений со стороны половой функции, что свидетельствует о полном восстановлении половой функции у всех добровольцев.
Все нежелательные явления в группах агомелатина и группе плацебо были легкими или умеренными по интенсивности. В группе пароксетина у 5 добровольцев (21.7%) зафиксировано 7 тяжелых нежелательных явлений, все из которых, кроме одного, были связаны с ПД. Во всех терапевтических группах сонливость и ПД расценивались как связанные с терапией. В ходе исследования не было ни одного случая смерти и серьезного нежелательного явления.
Что касается гормональных профилей, то в ходе исследования ни в одной из терапевтических групп не было обнаружено клинически значимых изменений средних плазменных концентраций пролактина, общего кортизола, общего и свободного тестостерона в сравнении с группой плацебо.
Средние стартовые значения витальных показателей средний оставались стабильными на момент финальной оценки во всех терапевтических группах. Клинически значимых изменений в средних показателях биохимических и гематологических параметров также не отмечалось.
Таблица 1. Резюме основных результатов оценки нежелательных явлений
| Первичный SOC Предпочтительный термин3 |
Агомелатин 25 мг (N =23) |
Агомелатин 50 мг (N=23) |
Пароксетин (N=23) |
Плацебо (N= 23) |
|||||
| n | % | n | % | n | % | n | % | ||
| Добровольцы с минимум одним нежелательным явлением |
21 | 91.3 | 15 | 65.2 | 21 | 91.3 | 17 | 73.9 | |
| Добровольцы, преждевременно выбывшие из исследования по причине нежелательного явления |
- | - | - | - | 1 | 4.3 | - | - | |
| Добровольцы с серьезными нежелательными явлениями |
- | - | - | - | - | - | - | - | |
| Расстройства нервной системы | 13 | 56.5 | 11 | 47.8 | 9 | 39.1 | 10 | 43.5 | |
| Сонливость | 10 | 43.5 | 11 | 47.8 | 5 | 21.7 | 6 | 26.1 | |
| Головная боль | 5 | 21.7 | 1 | 4.3 | 1 | 4.3 | 4 | 17.4 | |
| Головокружение | 1 | 4.3 | 1 | 4.3 | 3 | 13.0 | - | - | |
| Гастроинтестинальные расстройства | 5 | 21.7 | 6 | 26.1 | 9 | 39.1 | 3 | 13.0 | |
| Диарея | 2 | 8.7 | 1 | 4.3 | 4 | 17.4 | - | - | |
| Тошнота | 1 | 4.3 | 2 | 8.7 | 3 | 13.0 | 1 | 4.3 | |
a Наиболее типичные для нежелательных явлений системные органные классы (>20% добровольцев) и наиболее типичные нежелательные явления (минимум 3 добровольца в любой группе) чаще регистрировались в активной терапевтической группе, чем в группе плацебо.
Обсуждение
Данное исследование представляет собой одно из пяти рандомизированных клинических исследований, направленных на оценку половой переносимости антидепрессантов (в этом исследовании - агомелатин и пароксетин) у пациентов с депрессивными симптомами (Kennedy et al., 1996; Nafziger et al., 1999), с целью уточнения половых побочных эффектов, исключительно связанных с фармакодинамическими эффектами указанных выше антидепрессантов (не маскированные последствиями улучшения настроения по мере редукции депрессии). Половая переносимость агомелатина была значительно лучше, чем половая переносимость пароксетина. Здоровые субъекты мужского пола достоверно лучше переносили терапию (снижение риска развития ПД) при назначении агомелатина 25 или 50 мг в сравнении с пароксетином 20 мг. Частота ПД при терапии агомелатином 25 или 50 мг была ниже, чем при использовании пароксетина. Кроме того, хотя исследование не было специально спланировано для прямого сравнения агомелатина и плацебо, частота ПД при терапии агомелатином была такой же, как в группе плацебо. Отчетливые различия антидепрессантов по показателям половой переносимости в пользу агомелатина отмечались начиная со 2-й недели терапии и в последующем нарастали. Хотя при терапии агомелатином в дозе 25 мг отмечались лишь единичные явления ПД, следует отметить, что все они были легкими по интенсивности и не обнаруживали зависимости от дозы, так как не наблюдались у добровольцев, получавших агомелатин в дозе 50 мг. Соответственно в сравнении с пароксетином добровольцы из обеих групп агомелатина обнаруживали достоверно меньше умеренных или тяжелых ПД, а также стойких ПД. С эти согласуются данные о том, что средний 5-пунктовый суммарный балл шкалы PRSEXDQ-SALSEX был достоверно ниже в обеих группах агомелатина, чем в группе пароксетина, начиная со второй недели лечения, и эти различия сохранялись вплоть до завершения периода исследования. На момент финальной оценки дисфункции по каждому из пунктов PRSEXDQ-SALSEX (за исключением снижения либидо для агомелатина 25 мг) встречались достоверно реже при терапии агомелатином в сравнении с группой пароксетина. Более того, на момент финальной оценки половые дисфункции по всем пунктам шкалы PRSEXDQ-SALSEX, кроме эректильной дисфункции, достоверно чаще возникали в группе пароксетина, чем в группе плацебо.
Известно, что после начала терапии антидепрессантом нарушения половой функции развиваются в следующей хронологической последовательности: 1) задержка оргазма/эякуляции, 2) аноргазмия/отсутствие эякуляции (развивается на первом месяце терапии) 3) снижение либидо и 4) эректильная дисфункция (развивается и нарастает через 1-3 месяца приема препарата) (Montejo et al., 1997, 2001; Clayton et al., 2006). Следовательно можно предположить, что 8-недельная терапия пароксетином была недостаточно длительной для развития таких побочных эффектов, как снижение либидо и эректильная дисфункция, которые обычно возникают на более поздних сроках лечения.
Более того, в соответствии со всеми приведенными результатами не зафиксировано никаких изменений в стартовых средний суммарных баллах шкалы IIEF у добровольцев, получавших агомелатин в обеих дозах (или плацебо), тогда как в группе добровольцев, получавших пароксетин, средний стартовый суммарный балл IIEF достоверно снижался. Действительно, во всех исследованиях программы клинического развития было показано, что агомелатин не оказывает неблагоприятного влияния на половую функцию. Частота связанных с половой функцией нежелательных явлений всегда была ниже или одинаковой при терапии агомелатином и плацебо. Результаты анализа баллов шкалы ASEX (McGahuey et al., 2000), которая использовалась в кратковременных исследованиях эффективности, свидетельствуют, что агомелатин вызывает меньше ПД, чем плацебо (3.0% против 8.6% соответственно). Более того, в специальном исследовании с применением шкалы SEXFX было показано, что агомелатин 50 мг при 12-недельной терапии у пациенты с депрессией в состоянии ремиссии с сохранной половой активностью обеспечивает более благоприятный профиль половых дисфункций в сравнении с венлафаксином в дозе 150 мг (Kennedy et al., 2008). Данные настоящего исследования, выполненного на выборке здоровых добровольцев мужского пола, подтверждают, что пароксетин характеризуется высокой частотой ПД, о чем уже сообщалось ранее при его применении у больных депрессией (Montejo et al., 1996; Rosen et al., 1999; Montejo et al., 2001; Clayton и Montejo, 2006). Нарушения половой функции при терапии пароксетином верифицированы показателями шкал PRSEXDQ-SALSEX и IIEF. Известные эффекты пароксетина на половую функцию могут быть использованы в клинической практике для терапии преждевременной эякуляции (Waldinger et al., 1994, 1997, 1998, 2001a, b, 2003; Ludovico et al., 1996; Salonia et al., 2002; Waldinger и Olivier, 2004; Waldinger, 2007), поскольку, как и ожидалось, наиболее выраженным побочным эффектом пароксетина со стороны половой функции по шкале PRSEXDQ-SALSEX является задержка оргазма/эякуляции (отмечалась у 17 из 21 добровольца (81%)). В сравнении с пароксетином агомелатин редко вызывает задержку оргазма/эякуляции у здоровых добровольцев мужского пола, что может быть связано с его свойствами 5-HT2c антагониста, так как другие два антидепрессанта, обладающие таким же свойством, миртазапин и нефазодон, также не вызывают задержки эякуляции у мужчин без депрессии, страдающих на протяжении жизни преждевременной эякуляцией (Waldinger et al., 2001a, 2003). Ранее сходные данные с применением шкалы PRSEXDQ-SALSEX были получены у пациентов с БДР (Montejo et al., 1997, 2001). Более того, при регулярной терапии было установлено повышение риска преждевременной отмены лечения по причине связанных с антидепрессантами ПД, примерно 40% (Montejo, 2001), что подчеркивает важность применения препаратов, не нарушающих половую функцию.
Результаты оценки клинической безопасности агомелатина в дозах 25 и 50 мг у здоровых добровольцев согласуются с данными, полученными у пациентов с депрессией (Kennedy, 2007) и не содержат каких либо неожиданных нежелательных явлений. Эти данные дополнительно подтверждают хорошую переносимость агомелатина в обеих дозах. При использовании агомелатина в обеих дозах добровольцы испытывали преимущественно сонливость (легкой или умеренной интенсивности). Сонливость является известным эффектом терапии агомелатином, вероятно связанным с его свойствами агониста MT1 и MT2 мелатонинергических рецепторов. Однако частота сонливости, установленная у пациентов с БДР, получающих агомелатин 25/50 мг, обычно значительно ниже (примерно 3%), чем в данном исследование, что может объясняться повышенной предрасположенностью здоровых добровольцев к сонливости в сравнении с пациентами с депрессией. В группе пароксетина пациенты отмечали преимущественно половые дисфункции. После отмены терапии не отмечалось никаких нежелательных явлений, связанных с половыми дисфункциями, что дополнительно подтверждает их связь с лекарственной терапией.
В результате оценки гормонального профиля не обнаружено никаких клинически значимых средних изменений ни в одной из терапевтических групп. Эти данные представляют особый интерес учитывая отсутствие значимых изменений плазменных уровней пролактина у здоровых добровольцев. Ранее сообщалось, что длительное применение пароксетина может сопровождаться повышением концентрации пролактина в плазме у здоровых добровольцев (Cowen и Sargent, 1997), однако по данным других исследований этот эффект не выходит за рамки маргинальных показателей в рассматриваемой популяции (Schlosser et al., 2000). Предполагается, что гиперпролактинeмия является одним из многих механизмов, лежащих в основе развития ПД (Bhasin et al., 2007). Вероятно гиперпролактинeмия сопряжена преимущественно со снижением либидо и эректильной дисфункцией вследствие вторичного гипогонализма, тогда как информации по нарушениям функции оргазм или эякуляции пока недостаточно. Тем не менее, полученные в данном исследовании результаты свидетельствуют, что в отличие от антипсихотиков (Smith et al., 2002; Compton и Miller, 2002; Ahl et al., 2004), ПД, индуцированная пароксетином, состоит преимущественно из аномальных изменений оргазма и эякуляции, которые нельзя объяснить изменением уровней пролактина.
Заключение
С помощью шкал PRSEXDQ-SALSEX и IIEF в проведенном исследовании установлено статистически достоверное снижение риска ПД при терапии агомелатином в сравнении с пароксетином у здоровых добровольцев мужского пола, а также получены подтверждения фармакодинамических нарушений половой функции под влиянием пароксетина в сравнении с плацебо. Мы также может утверждать, что некоторые антидепрессанты действительно вызывают выраженные нарушения половой функции, независимо от аффективного состояния пациента.
Несмотря на определенные ограничения проведенного исследования, включая ограниченность выборки здоровыми добровольцами мужского пола, в совокупности полученные нами результаты и данные предыдущих исследований, полученные у пациентов с депрессией, подтверждают превосходство агомелатина в сравнении с СИОЗС по профилю половой переносимости.
Выражение благодарности
Мы выражаем благодарность всем медицинским сотрудникам и руководству Отдела клинических фармакологических исследований Клинической больницы Св. Карлоса и Психиатрической службы Университетской клиники Саламанки с особой признательностью среднему медицинскому персоналу: Vegas C, Paniagua S, Rojas A, Marcos ML, Martin C и Ballesteros C за их энтузиазм в сотрудничестве и преданностью проекту. Данное исследование спонсировалось компанией Servier.
Декларация интересов
Доктор AL Montejo выступает с устными сообщениями в интересах компаний Lilly, Astra Zeneca, Bristol-Myers Squibb, Servier, Glaxo-SmithKline, Lundbeck, Sanofi Synthelabo, Whyeth. Он также является консультантом компаний Lilly и Astra Zeneca и получал гранты от компаний Astra Zeneca, Bristol-Myers Squibb, Lilly, Servier, Glaxo-SmithKline, Lundbeck, Sanofi Synthelabo и Pfizer.
Доктор N Prieto получал гранты от компаний Astra Zeneca, Bristol-Myers Squibb, Lilly, Servier, Lundbeck, Sanofi Synthelabo, Janssen и Pfizer.
Доктор D Gonzalez Parra получал гранты от компаний Servier и Pfizer.
Доктор J Matias получал гранты от компаний Astra Zeneca, Bristol-Myers Squibb, Lilly, Servier, Lundbeck, Sanofi Synthelabo, Janssen и Pfizer. Dr Matias выступает с устными сообщениями в интересах компании Glaxo-SmithKline.
Доктор A Portoles заявляет, что не имеет никаких прямых или косвенных финансовых интересов ни с одной из фармацевтических компаний и не участвует в экспертных советах ни для одной из фармацевтических компаний. За последние 5 лет доктор A Portoles участвовал в качестве исследователя в клинических исследованиях фазы I, спонсированных несколькими компаниями (GSK, Pfizer, Belmac, Alter, Combinopharm, Tecnimede, Rubio, cinfa, Servier, TEVA), ни одно из которых не конкурирует с данной публикацией.
Список использованной литературы
