Вакцина Ваксигрип для профилактики гриппа (обзор литературы)
Статьи
"Вакцина Ваксигрип для профилактики гриппа (обзор литературы)"
№11 (5) сентябрь/октябрь 2000 г. (приложение)
Разделы:
ИНАКТИВИРОВАННАЯ РАСЩЕПЛЕННАЯ ГРИППОЗНАЯ ВАКЦИНА ВАКСИГРИП
Гендон Ю.З.
НИИ вирусных препаратов РАМН
Статья представляет собой обзор данных литературы по исследованию безопасности (реактогенности), иммуногенности и профилактической эффективности расщепленной инактивированной трехвалентной (A/H1N1, A/H3N2, B) гриппозной вакцины Ваксигрип. Результаты исследований, проведенных в ряде стран, показали, что эта вакцина обладает низкой реактогенностью как для детей, начиная с 6-месячного возраста, так и для взрослых вплоть до 65 лет и старше. Эта вакцина при однократном введении лицам, ранее болевшим гриппом, индуцирует защитный уровень антител ко всем трем компонентам вакцины у 70-90% вакцинированных. Однако детям до 8 лет включительно целесообразно двукратное введение вакцины. Вакцина защищает от заболевания гриппом от 70 до 90% вакцинированных любого возраста, начиная с 6 месяцев. Следует отметить, что снижение заболеваемости гриппом наблюдается даже в том случае, если вакцину применяют за неделю до начала эпидемии гриппа. Вакцина Ваксигрип может успешно применяться для профилактики гриппа у всех возрастных категорий, начиная с 6 месяцев, включая людей, страдающих заболеваниями дыхательной и сердечно-сосудистой систем.
Грипп – заболевание, известное с давних времен. Уже в 412 году до нашей эры Гиппократ описал вспышку заболевания, весьма сходного с гриппом (22). В дальнейшем эпидемии гриппа неоднократно упоминались в средние века и позже, однако причина этих эпидемий была не ясна. В Германии, например, полагали, что гриппозные эпидемии возникают зимой потому, что в это время едят много кислых яблок и соленой рыбы, а во Флоренции считали, что возникновение гриппозных эпидемий обусловлено влиянием луны и других планет (отсюда название гриппа – «инфлюенция», influence, т.е. влияние).
Лишь в 1933 году в Англии во время эпидемии гриппа в лаборатории Эндрюса был открыт истинный возбудитель этих эпидемий – вирус гриппа человека (44).
В течение весьма длительного времени грипп остается серьезной проблемой для здоровья людей, вызывая ежегодные эпидемии во время которых заболевает до 10% всего населения планеты, а во время возникающих время от времени гриппозных пандемий это число может возрастать в 4-6 раз (39). Кроме того, практически все эпидемии гриппа сопровождаются увеличением смертности. Так, например, в США на протяжении 25 эпидемических гриппозных сезонов смертность от гриппа составляла в среднем около 21 тысячи человек ежегодно, при этом 70% смертности приходилось на лиц старше 65 лет (43).
Эпидемии гриппа наносят также огромный экономический ущерб, как отдельным лицам, так и обществу в целом. Этот ущерб обусловлен не только затратами на лекарства, вызовы врачей и госпитализацию заболевших, но, в значительной степени, потерей рабочих дней. В США во время ежегодных эпидемий гриппа экономический ущерб оценивается от 3 до 5 млн. долларов (42). Ущерб от эпидемии гриппа в 1989 г. во Франции составил более 14 млрд. французских франков, при этом около 13 млрд. франков приходилось на потерю рабочих дней (29).
Однако грипп – заболевание, которое можно предотвратить с помощью вакцин. Имеется большое количество данных, свидетельствующих о том, что гриппозные вакцины, приготовленные из актуальных вакцинных штаммов вируса гриппа, и примененные в нужное время, способны защитить от заболевания гриппом около 80% здоровых детей и взрослых (34). У лиц пожилого возраста защита от заболеваемости гриппом несколько ниже, но существенно снижается смертность (19).
В настоящее время для профилактики гриппа в подавляющем большинстве стран применяют инактивированные гриппозные вакцины.
Впервые инактивированная формалином гриппозная вакцина из легких мышей, зараженных вирусом гриппа человека, была испытана на военных в Англии в 1938 году (45). Однако из-за того, что эпидемия гриппа закончилась перед вакцинацией, оценить профилактическую эффективность такой вакцины не удалось. В 1942-1943 гг. клинические и полевые испытания концентрированной очищенной инактивированной гриппозной вакцины из вируса гриппа, выращенного в куриных эмбрионах, проводили в армии США. В этих исследованиях впервые была показана способность вакцины защищать от инфекции вирусом гриппа около 80% вакцинированных (18).
В последующие годы проводились исследования по усовершенствованию инактивированных гриппозных вакцин и вакцины, применяемые в настоящее время, представляют собой препараты, содержащие вирусы гриппа человека (обычно три серотипа этого вируса, циркулирующие в настоящее время и вызывающие эпидемии – вирусы гриппа А/H1N1, А/H3N2 и В), выращенные в куриных эмбрионах, инактивированные и высокоочищенные от белков и других компонентов куриного эмбриона.
В настоящее время производятся и используются для профилактики гриппа три вида инактивированных гриппозных вакцин: цельновирионные вакцины, расщепленные вакцины и субъединичные вакцины.
Цельновирионная гриппозная вакцина представляет собой суспензию инактивированных высокоочищенных не разрушенных (цельных) вирионов вируса гриппа. Расщепленная вакцина содержит разрушенные инактивированные вирионы вируса гриппа, при этом в вакцине присутствуют все вирионные белки вируса, но за счет высокой очистки белки куриного эмбриона удаляются. Субъединичная вакцина состоит лишь из двух вирусных белков – гемагглютинина и нейраминидазы – играющих наиболее важную роль в индукции иммунитета против гриппа. Остальные вирионные белки, а также белки куриного эмбриона, удаляются.
Их этих трех видов гриппозных вакцин, цельновирионная вакцина вызывает несколько больше неблагоприятных реакций, особенно у маленьких детей, в сравнении с расщепленной вакциной, а наименее реактогенна субъединичная вакцина (25, 48). Иммуногенность цельновирионной и расщепленной вакцин практически одинакова (34).
В настоящее время инактивированные гриппозные вакцины изготавливают на фирмах многих стран Европы, Азии, Америки и Австралии. Одна из таких вакцин, а именно инактивированная высокоочищенная расщепленная вакцина Ваксигрип, уже более 30 лет (с 1969 года) производится фирмой Авентис Пастер. Ежегодно более 70 млн. доз этой вакцины применяется в странах Европы, Америки, Азии и Африки.
Вакцина Ваксигрип представляет собой тривалентный препарат, содержащий актуальные штаммы вируса гриппа человека трех серотипов – А/H1N1, А/H3N2 и В, ежегодно рекомендуемых Всемирной Организацией Здравоохранения на предстоящий эпидемический гриппозный сезон. Вирус гриппа выращивают в 10-12 дневных куриных эмбрионах и тщательно очищают от белков и других компонентов куриного эмбриона путем двукратного зонального ультрацентрифугирования. Очищенные вирионы вируса разрушают, используя в качестве детергента Твин80/эфир, а с 1995 года Тритон Х-100. После разрушения вирионов проводят инактивацию формальдегидом и содержащий вирусные белки материал фильтруют. Таким образом готовят моновалентные вакцины из вируса трех серотипов гриппа (А/H1N1, А/H3N2 и В), которые затем смешивают вместе таким образом, чтобы в одной дозе (0,5 мл) тривалентной вакцины содержание гемагглютинина каждого серотипа вируса – основного белка, ответственного за индукцию иммунитета к гриппу – составляло 15 мкг. Следует отметить, что благодаря высокой очистке содержание яичного овальбумина в одной дозе вакцины составляет 0,5 нг при допустимой концентрации этого белка 1,2 мкг (требования Европейской Фармакопеи). Вакцину фасуют либо во флаконы, содержащие по 10 доз, либо - в одноразовые шприцы по одной дозе, при этом доза для взрослых – 0,5 мл (15 мкг гемагглютинина каждого серотипа вируса), а для маленьких детей – 0,25 мл (7,5 мкг гемагглютинина). Препарат предназначен для подкожного или внутримышечного введения.
Безопасность (реактогенность) вакцины Ваксигрип исследовалась неоднократно при вакцинации детей, взрослых и пожилых лиц, в том числе людей с рядом хронических заболеваний.
По обобщенным данным исследований вакцины, проведенных в ряде стран (11, 30, 31, 41) (табл.1), при первичной вакцинации детей в возрасте от 3 месяцев до 6 лет местные реакции (боль в месте введения, покраснение, припухлость) практически отсутствовали, а общие реакции (температура выше 37,8 0С, озноб, головная боль, общее недомогание) наблюдались у 1,9% привитых; при повторной вакцинации этих детей ни местных, ни общих реакций не отмечалось. При первичной вакцинации детей от 7 лет и взрослых до 25 лет общие реакции наблюдались у 10%, а при повторной вакцинации – у 2%. При вакцинации взрослых от 20 до 60 лет местные реакции отмечались у 10,5% вакцинированных, а общие – у 5,2%. При вакцинации пожилых лиц в возрасте 60 лет и старше местные реакции выявлялись у 3,4% привитых, а общие – у 3%.
Табл.1 Обобщенные данные нескольких зарубежных и российских исследований по изучению реактогенности вакцины Ваксигрип
|
Категория пациентов |
Прочие условия |
Местные реакции, % |
Общие, реакции, % |
Исследование |
|
дети до 3 лет |
во время эпидемии |
4,3 |
6,7-8,7 |
9 |
|
дети 6 мес.-6 лет. |
1,7 |
2 |
2 |
|
|
дети 6 мес.-3 года |
0 |
1,9 |
11, 30, 31, 41 |
|
|
дети 7 лет – взрослые 25 лет |
н/д* |
2-10% |
11, 30, 31, 41 |
|
|
взрослые 30-60 лет |
10,5 |
5,2 |
11, 30, 31, 41 |
|
|
взрослые |
5,1 |
10,2 |
2 |
|
|
пожилые старше 60 лет |
3,4 |
3 |
11, 30, 31, 41 |
|
|
пожилые старше 65 лет |
12-14 |
7-8 |
46 |
|
|
пожилые старше 65 лет |
н/д* |
1 |
23 |
* - нет данных
В исследованиях, проведенных в России по изучению реактогенности вакцины Ваксигрип (2), иммунизировали 405 детей в возрасте от 6 месяцев до 6 лет и 2390 взрослых, как здоровых, так и страдающих рядом хронических заболеваний. Детей вакцинировали двукратно и после первой иммунизации местные реакции наблюдались у 1,7% вакцинированных, а общие – у 2%, а после второй вакцинации местные реакции не отмечались, а общие регистрировались у 0,7 % вакцинированных. Взрослых вакцинировали однократно и у 1,7% привитых наблюдались местные реакции и у 2% общие.
В другом исследовании, проведенном в России в период эпидемического подъема гриппа, общие реакции у детей до 3 лет (повышение температуры тела до 37,5-38,1° С, сонливость, ухудшение самочувствия и др.) наблюдались с частотой 6,7 и 8,7% (у вакцинированных однократно и двукратно соответственно). Местные реакции имели место у 4,3% привитых. Среди взрослых частота общих реакций (повышение температуры тела до 38,1°С) составила 10,2%, местных – 5,1% обследованных (9).
При иммунизации вакциной Ваксигрип 4581 престарелых в возрасте 65 лет и старше общие реакции наблюдались лишь у 1% (23). В сходных исследованиях (46) при иммунизации вакциной Ваксигрип 4483 человек в возрасте 65 лет и старше местные реакции регистрировались у 12-14% вакцинированных, а общие – у 7-8%, при этом повышение температуры выше 380С отмечалось не более, чем у 0,6% привитых.
Было показано также, что инактивированные гриппозные вакцины не вызывают каких-либо серьезных неблагоприятных реакций при вакцинации людей, страдающих хроническими болезнями легких, в том числе хронической астмой, болезнями сердца, диабетом и пр. (4, 14, 47) или с нарушениями иммунной системы, в частности, больных СПИДом (24).
Таким образом, на основании имеющихся данных можно сделать вывод, что инактивированная расщепленная вакцина Ваксигрип обладает весьма низкой реактогенностью как для детей, начиная от 6 месяцев, так и для взрослых, в том числе старше 65 лет, а также страдающих хроническими заболеваниями.
Иммуногенность вакцины Ваксигрип, т.е. способность этого препарата индуцировать выработку противогриппозных антител, исследовалась неоднократно. Было показано, что после однократной вакцинации взрослых людей этой вакциной, защитный уровень противогриппозных антител (антител к гемагглютинину в титре ³1:40) возникал у 70-95% вакцинированных (21).
В исследованиях, проведенных в Италии (50), три группы лиц - от 17 до 30 лет, от 40 до 59 лет и от 60 лет и старше – примерно по 20 человек в каждой группе, однократно вакцинировали вакциной Ваксигрип, содержащей 10 мкг гемагглютинина каждого серотипа вируса в одной дозе. Было обнаружено, что после вакцинации защитный титр антител (³ 1:40) к серотипу А/H3N2 наблюдался у 71% пожилых лиц, у 55,5% лиц среднего возраста и у 65% лиц более молодого возраста. К серотипу А/H1N1 защитный титр антител наблюдался у 71%, 67% и 83% лиц соответственно, а к серотипу В у 42%, 33% и 53% лиц соответственно. Следует отметить, что до вакцинации у лиц 17-30 лет защитный титр антител к серотипу А/H3N2 наблюдался лишь у 6%, а к серотипам А/H1N1 и В не отмечался вообще.
В более поздних исследованиях (27) с вакциной Ваксигрип при содержании в дозе 15 мкг гемагглютинина каждого серотипа вируса было показано, что у лиц в возрасте от 18 до 60 лет, иммунизированных однократно, защитный уровень антител наблюдался к серотипу А/H3N2 у 99% вакцинированных, а к серотипам А/H1N1 и В – у 100%. У лиц старше 60 лет защитный уровень антител к серотипу А/H3N2 отмечался у 73% привитых, к серотипу А/H1N1 - у 89% и к серотипу В – у 99%. Эти показатели превышают требования Европейской Фармакопеи к иммуногенности гриппозных вакцин – не менее 70% для лиц до 60 лет и 60% для лиц 60 лет и старше (15).
В исследованиях, проведенных в России (8) при вакцинации вакциной Ваксигрип 103 взрослых лиц было обнаружено, что защитный титр антител до вакцинации к серотипу А/H1N1 наблюдался у 23,4% лиц, к серотипу А/H3N2 - у 71,9%, и к серотипу В – у 42,2%, а после вакцинации составил 89%, 96,9% и 100% соответственно.
В других российских исследованиях (4) вакциной Ваксигрип иммунизировали около 100 человек старше 65 лет, среди которых большинство имели в анамнезе ряд хронических заболеваний, в том числе ишемическую болезнь сердца, хронических бронхит, гипертонию, диабет и др. Было обнаружено, что вакцинация не вызывает неблагоприятных реакций и после прививки защитный титр антител к серотипу А/H1N1 и А/H3N2 наблюдался у 89% вакцинированных, а к серотипу В – у 86% (рис.1).
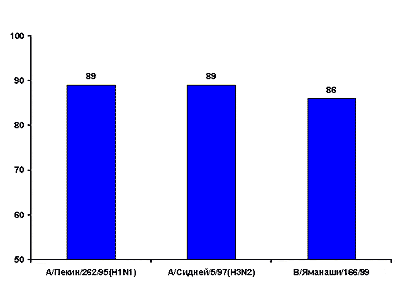
Рис.1. Диагностические приросты титров антител (%) к антигенам вирусов гриппа А и В у пожилых людей, привитых вакциной Ваксигрип в эпидемическом сезоне 1999-2000 гг. (по данным [4])
При двукратной вакцинации детей в возрасте от 6 месяцев до 3 лет (49 детей) при использовании дозы 0,25 мл (7,5 мкг гемагглютинина каждого серотипа вируса) защитный уровень антител к серотипу А/H3N2 вируса гриппа был индуцирован у 91,8% детей, к серотипу А/H1N1 – у 81,6% и к серотипу В – у 93,9% (38). При двукратной вакцинации дозой 0,5 мл (15 мкг белка) 64 детей в возрасте от 3 до 8 лет защитный уровень антител к серотипам – А/H1N1, А/H3N2 и В наблюдался у 96%, 98% и 97% привитых соответственно (37). Двукратная вакцинация 73 детей в возрасте от 3 лет и старше при дозе вакцины 0,5 мл индуцировала защитный уровень антител к серотипу A/H3N2 у 90% детей, к серотипу A/H1N1 – у 99% и к серотипу В – у 92% (3).
Интересные данные были получены при вакцинации вакциной Ваксигрип 285 пожилых лиц в возрасте 75 лет и старше (средний возраст 85 лет), живших в домах для престарелых (36). Среди вакцинированных защитный уровень антител к серотипу А/H1N1 оказался довольно низким – лишь у 21% привитых. Однако во время гриппозной эпидемии, вызванной вирусом гриппа А/H1N1, заболел гриппом лишь один из 285 вакцинированных. В то же время среди не вакцинированного персонала заболело гриппом 20% служащих. Таким образом, профилактическая эффективность расщепленной вакцины для пожилых лиц может превышать серологические данные, оцениваемые, как правило, только на основании титров антител к гемагглютинину.
Не исключено, что в защите от гриппа при использовании инактивированных вакцин могут играть существенную роль местные секреторные IgA антитела, появляющиеся в носоглотке (12, 19а).
В этом разделе следует отметить данные литературы о том, что при вакцинации расщепленной гриппозной вакциной Ваксигрип защитный гуморальный иммунный ответ может наблюдаться уже через одну неделю после однократной иммунизации. Так, было показано, что при однократной вакцинации молодых взрослых людей вакциной Ваксигрип защитный увовень антител в крови к вирусам гриппа серотипов А и В наблюдался у большинства вакцинированных уже на 6-7 день после вакцинации (12, 15в, 51), а у некоторых лиц даже на 2-й день после введения вакцины. Следует также отметить, что вакцинация вызывает быстрое появление не только системного, но также местного иммунитета в носоглотке (12,15в). Предполагается, что такая быстрая иммунная реакция на введение вакцины может наблюдаться только у лиц, ранее болевших гриппом, у которых иммунные клетки уже праймированы.
Таким образом, изучение иммуногенности инактивированной расщепленной вакцины Ваксигрип показало, что этот препарат способен индуцировать защитный уровень противогриппозных сывороточных антител у большинства вакцинируемых, а также вызывать образование местных секреторных антител в носоглотке. Важно подчеркнуть, что защитный уровень сывороточных антител удается индуцировать у большинства детей, начиная с 6 месяцев, а также у значительного числа лиц пожилого возраста, что позволяет сделать вывод о целесообразности применения слабо реактогенной инактивированной расщепленной вакцины для профилактики гриппа у лиц всех возрастов, начиная с 6 месяцев, в том числе у людей с хроническими заболеваниями легких, сердца, иммунной системы и др.
Главным показателем профилактической ценности вакцины, равно как и других препаратов, является профилактическая эффективность, исследованная в хорошо организованных контролируемых испытаниях при сравнении заболеваемости среди вакцинированных и аналогичной группы невакцинированных лиц.
Оценка эффективности вакцины Ваксигрип проводилась неоднократно. Наиболее впечатляющие данные были получены во Франции во время эпидемии гриппа 1989/90 гг. в армейских коллективах, в которых было вакцинировано 53382 человека. При анализе заболеваемости гриппом, подтвержденным лабораторно среди вакцинированных и невакцинированных лиц, профилактическая эффективность вакцины составила 89% (32). При исследованиях эффективности вакцины Ваксигрип, проведенных в Китае (26), было вакцинировано 678 человек, из них 80 детей (3-6 лет), 363 взрослых (18-59 лет) и 235 человек старше 60 лет. В контрольной невакцинированной группе было также 678 человек – 88, 372 и 218 человек соответственно. Сравнение заболеваемости в сезон 1996/97 гг. среди вакцинированных и невакцинированных показало снижение заболеваемости гриппом у детей на 84,8%, у взрослых – на 68,6% и у пожилых лиц – на 74,0%.
Высокая эффективность вакцины Ваксигрип была также показана при иммунизации 285 пожилых лиц в возрасте от 75 до 95 лет, среди которых многие имели хронические болезни (36). Во время эпидемии гриппа среди вакцинированных заболел гриппом лишь один человек.
В эпидсезон 1997/98 гг. в Москве вакциной Ваксигрип было провакцинировано 20208 человек в возрасте от 15 до 90 лет и старше, работающих на различных предприятиях (49). При сравнении заболеваемости гриппом (клинический диагноз) в группе вакцинированных и такой же по численности группе невакцинированных людей заболеваемость гриппом среди вакцинированных снизилась на 63%. Кроме того, количество осложнений при гриппозной инфекции в группе вакцинированных лиц было на 40% меньше по сравнению с контрольной группой.
Еще одни исследования, проведенные в Москве, при иммунизации вакциной Ваксигрип пожилых людей в возрасте 65 лет и старше показали, что при анализе лабораторно подтвержденных случаев гриппа индекс профилактической эффективности вакцины составил 2,7 (5 случаев гриппа у 67 вакцинированных против 11 случаев у 55 невакцинированных (4а)).
Интересные исследования провела медицинская страховая компания «Макс-М» (1). С помощью этой компании в одном предприятии г. Москвы было провакцинировано вакциной Ваксигрип 2100 человек, что составило 87% от общего числа работающих. В качестве контроля было использовано другое предприятие, сходное с первым по профилю производства, структуре кадров и численности работников. Временная нетрудоспособность вследствие заболеваемости гриппом в 1 квартале 1998 года в первом предприятии среди вакцинированных была снижена в сравнении с невакцинированными в 6,2 раза в днях нетрудоспособности и в 3,4 раза в случаях заболевания гриппом. При сравнении с контрольным (невакцинированным) предприятием нетрудоспособность вследствие заболеваемости гриппом в «вакцинированном» предприятии была ниже на 65%. Автор делает вывод, что массовая вакцинация работников значительно снижает трудопотери, обусловленные заболеванием гриппом.
Известно, что наибольшая заболеваемость гриппом наблюдается у детей дошкольного и раннего школьного возрастов, которые, к тому же, являются основными распространителями гриппозной инфекции (17, 20, 22а). По данным И.Л.Шаханиной (10) заболеваемость гриппом детей в России в 2,6 раза выше, чем взрослых. Поэтому особое внимание обращается на профилактику гриппа у детей, начиная с 6-месячного возраста. Вакцинация детей в возрасте 6-9 месяцев особенно важна, ибо к этому времени материнские противогриппозные антитела уже исчезают из крови детей, и первичная инфекция вирусом гриппа неиммунных детей может вызвать тяжело протекающее заболевание с серьезными осложнениями.
Выше были приведены данные о низкой реактогенности и хорошей иммуногенности вакцины Ваксигрип для детей, начиная с 6-месячного возраста. Исследования профилактической эффективности этой вакцины для маленьких детей также дали хорошие результаты.
Были получены данные (2), показавшие что среди детей в возрасте от 6 месяцев до 6 лет, двукратно вакцинированных вакциной Ваксигрип в дозе 0,25 мл, заболеваемость во время гриппозных эпидемий в Москве в 1996, 1997 и 1998 гг. составила лишь 0,7-0,8%. В другом исследовании (3) детей в возрасте от 3 лет и старше (73 ребенка) с поражениями ЦНС и нарушениями психического развития, а также имевших ряд других хронических заболеваний, дважды вакцинировали вакциной Ваксигрип в дозе 0,5 мл. Заболевание гриппом наблюдалось лишь у 8,2% вакцинированных против 38,8% заболевших в контрольной группе (72 ребенка). Индекс профилактической эффективности вакцинации составил 4,7, а коэффициент эффективности – 79%.
В г. Смоленске был проведен анализ заболеваемости гриппом 629 детей в возрасте от 3 до 12 лет, двукратно вакцинированных вакциной Ваксигрип, в сравнении с 793 невакцинированными детьми (6). Полученные данные показали, что в эпидсезоне 1998 г. заболеваемость гриппом вакцинированных детей была в 3.8 раза ниже, чем невакцинированных.
По существующим рекомендациям, детей в возрасте от 6 месяцев до 9 лет следует вакцинировать двукратно. Эти рекомендации подтверждаются рядом данных. Так, в исследованиях, проведенных на ограниченном контингенте детей в возрасте до 3 лет, двукратная вакцинация вакциной Ваксигрип снизила заболеваемость гриппом у вакцинированных детей в 8 раз в сравнении с контрольной невакцинированной группой. В то же время однократная вакцинация не привела к существенному снижению заболеваемости, хотя у вакцинированных детей грипп протекал значительно легче, чем у непривитых (9). В другом исследовании (6) при сравнении заболеваемости гриппом среди 629 детей в возрасте от 3 до 7 лет, двукратно привитых той же вакциной, и 275 детей того же возраста, вакцинированных однократно, у детей, получивших вакцину дважды, заболеваемость гриппом снизилась в 3,8 раза в сравнении с контрольной группой невакцинированных детей (793 ребенка), в то время как у привитых однократно снижения заболеваемости гриппом установлено не было (рис.2).
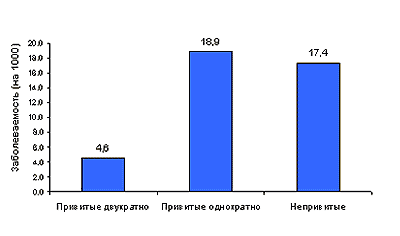
Рис. 2. Сравнительная эффективность 1- и 2-кратной иммунизации вакциной Ваксигрип среди детей в возрасте 3-7 лет, ранее не получавших прививок против гриппа [6]
В последнее время для профилактики гриппа стали использоваться некоторые иммуностимуляторы, а также гомеопатические препараты. Была проведена оценка профилактической эффективности вакцины Ваксигрип и таких иммуностимуляторов как дибазол, настойка элеуторококка и поливитамины (рис.3) (5). В этих исследованиях 910 детей в возрасте от 2 до 15 лет (238 дошкольника и 672 школьника) осенью 1997 г. вакцинировали вакциной Ваксигрип. Профилактику гриппа иммуностимуляторами проводили в осенне-зимний период 1997/98 гг., при этом иммуностимуляторы получили 1222 ребенка тех же возрастов (252 – дошкольники и 970 школьников). Было обнаружено, что заболеваемость гриппом в группах вакцинированных детей составила 3,4%, а в группах детей, получавших иммуностимуляторы – 11,7%. Индекс профилактической эффективности вакцины Ваксигрип в сравнении с заболеваемостью в группе детей, получавших иммуностимуляторы, составил 3,4. Кроме того, грипп у вакцинированных детей протекал достаточно легко и без развития осложнений. В то же время среди заболевших детей, получавших иммуностимуляторы, в 5 случаях заболевания гриппом наблюдались серьезные осложнения, потребовавшие госпитализации.
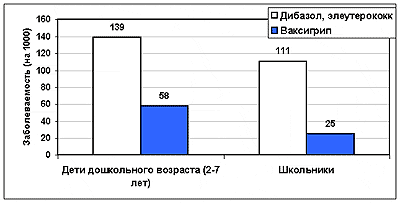
Рис.3 Сравнение эффективности неспецифической и специфической профилактики гриппа у детей (по данным [5])
В сравнительных исследованиях была также изучена профилактическая эффективность вакцины Ваксигрип и ряда гомеопатических препаратов (7). 100 медицинских работников лечебно-профилактических учреждений были вакцинированы однократно вакциной Ваксигрип, 160 медицинских работников получали гомеопатические препараты французских фирм: Polyinfluenzin, Dolisococcil или Oscillococcinum) и 100 медицинских работников – Aнтигриппин фирмы «Гомеофарм». Импортные препараты применяли по 1 грануле 1 раз в день, Aнтигриппин - 5 гранул 1 раз в день. Диагноз гриппа устанавливали по клинической картине. Анализ заболеваемости гриппом показал, что в группе привитых вакциной, гриппом заболело лишь 2% вакцинированных, против 5,7% в группах, получавших гомеопатические препараты, т.е. профилактическая эффективность вакцины оказалась в 2,8 раза выше.
Обычно рекомендуется проводить профилактику гриппа с помощью вакцин за 1 месяц до начала эпидемии гриппа, что обусловлено необходимостью иметь время для выработки достаточно высокого противогриппозного иммунитета после вакцинации. Однако точно предсказать начало эпидемии гриппа достаточно трудно, ибо эпидемии гриппа могут возникать с конца ноября до начала апреля. Поэтому также трудно определить точное время начала вакцинации. Тем не менее, при применении вакцины в октябре – начале ноября можно полагать, что возникший иммунитет будет способен защитить большинство вакцинированных от гриппа в любое время возникновения эпидемии. Однако в том случае, если вакцинация не была проведена вовремя, возможно достичь значительного процента защиты от заболевания гриппом даже в том случае, если вакцинация будет проведена за 1-2 недели до начала эпидемии. Как уже упоминалось выше, у лиц, перенесших ранее заболевание гриппом (а таких подавляющее большинство), однократное введение инактивированной вакцины индуцирует защитный уровень противогриппозных антител уже через неделю после вакцинации. В этой связи весьма интересны данные исследований, проведенных Шариповой с сотр. (9), в которых 95 взрослых людей были привиты вакциной Ваксигрип лишь за 7 дней до начала эпидемического подъема заболеваемости гриппом. Несмотря на такой короткий промежуток времени между вакцинацией и началом гриппозной эпидемии индекс профилактической эффективности вакцины составил 2,5. В тех же исследованиях детей в возрасте до 3 лет прививали вакциной двукратно. При этом первую прививку делали за 7 дней до начала эпидемии гриппа, а вторую – на пике эпидемического подъема заболеваемости гриппом. Сравнение заболеваемости гриппом среди вакцинированных детей и детей контрольной группы (невакцинированных) показало, что случаев заболевания гриппом у вакцинированных детей было в 8 раз меньше, чем среди невакцинированных.
Вышеприведенные данные свидетельствуют в пользу того, что значительная профилактика заболеваемости гриппом может быть достигнута и в том случае, если расщепленную инактивированную вакцину Ваксигрип применяют всего за неделю до начала гриппозной эпидемии.
Следует отметить, что в проеденных в 1958 г. исследованиях эффективности инактивированной гриппозной вакцины, при иммунизации около 3000 человек была обнаружена существенная защита от заболевания гриппом уже на 8 день после иммунизации (15а).
Как уже отмечалось выше, гриппозные эпидемии причиняют значительный экономический ущерб, как отдельным лицам, так и обществу в целом. В то же время профилактика гриппа с помощью вакцин может существенно снизить эти экономические потери.
Исследования, проведенные во Франции (29), показали, что экономический ущерб, причиненный эпидемией гриппа в 1998 г., составил 14 млрд. 323 миллиона французских франков, что включает оплату визитов врачей, лекарств, госпитализацию и потерю рабочих дней. Этот же автор показал (28, 29), что при вакцинации вакциной Ваксигрип работающих людей в возрасте от 25 до 65 лет даже в том случае, если будет привито лишь 12 % работников, при заболеваемости во время эпидемии 10% невакцинированных работников и защите от гриппа 80% вакцинированных, экономия для общества в целом может составить 715 млн. французских франков в год, а для индивидуального лица – 211 франков. В случае более высокой заболеваемости при эпидемии гриппа экономия увеличивается до 1 млрд. 575 млн. франков для общества и 465 франков для отдельного лица.
В другом исследовании (13) проводили анализ 4030 работающих взрослых людей, вакцинированных вакциной Ваксигрип. Затраты на вакцинацию (стоимость вакцины, самой вакцинации, лечения осложнений при вакцинации, административных затрат) составили 82 506 долларов США при 24,09 доллара на одного вакцинированного. С учетом заболеваемости гриппом среди невакцинированных работников, 400 человек из исследуемого коллектива вакцинированных лиц должны были заболеть гриппом, что привело бы к потере 727 рабочих дней. Из 4030 работников было вакцинировано 85% и число заболевших среди них составило 133 человека, что привело к потере лишь 230,5 рабочих дней. При этом экономический ущерб от потери рабочих дней снизился на 77 384 доллара, а с учетом затрат на медицинское обслуживание заболевших и зарплату тем лицам, которые заменяли заболевших, и некоторых других затрат, общая экономия составила 203 947 долларов, а экономия на каждого человека – 35,45 доллара. Таким образом, за вычетом затрат на вакцинацию, возможный экономический ущерб уменьшился почти на 120 000 долларов. Естественно, что экономия зависит от цены вакцины, эффективности вакцины, стоимости рабочего дня и частоты заболеваемости гриппом во время эпидемии. Однако по данным анализа, проведенного этими авторами, экономический эффект от вакцинации будет иметь место даже в том случае, если стоимость вакцинации для одного человека составит 45,4 доллара, а эффективность вакцины всего 32,5%.
В России экономический ущерб, причиняемый гриппозными эпидемиями, весьма велик. Например, в 1997 году этот ущерб составил 4 млрд. 235 млн. рублей (по ценам 1998 года) (10). Проведенные исследования в Московской области (7) показали, что при вакцинации в 1997 г. 56 работников вакциной Ваксигрип затраты, связанные с вакцинацией, составили 3361 рубль. С учетом стоимости вакцины и вакцинации, а также оплаты больничных листов и зарплаты лицам, которые должны были заменять заболевших в том случае, если бы эти 56 человек не были привиты, экономический эффект от вакцинации оказался равен 30 860 рублям. В других исследованиях (1) анализировали экономический эффект вакцинации вакциной Ваксигрип более 20 000 работающих лиц, при этом среди привитых заболеваемость гриппом снизилась в 6 раз. В группе вакцинированных в сравнении с аналогичной группой невакцинированных лиц затраты страховой компании на оплату лечения в больницах заболевших гриппом снизились на 18%, а потеря рабочих дней на 1356 дней.
Следует отметить, что во Франции страховые компании после экономического анализа стоимости вакцинации против гриппа и лечения заболевших гриппом людей пожилого возраста вакцинируют лиц этой возрастной группы бесплатно, поскольку, это оказалось значительно дешевле оплаты за лечение.
Существенный экономический эффект при профилактике гриппа вакцинами был получен при использовании других инактивированных гриппозных вакцин при вакцинации детей, работающих взрослых и лиц пожилого возраста (33, 35, 40).
Таким образом, профилактика гриппа с помощью вакцин, в частности, вакцины Ваксигрип, не только защищает большинство вакцинированных от заболевания гриппом, но также значительно снижает экономический ущерб, вызываемый гриппозными эпидемиями.
Какова же должна быть стратегия борьбы с гриппом?
В настоящее время в подавляющем большинстве стран профилактика гриппа с помощью вакцин ограничивается лишь иммунизацией лиц, относящихся к группам высокого риска заболеваемости и смертности от гриппа, т. е. людей любого возраста с хроническими заболеваниями дыхательной системы (особенно страдающих астмой), сердечно-сосудистой системы, эндокринной системы (особенно больных диабетом), а также имеющих нарушения функции почек, при нарушениях обмена, больных анемией и имеющих нарушения иммунной системы (включая получающих иммуносупрессанты), детей и подростков, находящихся на длительной аспиринотерапии, беременных женщин и всех лиц старше 60-65 лет, на долю которых приходится основная смертность от гриппа. Однако даже в тех странах, где вакцинация лиц групп риска проводится бесплатно, вакцинируется менее 50% (16).
Ясно, что при вакцинации против гриппа только лиц, относящихся к группам риска, можно достичь лишь индивидуальной защиты небольшого процента от всего населения, что никак не скажется на эпидемической ситуации при эпидемиях гриппа в целом. Естественно, что ежегодная вакцинация против гриппа 70-80% всего населения невозможна. Однако если существенно расширить контингент вакцинируемых лиц и, в первую очередь, за счет тех групп лиц, которые, в силу профессии или возраста, подвергаются высокому риску заражения вирусом гриппа, а с другой стороны, опять же из-за возраста или профессии, являются основными распространителями гриппозной инфекции, то можно будет повлиять и на гриппозную эпидемию в целом.
К таким группам относятся, прежде всего, дети от 6 месяцев до 12-14 лет, которые являются главными распространителями гриппозной инфекции, поскольку болеют гриппом во много раз чаще, чем взрослые (10, 17, 20, 22а) и имеют частые и тесные контакты с родителями и другими детьми в детских садах и школах. Далее, часто болеют и распространяют грипп работники тех профессий, которые имеют частые и постоянные контакты с другими лицами, в том числе при гриппозных эпидемиях. Это медицинские работники, служащие общественного транспорта, общественного питания, торговой сети, учебных заведений, банков, муниципальных офисов, милиции и некоторые другие. При этом как детей, так и работников вышеупомянутых профессиональных предприятий необходимо вакцинировать не выборочно, а массово, по крайней мере, 75-80% с тем, чтобы создать коллективный иммунитет. Следует упомянуть, что в Методических указаниях по вакцинопрофилактике гриппа Министерства Здравоохранения Российской Федерации (1998) отмечается необходимость профилактики гриппа у большинства вышеупомянутых групп, однако на практике эти рекомендации не выполняются.
Стоит еще раз напомнить, что вакцинация против гриппа не только сохраняет здоровье и снижает смертность, но также дает важный экономический эффект и чем больше людей будет защищено от гриппа, в том числе работающих лиц, тем выше будет этот экономический эффект.
Можно надеяться, что с большим пониманием серьезности ущерба для здоровья людей и экономики общества, вызываемого гриппозными эпидемиями и реальной возможности существенно снизить неблагоприятное воздействие этих эпидемий с помощью вакцин, органы здравоохранения, страховые компании и руководители предприятий будут уделять больше внимания и средств на борьбу с этой ежегодной инфекцией, что многократно окупится как с гуманитарной, так и с финансовой точек зрения.
Гендон Ю.З.
Профессор вирусологии
Доктор медицинских наук
Академик Европейской Академии
Литература
- Алексеев А. Оценка эффективности вакцинации населения г. Москвы вакциной Ваксигрип. В сб. Вакцинопрофилактика гриппа, Москва, 1998: 60-70
- Алексина С., Дорохова Н., Извольская З. и др. Опыт применения вакцины Ваксигрип у детского и взрослого населения г. Москвы. Вакцинация, 1999, № 5:10
- Бурцева Е., Шамшева О., Слепушкин А. и др. Применение вакцины Ваксигрип у детей с патологией. Вакцинация, 1999, №6: 10-11
- Бурцева Е., Слепушкин А., Власова А. и др. Опыт вакцинопрофилактики гриппа у лиц пожилого возраста. Реактогенность и иммуногенность инактивированных вакцин. ЖМЭИ, 2000, №5: в печати. 4а. Бурцева Е., Слепушкин А.. Власова Л. и др. Защитная эффективность инактивированных гриппозных вакцин у лиц пожилого возраста. Вакцинация, 2000, №11 (5), в печати.
- Коровина Н., Заплатников А., Захарова И. и др. Сравнительная эффективность вакцины Ваксигрип и средств неспецифической профилактики гриппа. Terra Medica, 1999, №2:20-21
- Мешкова Р., Андреева И., Андреева Е. и др. Снижение заболеваемости гриппом и ОРВИ у детей, привитых вакциной Ваксигрип. В сб. Вакцинопрофилактика гриппа, Москва, 1998:50-54
- Титкова И., Ерохин Е., Косятникова Л. Вакцина Ваксигрип и гомеопатические препараты. Лечащий врач, 1999, №7: 38-39
- Шарипова И., Фельдблюм И., Кузьминых С. и др. Оценка иммунологической эффективности вакцины Ваксигрип французской фирмы Пастер Мерье Коннот. Medical Market, 1998, 3:30-32
- Шарипова И., Фельдблюм И., Ромашова Л. и др. Эффективность применения вакцины Ваксигрип в период эпидемии. Вакцинация, 1999, №5: 8-9
- Шаханина И. Грипп и острые респираторные заболевания – приоритетная социально-экономическая проблема здравоохранения. В сб. Вакцинопрофилактика гриппа, Москва, 1998: 10-16
- Bentejac M, Larbaigt G., Trian R. Incidence of influenza vaccination on local and general tolerance. Rev.de Medicine, 1980, 38: 1989-1993
- Brokstad K., Cox R., Olofsson J. Et al. Parental influenza vaccination induces a rapid systemic and local immune response. J. Inf. Dis., 1995, 171: 198-203
- Burckel E., Ashraf T., Felho J. et al. Economic impact of providing workplace influenza vaccination. Pharm. Economics, 1999, 16: 563-576
- Canbenr Y. La vaccination antigrippale ne destabilise par l’asthme chez l’enfant. La revue de pediatrie, 1991, 4: 169-172
- Commission of the European Communities. Harmonization of requirements for influenza vaccines. EEC document III/3118/91 – EN
- 15a. Committee on influenza and other respiratory virus vaccines. Trials of an Asian influenza vaccine. Brit. Med. J., 1958, i:415-418.
- 15b. Cox R., Brokstad K., Zuckerman M., et al. An early humoral immune responce in peripheral blood following parenteral inactivated influenza vaccination. Vaccine, 1994, 12 : 993-999.
- Fedson D., Lift J. Implementation of vaccine policy. In Options for the control of influenza III. Eds Brown L., Hampson A., Webster R., Elsevier Sci., 1996: 140-148
- Fleming D., Crombie D., Norbury C. et al. Observation on the influenza epidemic of November/December 1989. Brit. J.Gen. Pract., 1990, 40: 495-497
- Francis T. Vaccination against influenza. Bull. WHO, 1953, 8: 725-741
- Ghendon Y. Vaccination against influenza viruses: Current status. Viral vaccines. Advances in biotechnological processes. Ed. Mirrahi E., 1990, 14: 159-201 19а. Ghendon Y. The immune responce to influenza infection. Acta virol., 1990, 34:295-304.
- Glezen P. Consideration of the risk of influenza in children and indication for prophylaxis. Rev. Inf. Dis., 1980, 2: 408-420
- Gobert R., Vincent-Flaquet J., Bentejac V. et al. Immunogenicity of the influenza virus vaccine alone and associated with the tetanus anatoxin amongst aged people. Franco-Soviet Colloquium on respiratory diseases and influenza: 1985: 1-6
- Grmek M. Les maladies a l'aube de la civilization accidentale. Payot., Paris, 1893. 22a. Gruber W. Children as a target for immunization. Textbook of influenza. Eds K. Nicholson, R. Webster, A. Hay, Blackwell Sci., 1998: 435-444
- Honkanen P., Keistinen T., Kivela S. Reaction following administration of influenza vaccine alone or with pneumococcal vaccine to the elderly. Arch. Intern. Med., 1996, 156: 205-208
- Huang K., Ruben F., Rinaldo C. et al. Antibody responses after influenza and pneumococcal immunization in HIV infected homosexual man. JAMA, 1987, 257: 2047-2050
- Jennings R. et al. Inactivated influenza virus vaccines in man: a comparative study of subunit and split vaccines using two methods for assessment of antibody responses. Vaccine, 1984, 2: 75-79
- Jianping H., Xin F., Changshun L. et al. Assessment of effectiveness of Vaxigrip. Vaccine, 1999, 17: S57-S58
- Juline, Dupret. Etude de l'immunogenicite et de la tolerance du vaccine contre le grippe fragmente an tween-ether dan une population de sujets jeunes et ages 1993. Data of file at Pasteur Merieux Serum and Vaccine.
- Levy E. A cost-benefit study of influenza vaccination for 25 to 64 year old French people. In Options for the control of influenza II. Eds. Hannonn C., Kendal A., Klenn H., Elsevier Sci., 1993: 47-52
- Levy E. French economic evaluation of influenza and influenza vaccination. Pharm. Economics. 1996., 9 Suppl. 3: 62-66
- Margolis K., Ploand G., Nichol K. et al. Frequency of adverse reactions after influenza vaccination. Am. J. Med., 1989, 88: 27-29
- Margolis K., Nichlol K., Poland G. et al. Frequency of adverse reactions to influenza vaccine in the elderly. A randomized controlled trial. JAMA, 1990, 264: 1139-1141
- Merlin M., Buisson Y. L'evaluation de l'efficacite de la vaccination antigrippale dans les armees an cours de l'hiver 1989-1990. Bull. Epidemiol. Hebdomadaire, 1990, N41: 175-176
- Nichol K., Lind A., Margolis K., et al. The effectiveness of vaccination against influenza in healthy, working adults. N. Engl. J. Med., 1995, 333: 889-893
- Nichol K. Efficacy / clinical effectiveness of inactivated influenza virus vaccines in adults. Textbook of Influenza Eds Nicholson K., Webster R., Hay A. Blackwell Sci., 1998: 358-372
- Nichol K., Goodman M. The health and economic benefit of influenza vaccination for healthy and at-risk persons aged 65 to 74 years. Pharm. Economics. 1999, 16: 63-71
- Odelin M., Pozzetto B., Aymard M. et al. Role of influenza vaccination in the elderly during an epidemic of A/H1N1 virus in 1988-1989: clinical and serological data. Gerontology, 1999, 39: 109-116
- Picolet H. Immunogenicity and safety of two doses of inactivated triton split influenza vaccine in children between 3 and 8 years old. Pasteur Merieux Serum and Vaccines. Expert report A 146 pVB1/6RT03295, 1995.
- Picolet H. Paediatric influenza vaccine. Pasteur Merieux Serum and Vaccines. Expert report A 164 IC3/11.96, 1996.
- Potter C. Chronicle of influenza pandemics. Textbook of Influenza. Eds. Nicholson K., Webster R., Hay H. Blackwell Sci., 1998: 3-18.
- Riddiongh M., Sisk J., bell J. Influenza vaccination Cost-effectiveness and public policy. JAMA, 1983, 249: 3189-3195
- Sheifele D., Biornson G., Johnston J. Evaluation of adverse events after influenza vaccination in hospital personnel. Can. Med. Assoc. J. 1990, 142: 127-130
- Schoenbaum S. Impact of influenza in persons and population. In Options for the control of influenza III. Eds. Brown. L. Hampson A., Webster. R., Elsevier Sci., 1996: 17-25
- Simonsen L., Schonbenger L., Stroup D., et al. The impact of influenza on mortality in the USA. In Options for the control of influenza III. Eds. Brown L., Hampson A., Webster R. Elsevier Sci., 1996: 26-33
- Smith W., Andrews C., Laidlaw P. A virus obtained from influenza patients. Lancet., 1933. i: 66-68
- Smith W., Andrews C., Stuart-Harris C. The immunization of human volunteers. Special Rep. Ser. Med. Res. Counci, 1938, 228: 137-144
- Spila-Alegani S., Salmaso S., Rota M. et al. Reactogenicity in the elderly of nine commercial influenza vaccines: results form Italian SVEVA study. Vaccine, 1999, 17: 1898-1904
- Stenius-Aarniala B., Huttinen J., Pyhala R et al. Lack of clinical exacerbations in adults with killed influenza virus. Chest. 1986, 89: 786-789
- Wiselka M., Vaccine Safety. Textbook of Influenza Eds. Nicholson K., Webster R., Hay A. Blackwell Sci., 1998: 346-357
- Wood S., Alexseiv A., Nguyen V. Effectiveness and economical impact of vaccination against influenza among a working population in Moscow. Vaccine, 1999, 17: S81-S87
- Zei T., Neri M. Iozio A. Immunogenicity of trivalent subunit and split influenza vaccines (1989-90 winter season) in volunteers of different groups of age. Vaccine, 1991, 9: 613-617
- Zuckerman M., Wood J., Chakraverty P., et al. Serological responce in volunteers to inactivated trivalent subunit influenza vaccine: antibody reactivity with epidemic influenza A and B strains and evidence of a rapid immune responce. J Med Virol., 1991, 33:133-137.
