Противовоспалительные свойства фузафунгина
СтатьиД.м.н., проф. А.С. Лопатин, асп. А.В. Варвянская
Кафедра болезней уха, горла и носа (зав. — проф. А.С. Лопатин) Московской медицинской академии им. И.М. Сеченова
Ключевые слова: воспаление, заболевания верхних дыхательных путей, лечение, фузафунгин.
THE ANTI-INFLAMMATORY PROPERTIES OF FUSAFUNGINE
A.S. Lopatin , A.V. Varvyanskaya
Key words: inflammation, upper respiratory tract diseases, treatment, fusafungine.
Фузафунгин (биопарокс) — бактериостатический полипептидный антибиотик широкого спектра действия, предназначенный для местного применения [7]. Препарат используется для лечения инфекционно-воспалительных заболеваний дыхательных путей (ринит, ринофарингит, трахеит, ларингит, тонзиллит, состояние после тонзиллэктомии, синусит и бронхит). Фузафунгин представляет экстракт, полученный из Fusarium lateritium WR (штамм 437), состоящий из циклогексапептидов, группы енниатинов, в которых α-оксикислота представлена α-оксиизовалериановой кислотой, а α-аминокислоты находятся в N-метилированной форме. Спектр антибактериальной активности фузафунгина распространяется на все грамположительные бактерии, включая Streptococcus pneumoniae, Streptococcus pyogenes, Staphylococcus aureus и др., а также на некоторые грамотрицательные бактерии (Moraxella catarrhalis, Neisseria meningitidis), ряд анаэробных микроорганизмов, Candida albicans и Mycoplasma pneumoniae. На сегодняшний день отсутствуют сообщения как о прямой, так и о перекрестной устойчивости указанных микроорганизмов к фузафунгину [5]. Помимо прямого антибактериального действия фузафунгин обладает дополнительными противовоспалительными свойствами, обнаруженными в экспериментальных исследованиях и подтвержденными на животных, а также в клинических плацебо-контролируемых исследованиях. Об этих свойствах и пойдет речь в данном обзоре.
Как известно, воспаление в норме является защитным механизмом, благодаря которому происходит обезвреживание и уничтожение патогенных факторов. При этом воспалительный ответ должен быть не чрезмерным и не слишком слабым, а достаточным и адекватным по силе. В норме инфекционный воспалительный процесс протекает следующим образом: патогенные микроорганизмы повреждают ткани организма, поврежденные ткани вырабатывают хемоаттрактанты, привлекающие макрофаги в очаг инфекции. Макрофаги путем фагоцитоза уничтожают микроорганизмы в области их внедрения. Происходит восстановление поврежденных тканей и завершение воспалительного процесса. При чрезмерной воспалительной реакции и при подавлении естественных защитных сил, когда организму не удается освободиться от повреждающих агентов, продукция фагоцитами свободных радикалов может стать неконтролируемой. В этом случае происходит деструкция тканей организма [9]. Вырабатываемые макрофагами лизосомальные ферменты, свободные радикалы и провоспалительные цитокины привлекают в очаг воспаления новые макрофаги и также повреждают ткани организма. Формируется порочный круг — воспаление становится хроническим.
Противовоспалительное действие фузафунгина основано на его способности ингибировать продукцию различных провоспалительных медиаторов при сохранении способности макрофагов к фагоцитозу. Механизм ингибирующего действия фузафунгина на клетки (макрофаги, Т-клетки, полиморфно-ядерные лейкоциты) и медиаторы воспаления схематично представлен на рис. 1.
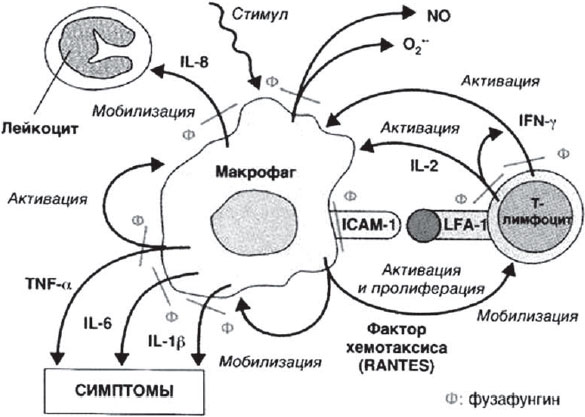
Рис. 1. Ингибирующее действие фузафунгина на клетки и медиаторы воспаления.
В ряде экспериментов было доказано, что фузафунгин снижает выработку макрофагами свободных радикалов, не нарушая при этом процесс фагоцитоза.
В 1998 г. R. White и соавт. [11] в экспериментальных исследованиях in vitro продемонстрировали, что выработка свободных радикалов макрофагами значительно снижается в присутствии фузафунгина. Исследователи изучили синтез супероксиданиона мышиными перитонеальными макрофагами. Фузафунгин достоверно снижал продукцию свободных радикалов (О2—) стимулированными макрофагами. Сходный эффект наблюдался и при действии пироксикама, в то время как индометацин не обнаруживал никакой ингибиторной активности, что подтверждает предыдущие результаты.
Влияние фузафунгина на фагоцитоз было изучено этой же группой исследователей с использованием меченых эритроцитов радиоактивным изотопом и активированных макрофагов. Эритроциты, прилипшие к поверхности макрофагов, и фагоцитированные клетки можно было легко отличить с помощью лизиса эритроцитов на поверхности макрофагов. Все интактные макрофаги фагоцитировали эритроциты, которые можно было идентифицировать визуально или по радиоактивной метке. Фузафунгин обладал очень слабым ингибирующим эффектом в отношении фагоцитоза через 45 мин реакции при низкой достоверности результата (0,01<2p<0,05). Полученные данные позволили сделать вывод о том, что в присутствии фузафунгина фагоцитоз сохраняется.
Подавляющее действие фузафунгина на продукцию фагоцитами свободных радикалов было также продемонстрировано в исследовании, проведенном S. Gossart и соавт. [4]. В данной работе было изучено воздействие фузуфунгина на образование свободных радикалов макрофагами мыши, стимулированными различными объектами фагоцитоза, в том числе Staphylococcus aureus. Продукцию активных форм кислорода оценивали методом хемилюминесценции. Полученные результаты свидетельствуют о том, что фузафунгин вызывает быструю и обратимую мобилизацию внутриклеточного кальция (Са2+) в макрофагах. На основании этих исследований французские ученые пришли к выводу, что фузафунгин ингибирует образование свободных радикалов макрофагами по кальцийзависимому механизму, в котором задействована АТФаза.
Фузафунгин подавляет секрецию молекул межклеточной адгезии (ICAM-1) и экспрессию фактора некроза опухоли α (TNF-α) на поверхности макрофагов in vitro [3]. Альвеолярные макрофаги играют ключевую роль в воспалительной реакции респираторной системы. Во время острой фазы воспаления макрофаги высвобождают TNF-α, индуцируя выраженную экспрессию ICAM-1 на поверхности макрофагов. Регуляция экспрессии TNF-α и ICAM-1 может оказаться одним из главных механизмов, с помощью которого макрофаги регулируют воспалительную реакцию. Следовательно, воздействие на уровне макрофагов открывает новые перспективы в плане контролирования хода воспалительной реакции. Было исследовано влияние фузафунгина на активированные альвеолярные макрофаги и экспрессию TNF-а, а также секрецию ICAM-1. Альвеолярные макрофаги, выделенные от пациентов после пересадки легких, культивировали, обогащали, активировали в течение 24 ч рекомбинантным Y-интерфероном и экспонировали в присутствии различных концентраций фузафунгина. Экспрессию ICAM-1 антигена на поверхности макрофагов определяли методом проточной цитометрии с помощью моноклональных антител против CD54, а секрецию TNF-α оценивали в иммуноферментном анализе. Фузафунгин подавлял экспрессию ICAM-1 антигена и достоверно ингибировал экспрессию молекул ICAM-1 начиная с концентрации 2 мкг/мл. Помимо этого фузафунгин достоверно дозозависимым образом ингибировал индуцированную рекомбинантным γ-интерфероном секрецию TNF-α начиная с концентрации 2 мкг/мл. Механизм, с помощью которого фузафунгин подавляет экспрессию TNF-α и ICAM-1, по-видимому, реализуется на посттранскрипционном уровне, поскольку фузафунгин никак не влиял на синтез и РНК молекул TNF-α и ICAM-1. Эти результаты свидетельствуют о том, что фузафунгин оказывает противовоспалительное действие в терапевтических концентрациях.
Кроме того, фузафунгин обладает антиадгезивной активностью по отношению к Haemophilus inflenzae, не оказывая в отношении этого возбудителя прямого антибактериального действия [2]. Известно, что первым этапом инфекционного процесса является адгезия бактерий к эпителию. Поэтому препараты, действующие на этот феномен, могут влиять на последующие этапы развития инфекции. Было изучено действие фузафунгина на адгезивные свойства штаммов H. inflenzae, полученных от пациентов с инфекциями верхних дыхательных путей. Результаты показали, что даже половина минимальной ингибирующей концентрации фузафунгина достоверно уменьшает число прилипающих к эпителию бактерий. Этот факт убедительно показывает, что фузафунгин предупреждает колонизацию слизистой оболочки носоглотки бактериями H. influenzae (рис. 2).
Рис. 2. Влияние фузафунгина на адгезивные свойства возбудителей инфекции.
K. Westrin [10] в своем исследовании продемонстрировал противовоспалительные свойства фузафунгина в экспериментальной модели риносинусита у кроликов. В этой работе 20 кроликов были инфицированы S. pneumoniae.
В течение 10 дней проводилось лечение риносинусита фузафунгином либо плацебо. После вскрытия животных в основной группе было отмечено достоверно менее выраженное воспалительное изменение слизистой оболочки носа и околоносовых пазух, а также снижение высвобождения медиаторов воспаления (альбумина, миелопероксидазы) по сравнению с группой плацебо.
Изученные в экспериментальных работах противовоспалительные свойства фузафунгина нашли подтверждение в ряде рандомизированных плацебо-контролируемых двойных слепых клинических исследований.
Так, A. Ghaem [1] методом риноманометрии оценил влияние 10-дневного курса лечения фузафунгином на состояние слизистой оболочки полости носа после провокации аэроаллергеном. В исследовании приняли участие 48 добровольцев с аллергическим ринитом, которым носовое дыхание исследовали методом передней активной риноманометрии в состоянии покоя, после чего проводилась интраназальная провокация причинным аэроаллергеном. В течение 10 дней пациенты получали фузафунгин либо плацебо, после чего проводилась повторная риноманометрия. После провокации аллергеном в группе плацебо носовое сопротивление до и после лечения достоверно не различалось. Напротив, после лечения фузафунгином наблюдалось достоверное снижение носового сопротивления. Более того, реакция слизистой оболочки носа на введение аллергена в группе, получавшей лечение фузафунгином, была достоверно ниже, чем в группе плацебо.
В исследовании, проведенном M. Schwellnus и соавт. [8], была проведена оценка эффективности фузафунгина по устранению симптомов раздражения верхних дыхательных путей у бегунов на марафонскую дистанцию (56 км). Установлено, что в этой группе пациентов инфекции респираторного тракта в течение 2 нед после забега возникают в 2 раза чаще, чем у не участвовавших в забеге. В исследование были включены 96 бегунов на марафонскую дистанцию, не имеющих сенсибилизации к аэроаллергенам. Пациенты основной группы получали 4 дозы фузафунгина 4 раза в день за 2 дня до забега и в течение 9 дней после него. Участники исследования самостоятельно проводили оценку выраженности симптомов раздражения верхних дыхательных путей (насморк, заложенность носа) до забега и в течение последующих 9 дней. Было установлено, что в течение 9 дней после забега симптомы раздражения верхних дыхательных путей достоверно менее выражены у получавших фузафунгин по сравнению с группой плацебо. Кроме того, у бегунов основной группы не было получено роста патогенной микрофлоры в посевах, взятых со слизистой оболочки глотки.
В 2002 г. в Германии были опубликованы результаты исследования эффективности фузафунгина при лечении ранней стадии острого риносинусита [6], которая, как известно, имеет вирусную этиологию. В этом двойном слепом плацебо-контролируемом исследовании приняли участие 20 пациентов c острым риносинуситом, которые в течение 2 нед получали лечение фузафунгином либо плацебо по 2 дозы в обе половины носа каждые 4 ч. Для оценки эффективности лечения использовались объективные методы (эндоскопическое исследование полости носа, передняя активная риноманометрия, акустическая ринометрия, сонография). Также проводилась субъективная оценка выраженности симптомов риносинусита исследователями и пациентом до начала лечения и на контрольных визитах (1, 3, 7, 10 и 14-й дни). В группе, получавшей лечение фузафунгином, отмечалось достоверное уменьшение выраженности симптомов заболевания уже в 1-е сутки лечения, чего не было отмечено в группе плацебо. По окончании курса лечения и исследователи, и пациенты отметили достоверно лучшие результаты терапии в основной группе. В исследовании было доказано, что фузафунгин устраняет симптомы острого риносинусита в первые дни заболевания и предотвращает развитие его более тяжелых форм.
Таким образом, проведенные клинические исследования убедительно подтвердили наличие открытых ранее противовоспалительных свойств фузафунгина, поскольку только этими свойствами может быть объяснен эффект препарата в ситуациях, когда воспалительный процесс в верхних дыхательных путях имеет не бактериальную, а иную (вирусную, аллергическую) природу. Эти дополнительные свойства препарата, формально считающегося антибиотиком, и открывающиеся в связи с их наличием новые перспективы применения в клинике, безусловно, требуют дальнейшего изучения.
ЛИТЕРАТУРА
1. Ghaem A., Harpey C. Evaluation of the anti-inflammatory activity of fusafungine by rhinomanometry. Rhinology 1988; 5: 63—68.
2. German-Fattal M. Adherence of Haemophilus influenza to human epithelial cells. Eur Resp 1989; 2: Suppl 18: 454.
3. German-Fattal M. Expression and modulation of TNF-α and ICAM-1 RANTES in human alveolar macrophages from lung-transplant recipients in vitro. Transpl Immunol 1998; 6: 1983—1992.
4. Gossart S., Quartulli F., Bernard J., Pipy B. Fusafungine, an antibiotic, inhibits inflammatory stimuli-triggered respiratory burst in macrophages via a calcium-dependent mechanism. Am J Resp Crit Care Med 1998; 157: Suppl 3: 272.
5. Leclerq R., Auzou M. Evaluation of the in vitro activity of fusafungine. Chenotherapy 2005; 17: Suppl 3: 210.
6. Mosges R., Spaeth J., Berger K. et al. Topical treatment of rhinosinusitis with fusafungine nasal spray. Arzneim Forsch Drug Res 2002; 12: 877—883.
7. Newman S.P. Scintigraphic assessment of the oropharyngeal and nasal depositions of fusafungine from pressurized inhaler and from a novel pump spray device. J Pharmacol 1995; 47: 818—821.
8. Schwellnus M.P., Kiessig M.G., Derman E.W., Noakes T.D. Fusafungine reduces symptoms of upper respiratory tract infections (URTI) in runners after 56 km race. Med Sci Sports Exer 1997; 29: Suppl 5: 1685: Abstract: PU23598.
9. Weissmann G., Korchak H.M., Perez D.H. et al. Leukocytes as secretory organs of inflammation. Adv Inflam Res 1979; 1: 95.
10. Westrin K.M. The anti-inflammatory effect of fusafungin, during experimentally induced rhinosinusitis in rabbits. Eur Arch Otorhinolaryngol 1998; 255: 195—201.
11. White R.R., Mattenberg L., Giessinger N. et al. Anti-inflammatory activity of fusafungine: effect on macrophages. Drugs Dis 1987; 3: 77—82.
Комментарии
ПРАКТИКА ПЕДИАТРА
