Зуд при атопическом дерматите у детей: известные механизмы и возможности его долгосрочного контроля
Статьи Опубликовано в журнале:
РМЖ « ПЕДИАТРИЯ » № 1, 2015 К.м.н. А.В. Камаев1, к.м.н. О.В. Трусова1, к.м.н. И.А. Камаева2
1 ГБОУ ВПО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России
2 ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Зуд и вызванное им расчесывание кожи тесно связаны с атопическим дерматитом (АД). Во многих руководствах и клинических описаниях кожный зуд рассматривается как ключевая, часто дифференциально-диагностическая характеристика АД [1–3].
Именно в педиатрической практике влияние зуда на выраженность клинических проявлений АД трудно переоценить. Пациенты разного возраста при отсутствии контроля над зудом могут расчесывать кожу вплоть до кровоточащих эрозий; в свою очередь, травматизация кожных покровов стимулирует локальную активацию нервных окончаний и выброс биологически активных веществ, поддерживая патологическое ощущение зуда у детей с АД. В публикациях дерматовенерологов встречаются определения АД как «кожного зуда, который высыпает» [4]. Это указывает на ключевую роль кожного зуда и расчесывания в патогенезе АД у детей.
Следует отметить важнейшую роль кожного зуда в формировании внутренней картины болезни у страдающего ребенка. На сегодняшний день АД как хроническое заболевание относится к контролируемым, но неизлечимым заболеваниям. В этой связи такой показатель, как качество жизни больного, является одним из ведущих маркеров контроля болезни в целом. Показано, что именно зуд кожи имеет определяющее влияние на итоговое качество жизни у пациентов с АД [5]. Пиковое нарастание ощущения кожного зуда в вечерние и ночные часы приводит к нарушениям сна; расчесы и дискомфорт могут вести к стигматизации и социальной дезадаптации. Таким образом, понимание механизмов кожного зуда и фармакологические и нефармакологические инструменты его контроля являются краеугольным камнем терапии и, шире, динамического наблюдения пациентов с АД, особенно в педиатрической практике.
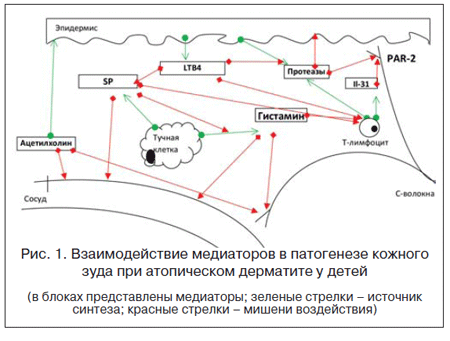
Современная база доказательных медицинских знаний отличается разнообразием подходов к пониманию патогенеза и возможных терапевтических мишеней в отношении кожного зуда при АД у детей. Начало XXI в. ознаменовалось большим числом часто противоречивых публикаций по молекулярным основам зуда как патологического процесса. Получены новые сведения об особом неврологическом восприятии кожного зуда как ощущения; обсуждаются наличие и значимость специфических периферических немиелинизированных С-волокон и их взаимоотношения с рецепторами и путями передачи болевых ощущений. Наряду с гистамином, который традиционно рассматривался как основной медиатор зуда при АД, обсуждается роль таких посредников, как субстанция Р (SP), протеазы, ацетилхолин, некоторые цитокины, фактор активации тромбоцитов, лейкотриены (LT) и серотонин [6].
Открытие каждого из этих молекулярных посредников сопровождалось надеждой на новую терапевтическую мишень применительно к АД. Однако детальное нейрофизиологическое и биохимическое изучение механизмов зуда привело к пониманию всей сложности медиаторной регуляции этого процесса. Не исключена различная вовлеченность каждого из представленных механизмов при одном и том же заболевании у разных пациентов. Рассмотрим подробнее патогенетическую роль наиболее значимых из перечисленных молекул.
Молекулярные медиаторы зуда АД у детей
Протеазы
Экспериментально показано, что ферменты, которые относятся к группе эндогенных сериновых протеаз: трипсин, триптаза у человека при внутрикожном введении вызывают ощущение кожного зуда [7]. Введение этих и других протеаз вызывает расчесывание и у лабораторных животных [8]. В коже больных АД эндогенные протеазы находятся в активированном состоянии [7]. У протеаз много биологических функций, но можно выделить механизм, через который возникает зуд, – это взаимодействие с особыми рецепторами, активируемыми протеазами (PAR).
Известно 4 вида таких рецепторов, их обозначают PAR1-4; все они относятся к рецепторам, связанным с G-протеином.
В моделях на животных показано возникновение расчесывания в результате активации рецепторов PAR1 и PAR4, но большинство исследований сосредоточено на роли PAR2 рецепторов в происхождении зуда [8]. Активация рецептора PAR2 селективными агонистами как у человека, так и у лабораторных животных вызывает выраженный зуд и расчесывание [7].
Агонистами рецепторов группы PAR могут выступать различные эндогенные и экзогенные протеазы, при взаимодействии с этими рецепторами все они вызывают ощущение зуда. Интересно, что трипсин активирует все 4 подтипа PAR рецепторов, а триптаза избирательно активирует PAR2 [9]. Важным звеном патогенеза АД и зуда, связанного с аллергическим воспалением, являются тучные клетки – богатый источник триптазы [10].
Различные клетки (в первую очередь поврежденные эпителиоциты и лимфоциты) становятся источниками пептидаз семейства калликреина (KLKs), особенно KLK5 и KLK14. Эти белки также могут активировать PAR2, они обнаружены в активированном состоянии в участках пораженной кожи при АД у людей [11].
Многие аллергены содержат экзогенные протеазы, стимулирующие рецепторы PAR: например, протеазы клещей домашней пыли, тараканов (активируют PAR2) [12, 13].
Рецепторы PAR представлены на клетках различных типов. В патогенезе кожного зуда важно, что они хорошо представлены на нейронах – чувствительных нервных окончаниях и в спинальных ганглиях. При этом экспрессия PAR2 на нейронах у детей с АД резко увеличивается [6, 11]. При активации рецептора PAR2 стимуляция нервного волокна происходит через ионный канал TRPV1. В экспериментальной модели на мышах показано, что вызванное трипсином расчесывание ингибируется антагонистами рецептора TRPV1 либо в случае генетического выключения экспрессии гена TRPV1 [14].
Наличие экспрессии рецепторов PAR2 на других клетках (не нейронах) свидетельствует о том, что при активации PAR2 зуд может возникать непрямым путем. Например, стимуляция PAR2 на кератиноцитах приводит к расчесыванию с участием LTB4 [15].
Лейкотриены
Внутрикожное введение цистеиниловых LT, в частности LTB4, вызывает локальное воспаление, которое у некоторой части испытуемых людей сопровождается зудом [16]. У мышей внутрикожное введение LTB4 провоцирует расчесывание, а антагонисты рецептора LTВ4 купируют этот эффект [15].
Неизвестно, связаны ли индуцированные LTВ4 зуд и расчесывание с прямым воздействием на сенсорные нервные окончания, либо они вторичны и появляются в результате воспалительного процесса. Интересно, что и сами LT могут выступать одним из комплексов посредников при реализации зуда, вызванного введением других медиаторов. Так, расчесывание у мышей, спровоцированное S Р, подавляется ингибиторами 5-липоксигеназы и рецептора к LTВ4 [17].
Субстанция Р
SP представляет собой нейропептид, обнаруживаемый главным образом в нервных окончаниях кожи, воспринимающих боль (ноцицептивных). Это вещество может высвобождаться и влиять на проницаемость сосудистой стенки и иммунный ответ, приводя к процессам, которые обобщены термином «нейрогенное воспаление» [18]. Такую же роль SP играет и при аллергическом воспалении, при этом его источником служат не нервные, а тучные клетки кожи человека [19]. При экспериментальном внутрикожном введении людям SP провоцирует ощущение зуда как у здоровых индивидуумов, так и у пациентов с АД [19, 20]. Более того, у пациентов с АД была показана повышенная плотность SP-позитив-ных нервных волокон кожи [21].
Считается, что у людей в основе механизма зуда, провоцируемого S P, в значительной мере лежит высвобождение гистамина из тучных клеток [19, 20]. Назначение антагонистов Н1-рецепторов в экспериментальных условиях подавляет формирование кожного зуда как у здоровых добровольцев, так и у пациентов с АД [19, 20]. SP главным образом активирует рецепторы нейрокинина-1 в наномолярных концентрациях. Этот механизм дегрануляции тучных клеток, индуцированной S P, представляется наиболее вероятным, но могут быть задействованы и другие механизмы. Недавно было показано, что SP в сопоставимой концентрации стимулирует также и MrgX2-рецепторы, которые спарены с G-белком и экспрессируются на тучных клетках человека. Некоторые MrgX2-агонисты (включая SP) провоцируют высвобождение гистамина [23].
Интерлейкин-31
В исследованиях показано заметное повышение концентрации T-хелперов 2-го типа интерлейкина (IL) -31 в коже пациентов с зудящими дерматозами (АД, но-дулярное пруриго) [23]. IL-31 принадлежит к семейству IL-6 и связывается с гетеродимерными рецепторами: IL-31 рецептор и рецептор онкостатина М [24]. В одной из моделей генетически детерминированного АД на мышах концентрация IL-31 в коже резко повышена, такая избыточная экспрессия IL-31 приводит к постоянному почесыванию. Интересно, что блокада IL-31 анти-IL-31 антителами уменьшает расчесывание у этих мышей [25].
В коже IL-31 может взаимодействовать с клетками различных типов, но исследования, описанные выше, показали, что IL-31, возможно, вызывает зуд в результате прямого воздействия на чувствительные нервные окончания.
Брадикинин
Уже более 30 лет известно, что у всех здоровых добровольцев при внутрикожном введении брадикинина появляется чувство сильной, жгучей боли. Приблизительно у 60% испытуемых развивается слабый или умеренно выраженный кожный зуд, однако он отмечается лишь после того, как ослабевает боль [26]. Интересны данные, опубликованные в 2006 г., о том, что при введении брадикинина больным с АД в участки пораженной кожи развивается в первую очередь интенсивный зуд, а болевые ощущения выражены в существенно меньшей степени [20].
Серотонин
Одним из эндогенных биогенных аминов, который может провоцировать кожный зуд даже у здоровых у людей, является серотонин. Описанный механизм формирования зуда заключается в стимуляции залпового потенциала действия в С-волокнах кожи человека [27]. По сравнению с чувством кожного зуда, вызванным гиста-мином, ощущения, вызываемые серотонином, были более слабыми [20, 27]. Хотя для нормальной, не поврежденной кожи серотонин является более слабым пруритогеном, опубликованы данные о том, что при введении в поврежденную кожу пациентов с АД он может являться более сильным пруритогеном [20].
На основании данных исследований селективных агонистов и антагонистов у мышей выделен особый подтип серотониновых рецепторов, который связан с формированием зуда, индуцируемого серотонином [28]. На нервных клетках человека специального подтипа рецепторов, ответственных за формирование зуда, вызванного серотонином, к настоящему моменту не выделено. Тем не менее примечательно, что зуд, связанный с истинной полицитемией, может подавляться применением пизотифена, антагониста серотониновых рецепторов 2-го типа [6].
Ацетилхолин
Внутрикожное введение ацетилхолина у здоровых людей провоцирует зуд, но, как и в случае с серотонином, он является более слабым пруритогеном, чем гистамин [27]. Ацетилхолин также может вызывать чувство боли [27]. На относительное ощущение боли и зуда могут оказывать влияние воспалительные заболевания кожи. Например, введение ацетилхолина у здоровых людей стабильно вызывает ощущение боли, а у пациентов с АД – ощущение зуда [29].
В эксперименте у мышей ацетилхолин провоцирует расчесывание кожи, которое подавляется применением антагонистов М3-мускариновых рецепторов [6]. Интересно заметить, что концентрация ацетилхолина в коже у пациентов с АД в 10 раз выше, чем у здоровых лиц. Источник ацетилхолина не ясен, но холиновая ацетилтрансфераза (фермент, необходимый для синтеза ацетилхолина) может быть обнаружена в кератиноцитах и эндотелиальных клетках кожи [30].
Гистамин
Гистамин – самый изучаемый пруритоген. Внутрикожное введение гистамина вызывает интенсивное чувство зуда, но не болезненные ощущения. В коже гистамин вырабатывается главным образом тучными клетками кожи и тесно связан с симптомами аллергического воспаления. Таким образом, зуд, вызванный острым воздействием аллергенов, является следствием высвобождения из тучных клеток гистамина, вероятно, взаимодействующего с прурецептивными С-волокнами.
Гистамин связывается с рецепторами, спаренными с G-белком. К настоящему времени выделены и клонированы 4 типа гистаминовых рецепторов, обозначаемых как H1–4 [31]. В предыдущих исследованиях было показано, что основными рецепторами, отвечающими за развитие зуда в ответ на гистамин, являются Н1-ре-цепторы, в то время как Н2-рецепторы у людей играют небольшую роль [30]. Антагонисты Н1-рецепторов подавляют зуд, связанный с воздействием аллергенов на конъюнктиву и слизистую оболочку носа [32].
Были получены экспериментальные данные, позволяющие предположить, что развитие зуда у мышей опосредуют Н1- и Н4-рецепторы [33]. Активация Н3-рецепторов у мышей ассоциирована с подавлением расчесываний, в то время как введение селективных антагонистов Н3-рецепторов провоцирует расчесывание у животных [34].
Связывание гистамина Н1-рецептором запускает каскад внутриклеточных изменений. Эти изменения могут быть специфичными для разных типов клеток (нервные, тучные, эндотелиальные, лимфоциты); общим является регулирующее влияние гистамина и активации его рецепторов на другие факторы развития чувства кожного зуда. Активация гистаминовых рецепторов опосредована G-белками и предполагает открытие различных мембранных ионных каналов, в частности, TRPV1-рецепторов (которые известны как рецепторы к капсаицину) [6].
Хотя зуд, индуцируемый гистамином, зависит от TRPV1-активации, ощущения, вызываемые гистамином (кожный зуд), не воспроизводятся путем применения агонистов TRPV1-рецепторов. TRPV1-рецепторы активируются разнообразными ноцицептивными стимулами, включая капсаицин, кислоту и болезненное нагревание [30]. В исследовании у людей было показано, что введение капсаицина в кожу человека подавляет ощущение зуда, вызываемого гистамином [6].
Таким образом, гистамин, по данным экспериментальных и клинических исследований, является одним из наиболее мощных пруритогенов. Кроме того, он выступает в качестве регулятора синтеза или выделения клетками некоторых других пруритогенов (ацетилхолина, серотонина), либо сам может быть одной из конечных молекул-эффекторов, опосредующих действие других пруритогенов (SР). В целом представленное на рисунке 1 многообразие биологических механизмов формирования кожного зуда при АД у детей отражает активный исследовательский поиск, но пока не достигает этапа доступных терапевтических воздействий. При значимости этих механизмов именно гистамин, во-первых, является ключевым звеном патогенеза аллергических реакций, а во-вторых – прямо взаимодействует с S Р, серотонином, фактором активации тромбоцитов и некоторыми другими из представленных молекул. Кроме того, только для гистамина, в отличие от других обсуждавшихся посредников, в настоящий момент доступна широкая линейка безопасных, хорошо изученных блокирующих фармакологических препаратов.
Антигистаминные препараты традиционно использовались для терапии зудящих дерматозов, особенно аллергической природы.
Современные знания позволяют предполагать, что, используя антигистаминные средства, мы достигаем не только прямого эффекта нарушения взаимодействия гистамина с его рецепторами, но и косвенно влияем на метаболизм и экспрессию других медиаторов пруритогенеза.
Современные антигистаминные препараты
Было предпринято несколько попыток различных классификаций антигистаминных препаратов. Наряду с выделением групп по химической структуре наиболее клинически ориентированным представляется разделение на препараты первого поколения (старые) и современные антигистамины. Современные антигистаминные препараты отличаются неспособностью проникать через гематоэнцефалический барьер, т. е. минимизацией седативного эффекта, вызванного у препаратов первого поколения связыванием с гистаминовыми рецепторами головного мозга. Часто это связывание было более продолжительным, чем взаимодействие с Н1-рецепторами на периферии; наряду со снижением познавательной функции блокада гистаминовых рецепторов головного мозга приводит к уменьшению перцепции (субъективного восприятия) зуда. Этот механизм, хотя и кратковременный и не лишенный определенного риска, иногда используется практическими врачами для купирования неконтролируемого зуда на пике обострения АД [35]. Подчеркнем, что седация в этом случае носит генерализованный характер. Такая схема малоприменима, например, у подростков при интенсивной учебной нагрузке. Нельзя исключать и минимальный, но существующий риск синдрома внезапной смерти детей первого года, связанный с приемом антигистаминных препаратов первого поколения [36].
Второй важной особенностью современных антигистаминных препаратов является способ их взаимодействия с гистаминовым рецептором. Молекулы препаратов первого поколения были прямыми конкурентными ингибиторами и связывались непосредственно с участком прикрепления гистамина, не меняя конформацию рецептора. Вследствие этого для них была характерна тахифилаксия, т. е. химически обусловленное снижение клинической эффективности при непрерывном использовании на протяжении более 10–14 дней. В отличие от них современные антигистаминные препараты связываются с молекулами гистаминовых рецепторов вне области прикрепления собственно гистамина; биохимический эффект их применения заключается в длительном поддержании именно неактивной, не связывающей гистамин конформации Н1-рецептора. Такое взаимодействие с рецептором не является конкурентным и не предполагает развития тахифилаксии, т. е. не требует смены препарата при клинически обусловленном длительном непрерывном применении лекарства [37].
Появление новых молекул (неседативного поколения) этой группы препаратов, направленное в первую очередь на борьбу с нежелательными явлениями (проникновением через гематоэнцефалический барьер) и тахифилаксией, сопровождалось появлением сведений из клинических исследований о неэффективности некоторых современных антигистаминов в терапии АД (в частности, в отношении уменьшения зуда).
Появление таких результатов клинических исследований привело к исключению АД из спектра показаний к применению, например, препаратов дезлоратадина. В то же время другие молекулы, относящиеся к группе современных неседативных антигистаминов, сохранили АД в качестве показания к применению.
В этом отношении интересна публикация обзора Кокрейновской библиотеки [38], в котором авторы рассматривали возможность монотерапии АД антигистаминными препаратами.
Ключевыми выводами обзора стали положения об отсутствии доказательств эффективности монотерапии ангистаминами при АД и оснований для исключения антигистаминных препаратов из комплексных схем терапии АД, что соответствует реальной клинической практике. Кроме того, длительное применение современных антигистаминных препаратов приводит и к изменению проницаемости сосудистой стенки, и к меньшим концентрациям хемоаттрактантов и других биологически активных веществ в очаге аллергического воспаления, т. е. реализует свойства, близкие к противовоспалительному действию [39].
Одним из эффективных и широко используемых в педиатрической практике препаратов группы современных неседативных антигистаминов является левоцетиризин.
Фармакологические свойства левоцетиризина
Левоцетиризин – это R-энантиомер, или активный изомер цетиризина. S-энантиомер (дистомер) – декстроцетиризин практически не обладает антигистаминным действием [40].
Фармакологические испытания показали целесообразность изоляции левовращающего изомера. Были доказаны хорошие фармакодинамические характеристики левоцетиризина: избирательная, стойкая и длительная связь с Н1-рецептором, а также низкая межсубъектная вариабельность, т. е. предсказуемость антигистаминного действия [41]. Способность связываться и продолжительность связи с Н1-рецептором у левоцетиризина в 2 раза превышают аффинность цетиризина и приблизительно в 30 раз – декстроцетиризина [42]. В ряде рандомизированных двойных слепых плацебо-контролируемых исследований in vivo показано отсутствие биологического действия декстроцетиризина. После приема левоцетиризина (2,5 мг) и цетиризина (5 мг) блокируются назальная [43] и кожная [42] провокационные пробы с гистамином, а эффект декстроцетиризина не отличается от эффекта плацебо.
Блокирование уртикарной реакции левоцетиризи-ном не менее чем на 70% длилось в среднем 21,4 ч после однократного приема данного препарата [44]. При сравнении антигистаминных препаратов in vivo показано, что левоцетиризин обладает наилучшей способностью предотвращать развитие гиперемии, волдыря и ощущения зуда в месте подкожного введения раствора гистамина по сравнению с такими соединениями, как дезлоратадин, эбастин, фексофенадин, мизоластин, лоратадин [45].
Для левоцетиризина, применяемого в терапевтических концентрациях, как и для других препаратов последнего поколения, кроме прямого антигистаминного действия характерна противовоспалительная активность. В исследованиях in vitro показано, что левоцетиризин оказывает тормозящее влияние на компоненты воспалительного каскада: привлечение и миграцию эозинофилов, высвобождение растворимых молекул ICAM-1, увеличение проницаемости сосудов [46, 47].
Проведены тщательные и подробные исследования влияния левоцетиризина на познавательную способность и психомоторную функцию. Показателями качества проведенных исследований являются: применение двойного контроля – положительного (препарат с известным седативным эффектом и сходными временными параметрами фармакокинетики) и отрицательного (плацебо), а также то, что добровольцы – участники исследования проходили тестирование нескольких различных видов деятельности ЦНС. Все это делалось для получения достоверных, непротиворечивых результатов [48]. В исследованиях не получено доказательств в пользу седативной активности левоцетиризина и влияния препарата на психомоторные функции испытуемых.
В целом подгруппа цвиттер-ионных антигистаминных препаратов (цетиризин, левоцетиризин) в практике ведения АД выгодно отличается как по наличию зафиксированных в инструкции к применению показаний, так и по лекарственным формам для пациентов младшей возрастной группы от других современных антигистаминов, представленных в РФ (табл. 1).
Супрастинекс – эффективный и доступный препарат левоцетиризина
С начала 2011 г. в Российской Федерации используется Супрастинекс – препарат левоцетиризина венгерской фармацевтической компании «Эгис». Препарат выпускается в виде таблеток 5 мг и раствора для перорального капельного применения 5 мг / 1 мл. Рекомендован к использованию с 2 лет. Компания «Эгис» пользуется заслуженной репутацией фармацевтического производства, выпускающего высококачественную продукцию; при изготовлении Супрастинекса соблюдаются все требования стандарта GMP. Производитель в соответствии с международными нормами клинических исследований, национальными регуляторными требованиями и принципами, определенными в
Хельсинкской декларации, выполнил рандомизированное двойное перекрестное исследование, доказывающее биоэквивалентность Супрастинекса и оригинального препарата левоцетиризина [49].
Таблица 1.
Сравнительная характеристика неседативных антигистаминов
| Международное непатентованное наименование | АД в показаниях к применению | Лекарственные формы для пациентов до 5 лет, зарегистрированные в РФ |
|---|---|---|
| Лоратадин | ? (кожные заболевания аллергического происхождения) | Сироп |
| Дезлоратадин | Нет | Сироп |
| Цетиризин | Да | Пероральные капли |
| Левоцетиризин | Да | Пероральные капли |
| Рупатадина фумарат | Нет | Нет |
| Фексофенадин | Нет | Нет |
Отечественные дерматологи и аллергологи обращают внимание на выраженный клинический противозудный эффект Супрастинекса [50]. Отдельно отмечаются широкий спектр показаний к применению Супрастинекса, наличие специальной педиатрической лекарственной формы и возможность его использования как при сочетании различных аллергических заболеваний, так и с целью минимизации риска развития респираторной аллергии у пациентов с имеющимся АД [51].
Положительный опыт применения препарата описан в публикациях ведущих российских экспертов в области детской аллергологии, посвященных терапии аллергического ринита и АД у детей [52, 53]. Подчеркивается именно контролирующая, а не только симптоматическая роль включения Супрастинекса в комплексные схемы терапии аллергических заболеваний у детей.
Несмотря на отсутствие доказательств, удовлетворяющих современным критериям доказательной медицины и неоднозначные результаты исследования EPAAC, применение длительных курсов левоцетиризина у детей с АД для отдельных подгрупп пациентов может обладать профилактическим эффектом в отношении прогрессирования атопического марша. Показано, что у детей с ранней ингаляционной сенсибилизацией применение левоцетиризина курсом более 6 мес. влияло на частоту формирования бронхиальной астмы и заметно снижало риск формирования тяжелого течения респираторной патологии [53, 54].
Огромное значение имеет и то, что безопасность такого и даже более долгосрочного (непрерывно до 18 мес.) применения левоцетиризина имеет солидную международную доказательную базу [55].
Заключение
Таким образом, несмотря на сложный и многоуровневый патогенетический механизм кожного зуда при АД у детей, ведущей и практически достижимой терапевтической мишенью на сегодня остаются гистамин и его рецепторы. Применение в комплексной терапии АД современных антигистаминных препаратов, например, левоцетиризина, не противоречит имеющимся данным доказательной медицины и неоднократно демонстрировало свою клиническую эффективность. Наличие в арсенале российских аллергологов, дерматологов, педиатров такого современного и доступного препарата, как Супрастинекс, позволяет уверенно контролировать и предотвращать у детей проявления АД и атопической болезни в целом.
Литература
1. Hanifin J.M., Rajka G. Diagnostic features of atopic dermatitis // Acta Derm Venereol (Stockh). 1980. № 92. Р. 44–47.
2. Akdis C.A., Akdis M., Bieber T. et al. Diagnosis and treatment of atopic dermatitis in children and adults: European Academy of Allergology and Clinical Immunology/American Academy of Allergy, Asthma and Immunology / PRACTALL Consensus Report // J Allergy Clin Immunol. 2006. Vol. 118. № 1. P. 152–169.
3. Федеральные клинические рекомендации по диагностике и лечению АД (РААКИ, 2013). Доступно на http: //nrcii.ru/docs/4.atopic_dermatitis (11.02.15).
4. Romeo S.P. Atopic dermatitis: The itch that rashes // Pediatr Nurs. 1995. № 21. P. 157–163.
5. Buske-Kirschbaum A., Geiben A., Hellhammer D. Psychobiological aspects of atopic dermatitis: An overview // Psychother Psychosom. 2001. № 70. P. 6–16.
6. Potenzieri C., Undem B.J. Basic Mechanisms of Itch // Clin Exp Allergy. 2012. Vol. 42. № 1. P. 8–19.
7. Steinhoff M., Neisius U., Ikoma A., Fartasch M., Heyer G., Skov P.S., Luger T.A., Schmelz M. Pro-teinase-activated receptor-2 mediates itch: a novel pathway for pruritus in human skin // J Neuros-ci. 2003. № 23. P. 6176–6180.
8. Tsujii K., Andoh T., Lee J.B., Kuraishi Y. Activation of proteinase-activated receptors induces itc-hassociated response through histamine-dependent and -independent pathways in mice //J Pharmacol Sci. 2008. № 108. P. 385–388.
9. Barry G.D., Le G.T., Fairlie D.P. Agonists and antagonists of protease activated receptors (PARs) // Curr Med Chem. 2006. № 13. P. 243–265.
10. Schwartz L.B. Tryptase a mediator of human mast cells // J Allergy Clin Immunol. 1990. № 86. P. 594– 598.
11. Stefansson K., Brattsand M., Roosterman D., Kempkes C., Bocheva G., Steinhoff M., Egelrud T. Activation of proteinase-activated receptor-2 by human kallikrein-related peptidases // J Invest Dermatol. 2008. № 128. P. 18–25.
12. Page K., Strunk V.S., Hershenson M.B. Cockroach proteases increase IL-8 expression in human bronchial epithelial cells via activation of protease-activated receptor (PAR)-2 and extracellularsignal-regulated kinase // J Allergy Clin Immunol. 2003. № 112. P. 1112–1118.
13. Kato T., Takai T., Fujimura T., Matsuoka H., Ogawa T., Murayama K., Ishii A., Ikeda S., Okumu-ra K., Ogawa H. Mite serine protease activates protease-activated receptor-2 and induces cytokine release in human keratinocytes // Allergy. 2009. № 64. P. 1366–1374.
14. Costa R., Marotta D.M., Manjavachi M.N., Fernandes E.S., Lima-Garcia J.F., Paszcuk A.F., Quintao N.L., Juliano L., Brain S.D., Calixto J.B. Evidence for the role of neurogenic inflammation components in trypsin-elicited scratching behaviour in mice // Br J Pharmacol. 2008. № 154. P. 1094–1103.
15. Andoh T., Kuraishi Y. Intradermal leukotriene B4, but not prostaglandin E2, induces itchassocia-ted responses in mice // Eur J Pharmacol. 1998. № 353. P. 93–96.
16. Camp R.D., Coutts A.A., Greaves M.W., Kay A.B., Walport M.J. Responses of human skin to in-tradermal injection of leukotrienes C4, D4 and B4 // Br J Pharmacol. 1983. № 80. P. 497–502.
17. Andoh T., Katsube N., Maruyama M., Kuraishi Y. Involvement of leukotriene B(4) in substance P induced itch-associated response in mice // J Invest Dermatol. 2001. № 117. P. 1621–1626.
18. Peters E.M., Ericson M.E., Hosoi J., Seiffert K., Hordinsky M.K., Ansel J.C., Paus R., Scholzen T.E. Neuropeptide control mechanisms in cutaneous biology: physiological and clinical significance // J Invest Dermatol. 2006. № 126. P. 1937–1947.
19. Toyoda M., Makino T., Kagoura M., Morohashi M. Immunolocalization of substance P in human skin mast cells // Arch Dermatol Res. 2000. № 292. P. 418–421.
20. Hosogi M., Schmelz M., Miyachi Y., Ikoma A. Bradykinin is a potent pruritogen in atopic dermatitis: a switch from pain to itch // Pain. 2006. № 126. P. 16–23.
21. Haas S., Capellino S., Phan N.Q., Bohm M., Luger T.A., Straub R.H., Stander S. Low density of sympathetic nerve fibers relative to substance P-positive nerve fibers in lesional skin of chronic pruritus and prurigo nodularis // J Dermatol Sci. 2010. № 58. P. 193–197.
22. Tatemoto K., Nozaki Y., Tsuda R., Konno S., Tomura K., Furuno M., Ogasawara H., Edamura K., Takagi H., Iwamura H., Noguchi M., Naito T. Immunoglobulin E-independent activation of mast cell is mediated by Mrg receptors // Biochem Biophys Res Commun. 2006. № 349. P.1322–1328.
23. Sonkoly E., Muller A., Lauerma A.I., Pivarcsi A., Soto H., Kemeny L., Alenius H., Dieu-Nosjean M.C., Meller S., Rieker J., Steinhoff M., Hoffmann T.K., Ruzicka T., Zlotnik A., Homey B. IL-31: a new link between T cells and pruritus in atopic skin inflammation // J Allergy Clin Immunol. 2006. № 117. P. 411–417.
24. Zhang Q., Putheti P., Zhou Q., Liu Q., Gao W. Structures and biological functions of IL-31 and IL-31 receptors // Cytokine Growth Factor Rev. 2008. № 19. P. 347–356.
25. Grimstad O., Sawanobori Y., Vestergaard C., Bilsborough J., Olsen U.B., Gronhoj-Larsen C., Matsushima K. Anti-interleukin-31-antibodies ameliorate scratching behaviour in NC/Nga mice: a model of atopic dermatitis // Exp Dermatol. 2009. № 18. P. 35–43.
26. Manning D.C., Raja S.N., Meyer R.A., Campbell J.N. Pain and hyperalgesia after intradermal injection of bradykinin in humans // Clin Pharmacol Ther. 1991. № 50. P. 721–729.
27. Schmelz M., Schmidt R., Weidner C., Hilliges M., Torebjork H.E., Handwerker H.O. Chemical response pattern of different classes of C-nociceptors to pruritogens and algogens // J Neurophy-siol. 2003. № 89. P. 2441–2448.
28. Yamaguchi T., Nagasawa T., Satoh M., Kuraishi Y. Itch-associated response induced by intra-dermal serotonin through 5-HT2 receptors in mice // Neurosci Res. 1999. № 35. P. 77–83.
29. Vogelsang M., Heyer G., Hornstein O.P. Acetylcholine induces different cutaneous sensations in atopic and non-atopic subjects // Acta Derm Venereol. 1995. № 75. P. 434–436.
30. Darsow U., Pfab F., Valet M. et al. Pruritus and Atopic Dermatitis // Clin Rev Allergy Immunol. 2011. Vol. 41. № 3. P. 237–244.
31. Shim W.S., Oh U. Histamine-induced itch and its relationship with pain // Mol Pain. 2008. № 4. P. 29.
32. Чебуркин А.А. Зуд: дифференциальная диагностика и терапия // Терапевтический архив. 2014. № 4. С. 85–90.
33. Cowden J.M., Zhang M., Dunford P.J., Thurmond R.L. The histamine H4 receptor mediates inflammation and pruritus in Th2-dependent dermal inflammation // J Invest Dermatol. 2010. № 130. P. 1023–1033.
34. Hossen M.A., Inoue T., Shinmei Y., Fujii Y., Watanabe T., Kamei C. Role of substance P on hi-stamine H(3) antagonist-induced scratching behavior in mice // J Pharmacol Sci. 2006. № 100. P. 297– 302.
35. Дворянкова Е.В., Корсунская И.М., Сакания Л.Р., Тогоева Л.Ш., Денисова Е.В., Лавров А.А. Антигистаминные препараты в решении проблемы кожного зуда // Клиническая дерматология и венерология. 2013. № 3. С. 88–91.
36. Church M.K., Maurer M., Simons F.E.R. et al. Risk of first-generation H1-antihistamines: a GA2LEN position paper // Allergy. 2010. № 65. Р. 459–466.
37. Гущин И.С. Аллергическое воспаление и его фармакологический контроль. М.: Фармарус Принт, 1998. 252 с.
38. Van Zuuren E.J.1., Apfelbacher C.J., Fedorowicz Z. et al. No high level evidence to support the use of oral H1 antihistamines as monotherapy for eczema: a summary of a Cochrane systematic review // Syst Rev. 2014. № 3. P. 25.
39. Вялов С.С., Дроздова Г.А. Коррекция кожного зуда у пациентов с зудящими дерматозами, сенильным и идиопатическим зудом // Клиническая дерматология и венерология. 2014. № 3. С. 40–48.
40. Day J.H., Ellis A.K., Rafeiro E. Levocetirizine. A new selective H1 receptor antagonist for use in allergic disorders // Drugs of today. 2004. Vol. 40. № 5. P. 415–421.
41. DeVos C., Bachert C. Business and science: a partnership for the benefit of allergic patients // Clin. Exp. Allergy Reviews. 2006. Vol. 6. P. 25–29.
42. Devalia J.L., DeVos C., Hanotte F. et al. A randomized, double blind, crossover comparison among cetirizine, levocetirizine, and ucb28557 on histamine-induced cutaneous responses in healthy adult volunteers // Allergy. 2001. Vol. 56. P. 50–57.
43. Wang D.Y., Hanotte F., De Vos C. et al. Effect of cetirizine, levocetirizine, and dextrocetirizine on histamine induced nasal response in healthy adult volunteers // Allergy. 2001. Vol. 56. P. 339–343.
44. Purohit A., Melac M., Pauli G Frossard N. Twenty four hour activity and consistency of activity of levocetirizine and desloratadine in the skin // Br. J. Clin. Pharmacol. 2003. Vol. 56. P. 388–394.
45. Clough G.F., Boutsiouki P., Church M.K. Comparison of the effects of levocetirizine and lorata-dine on histamine induced wheal, flare and itch in human skin // Allergy. 2001. Vol. 56. P. 985–988.
46. Michel L., Jean-Louis F., Dubertret L. Pharmacologic study of levocetirizine in IgE dependent hy-persensitivity cutaneous reaction in grass pollen allergic volunteers: Demonstration of mediator release and eosinophil recruitment modulation by levocetirizine // Allergy. —2001. Vol. 56. P. 150–151.
47. Thomson L., Blaylock M.G., Sexton D.W. et al. Cetirizine and levocetirizine inhibit eotaxin induced eosinophil transendothelial migration through human dermal or lung microvascular endothelial cells // Clin. Exp. Allergy. 2002. Vol. 32. P. 1187–1192.
48. Трусова О.В., Коростовцев Д.С. Левоцетиризин (Ксизал). Характеристика препарата и опыт клинического применения // Аллергология. 2006. № 2. С. 3–12.
49. Васильева О.С. Супрастинекс (левоцетиризин) – инновационный антигистаминный препарат для лечения аллергических заболеваний // Русский медицинский журнал. 2012. Т. 20. № 6. С. 336–340.
50. Круглова Л.С., Масюкова С.А., Абесадзе Г.А. Cовременные антигистаминные препараты в комплексном лечении зудящих дерматозов // Клиническая дерматология и венерология. 2014. Т. 12. № 1. С. 52–58.
51. Делягин В.М., Уразбагамбетов А. Применение супрастинекса (левоцетиризина) при атопии у детей и подростков // Русский медицинский журнал. 2012. Т. 20. № 16. С. 828–830.
52. Кондюрина Е.Г., Зеленская В.В. Антигистаминные препараты в контроле аллергических заболеваний у детей // Русский медицинский журнал. 2012. Т. 20. № 2. С. 56–57.
53. Гущин И.С. Полифункциональные противоаллергические возможности антагониста Н1-ре-цепторов – левоцетиризина // Российский аллергологический журнал. 2014. № 2. С. 11–24.
54. Caffarelli C., Santamaria F., Vottero A. et al. Progress in pediatrics in 2013: choices in allergology, endocrinology, gastroenterology, hypertension, infectious diseases, neonatology, neurology, nutrition and respiratory tract illnesses // Ital J Pediatr. 2014. № 40. P. 62.
55. Simons F.E.1. Early Prevention of Asthma in Atopic Children (EPAAC) Study Group. Safety of le-vocetirizine treatment in young atopic children: An 18-month study // Pediatr Allergy Immunol. 2007. Vol. 18. № 6. P. 535–542.
