Эффективность воздействия новейшего антидепрессанта агомелатина на расстройства циркадианного цикла отдых-активность, депрессивные и тревожные симптомы у пациентов с большим депрессивным расстройством: рандомизированное, двойное-слепое сравнение с сертрал
Статьи Опубликовано в :«ОБОЗРЕНИЕ ПСИХИАТРИИ И МЕДИЦИНСКОЙ ПСИХОЛОГИИ» »» № 3
Efficacy the Novel Antidepressant Agomelatine on the Circadian Rest-Activity Cycle and Depressive and Anxiety Symptoms in Patients With Major Depressive Disorder: A Randomized, Double-Blind Comparison With Sertraline
Siegfried Kasper, MD, PhD; Goran Hajak, MD; Katharina Wulff, PhD; Witte J. G. Hoogendijk, MD, PhD; Angel Luis Montejo, MD, PhD; Enrico Smeraldi, MD; Janusz K. Rybakowski, MD; Maria-Antonia Quera-Salva, MD; Anna M. Wirz-Justice, PhD; FranAoise Picarel-Blanchot, PhD; Franck J. Bayle, MD
J Clin Psychiatry 2010; 71:109-120
Ключевые слова: депрессия, кардиология, Вальдоксан
Цель: Оценка эффективности агомелатина, первого антидепрессанта, действующего как агонист MT1/MT2 рецепторов и антагонист 5-HT2C рецепторов, в сравнении с сертралином по показателям амплитуды циркадианного цикла отдых-активность, депрессивных и тревожных симптомов у пациентов с большим депрессивным расстройством (БДР).
Метод: Амбулаторные пациенты с диагнозом БДР по критериям DSM-IV-IR получали агомелатин 25 - 50 мг (n = 154) или сертралин 50 - 100 мг (n = 159) в рамках 6-недельной рандомизированной двойной-слепой терапии. Исследование проводилось с 2005 по 2006 г.г. Главным показателем эффективности было изменение стартовой амплитуды индивидуального цикла отдых-активность через 6 недель терапии в соответствии с непрерывными измерениями методом запястной актиграфии и записями сна. Дополнительными показателями эффективности были эффективность сна и латентность сна, которые регистрировались методом актиграфии, а также эффективность редукции симптомов депрессии (суммарный балл 17-пунктовой Шкалы депрессии Гамильтона и баллы Шкала общего клинического впечатления) и симптомы тревоги (Шкала тревоги Гамильтона - суммарный балл и баллы подшкал). Результаты: Установлено достоверное различие в пользу агомелатина в сравнении с сертралином по изменениям амплитуды циркадианного цикла отдых-активность к концу первой недели терапии (P = 0.01). При этом отмечалось параллельное достоверное улучшение латентности сна (P < 0.001) и эффективности сна (P < 0.001) с 1 по 6 неделю при терапии агомелатином в сравнении с сертралином. За 6 недель терапии агомелатином отмечалась более выраженная в сравнении с сертралином редукция симптомов депрессии (P Заключение: Превосходство агомелатина в коррекции амплитуды циркадианного цикла отдых-активность/сон-бодрствование у пациентов с депрессией на первой неделе проявляется быстрым улучшением сна и функционирования в дневное время. Установлена более высокая эффективность терапии агомелатином в сравнении с сертралином в воздействии на симптомы депрессии и тревоги за 6 недель терапии наряду с благоприятным профилем переносимости. Полученные данные позволяют прогнозировать клиническую пользу агомелатина для пациентов с БДР.
Почти все пациенты с большим депрессивным расстройством (БДР) обнаруживают психомоторные нарушения,[1] аномальные изменения циркадианных ритмов [2] (например, смещение на более раннее или позднее время фазы ритмов гормональной секреции, температуры тела или деятельности сердца [3]) и нарушения сна.[4] Существует тесная связь между регуляцией сна и циркадианных ритмов и регуляцией настроения.[5,6] Циркадианные ритмы контролируются супрахиазматическим ядром - биологическими часами в гипоталамусе, которое обнаруживает патологические изменения в посмертных исследованиях тканей головного мозга пациентов с депрессией. Нарушения сна относятся к главным симптомам депрессии: более 90% пациентов отмечает расстройства сна, неблагоприятно влияющие на функционирование в дневное время.[8] Кроме того нарушения сна относятся к наиболее частым резидуальным симптомам, связанным с неполной ремиссией и, следовательно, повышением риска рецидивов и повторных депрессивных эпизодов.[9,10] Соответственно нарушения сна часто становятся ведущей причиной обращения пациентов с депрессией за медицинской помощью, а улучшение сна является важным фактором повышения комплаентности к фармакотерапии.[11] Хотя эффективная терапия депрессии обычно сопровождается улучшением сна, антидепрессанты, такие как селективные ингибиторы обратного захвата серотонина (СИОЗС) и селективные ингибиторы обратного захвата норадреналина меняют архитектуру сна, а некоторые из них даже вызывают нарушения сна, особенно в начале терапии.[11,13] - Примерное 35% пациентов, получающих терапию СИОЗС, дополнительно назначаются гипнотики для коррекции индуцированных СИОЗС нарушений сна и тревоги.[14] Некоторые антидепрессанты, включая амитриптилин, тразодон и миртазапин, вызывают седацию и улучшают сон, но могут вызывать сонливость в дневное время.[11,12]
Психомоторная заторможенность или ажитация считаются ядерными симптомами депрессии, особенно при депрессивных состояниях с явлениями меланхолии, поэтому психомоторные дисфункции являются ключевыми симптомами для пациентов с депрессией. Психомоторная дисфункция при БДР проявляется нарушениями 24-часового профиля моторной активности.[1,15,16]
Предполагается, что актиграфические измерения являются более объективными показателями оценки психомоторной дисфункции, чем шкала заторможенности. В соответствии с данными одного из последних исследований относительная амплитуда (ОА), которая рассчитывается пропорцией активности в дневное и ночное время, также является информативным показателем психомоторных нарушений. [17] Можно предположить, что нормализация циркадианного цикла отдых-активность до развития эффекта повышения настроения может инициировать раннее общее клиническое улучшение и, следовательно, способствовать комплаентности пациента к терапии.
Агомелатин, который является первым мелатонинергическим антидепрессантом, действует как мощный агонист MT1/MT2 рецепторов и обладает свойствами антагониста 5-HT2C рецепторов.[18,19] Оба рецепторных механизма соучаствуют в реализации антидепрессивного эффекта агомелатина. [20,21] Агомелатин способен ресинхронизировать нарушенные циркадианные ритмы, как в экспериментальных моделях депрессии у животных [22], так и у здоровых молодых мужчин [23]. Эффективность агомелатина при большой депрессии подтверждена в плацебо-контролируемых исследованиях [24-26] и в исследованиях с очным сравнением с активными препаратами. [27,28] Агомелатин оказывает более быстрое и благоприятное влияние на субъективные показатели сна и функционирование в дневное время в сравнении с венлафаксином, начиная у же с первой недели лечения [27], а также корректирует объективные нарушения сна у пациентов с депрессией [29].
Целью настоящего исследования была оценка эффективности агомелатина в сравнении с сертралином с особым вниманием к показателям циркадианного цикла отдых-активность у амбулаторных пациентов с БДР. Сертралин был выбран в качестве препарата сравнения в связи с его активирующими свойствами [30] и эффектами на архитектуру сна (с нормализацией пропорции дельта сна) у пациентов с депрессией [31] , сходными с эффектами агомелатина [29]. Предполагалось, что агомелатин будет улучшать цикл отдых-активность быстрее, чем сертралин, при сопоставимом улучшении цикла отдых-активность вследствие редукции депрессии через 6 недель терапии.
Главной задачей исследования было подтвердить, что агомелатин (25-50 мг/сут) улучшает циркадианный цикл отдых-активность быстрее, чем сертралин у амбулаторных пациентов с БДР. Дополнительные задачи включали оценки влияния агомелатина на эффективность сна и латентность сна по показателям актиграфия, эффективности редукции симптомов депрессии и тревоги в сравнении с сертралином и переносимости.
Для высокой точности анализа использовалась актиграфия как метод объективного измерения циркадианных профилей отдыха и активности пациентов. В исследовании использовались миниатюрные устройства с креплением на запястье, которые позволяли выполнять амбулаторные измерения в течение нескольких недель, когда пациенты находились в естественных для них условиях с минимальными изменениями привычного образа жизни.[32] В исследованиях сна и хронобиологии показано, что актиграфия является ценным методом непрямого измерения сна и 24-часового цикла сон-бодрствование, однако этот метод редко использовался для оценки эффектов антидепрессантов у пациентов с БДР. [16]
Рисунок 1. Дизайн исследования
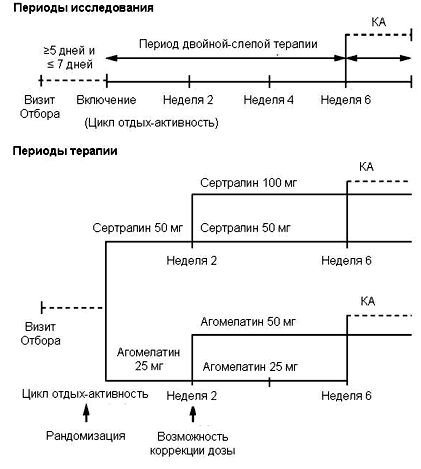
МЕТОДЫ
Выполнено международное, двойное-слепое, рандомизированное поисковое исследование с параллельными группами, которое проводилось в период с 2005 до 2006 г.г. в 37 центрах из 6 Европейских стран (Франция, Германия, Австрия, Испания, Италия и Польша) у амбулаторных пациентов с БДР, требующих терапии антидепрессантами. Дизайн исследования представлена на Рисунке 1.
Исследование проводилось в соответствии с принципами Качественной клинической практики E6 Международной конференции по гармонизации (CPMP/ICH/135/95) и Хельсинской декларации, Финляндия, 1964 г. (пересмотр в Токио, 2004). Исследование было одобрено соответствующими местными этическими комитетами. В исследовании участвовали только пациенты, давшие письменное информированное согласие.
В исследовании был предусмотрен период отмывки, соответствовавший периодам полужизни препаратов предыдущей терапии. Длительность периода отмывки была минимум 1 неделю, увеличивалась до 2 недель, если пациент получал ранее ингибиторы моноаминоксидазы и до максимум 5 недель, если пациент получал терапию флуоксетином или тразодоном. Соответствовавшие критериям отбора пациента методом рандомизации распределялись для терапии агомелатином 25 мг/сут или сертралином 50 мг/сут в течение 6 недель. В ходе исследования предусматривалось четыре визита: неделя 0 (стартовый) и каждые 2 недели (недели 2, 4 и 6).
Через 2 недели терапии допускалось повышение дозы агомелатина до 50 мг/сут или сертралина до 100 мг/сут в случае недостаточного улучшения в соответствии с заранее составленными критериями. Оценка соответствия этим критериям и повышение дозы осуществлялись централизованно с применением Интерактивной голосовой системы ответов; ни исследователь, ни пациент не получали этой информации. Доза сертралина 50 мг/сут считается стандартной эффективной и оптимальной терапевтической дозой, которая может повышаться по 50 мг/сут у пациентов, не обнаруживающих адекватного терапевтического эффекта в течение 2-4 недель лечения в соответствии с рекомендациями производителя. [33]
На протяжении всего периода исследования все пациенты получали по 2 таблетки внутрь однократно в сутки, независимо от назначенного препарата и суточной дозы. Все таблетки имели идентичный внешний вид от включения до завершения периода терапии у всех пациентов. Упаковки и маркировки также были полностью идентичными.
Обучение оценщиков
В исследовании участвовали опытные клиницисты, которые участвовали в совещании до начала исследования, на котором проводилось обучение процедурам измерений и была установлена согласованность оценок. До начала исследования и в ходе исследования исследователи обучались диагностике депрессии и оценке по 17-пунктовой Шкале депрессии Гамильтона (HDRS) с использованием видеоматериалов с записями интервью пациентов.
Пациенты
В исследование включались амбулаторные пациенты мужского и женского пола в возрасте от 18 до 60 лет с основным диагнозом большого депрессивного расстройства, единичный или рекуррентный эпизод умеренной или тяжелой степени по критериям DSM-IV-TR,[34] подтвержденным Кратким нейропсихиатрическим вопросником (Mini-International Neuropsychiatric Interview)[35], с баллом HDRS > 22 и суммарным баллом > 3 по пунктам HDRS №5 («инсомния: середина ночи») и №6 («инсомния: ранние утренние часы»). У пациентов не должно было быть сезонного характера обострений аффективного расстройства, психотических или кататонических симптомов, послеродовой депрессии, а продолжительность текущего депрессивного эпизода должна была составлять не менее 4-х недель. Пациенты исключались из исследования в случае высокого риска самоубийства или суицидальных попыток в течение последних 6 месяцев (балл > 2 по пункту №3 шкалы HDRS); биполярного расстройства; симптомов тревоги, например, текущего панического расстройства, обсессивно-компульсивного расстройства, посттравматического стрессового расстройства или острого стрессового расстройства; злоупотреблением или зависимостью от психоактивных веществ в течение последних 12 месяцев; резистентной к антидепрессантам депрессии в анамнезе; электросудорожной терапии или формальной психотерапии в течение последних 3-х месяцев; или светотерапии, начавшейся в пределах последних 2-х недель. Также исключались пациенты с расстройствами сна, включая обструктивное апноэ во сне и синдром беспокойных ног. Из исследования исключались пациенты с неврологическими расстройствами (деменция, судорожные состояния и инсульт), ожирением с функциональными нарушениями, серьезным или нестабильным соматическим заболеванием (неоплазия, сердечнососудистая или легочная патология, либо неконтролируемый диабет 1 или 2 типа). Другие антидепрессанты, гипнотики, анксиолитики и нейролептики запрещались для применения в ходе исследования и отменялись до начала исследования; длительность периода отмены варьировала в зависимости от периода полужизни препарата. Если требовался период отмывки гипнотика или анксиолитика, его прием должен был прекращаться не позже визита отбора.
Актиграфия
В ходе исследования от визита отбора до окончания 6-й недели терапии проводилась непрерывная запись профилей отдых-активность пациентов путем регистрации движений кисти с 2-минутными интервалами с помощью мониторов активности (Actiwatch Plus, Cambridge Neurotechnology Ltd. [CNT], Cambridgeshire, United Kingdom). [17,36,37] Пациенты носили актографы на запястье не доминантной руки, снимая их только на время принятия душа или купания. Пациенты должны были нажимать кнопку маркера событий перед засыпанием и незамедлительно после пробуждения, чтобы регистрировать эти события на актиграмме. Кроме того пациенты должны были ежедневно регистрировать распорядок сна, записывая «время засыпания» и «время пробуждения» после мониторинга активности. Эти данные сопоставлялись для определения корректного времени сна и бодрствования. Данные актиграфии загружались в компьютер, в котором генерировались актограммы, отражающие профили отдых-активность с помощью пакета программного обеспечения Actiwatch Activity and Sleep версии 7 (CNT). Затем на распечатки актограмм ежедневно вручную вносилась информация из дневников пациентов (42 дня на пациента) для верификации соответствия с маркерами в данных актиграфии с целью определения «время засыпания» и «времени пробуждения» и редактировались пробелы в данных, связанные с приемом душа/купанием.
Измерения эффективности
Эффективность влияния на циркадианный цикл отдых-активность.
Анализ записей актиграфии проводился централизованно и вслепую. С помощью программ актиграфического анализа выявлялись «циркадианные» характеристики и показатели «сна». Для определения циркадианных параметров использовался непараметрический анализ циркадианных ритмов (Non-Parametric Circadian Rhythms Анализ; NPCRA), который предусматривал совмещение всех ежедневных данных (примерно 7 дней от полуночи до полуночи) для формирования «среднего суточного» профиля активности на каждой неделе исследования. Относительная амплитуда (ОА) циркадианного цикла отдых-активность пациента, которая определялась на основании записей актиграфии, использовалась для оценки изменений циркадианных профилей сна и бодрствования в ходе терапии. ОА цикла отдых-активность рассчитывали как разность между средним уровнем активности в течение 10-ти наиболее активных часов (M10) и 5 часами минимальной активности (L5) за 24-часовой, деленная на сумму M10 и L5. Показатель варьировал от 0 до 1.
| ОА= | M10 - L5 |
| M10 + L5 |
Различие между M10 и L5 отражает амплитуду ритма. Более высокие значения ОА свидетельствуют о ритме с более высокой амплитудой, который считается нормальным и характерен для людей, не страдающих депрессией.
Эффективность влияния на сон.
Для объективной оценки изменений сна в ходе терапии использовались данные актиграфии. Вторая программа позволяет получить большое количество параметров сна на основании актиграфии. Алгоритм анализа сна, заложенный в программе CNT, использовался для определения начала сна, завершения сна, латентности сна, эффективности сна и средней продолжительности эпизодов бодрствования каждой ночью. Эффективность терапии оценивалась по показателям эффективности сна (процент времени сна за весь период пребывания в постели), латентности сна (интервал между укладыванием в постель и началом сна) и средней продолжительности пробуждений, которая определялась делением суммарной длительности бодрствования в периоде сна на на соответствующее число пробуждений.
Субъективные показатели сна оценивались с помощью Вопросник для оценки сна Leeds (Leeds Sleep Evaluation Questionnaire; LSEQ)[38], стандартизованно1 валидизированной шкалы для самооценки, предназначенной для измерения нарушений сна в условиях клиники. Вопросник содержит 10 пунктов, каждый из которых измеряется по 100 мм визуальной аналоговой шкале (Visual analog scale; VAS); результаты измерения группируются по 4 баллам, которые отражают легкость засыпания (складывается из 3-х компонентных пунктов VAS), субъективное качество сна (2 пункта VAS), легкость пробуждения (2 пункта VAS) и целостность поведения после пробуждения (3 пункта VAS, оценивающие уровень бодрствования и неповоротливости после покидания постели).
Вопросы LSEQ оценивают изменения в ходе лечения относительно состояния пациента до начала терапии исследования; соответственно, стартовых измерений не проводилось. В отсутствие формальных стартовых показателей середина шкалы на уровне 50 мм интерпретируется как отсутствие изменений в исходном (до начала исследования) состоянии пациента и может использоваться в качестве стартового значения. [39] Вопросник LSEQ заполнялся пациента на 2, 4 и 6 неделе.
Финальный показатель каждого пункта рассчитывается вычитанием из 100 мм, соответственно, чем выше балл, тем больше улучшение сна на фоне терапии.
Эффективность влияния на симптомы депрессии и тревоги.
Эффективность влияния препарата исследования на депрессии и тревогу оценивалась исследователями на каждом визите с помощью 17-пунктовой шкалы HDRS [40] и Шкалы тревоги Гамильтона (HARS),[41] соответственно. Кроме того, эффективность влияния терапии на тяжесть заболевания и общее улучшение состояния пациента оценивались с помощью Шкалы общего клинического впечатления - улучшение (CGI)[42], пункты 1 (тяжесть заболевания) и пункт 2 (общее улучшение), соответственно. Респондерами считали пациентов с редукцией стартового суммарного балла HDRS на минимум 50%. У пациентов с суммарным баллом HDRS меньше или равным 6 на момент последнего измерения квалифицировалась ремиссия.
В соответствии с показателями общего улучшения, пациенты с баллом 1 или 2 считались респондерами, а у пациентов с баллом 1 квалифицировали ремиссию.
Оценка безопасности
Нежелательные явления, сообщавшиеся пациентами, регистрировались на каждом визите. Также оценивались и регистрировались все соматические жалобы, спонтанно сообщаемые пациентом или выявленные при обследовании. Исследователь регистрировал диагноз, если нежелательное явление персистировало, дату его начала, исход, предпринятые обследования, дату ремиссии или стабилизации. Исследователь также оценивал нежелательные явления на предмет его тяжести, связи с терапией и серьезности.
На 0 и 6 неделе измерялись следующие показатели: индекс массы тела (ИМТ), который рассчитывался на основании массы тела; артериальное давление; и частота сердечных сокращений. Запись электрокардиограммы в 12-ти отведениях проводилась на неделе 0 и в случае исключения из исследования. Биохимические и гематологические показатели измерялись на 0 и 6 неделе, а также в случае преждевременного исключения из исследования.
Комплаентность
Комплаентность оценивали методом подсчета возвращенных таблеток. Комплаентность оценивали на каждом визите, затем рассчитывали общую комплаентность за период от недели 0 до недели 6.
Статистический анализ
Для оценки эффективности использовались две выборки пациентов: (1) выборка для анализа параметров актиграфии (AAS), предусматривавшего оценку объективных показателей сна, включала всех рандомизированных пациентов, принявших минимум 1 дозу терапии исследования, имеющих минимум 1 надежное стартовое значение и минимум 1 надежное послестартовое значение f ОА; (2) полная выборка для анализа (FAS), предусматривавшего оценку других показателей эффективности, включала всех рандомизированных пациентов, принявших минимум 1 дозу терапии исследования и имевших минимум 1 послестартовое значение (кроме актиграфических показателей) за 6 недель терапии.
В рамках главного анализа терапевтические группы сравнивали по выборкам AAS с помощью модели смешанных эффектов с повторными измерениями (MMRM), включая факторы терапии, времени и взаимодействия терапия-время в качестве фиксированных эффектов и стартовое значение ОА (неделя 0) в качестве коварианты: (1) в контексте динамики среднего значения ОА (выражается как изменение стартового значения) во времени (недели 1, 2, 3, 4, 5 и 6) и (2) в первые 3 послестартовые измерения (недели 1, 2 и 3). Процедура Hochberg43 использовалась для сравнения терапевтических групп на неделе 1, неделе 2 и неделе 3 для того, чтобы учитывать множественность тестов. Сходный анализ проводился для оценки среднего уровня активности в течение 10 наиболее активных часов (M10) и 5 наименее активных часов (L5) (дополнительные анализы).
Модель основного анализа также использовалась в выборке AAS для оценки средней эффективности сна, средней латентности сна и длительности пробуждений (все показатели оценивались как изменение стартовых значений) ц елью определения общего эффекта терапии за 6 недель лечения и эффекта терапии (значение Р в сравнении с 5%) на каждом послестартовом измерении (недели 1, 2, 3, 4, 5 и 6) (дополнительные анализы).
Различие между группами агомелатина и сертралина по суммарным баллам HDRS оценивались в выборке FAS методом 2-стороннего ковариационного анализа с включением факторов терапия, центра (случайный эффект) и суммарного балла HDRS на неделе 0 (стартовые значения) в качестве коварианты, на неделе 2 (дополнительный анализ) и на момент последнего послестартового измерения. Сходный анализ проводился для оценки баллов ядерных симптомов депрессии по HDRS (по Bech - суммарный балл по пунктам 1, 2, 7, 8, 10 и 13) и суммарных баллов HDRS с исключением пунктов для оценки сна, оба показателя выражались как изменение стартовых значений на момент последнего послестартового измерения (дополнительные анализы). Тест хи-квадрат использовался для оценки респондеров на неделе 2 (post hoc анализ) с учетом последнего послестартового значения и для оценки уровня ремиссии по последним послестартовым значениям (post hoc анализ).
Двусторонний t тест Student для независимых выборок проводился в выборке FAS для сравнения терапевтических групп по баллам пунктов инсомнии шкалы HDRS (суммарный балл по пунктам 4, 5 и 6) на неделе 2 и неделя 6, а также на и на момент последнего послестартового изменения, по пунктам 1 и 2 шкалы CGI с использованием последних послестартовых значений и баллов по пунктам вопросника LSEQ «засыпание» и «качество сна» на неделе 2 и для последних значений по пункту 1 вопросника LSEQ (post hoc анализы). Различия между группами агомелатина и сертралина по суммарным баллам HARS, баллам подшкал и суммарным баллам с исключением пунктов для оценки сна определялись в выборке FAS методом 1 -стороннего ковариационного анализа с включением стартовых значений в качестве ковариант для оценки изменений стартовых баллов на момент последнего послестартового измерения (post hoc анализы).
Дескриптивный анализ параметров безопасности проводился в выборке безопасности, которую составили все включенные пациенты, принявшие минимум 1 дозу терапии исследования.
РЕЗУЛЬТАТЫ
Пациенты
Из 372 пациентов, прошедших скрининг, 313 пациентов были рандомизированы для терапии агомелатином (154 пациенты) или сертралином (159 пациенты) в течение 6 недель. Возраст рандомизированных пациентов варьировал от 18 до 60 лет, средний ± SD возраст составил 43.9 ± 10.3 лет, 70.6% были женского пола. В соответствии с критериями DSM-IV-TR всем пациентам был поставлен диагноз большое депрессивное расстройство, преимущественно умеренной степени (74.4% пациентов), со средним баллом HDRS 26.3 ± 2.9. У большинства пациентов (70.3%) зафиксирован рекуррентный эпизод, среднее число предыдущих эпизодов составило 2.9 ± 2.8, средняя продолжительность текущего эпизода была 4.7 ± 4.2 месяцев. Распределение пациентов в ходе исследования от стартового визита до недели 6 представлено на Рисунке 2.
Рисунок 2. Распределение включенных пациентов.
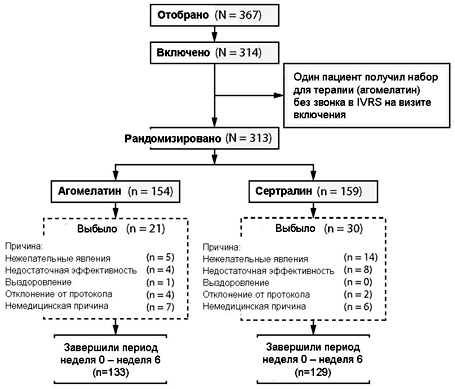
За период от недели 0 до недели 6 из исследования выбыл 51 пациент (16.3%), из них 21 (13.6%) из группы агомелатина и 30 (18.9%) из группы сертралина. Основными причинами исключения были нежелательные явления (6.1%), не медицинские причины (4.2%) и недостаточная эффективность (3.8%). Процент преждевременно выбывших пациентов был ниже в группе агомелатина, чем в группе сертралина, особенно по причине нежелательных явлений (3.2% пациентов в группе агомелатина и 8.8% в группе сертралина) и недостаточной эффективности (2.6% и 5.0%, соответственно). В подгруппе пациентов с повышением суточной дозы на неделе 2 (25.3% рандомизированных пациентов в группе агомелатина и 24.5% в группе сертралина) не было ни одного случая преждевременного исключения между неделей 2 и неделей 6 из числа пациентов, получавших агомелатин, против 6-ти преждевременно выбывших пациентов, получавших сертралин, причем 4 из них были исключены из-за недостаточной эффективности. Всего полностью завершили весь период исследования (от недели 0 до недели 6) 262 пациентов, из них 133 (86.4%) в группе агомелатина и 129 (81.1%) в группе сертралина.
Комплаентность к терапии составила 94.3% в группе агомелатина и 93.0% в группе сертралина.
Стартовые демографические и клинические характеристики пациентов из выборки FAS по терапевтическим группам представлены в Таблице 1. Значимых различий между группами по стартовым показателям не обнаружено. В выборке AAS, данные которой использовались для анализа главного критерия эффективности и актиграфических параметров сна стартовые характеристики и основные показатели эффективности рандомизированных пациентов также были одинаковыми в обеих группах. Средние ± SD стартовые значения ОА составили 0.87 ± 0.08 в группе агомелатина и 0.85 ± 0.11 в группе сертралина, без различий между группами ( P = 0.105, дополнительный анализ).
6 рандомизированных пациентов (4 в группе агомелатина и 2 в группе сертралина) не включались в выборку FAS, так как не принимали терапию исследования или не прошли после-стартовые оценки эффективности по рейтинговым шкалам и вопросникам. Выборку FAS составили 150 пациентов, получавших терапию агомелатином, и 157 пациентов, получавших терапию сертралином. Выборку AAS составили 233 пациента (73% от выборки FAS: агомелатин 117 [76%], сертралин 116 [73%]).
Таблица 1. Основные демографические показатели и характеристики БДР на момент отбора в выборке исследования
| Показатель | Агомелатин (N = 150) | Сертралин (N = 157) | Все (N = 307) |
| Возраст (лет) | |||
| Среднее ± SD | 43.3 ± 10.3 | 44.4 ± 10.2 | 43.8 ± 10.2 |
| Минимум-максимум | 19-60 | 18-60 | 18-60 |
| Пол, n (%) | |||
| Мужской | 41 (27.3) | 51 (32.5) | 92 (30) |
| Женский | 109 (72.7) | 106 (67.5) | 215 (70) |
| Число депрессивных эпизодов | |||
| Среднее ± SD | 2.8 ± 2.3 | 3.0 ± 3.2 | 2.9 ± 2.8 |
| Минимум-максимум | 1-20 | 1-30 | 1-30 |
| Медиана | 2.0 | 2.0 | 2.0 |
| Длительность текущего БДЭ, мес | |||
| Минимум- максимум | 0.5-21.8 | 0.9-20.4 | 0.5-21.8 |
| Медиана | 3.1 | 3.1 | 3.1 |
| Характеристики заболевания (критерии DSM-IV), n (%) | |||
| Рекуррентный эпизод | 104 (69.3) | 113 (72) | 217 (70.7) |
| Тяжесть | |||
| Умеренный | 110 (73.3) | 117 (74.5) | 227 (73.9) |
| Тяжелый без психотических симптомов | 40 (26.7) | 40 (25.5) | 80 (26.1) |
| С явлениями меланхолии | 34 (22.7) | 44 (28) | 78 (25.4) |
Эффективность влияния на циркадианный цикл отдых-активность
Среднее изменение стартовых значений ОА цикла отдых-активность на неделе 1 были статистически достоверно более выраженными при терапии агомелатином в сравнении с сертралином (разница между группами: -0.027; 95% CI, от -0.0478 до -0.0067; P = 0.010 в сравнении с 0.017, процедура Hochberg).
В выборке AAS динамика средней ОА статистически различалась в группах агомелатина и сертралина (взаимодействие терапия-время, P = 0.023). В группе агомелатина средняя ОА оставалась стабильной, тогда как в группе сертралина средняя ОА снижалась в периоде от неделе 0 до недели 1. Начиная с недели 2 и далее средняя ОА в группе сертралина становилась сопоставимой со средней ОА в группе агомелатина без статистически достоверных различий между терапевтическими группами (P = 0.184 на неделе 2 и P = 0.521 на неделе 3). Среднее ± SD стартовое значение средней активности за 10 наиболее активных часов (M10) повышалось на момент последнего послестартового измерения в группе агомелатина (386.6 ± 6914.9), но снижалось в группе сертралина (-430.5 ± 5934.2) со статистически достоверными различиями между терапевтическими группами в динамике показателя среднего M10 (взаимодействие терапия-время, P = 0.006).
Среднее ± SD стартовое значение средней активности за 5 наименее активных часов (L5) снижалось в обеих группах на момент последнего послестартового измерения: -120.8 ± 1302.8 в группе агомелатина и -366.8 ± 1367.1 в группе сертралина; различия в динамике между группами приближались к статистически достоверным (взаимодействие терапия-время, P = 0.121).
Эффективность влияния на параметры сна по данным актиграфии
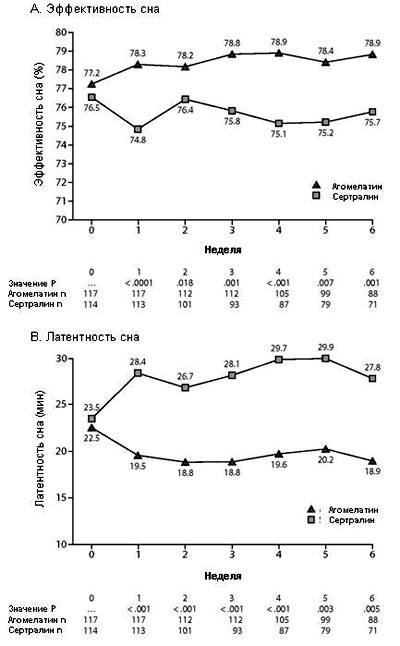
Уже с конца недели 1 и вплоть до завершения периода терапии средняя эффективность сна повышалась в группе агомелатина и снижалась в группе сертралина, со статистически достоверными различиями на каждом этапе оценки в пользу агомелатина (общее различие между терапевтическими группами, P < 0.001). Через 6 недель терапии изменение стартовых показателей эффективности сна составило 1.59 ± 5.10% для агомелатина и -1.18 ± 7.09% для сертралина, со статистически достоверными различиями между группами в пользу агомелатина (P < 0.001) (Рисунок 3).
Сходным образом, с конца недели 1 и до недели 6 средняя латентность сна снижалась в группе агомелатина, но повышалась в группе сертралина (-2.35 ± 15.75 минут для агомелатина и +6.52 ± 22.57 минут для сертралина, P < 0.001), со статистически достоверными различиями в пользу агомелатина на каждом этапе оценки, вплоть до завершения периода терапии (Рисунок 3).
Средняя длительность пробуждений снижалась при лечении агомелатином и повышалась при терапии сертралином, начиная с недели 1 (-0.84 ± 19.78 минут для агомелатина и +6.92 ± 30.13 минут для сертралина, P = 0.004), различия также были статистически достоверными на неделе 6 (P = 0.018).
Эффективность влияния на субъективные показатели сна
В выборке FAS отмечалось снижение 4-х средних баллов LSEQ в течение 6-недельного периода терапии в обеих терапевтических группах. На неделе 2 (первое измерение) отмечалось достоверно более выраженное улучшение засыпания по LSEQ при терапии агомелатином (61.61 ± 16.63 мм) в сравнении с сертралином (54.21 ± 16.99 мм) (разница между группами 7.40; 95% CI, 3.38-11.41; P < 0.001). При последнем измерении средний балл оставался выше в группе агомелатина, но без статистически достоверных различий между терапевтическими группами. Показатель качества сна обнаруживал достоверно более выраженное улучшение на неделе 2 при терапии агомелатином (60.60 ± 18.25 мм) в сравнении с сертралином (54.39 ± 19.99 мм) (разница между группами 5.21; 95% CI, 0.67-9.75; P = 0.025). При последнем измерении улучшение средних баллов было одинаковым в группе агомелатина (67.63 ± 19.51 мм) и в группе сертралина (64.61 ± 20.92 мм) без значимых различий между терапевтическими группами.
В выборке FAS улучшение показателей легкости пробуждения и целостности поведения по LSEQ измерения за весь период терапии было одинаковым в обеих терапевтических группах (Рисунок 4).
В выборке FAS стартовый балл инсомнии по шкале HDRS (сумма баллов по пунктам 4, 5 и 6) снижался на момент последнего измерения со статистически достоверными различиями между терапевтическими группами в пользу агомелатина на 0.67 (95% CI, 0.26-1.08; P = 0.001).
Такое превосходство агомелатина над сертралином также отмечалось на неделе 2 (различиями между терапевтическими группами 0.43; 95% CI, 0.04-0.81; P = 0.030) и на неделе 6 (различиями между терапевтическими группами 0.40; 95% CI, 0.01 - 0.79; P = 0.043).
Рисунок 3. Стартовые значения и различия показателей Эффективность сна (A) и Латентность сна (B) между терапевтическими группами в каждом послестартовом 7-дневном периоде по результатам анализа данных актиграфии.
Эффективность влияния на депрессивные симптомы
Шкала депрессии Гамильтона.
В выборке FAS уже на второй неделе терапии снижение стартового суммарного балла HDRS отмечалось в обеих терапевтических группах: с 26.1 ± 2.8 до 18.9 ± 6.4 для агомелатина и с 26.5 ± 3.0 до 20.3 ± 5.8 для сертралина, с тенденцией в пользу агомелатина в различиях между терапевтическими группами (различие 1.06; 95% CI, от -0.08 до 2.21; P = 0.069). Процент респондеров на неделе 2 был достоверно выше в группе агомелатина (20.0%), чем в группе сертралина (10.9%), со статистически достоверными различиями между терапевтическими группами в пользу агомелатина 9.10% (95% CI, 1.05 - 17.16; P = 0.027).
Через 6 недель терапии агомелатин превосходил сертралин по средней редукции финальных баллов HDRS (суммарные баллы HDRS составили 10.3 ± 7.0 и 12.1 ± 8.3, соответственно), с различиями между терапевтическими группами в пользу агомелатина 1.68 (95% CI, 0.15 -3.20; P = 0.031) при последнем измерении (Таблица 2). На момент последнего измерения суммарный балл HDRS с исключением пунктов для оценки сна (пункты 4, 5 и 6) составил 8.6 ± 6.0 в группе агомелатина и 9.7 ± 6.8 в группе сертралина, с различиями между терапевтическими группами 1.03 (95% CI, от -0.22 до 2.29; P = 0.107). Снижение стартовых баллов ядерных симптомов по критерию Bech свидетельствовало о превосходстве агомелатина в абсолютных значениях (-7.9 ± 4.0) в сравнении с сертралином (-7.6 ± 4.6), с различиями между терапевтическими группами 0.33 (95% CI, от -0.45 до 1.11; P = 0.406).
Процент респондеров за 6 недель терапии составил 70% в группе агомелатина и 61.5% в группе сертралина с различием в 8.5% (95% CI, -2.12 to 19.05; P = 0.119) при последнем измерении. Процент пациентов в ремиссии (суммарный балл HDRS < 6) через 6 недель терапии составил 32.7% в группе агомелатина и 28.8% в группе сертралина при последнем измерении с различием 3.82 (95% CI, от -6.52 до 14.16; P = 0.469).
Шкала общего клинического впечатления.
В выборке FAS за 6 недель терапии среднее снижение стартовых баллов шкалы CGI тяжесть заболевания на момент последнего измерения было достоверно более выраженным при терапии агомелатином (от 4.7 ± 0.7 до 2.5 ± 1.1) в сравнении с сертралином (от 4.7 ± 0.7 до 2.8 ± 1.3) (различие 0.28; 95% CI, 0.01-0.56; P = 0.043). Среднее снижение балла шкалы CGI общее улучшение с недели 2 до последнего измерения было более выраженным в группе агомелатина (1.8 ± 1.0) в сравнении с группой сертралина (2.1 ± 1.2) (различие 0.29; 95% CI, 0.040.54; P = 0.023).
Через 6 недель терапии процент респондеров составил 83.3% при терапии агомелатином и 76.9% при терапии сертралином, а процент пациентов в ремиссии был равен 46.7% при терапии агомелатином и 37.8% при лечении сертралином.
Эффективность влияния на симптомы тревоги
В выборке FAS за 6 недель терапии снижение стартового суммарного балла HARS при последнем измерении было достоверно более выраженным в группе агомелатина (среднее снижение -14.5 ± 9.8) в сравнении с группой сертралина (среднее снижение -13.1 ± 11.0) (различие 2.34; 95% CI, 0.43-4.26; P = 0.017).
Снижение стартовых суммарных баллов HARS за исключением пунктов для оценки сна было достоверно более выраженным для агомелатина (-12.4 ± 9.1), чем для сертралина (-11.4 ± 10.0) (различие 1.89; 95% CI, 0.16-3.62; P = 0.033). Превосходство агомелатина над сертралином дополнительно выявлено при сравнении финальных баллов психической тревоги по HARS (различие 1.26; 95% CI, 0.11-2.40; P = 0.031) и соматической тревоги по HARS (различие 1.00; 95% CI, 0.11-1.90; P = 0.028).
Безопасность
В выборке безопасности частота связанных с терапией нежелательных явлений (СТНЯ) составила 48.0% (N = 73) в группе агомелатина и 49.1% (N = 78) в группе сертралина. СТНЯ, встречавшиеся чаще, чем у 5% пациентов, перечислены в Таблице 3. Наиболее частыми нежелательными явлениями в обеих терапевтических группах были головная боль, сухость во рту и диарея. Слабость чаще отмечалась в группе агомелатина (5.9%), чем в группе сертралина (1.3%), тогда как гипергидроз развивался только в группе сертралина (5%). Суммарное число СТНЯ, ставших причиной преждевременной отмены терапии, было в 4.5 раза больше в группе сертралина (18 пациентов [11.3%]) в сравнении с агомелатином (4 пациента [2.6%]), преимущественно за счет психических расстройств, таких как тревога, депрессия, утрата либидо, ажитация, инсомния и расстройства сна (5.7% против 0%, соответственно). Что касается динамики биологических параметров, то не было обнаружено клинически значимых изменений ни в одной из терапевтических групп, за исключением γ-глутамил трансферазы (ГГТ), среднее повышение которой составило 8.0 ± 110.0 U/L в группе агомелатина в связи с высокими значениями у одного пациента с алкоголизмом, у которого отмечалось превышение верхней границы нормы (ULN) для ГГТ более чем в 30 раз, для аспартат аминотрансферазы более чем в 6 раз, аланин аминотрансферазы более чем в 3 раза, билирубина более чем в 1 раз, а также зарегистрированы высокие уровни глюкозы и триглицеридов. Значимых изменений в витальных показателях (масса тела, артериальное давление, частота сердечных сокращений и ЭКГ) не отмечалось ни в одной из терапевтических групп. Случаев смерти во время исследования не зафиксировано.
Рисунок 4. Изменения в стартовых баллах LSEQ по пунктам «засыпание» (A) и «качество сна» (B) (мм) на момент последнего измерения в периоде от недели 0 до недели 6 по результатам полного анализа.
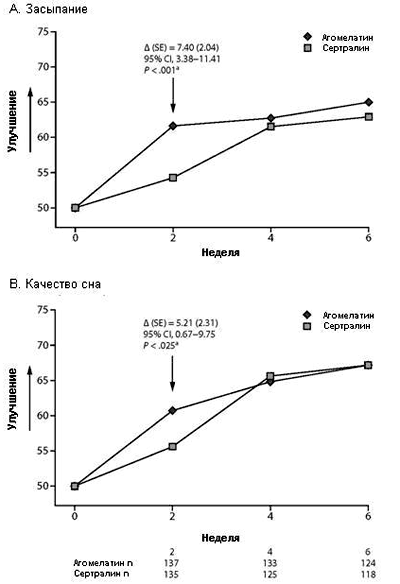
Таблица 2. Изменение стартового суммарного балла HDRS на момент последнего измерения в 6-недельном периоде терапии (от недели 0 до недели 6) по результатам полного набора анализов
| Суммарный балл HDRS | Агомелатин (N = 150) | Сертралин (N = 157) |
| Стартовое значение (неделя 0) n | 150 | 156 |
| Среднее ± SD | 26.1 ± 2.8 | 26.5 ± 3.0 |
| Последнее послестартовое значение n | 150 | 156 |
| Среднее ± SD | 10.3 ± 7.0 | 12.1 ± 8.3 |
| Последнее послестартовое – стартовое значение n | 150 | 156 |
| Среднее ± SD | -15.8 ± 7.3 | -14.4 ± 8.7 |
| Результаты статистического анализаa |
||
| E(SE)b | 1.68 (0.77) | |
| 95% CIc | 0.15 - 3.20 | |
| Значение Рd | 0.031 | |
b Оценка (стандартная ошибка) различия между скорректированными средними в терапевтических группах: сертралин минус агомелатин.
c 95% CI различия.
d Значение Р для терапевтического эффекта.
Сокращение: HDRS = Шкала депрессии Гамильтона.
Таблица 3. Наиболее частые связанные с терапией нежелательные явления (> 5.0% пациентов в любой терапевтической группе); приводится процент пациентов с НЯ от числа получавших двойную-слепую терапию в выборке безопасности
| Связанное с терапией нежелательное явление | Агомелатин (N = 152) | Сертралин (N = 157) |
| Головная боль | 8.6 | 10.1 |
| Сухость во рту | 5.3 | 5.0 |
| Диарея | 3.9 | 5.7 |
| Слабость | 5.9 | 1.3 |
| Гипергидроз | 0.0 | 5.0 |
ОБСУЖДЕНИЕ
Это первое сравнение двух антидепрессантов (агомелатина и сертралина) с разными механизмами действия по эффективности воздействия на циркадианный ритм и цикл сон-бодрствование в соответствии с показателем относительной амплитуды (ОА) у пациентов с БДР. Запястная актиграфия использовалась для объективных измерений организации цикла сон-бодрствование и качества сна у пациентов с БДР. Непрерывная запись движений в области запястья позволила получить 24-часовые показатели бодрствования-активности (непрерывные интенсивные движения) и сна/отдыха (редуцированное число движений) на протяжении нескольких недель.
В нашем исследовании мы измеряли ОА циркадианного цикла отдых-активность - параметр, который обеспечивает нормализованное значение амплитуды циркадианного ритма и позволяет проводить индивидуальные сравнения. Относительная амплитуда использовалась как показатель эффекта агомелатина в контексте восстановления циркадианных ритмов у пациентов с депрессией. В соответствии с нашей гипотезой предполагалось, что нарушения ночного сна, включая засыпание, непрерывность и/или пробуждения в совокупности с заторможенностью и дремотой в дневное время приводят к редукции ОА, а улучшение указанных функций сна, напротив, способствует повышению ОА. Такое предположение не обязательно верно для ажитированных пациентов, у которых улучшение происходит в противоположном направлении (хотя это будет зависеть от качества их сна). В данном исследовании среднее изменение стартовых показателей ОА на 1 -й неделе было достоверно более выраженным при терапии агомелатином в сравнении с сертралином. В целом, ОА оставалась относительно стабильной при терапии агомелатином, тогда как сертралин вызывал снижение ОА на первой неделе терапии и лишь в последующем обеспечивал сопоставимый с агомелатином эффект, начиная со 2-й недели лечения. Со 2-й недели ОА оставалась достаточно стабильной и одинаковой в обеих терапевтических группах вплоть до завершения исследования, даже несмотря на значимую редукцию депрессивного состояния за этот период времени, т.е. мы не обнаружили прямых корреляций между динамикой ОА и симптомами депрессии. Отсутствие таких корреляций можно объяснить тем, что показатель ОА не обладает необходимой чувствительностью в изученной популяции амбулаторных пациентов с депрессией и, вероятно, не является адекватным показателем для измерения циркадианных изменений у таких пациентов с высокими стартовыми значениями ОА.
Интересным представляется тот факт, что пациенты с низкими значениями ОА страдали наиболее тяжелыми депрессивными состояниями, в связи с чем можно предположить, что ОА может быть более адекватным маркером для госпитальных пациентов смеланхоличексими депрессиями. Такое предположение согласуется с результатами единственного на сегодня исследования,16 в котором оценивался циркадианный цикл отдых-активность у 26 госпитализированных пациентов с БДР (включая 5 биполярных пациентов) в течение 4-недельной терапии трициклическими антидепрессантами (кломипрамин, мапротилин или тримипрамин в дозе 150 мг/сут) в комбинации со стабильной и умеренной терапией гипнотиками. Авторы сообщают о низкой амплитуде циркадианного ритма отдых-активность на момент начала терапии и позитивных корреляциях между клинической динамикой и 24-часовыми изменениями уровня активности. Однако, малое число пациентов и возможное влияние гипнотиков на уровень активности ограничивают возможности интерпретации полученных данных.[16] В настоящее время продолжаются другие исследования с использованием метода актиграфии и анализа ОА, которые позволят уточнить ценность этого показателя у пациентов с БДР, получающих фармакотерапию, и подтвердить предположение о его изменении при таких состояниях.
Определение параметра ОА на основании 5 часов наилучшего ночного сна и 10 часов наибольшей активности в дневное время представляется дискуссионным, так как возникает вероятность стирания существенной редукции различий в состоянии пациентов и, соответственно, чувствительности измерений.
На сегодня доступны лишь ограниченные сведения о чувствительности показателя ОА к связанным с депрессией психомоторным нарушениям и эффектам терапии антидепрессантами. Раньше запястная актиграфия использовалась преимущественно в исследованиях сна и хронобиологии, в которых этот метод оказался достаточно ценным, обеспечивая возможность непрямых и неинвазивных измерений сна [32,44-47] и цикла сон-бодрствование.
Хотя актиграфия не предусматривает прямого измерения сна, она позволяет оценить объективные показатели сна (например, латентность сна и эффективность сна). В исследовании с участием здоровых субъектов показано, что такие полученные с помощью актиграфии параметры сна в целом хорошо коррелируют с данными полисомнографической электроэнцефалографии (ЭЭГ) сна [47], несмотря на то, что и не являются идентичными показателям ЭЭГ. Пациент, спокойно лежащий в кровати в состоянии бодрствования на протяжении нескольких часов, практически не отличается от спящего субъекта, хотя следует учитывать ограниченность данных. Наряду с таким ограничением актиграфия имеет преимущество измерения сна в течение нескольких недель (такое невозможно для ЭЭГ), что обеспечивает возможность усредненной оценки поведения за длительные периоды и, следовательно, повышает надежность результатов.
Полученные нами данные о превосходстве агомелатина в сравнении с сертралином по степени улучшения эффективности сна и латентности в целом представляются статистически и клинически значимыми. В результате анализа актиграфии обнаружено достоверное сокращение латентности сна и длительности пробуждений наряду с достоверным повышением эффективности сна с 1 по 6 неделю лечения у пациентов, получавших агомелатин, в сравнении с пациентами, получавшими сертралин.
Кроме того, в соответствии с показателями вопросника LSEQ, пациенты, получавшие терапию агомелатином, отмечали более легкое засыпание и улучшение качества сна уже на 2-й неделе, тогда как в группе сертралина сходное улучшение в показателях «легкость пробуждения» и «целостность поведения после пробуждения» отмечалось позднее 2-й недели терапии. Одинаковое улучшение в периоде от 2 до 6 недели в обеих терапевтических группах свидетельствует, что позитивный эффект агомелатина на функционирование в дневное время реализуется параллельно эффекту стимуляции состояния бодрствования, свойственному сертралину.[48]
Наконец, в соответствии с баллами по пунктам сна шкалы HDRS при терапии агомелатином инсомния редуцировалась на 2-й неделе, а при назначении сертралина - на 6-й неделе лечения. В совокупности установленные различия подтверждают благоприятное влияние агомелатина на архитектура сна и функционирование в дневное время у пациентов с БДР, отмеченное в предыдущих исследованиях.[27,29]
Накопленные на сегодня данные подтверждают антидепрессивную эффективность [25,26,49,50] и противотревожные свойства [25] агомелатина у пациентов с БДР. Превосходство агомелатина над сертралином по показателям шкал HDRS и CGI может быть отчасти связано с более выраженным улучшением баллов по пунктам оценки нарушений сна, которые являются ядерным компонентом депрессивного состояния. Однако различия в пользу агомелатина в сравнении с сертралином, хотя и не достигавшие уровня статистической достоверности, сохранялись и после вычета баллов инсомнии из суммарного балла HDRS, а также сохранялись с достоверными различиями в пользу агомелатина после удаления пунктов инсомнии из расчета суммарного балла HARS.
Подобное превосходство агомелатина, которое также наблюдалось в очном сравнительном исследовании с флуоксетином51 по суммарным баллам HDRS и в сравнительном исследовании с венлафаксином по баллам общего улучшения по шкале CGI [27], может рассматриваться как подтверждение более высокой эффективности агомелатина в сравнении с указанными антидепрессантами. Эффективность агомелатина может быть обусловлена комбинацией собственно антидепрессивного эффекта с дополнительными свойствами, такими как улучшение ночного сна и состояния в дневное время, и профилем переносимости. Полученные результаты представляют особый интерес, поскольку в последнее время предполагается, что сертралин превосходит другие антидепрессанты новых поколений по эффективности и переносимости. [52]
Установленное превосходство агомелатина также может быть связано с особенностями выборки исследования, для отбора в которую требовалось, чтобы сумма баллов по пунктам 4 и 5 шкалы HDRS была не менее 3. Целью такого критерия включения было повышение вероятности низких значений ОА и исключение пациентов потенциально более чувствительных к агомелатину. Кроме того, как было показано ранее, указанные 2 пункта HDRS характеризуются высокой чувствительностью к эффекту антидепрессантов [53], как и 6 пунктов, составляющие ядерные симптомы по Bech.[54]
Мы осознаем определенные недостатки проведенного исследования. Одним из ограничений является выбор поискового показателя в качестве главного критерия эффективности. Показано, что показатель относительной амплитуды недостаточно чувствителен к изменениям в состоянии пациентов и, вероятно, не обеспечивает адекватной характеристики циркадианного цикла отдых-активность у амбулаторных пациентов с депрессией в течение 6 недель терапии. Агомелатин обладает особыми фармакологическими свойствами с тропностью к мелатонинергическим рецепторам, в связи с чем представляется целесообразным искать различные подходы и маркеры для оценки клинических проявлений подобных отличий от других антидепрессантов. С этой целью в нашем большом исследовании проводилась ежедневная запись актиграфии на протяжении 7 недель и дополнительный анализ суммарного ночного и дневного времени позволит использовать более информативный марке, чем ОА. В нашем исследовании получен ряд актиграфических данных, не конвертированных в ОА, содержащих убедительные доказательства раннего влияния на ночной сон и состояние дневного бодрствования.
Кроме того, использованный в нашем исследовании режим дозирования сертралина нельзя считать оптимальным, учитывая назначение этого препарата в вечернее время.[33] Однако такой режим назначения сертралина не противоречит его официальной инструкции по применению, в которой производитель не указывает какого либо предпочтительного времени суток для его приема.
Отсутствие плацебо контроля можно рассматривать как методологический недостаток, однако группа плацебо предполагает другое искажение данных, связанное с проблемой набора репрезентативной выборки пациентов с депрессией. [55]
Вопросник LSEQ считается ценным инструментом для субъективной оценки сна пациентом в ходе терапии,[11] даже с учетом того обстоятельства, что отсутствие стартовых измерений может рассматриваться как потенциальный фактор искажения результатов. Вопросник LSEQ, разработанный для оценки сна в исследованиях фармакологических средств, является валидизированным и чувствительным методом измерения субъективных параметров сна и поведения после пробуждения.[38] Вопросник LSEQ характеризуется высокой внутренней согласованностью и тест-ретест надежностью и уже использовался во многих клинических исследованиях для оценки влияния антидепрессантов на сон в ходе терапии депрессии.[56] Результаты нашего исследования согласуются с ранее опубликованными данными о раннем улучшении засыпания и качества сна, начиная со 2-й недели лечения (первое измерение). Профиль переносимости агомелатина является приемлемым, как уже было показано ранее [25,27,28,57] и более благоприятным в сравнении с сертралином. Частота связанных с терапией нежелательных явлений была низкой, при этом не выявлено никаких значимых изменений в витальных показателях и биологических параметрах, за исключением случая высокого содержания γ-глутамил трансферазы, связанного с описанными выше аномальными показателями функции печени у одного пациента, страдавшего алкоголизмом. Частота преждевременных исключений в была ниже при терапии агомелатином, причем доля пациентов с преждевременной отменой терапии исследования из-за нежелательных явлений в группе агомелатина была в 3 раза меньше, чем в группе сертралина. Единственным нежелательным явлением, которое встречалось чаще при терапии агомелатином и возникало преимущественно в первые 2 недели лечения, была слабость, которая отмечалась у 5.9% пациентов, получавших агомелатин, и 1.3% пациентов, получавших сертралин. Это различие не влияло на динамику ОА.
Таким образом, результаты проведенного исследования свидетельствуют о более благоприятном влиянии агомелатина на изменения амплитуды циркадианного цикла отдых-активность/ сон-бодрствование у пациентов с депрессией на 1-й неделе лечения, проявляющемся быстрым улучшением ночного сна и функционирования в дневное время. Ранний благоприятный эффект на цикл сон/бодрствование может способствовать повышению эффективности терапии в отношении симптомов депрессии и тревоги, что подтверждают результаты 6-недельной терапии агомелатином в сравнении с сертралином в проведенном исследовании. В ходе дополнительного анализа большой базы данных, содержащих стартовые показатели актиграфии при БДР, могут быть получены дополнительные сведения об отдельных показателях циркадианного ритма и сна, которые предположительно являются предикторами терапевтического эффекта.
Лекарственные названия: кломипрамин (анафранил и другие), флуоксетин (прозак и другие), миртазапин (ремерон и другие), сертралин (золофт и другие), тримипрамин (сурмонтил и другие), венлафаксин (эффексор и другие).
Место работы авторов: Department Psychiatry и Psychotherapy, Medical University Vienna, Austria (Д-р Kasper); Department Psychiatry, Psychosomatics и Psychotherapy, University Regensburg, Regensburg, Germany (Д-р Hajak); Циркадианный и Visual Neuroscience, Nuffield Laboratory Ophthalmology, University Oxford, John Radcliffe Hospital, Oxford, United Kingdom (Д-р Wulff); Department Psychiatry, VU University Medical Center, Amsterdam, the Netherlands (Д-р Hoogendijk); Hospital Universitario de Salamanca, Salamanca, Spain (Д-р Montejo); Department Clinical Neuroscience, Ospedale San Raffaele, Milan, Italy (Д-р Smeraldi); Department Adult Psychiatry, Poznan University Medical Sciences, Poznan, Poland (Д-р Rybakowski); Сон Unit, Raymond Poincare Hospital, Garches, France (Д-р Quera-Salva); Centre for Chronobiology, Psychiatric University Clinics, Basel; Switzerland (Д-р Wirz-Justice); Institut de Recherches Internationales Servier (IRIS), Courbevoie, France (Д-р Picarel-Blanchot); и Centre Hospitalier Sainte-Anne, Paris, France (Д-р Bayle).
Члены группы исследования агомелатина: Перечисленные ниже специалисты участвовали в исследовании совместно с авторами настоящего сообщения.
Из Австрии: Margot Schmitz, MD, Wien. Из Франции: Jean-Francois Arnaud, MD, Paris; Bernadette Bouyssou, MD, Altkirch; Joel Carrera, MD, Bordeaux; Michel Costes, MD, Centre Psychotherapique, Fontaine; Bernard Jomard, MD, Centre Medico-Psychologique, Bourg en Bresse; Fabrice Lanvin, MD, Lens; Beatrice Lognos, MD, Saint Georges D'Orques; Gregoire Martocq, MD, Cournonterall; Jean-Marc Perez, MD, Montpellier; Brigitte Ridel, MD, Nantes; Genevieve Saint-Mard, MD, Paris; Danielle Sire, MD, Dole; Sophie Vincent, MD, Nice. Из Германии: Bettina Bergtholdt, MD, Emovis Institut fur emotionale Gesundheit GmbH, Berlin; Hermann-Josef Gertz, MD, Universitatsklinikum Leipzig Klinik und Poliklinik fur Psychiatrie, Leipzig; Dieter Kunz, MD, Psychiatrische Universitats Klinik der Charite im St Hedwig Krakenhaus, Berlin; Eckart Ruther, Klinik fur Psychiatrie und Psychotherapie der Georg-August-Universitat Gottingen, Gottingen; Klaus-Christian Steinwachs, MD, Praxis Д-р. Steinwachs Neurologie und Psychiatrie, Nurnberg; Markus Gastpar, MD, Klinik fur Psychiatrie und Psychotherapie der Universitat Duisburg -Essen, Essen. Из Италии: Giuseppe Bersani, MD, Servizio Speciale di Medicina Psicosomatica e Psicofarmacologia Clinica Policlinico Umberto I, Rome; Filippo Bogetto, MD, Universita di Torino Dipartamento di Neuroscienze Clinica Psichiatrica, Torino; Carlo Faravelli, MD, Azienda Ospedaliera Careggi Clinica Neuropsichiatrica Policlinico Careggi, Firenze; Giovanni Muscettola, MD, Azienda Universitaria Policlinico Federico II di Napoli Dipartimento di Psichiatria psicoterapia audiologica psicologica, Napoli; Eugenio Aguglia, MD, Clinica Psichiatrica Universita degli studi di Trieste, Trieste.
Из Нидерландов: Joanneke van der Linde, MD, Parnassia, Den Haag; R. Verkes, MD, Universitair Medisch Centrum Sint-Radboud Locatie Psychiatrie; Nijmegen. Из Польши: Leszek Bidzan, MD, Private practice «Syntonia,» Gdynia; Jerzy Landowski, MD, SPSK nr1, Akademickie Centrum Kliniczne Akademii medycznej w Gdansku, Klinika Chorob Psychicznych i Zaburzen Nerwicowych, Gdansk. Из Испании: Jose Francisco Montilla, MD, Centro de Especialidades «Los Angeles,» Madrid; Pilar Rico, MD, Centro de Especialidades «Los Angeles,» Madrid; Cristina del Alamo, MD, Centro de Salud Mental, Madrid; Monica Pastor, MD, Centro de Salud Calahorra Consulta de Salud Mental, LOGRONO - La Rioja; Jose Otero, MD, Centro de Salud de Villalba, Madrid; Diego Palao, MD, Hospital General de Vic Servicio de Psiquiatria, Barcelona; Maria Jesus del Yerro, MD, Centro de Salud Mental de Carabanchel Servicio de Psiquiatria, Madrid; Santiago Vega, MD, Centro de Salud Mental de Usera, Madrid.
Потенциальный конфликт интересов:
Д-р Kasper получал грант/исследовательскую поддержку от компаний Eli Lilly, Lundbeck, Bristol-Myers Squibb, GlaxoSmithKline, Organon, Sepracor и Servier; выполнял обязанности консультанта или участвовал в экспертных советах для компаний AstraZeneca, Bristol-Myers Squibb, GlaxoSmithKline, Eli Lilly, Lundbeck, Pfizer, Organon, Schwabe, Sepracor, Servier, Janssen и Novartis; и выступал в качестве докладчика для компаний AstraZeneca, Eli Lilly, Lundbeck, Schwabe, Sepracor, Servier, Pierre Fabre и Janssen. Д-р Hajak выступал в качестве докладчика для компаний AstraZeneca, Bayer Vital, Bristol-Myers Squibb, Boehringer Ingelheim, Cephalon, EuMeCom, GlaxoSmithKline, Janssen-Cilag, Eli Lilly, Lundbeck, Merz, Neurim, Novartis, Organon, Pfizer, Sanofi-Aventis, Servier, Takeda и Wyeth; выполнял обязанности консультанта или участвовал в экспертных советах для компаний Actelion, AstraZeneca, Bristol-Myers Squibb, Euro RSCG Life Worldwide, Gerson Lerman Group, Janssen-Cilag, Eli Lilly, Lundbeck, McKinsey, Merck, Network Advisors, Neurim, Neurocrine, Novartis, Organon, Pfizer, Proctor & Gamble, Purdue, Sanofi-Aventis, Schering Plough, Sepracor, Servier, Takeda и Wyeth; получал спонсорскую помощь для исследований от компаний Actelion, AstraZeneca, Boehringer Ingelheim, BrainLab, GlaxoSmithKline, Lundbeck, Neurim, Novartis, Organon, Orphan, Sanofi-Aventis, Sepracor, Servier и Takeda. Д-р Wulff получал гонорары за анализ данных и консультации от компании Servier. Д-р Hoogendijk выступал с лекциями и участвовал в экспертных советах для компаний Lundbeck, Servier, Eli Lilly и Organon/Schering Plough, для которых Foundation for Depression Research GGZBA получали гранты и заработную плату. Д-р Montejo получал гонорары от компаний Servier, Eli Lilly, Bristol-Myers Squibb, GlaxoSmithKline, Sanofi, AstraZeneca, Boehringer и Wyeth и участвовал в экспертных советах для компаний Eli Lilly, Boehringer, GlaxoSmithKline, Servier и AstraZeneca. Д-р Smeraldi выполнял обязанности консультанта или докладчика для компаний Janssen-Cilag, Innova-Pharma и Wyeth. Д-р Rybakowski выполнял обязанности консультанта или докладчика для компаний Adamed-Poland, AstraZeneca, Bristol-Myers Squibb, Eli Lilly, Janssen-Cilag, Lundbeck, Organon, Pfizer, Sanofi-Aventis и Servier. Д-р Quera-Salva выполнял обязанности консультанта или участника экспертного совета для компании Servier. Д-р Wirz-Justice выполняла обязанности консультанта и докладчика для компании Servier. Д-р Picarel-Blanchot является сотрудником компании Servier. Д-р Bayle получал гонорары от компаний Bristol-Myers Squibb, Janssen-Cilag, Servier, Sanofi-Aventis, UCB Pharma Исследовательскую поддержку Bioprojet, Eli Lilly, Janssen-Cilag и Servier.
Финансирование/поддержка: Данное исследование спонсировалось компанией Servier (Courbevoie, France).
Предыдущие презентации результатов: Результаты исследования были представлены на 26-м конгрессе Международного колледжа по нейропсихофармакологии (Collegium Internationale Neuro-Psychopharmalogicum), 13-17 июля 2008, Мюнхен, Германия и 21-м конгрессе Европейского колледжа по нейропсихофармакологии (European College Neuropsychopharmacology), 30 августа - 3 сентября 2008 г., Барселона, Испания.
Выражение благодарности: Работа доктора Wulff была поддержана NIHR Biomedical Research Centre, Оксфорд, Великобритания.
Список использованной литературы
