Принципы диагностики и лечения больных с кожными проблемами, сопровождающимися зудом
СтатьиОпубликовано в :
РМЖ, 2011, № 11
Курбачева О.М., Павлова К.С.
Различные кожные проблемы, сопровождающиеся зудом, являются частой причиной обращения пациентов как к врачам общей практики (педиатрам, терапевтам, семейным врачам), так и к специалистам (дерматологам, аллергологам). Клинические проявления в виде нестерпимого кожного зуда и высыпаний существенно ухудшают сон и качество жизни пациентов и требуют активного и эффективного лечения, подбор которого возможно осуществить, обладая знаниями патогенеза и особенностей терапии. Кожный зуд сопровождает различные кожные заболевания, наиболее распространенными из которых являются атопический дерматит и крапивница. Клинические проявления этих заболеваний имеют разную картину, однако подходы к диагностике (с целью выявления всех причинно–значимых и триггерных факторов) и терапии (обусловленные наличием общего ведущего симптома – кожного зуда) сходны.
Атопический дерматит (АтД) (синонимы: синдром атопической экземы/дерматита (САЭД), атопическая экзема, детская экзема, конституциональная экзема, нейродермит, пруриго Бенье) – аллергическое заболевание кожи, возникающее, как правило, в раннем детском возрасте у лиц с наследственной предрасположенностью к атопическим заболеваниям, имеющее хроническое рецидивирующее течение, возрастные особенности локализации и морфологии очагов воспаления, характеризующееся кожным зудом и обусловленное гиперчувствительностью как к аллергенам, так и к неспецифическим раздражителям. Атопический дерматит часто сочетается с другими аллергическими заболеваниями, такими как бронхиальная астма, аллергический ринит, пищевая аллергия, а также может осложняться рецидивирующими кожными инфекциями [1].
В основе АтД лежит хроническое аллергическое воспаление кожи. Пусковым механизмом иммунного ответа при АтД является взаимодействие аллергенов с IgE антителами на поверхности тучных клеток и базофилов. Важную роль в формировании АтД играют пищевые и ингаляционные аллергены. Первые считаются основным фактором, приводящим в раннем детском возрасте к реализации предрасположенности к атопии [1]. Основными пищевыми аллергенами являются белки коровьего молока, куриного яйца, рыбы, а также пищевые злаки. С возрастом пищевая сенсибилизация трансформируется в сенсибилизацию к ингаляционным – аэроаллергенам. К их числу относят домашнюю пыль, клеща домашней пыли, аллергены животных и пыльцу растений [1]. Помимо пищевых и аэроаллергенов, IgE ответ могут инициировать суперантигены Staphylococcus aureus, а также грибы Malassezia spp, Candida spp. и аутоантигены [2]. Неаллергическая природа АтД установлена у 10–20% всех больных АтД с типичной клинической картиной АтД. При этой форме заболевания отсутствуют данные за наличие атопии: отрицательные кожные тесты с аллергенами, отсутствие специфических IgE антител к аллергенам и отсутствие респираторных проявлений атопии [1]. Важная роль в развитии АтД отводится дефекту врожденного иммунного ответа, в частности, нарушению функции эпидермального барьера, продукции противомикробных пептидов, а также миграции нейтрофилов. Эти нарушения лежат в основе повышенной колонизации кожи больных АтД S. aureus, Malassezia spp., Candida spp. и подверженности вирусной инфекции (herpes simplex virus, molluscum contagiosum virus, vaccinia virus) [1]. При АтД имеются нарушения нейровегетативной регуляции, чем объясняется хроническое течение заболевания даже при отсутствии экспозиции этиологически значимых аллергенов [1].
Крапивница – этиологически гетерогенное заболевание или синдром, основным проявлением которого является волдырь (лат – Urtica) и/или ангиоотек. Срок появления волдырей – от нескольких минут до нескольких часов. В большинстве случаев высыпания бесследно исчезают. У 50% больных крапивница может сопровождаться ангиоотеком (отеком Квинке), представляющим собой отек глубоких слоев дермы, подкожной клетчатки и подслизистого слоя [3]. Крапивница – полиэтиологическое заболевание, может быть вызвано медикаментами, пищевыми продуктами, ядом насекомых, контактным путем (латекс); IgG–аутоантителами к Fc RI или к IgE (при аутоиммунной крапивнице); С3а, С5а иммунными комплексами (при ревматоидном артрите, системной красной волчанке, синдроме Шегрена, уртикарном васкулите, сывороточной болезни и др.). Нередкой причиной развития и триггером обострений крапивницы являются инфекционные агенты: вирусы (особенно гепатита А, B и C, Эпштейна–Барра и др.), бактерии (cтрептококки, Helicobacter pylori, кишечная палочка, нейсерии, микоплазмы и др.), грибы, паразиты (лямблии, гельминты и др.). В развитии некоторых форм крапивницы имеют значение генетические факторы [3,4]. В патогенезе развития ангиоотека и крапивницы лежат единые механизмы, поэтому терапевтические подходы в обоих случаях сходные. Из многочисленных классификаций крапивницы наиболее важное значение в клинической практике имеет деление этой патологии на острую (продолжающуюся до 6 нед) и хроническую (более 6 нед).
Кожные проблемы, сопровождающиеся зудом, могут быть обусловлены псевдоаллергическими реакциями (ПАР), которые развиваются после употребления продуктов, богатых гистамином, тирамином, гистаминолибераторами, а также на примеси, обладающие высокой физической и биологической активностью, вносимые для улучшения вкуса, запаха, цвета, увеличения длительности хранения. В норме пищевые продукты расщепляются до соединений, не обладающих аллергизирующими свойствами (аминокислоты и другие неантигенные структуры), а кишечная стенка непроницаема для нерасщепленных продуктов. Однако при наличии заболеваний ЖКТ создаются условия, при которых обычные продукты проявляют аллергенную активность или способность вызывать ПАР. Нарушение процессов инактивации гистамина также может приводить к его накоплению в тканях. Чаще всего это происходит при заболеваниях печени и почек, что способствует развитию ПАР на медикаменты и пищевые продукты.
Диагностика атопического дерматита и крапивницы преследует целью выявление всех причинно–значимых и триггерных факторов для последующего ограничения их влияния на организм. Как правило, пациенты с зудящими дерматозами попадают на консультацию к дерматологам, и это особенно важно, так как именно в ведении этих специалистов лежит проведение дифференциальной диагностики и подбор наружной терапии. Однако учитывая системность аллергических заболеваний (общее влияние аллергенных факторов на организм, наличие сопутствующей аллергопатологии, изменения в иммунной системе, приводящие к хронизации и прогрессированию аллергического воспаления), с целью выявления причинно–значимых аллергенов и разработки тактики противоаллергического лечения этим пациентам показана консультация аллерголога–иммунолога. Аллергологическое обследование включает: сбор аллергоанамнеза, с 5 лет при стабильном состоянии кожи возможна постановка prick–тестов с атопическими аллергенами, исследование уровня общего IgE; определение специфических IgE антител к пищевым, бытовым, эпидермальным, пыльцевым, грибковым и бактериальным аллергенам.
При общеклиническом обследовании (клинический и биохимический анализ крови, общий анализ мочи) можно выявить эозинофилию периферической крови (что косвенно может свидетельствовать о наличии атопии, глистной инвазии или грибкового поражения кожи и слизистых у пациента), острые воспалительные реакции (важно в дифференциальной диагностике крапивницы), заподозрить функциональные нарушения органов желудочно–кишечного тракта и наличие другой сопутствующей патологии.
Глистные инвазии являются одним из самых мощных факторов сенсибилизации. Само по себе наличие гельминтоза или лямблиоза способно провоцировать появление симптомов зудящего дерматоза, а при наличии атопического дерматита усугублять его течение. Некоторые инфекционисты рекомендуют проводить профилактические курсы дегельминтизации два раза в год. Однако, учитывая высокую степень токсичности притивоглистных и противопаразитарных препаратов, особенности эффективности различных препаратов и схем терапии при определенных гельминтозах, а также возможность токсического воздействия в результате массовой гибели гельминтов в запущенных случаях, самостоятельное лечение «вслепую» может приводить к тяжелым последствиям или к хронизации процесса. Поэтому всем пациентам с зудящими дерматозами, особенно при наличии соответствующего эпидемиологического анамнеза, необходимо проводить паразитологическое обследование (анализ кала на я/глист и цисты простейших, соскоб на энтеробиоз, определение уровня антител к описторхисам, трихинеллам, токсокарам, эхинококку, аскаридам) и консультация инфекциониста/паразитолога (по показаниям).
Сопутствующая патология органов ЖКТ (гастрит поверхностный или эрозивный, ассоциированный с H. pylori, язвенная болезнь желудка или 12–перстной кишки, кандидозы слизистой ротовой полости и кишечника, дискинезия желчевыводящих путей, ферментопатия, дисбактериоз кишечника и др.) в той или иной степени определяется у 70–90% больных АтД и крапивницей [1,4]. Кроме того, обострение хронических заболеваний органов ЖКТ провоцирует обострение АтД, а при коррекции нарушений существенно снижается объем поддерживающей терапии. Поэтому в плане диагностики АтД и крапивницы всегда должно отводиться место обследованию органов ЖКТ: УЗИ органов брюшной полости, копрология, бактериологическое исследование фекалий и посевы со слизистых оболочек ротоглотки и других возможных очагов инфекции (по показаниям); гастроскопия (по показаниям), дыхательный тест на Helicobacter, дуоденальное зондирование с посевом желчи (по показаниям), консультация гастроэнтеролога. Учитывая возможное участие инфекционных агентов и аутоиммунных процессов в патогенезе крапивницы, этим пациентам показано: проведение серологической диагностики (гепатиты А, В, С, вирус Эпштейна–Барра и др.), консультация инфекциониста (по показаниям); поиск очагов хронической инфекции; исключение аутоиммунной патологии, определение компонентов комплемента и С1–ингибитора (с целью исключения наследственного ангионевротического отека).
Учитывая ведущий симптом зудящих дерматозов – зуд, а также важнейшую роль изменений нервной системы и ее влияние на возникновение и течение заболевания, пациенты с хронически рецидивирующим течением АтД и крапивницы нуждаются в консультации невропатолога, а в некоторых случаях и психотерапевта. Изнуряющий, биопсирующий зуд существенно ухудшает качество жизни этих больных и качество сна, снижает работоспособность. Косметологические дефекты кожи усугубляют психологический дискомфорт пациентов с АтД и хронической рецидивирующей крапивницей, ограничивая пациентов в общении и нарушая социальную адаптацию. Невротизация этих больных на фоне болезни формирует порочный круг патогенеза кожного зуда, усугубляя течение заболевания и приводя к хронизации процесса.
Таким образом, ведение пациентов с тяжелым течением крапивницы, АтД и других дерматозов должно осуществляться в тесной кооперации врачей разных специальностей, что позволяет контролировать течение сопутствующих нарушений, разрабатывать и проводить реабилитационные программы и минимизировать медикаментозное воздействие.
Лечение зудящих дерматозов зависит в первую очередь от клинического диагноза и наличия сопутствующей патологии. Для острых процессов с непродолжительным и легким течением объем диагностики и терапии будет существенно отличаться от такового в случае тяжелых рецидивирующих и торпидных к стандартной терапии дерматозов [1,3,4].
Элиминационные мероприятия, направленные на минимизацию воздействия причинно–значимых аллергенов и триггерных факторов, включают в себя разработку индивидуальной элиминационной диеты и создание гипоаллергенных условий (в большей степени это необходимо для больных с бытовой, эпидемальной и грибковой сенсибилизацией). Строгая гипоаллергенная диета не учитывает индивидуальную гиперчувствительность к пище, служит причиной неоправданного исключения большого числа необходимых продуктов питания, необходимых для роста и развития ребенка. Кроме того, значительные ограничения в продуктах отрицательно сказываются на психологическом состоянии пациента. Обучение пациента подразумевает проведение беседы о природе заболевания, мерах профилактики обострения АтД и крапивницы, основных правилах личной гигиены и ухода за кожей при АтД; методах лечения в период обострения и ремиссии.
Радикальным отличием терапии АтД от крапивницы является наружная терапия, проведение которой во втором случае не требуется. Подбор и использование средств ежедневного ухода, восстанавливающих липидный слой кожи, барьерную функцию, нормализующих функцию потовых и сальных желез является обязательным условием, которое должно выполняться не только в период обострения, но и в период ремиссии. Наружные глюкокортикостероиды (ГКС), являющиеся первой линией в терапии АтД, обладают противовоспалительным, противоаллергическим, антипролиферативным, иммунодепрессивным, противозудным и сосудосуживающим эффектами. ГКС угнетают высвобождение медиаторов воспаления, экссудацию, миграцию и пролиферацию клеток в зоне воспаления. Выбор средства наружного ГКС и лекарственной формы определяется стадией и выраженностью процесса, локализацией, а также возрастом больного. До 90% симптомов АтД удается контролировать с помощью увлажняющих средств, ванн и местных ГКС, которые добавляют к увлажняющим средствам в случае неэффективности последних (для купирования воспалительных явлений и зуда) [1]. Современные местные стероиды могут назначаться 1 раз в сутки, детям – лучше утром, на поверхность кожи не более 20%, избегая применения окклюзионных повязок. Современные нефторированные местные ГКС низкой/умеренной активности (мометазона фуроат, гидрокортизона ацепонат) можно наносить практически на любые участки тела. Местные ГКС назначаются до наступления ремиссии и исчезновения зуда (как правило, не более 1 месяца). При осложненном микробной инфекцией АтД целесообразно применять комбинированные наружные ЛС, содержащие, помимо ГКС, антибиотик, эффективный в отношении стафилококка и противогрибковый компонент. Также высокой эффективностью (в особенности при осложненных формах АтД) обладают препараты цинка, такие как цинка пиритионат (ЦП).
Системная фармакотерапия АтД и крапивницы включает: антигистаминные средства (Н1–блокаторы; системные ГКС (дексаметазон, преднизолон, метилпреднизолон) в случае длительного выраженного обострения распространенных форм или тяжелого диффузного АтД при неэффективности наружной терапии и системные иммунодепрессанты (циклоспорин) при упорном течении АтД/крапивницы и неэффективности других видов терапии [1,5]. При наличии показаний проводится системная антибактериальная (предпочтительно макролиды) и противогрибковая (кетоконазол, тербинафин, флуконазол и др.) терапия [1,2,4].
Особое внимание хотелось бы уделить выбору антигистаминного препарата. Традиционно «антигистаминными препаратами» называют препараты, избирательно препятствующие активирующему действию на Н1–рецепторы. С момента создания первого Н1–антигистаминного препарата прошло более 60 лет. За этот период были синтезированы новые лекарственные средства, обладающие бо’льшей эффективностью и высоким профилем безопасности. Современная классификация Н1–антигистаминных препаратов делит их на седативные (препараты первого поколения) и неседативные (второго поколения), в свою очередь, подразделяющиеся на метаболизируемые и активные метаболиты (некоторые врачи называют их третьим поколением). В многочисленных мультицентровых двойных слепых плацебо–контролируемых исследованиях, проведенных за последние годы, было показано, что Н1–антигистаминные препараты последнего поколения существенно превосходят по эффективности и безопасности своих предшественников. И хотя опыт применения препаратов второго поколения насчитывает более 20 лет, значительную долю продаж на фармацевтическом рынке России по–прежнему занимают препараты первого поколения, что можно объяснить сложившимися стереотипами, отсутствием собственного опыта применения относительно новых препаратов, а также недооценкой и незнанием побочных эффектов, характерных для препаратов первого поколения.
Единственным неоспоримым преимуществом Н1–антигистаминных первого поколения перед новыми препаратами является наличие инъекционных форм, которые применяются для купирования острых аллергических реакций и в качестве премедикации перед проведением рентгеноконтрастных и оперативных вмешательств. Однако в амбулаторной практике для лечения аллергических заболеваний в большинстве случаев показано назначение пероральных форм (таблетки, сироп, капли).
В то время как имеется огромное количество информации о клинической фармакологии, эффективности и безопасности большинства новых препаратов, немногие из старых препаратов были исследованы также подробно, поскольку внедрены за десятилетия до того, как органы управления стали требовать документацию об эффективности и безопасности. Также в связи с возросшими требованиями по регистрации препаратов антигистаминные средства второго поколения имеют большие возрастные ограничения по применению в педиатрической практике (цетиризин с 6 мес, дезлоратадин с 12 мес, лоратадин с 2 лет) по сравнению со старыми препаратами, многие из которых разрешены с 1 мес, хотя в соответствии с рекомендациями Pediatric Section EAACI (Педиатрической секции Европейской Академии аллергологов и клинических иммунологов), FDA (Food and Drug Administration – Администрация по контролю пищевых продуктов и лекарств в США), MHRA (Medicines and Healthcare products Regulatory Agency – Агентство по регулированию лекарственных средств и медицинских изделий Великобритании) применение антигистаминных препаратов первого поколения в Европе и США у детей в возрасте до 2 лет ограничено [5–9].
Эффективность антигистаминных, а также наличие и выраженность побочных эффектов в значительной мере зависят от селективности и специфичности действия препарата на Н1–рецепторы. Связывание препаратов первого поколения с рецептором носит кратковременный характер (3–6 часов), а следовые количества препарата могут сохраняться до 36 ч. Таким образом, для достижения фармакологического действия препарата требуется 2–4–кратный прием в сутки, а с учетом продолжительного периода выведения из организма отмечается повышение концентрации неактивного препарата в плазме в несколько раз, что приводит к развитию побочных реакций.
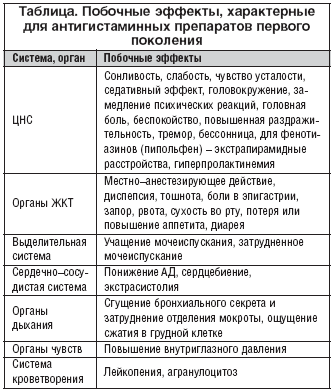
Практически все антигистаминные первого поколения, помимо антагонистического действия по отношению к Н1–рецепторам, блокируют и другие рецепторы, в частности мускариновые, серотониновые (пиперадины), допаминовые (фенотиазины), что приводит к развитию ряда побочных эффектов. Наиболее часто регистрируемыми побочными эффектами являются седация, сонливость, головокружение – следствие проникновения лекарственных средств через гемато–энцефалический барьер (ГЭБ) и связыванием там гистаминовых рецепторов. Гистамин является важным медиатором в ткани головного мозга, где участвует в регуляции цикла сна и бодрствования, общемозговой активности, психических функций и аппетита.
Некоторые врачи считают положительным наличие побочного седативного эффекта у антигистаминных препаратов в терапии зудящих дерматозов, сопровождающихся нарушением сна. Необходимо учитывать, что термин «седация» обозначает субъективные ощущения в виде сонливости и нарушение психомоторной функции, и его не стоит использовать для описания терапевтических эффектов препаратов, улучшающих сон и уменьшающих тревогу и возбуждение. Следует отметить, что качество сна при терапии седативными антигистаминными препаратами ухудшается. Седативные антигистаминные препараты (за исключением доксиламина) угнетают REM (rapid eye movement) фазу сна, после чего вызывают выраженный синдром отмены REM фазы – повышение ее количества и интенсивности. В результате сон становится прерывистым (фрагментация сна), нарушается сердечны ритм, развивается тканевая гипоксия и нарушение дыхания во сне (апноэ). Это приводит к дневной сонливости, снижению дневной активности и нарушению когнитивной функции. При апноэ во сне повышается риск внезапной смерти [6]. Кроме того, некоторые из этих препаратов (особенно у детей) могут оказывать парадоксальные эффекты возбуждения ЦНС и экстрапирамидные расстройства. Поэтому при нарушении сна пациента с зудящими дерматозами необходимо направлять на консультацию к специалистам (невропатологу, психоневрологу) с целью назначения соответствующей терапии, а при выборе антигистаминного отдавать предпочтение препаратам последнего поколения.
В специальных исследованиях, предполагающих оценку показателей когнитивной функции и способности к вождению автомобиля, было показано, что дифенгидрамин и другие препараты первого поколения вызывают сонливость и нарушение психомоторной функции в той же или даже большей степени, чем после приема алкоголя (при концентрациях его в крови, превышающих разрешенные уровни), в то время как средства второго поколения в обычных терапевтических дозах не давали подобных побочных эффектов. Кроме того, выраженность этих эффектов значительно усиливалась при одновременном применении препаратов первого поколения с алкоголем [7,10]. В других исследованиях было показано, что седативные антигистаминные препараты существенно снижают способность школьников к обучению, нарушая концентрацию внимания и память [5,8]. Многочисленные исследования, проводимые в течение последних 10 лет, выявили существенное повышение риска травм у пациентов при лечении седативными антигистаминными препаратами [5–9]. В противоположность этому в двойных слепых плацебо–контролируемых исследованиях было показано, что применение препаратов последнего поколения не только не снижает психомоторные функции, но и уменьшает сонливость и улучшает качество жизни, обусловленные заболеванием. Некоторые представители антигистаминных препаратов второго поколения также могут вызывать некоторую сонливость и нарушение психомоторной функции (в большей степени характерно для цетиризина, левоцетиризина), однако частота и выраженность этих явлений значительно ниже по сравнению с препаратами первого поколения. Большинство же антигистаминных препаратов второго поколения либо не проникают через ГЭБ, либо проникают в низких концентрациях и не оказывают в терапевтических дозах седативного и других эффектов на ЦНС. Федеральная администрация авиации США разрешает пилотам в случае необходимости пользоваться фексофенадином, лоратадином и дезлоратадином [3,7].
Репутация антигистаминных второго поколения была несколько «подпорчена» синтезированными впоследствии терфенадином и астемизолом, обладавшими кардиотоксическим эффектом при превышении терапевтической дозы в 2–4 раза (удлинение интервала QT на ЭКГ, развитие веретенообразной желудочковой экстрасистолии, или синдром «пируэта», атрио–вентрикулярной блокады и блокады ножек пучка Гиса). Однако вскоре после выявления данного феномена эти препараты были запрещены, а к новым препаратам стали предъявляться более высокие требования по безопасности. Среди современных антигистаминных препаратов последнего поколения потенциальный риск кардиотоксических эффектов сохраняется у эбастина (только при существенном превышении терапевтических доз), хотя более вероятным является развитие кардиотоксичности у продолжающих использовать препараты первого поколения.
Как известно, за счет влияния на холинергические мускариновые рецепторы антигистаминные препараты первого поколения способны вызвать сухость слизистых, сгущение бронхиального секрета и затруднение отделения мокроты, в связи с чем имеют противопоказание к применению у больных бронхиальной астмой (БА). По данным различных эпидемиологических исследований, у больных аллергическим ринитом (АР) в 10–30% случаев имеется БА, в то же время больные атопической БА в 95–99% случаев страдают АР [8,9]. В последние годы активно обсуждается целесообразность применения антигистаминных препаратов последнего поколения при лечении БА. Многочисленные исследования применения неседативных антигистаминных препаратов при лечении АР у больных с сочетанием БА подтвердили не только отсутствие негативных эффектов со стороны органов дыхания, но и наличие дополнительного клинического эффекта в виде уменьшения частоты приступов удушья, улучшения показателей пикфлоуметрии и ОФВ1 и повышения качества жизни больных БА.
Увеличение ассортимента антигистаминных препаратов второго поколения за счет дженериков (одним из которых является Кларотадин®), более доступных по цене для большинства пациентов, ставит под вопрос «преимущество» препаратов первого поколения в их относительно невысокой стоимости.
Кларотадин® (лоратадин) производства ОАО «Химико–фармацевтический комбинат «Акрихин» (Россия) относится к метаболизируемым антигистаминным препаратам последнего поколения, не обладающим центральным и антихолинергическим действием. Действие препарата начинает развиваться через 30 мин после приема и продолжается в течение 24 часов. Кларотадин® разрешен к применению в педиатрической практике с 2 лет в дозе 5 мг в сутки, а детям старше 12 лет (при массе более 30 кг) и взрослым – 10 мг в сутки. При использовании в терапевтических дозах вероятность развития побочных реакций минимальна. Риск побочных эффектов повышается при превышении терапевтической дозы, при наличии нарушений функции печени и почек. Одновременное применение лоратадина с антибиотиками группы макролидов, циметидином и кетоконазолом увеличивает концентрацию лоратадина в плазме крови, что не приводит к развитию клинического проявления и не оказывает влияния на данные ЭКГ.
Учитывая существующие у некоторых врачей сомнения относительно эффективности дженериков по сравнению с оригинальными препаратами, было проведено нескольких клинических исследований, посвященных изучению эффективности и безопасности препарата Кларотадин®. Было показано, что назначение Кларотадина® больным с крапивницей приводит к уменьшению выраженности или исчезновению кожного зуда и высыпаний [11]. В плацебо–контролируемом исследовании по оценке эффективности Кларотадина® у больных атопическим дерматитом было продемонстрировано существенное уменьшение кожного зуда и выраженности аллергического воспаления кожи на фоне терапии данным препаратом. Эти изменения статистически достоверно отличались (p<0,05) от группы контроля (плацебо) [12].
Частота развития побочных эффектов в виде легкой сонливости, головокружений и головной боли на фоне приема Кларотадина® не превышала 6% (при этом в группе пациентов, получавших плацебо, аналогичные побочные эффекты отмечались в 10% случаев). Регистрируемые побочные эффекты не требовали отмены препарата и самостоятельно купировались на фоне продолжения терапии. Ни у одного пациента на фоне терапии препаратом Кларотадин® не было отмечено значимых изменений при общеклиническом обследовании, а также не выявлено изменений на ЭКГ (ни в одном случае не зарегистрировано нарушений ритма, удлинения интервала QT, изменения амплитуды зубцов комплекса QRS) [11,12]. В целом во всех проведенных исследованиях была продемонстрирована хорошая эффективность Кларотадина®, сочетающаяся с высоким профилем безопасности.
Высокая эффективность, наличие дополнительной противовоспалительной активности, отсутствие (или наличие слабо выраженных) побочных эффектов, возможность однократного приема в сутки, наличие жидких форм (сироп, капли) для перорального применения, позволяющих легко дозировать препарат при назначении в педиатрической практике, а также отсутствие значимых лекарственных взаимодействий однозначно решают вопрос выбора антигистаминных средств в пользу препаратов последнего поколения.
Литература
1. Феденко Е.С., Елисютина О.Г. Роль грибковой инфекции в развитии атопического дерматита и целесообразность противогрибковой терапии. РАЖ, 2006, №5, стр. 4–13.
2. Феденко Е.С., Ильина Н.И. Аллергические заболевания кожи в клинической практике. РАЖ, 2005, №3, стр. 55–67.
3. EAACI/GA2LEN/EDF guideline: management of urticaria. Allergy. 2006, v.61, p. 321 – 331.
4. Голубчикова Р.Н., Данилычева И.В. Этиология хронической крапивницы. РАЖ, 2009, №6, стр. 12–17.
5. DuBuske L.M. Pharmacokinetics/pharmacodynamics and psychomotor performance aspects of antihistamine therapies. Clin Appl Immunol Rev. 2001, v. 1, p. 277–289.
6. Church M. K., Maurer M., Simons F. E. R., Bindslev–Jensen C., van Cauwenberge P., Bousquet J., Holgate S. T., Zuberbier T. Risk of first–generation H1–antihistamines: a GA2LEN position paper. Allergy. 2010, v. 65 (4), p. 459–466.
7. Finkle W.D., Adams J.L., Greenland S, Melmon K.L. Increased risk of serious injury following an initial prescription for diphenhydramine. Ann Allergy Asthma lmmunol. 2002, v. 89, p. 244–250.
8. Over the counter cough and cold medications for pediatric use; notice of public hearing. Federal Register. 2008, v.73 (165), p.50033–50036.
9. Gilmore T.M., Alexander B.H., Mueller B.A., Rivara F.P. Occupational injuries and medication use. Am J lnd Med. 1996, v. 30, p. 234–239.
10. Гущин И.С. Аллергическое воспаление и его фармакологический контроль. М., Фармарус принт, 1998, 252 с.
11. Кларотадин. Клинические исследования (под ред. Сидоренко И.В.). М. 2001, 40с.
12. Попова И.С., Матушевская Е.В., Свирщевская Е.В. Двойное слепое плацебо–контролируемое исследование эффективности и переносимости кларотадина при атопическом дерматите. Русс. Мед. Журн. Дерматология, Венерология. 2001, т.9, №4, с.477–483.
