Анемии в кардиологической практике
Статьи Опубликовано в журнале:«Трудный пациент»; ТОМ 9; № 4; 2011; стр. 50-56.
Ф.Ю.Копылов, Д.Ю.Щекочихин
Первый МГМУ им. И.М. Сеченова Кафедра профилактической и неотложной кардиологии ФППОВ, Москва
Анемия с давних времен является спутником человечества. Выдающийся немецкий врач Йоханнес Ланге (Johannes Lange) уже в 1554 г. дал название анемии как «болезни девственниц (morbus virgineus)». Он считал эту болезнь специфичной для целомудренных девушек, а причиной указывал задержку менструальной крови [1], ссылаясь на описание Гиппократа, представленное в сочинении «О болезнях девушек».
За последующие несколько столетий мы существенно продвинулись в понимании патофизиологии анемии, и в настоящий момент крупные исследования посвящаются оценки роли анемии в развитии и течении различных заболеваний на популяционном уровне. Касательно сердечно-сосудистых заболеваний (ССЗ) доказано, что анемия является независимым фактором риска неблагоприятных исходов ССЗ у пациентов с хронической сердечной недостаточностью (ХСН) и хронической почечной недостаточностью (ХПН). Для общей популяции больных ССЗ большинство данных свидетельствует о том, что анемия является и здесь независимым фактором риска, однако данных для включения в официальные рекомендации пока недостаточно [2].
Определение понятия и распространенность
Согласно определению ВОЗ, анемия регистрируется у взрослых женщин при снижении концентрации гемоглобина ниже 12 г/дл, а у мужчин ниже 13 г/дл [3]. На рис. 1 проиллюстрировано применение данных критериев на примере крупной выборки исследования NHANES III (n=40 000) [4]. Применение критерия 12 г/дл для женщин позволяет включить в число страдающих анемией существенно большее число лиц, по сравнению с мужчинами. Этот факт находит свое отражение и в других исследованиях, в которых распространенность анемии у женщин почти в 3 раза превышает таковую у мужчин: 13 и 4,8% соответственно [5], и должен быть принят во внимание при оценке результатов различных исследований.
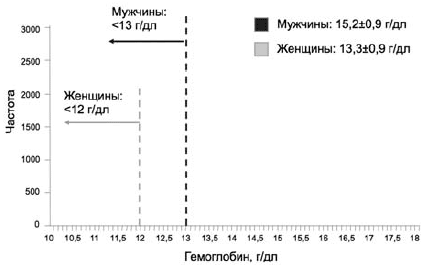
Рис 1. Применение критериев ВОЗ для определения анемии на популяционном уровне [4]
Распространенность анемии среди пациентов с сердечно-сосудистыми заболеваниями относительно хорошо изучена. Среди пациентов с ишемической болезни сердца (ИБС) составляет от 10 до 30% [6, 7], а на примере ХСН - варьирует в широком диапазоне от 4 до 61% (в среднем 18%) в зависимости от тяжести основного заболевания и применяемых критериев анемии [8].
Этиология и патогенез
Причинами анемии у пациента кардиологического профиля могут быть все факторы характерные для общей популяции. Однако если рассматривать группу больных с прогрессирующими ССЗ и в первую очередь с ХСН, то основными этиопатогенетическими факторами анемии можно считать следующие:
1. Анемия хронических заболеваний.
2. Анемия за счет гемодилюции (псевдоанемия).
3. Анемия за счет недостатка железа/витаминов.
4. Нарушение функции почек - снижение продукции эритропоэтина.
5. Действие лекарств.
Анемия хронических заболеваний
Анемия, возникающая у пациентов с инфекцией, воспалением, неоплазиями, хронической почечной недостаточностью и продолжающаяся более 1-2 мес, обозначается как анемия хронических заболеваний (АХЗ) - «анемия воспаления», «цитокинопосредованная анемия». Характерной чертой этого типа анемии является сочетание пониженного уровня железа сыворотки с достаточными его запасами в ретикулоэндотелиальной системе (РЭС). АХЗ по распространенности занимает 2-е место среди анемий (после железодефицитной - ЖДА) [9]. В случае наличия ХСН данный вид анемии является самым распространенным и отмечается у 58% пациентов [10].
В настоящее время считается, что в основе АХЗ лежит иммуноопосредованный механизм: цитокины и клетки РЭС вызывают изменения в гомеостазе железа, пролиферации эритроидных предшественников, продукции эритропоэтина и продолжительности жизни эритроцитов [11]. Открытие гепсидина (hepcidin) - железорегулирующего острофазового белка - позволило во многом прояснить связь между иммунным механизмом нарушения гомеостаза железа и развитием АХЗ: именно через усиление синтеза в печени гепсидина под влиянием воспалительных стимулов, (главным образом интерлейкина-6), происходят снижение абсорбции железа в кишечнике и блокирование высвобождения железа из макрофагов (рис. 2). Дизрегуляция гомеостаза железа ведет к последующей недостаточности доступного для эритроидных предшественников железа, ослаблению пролиферации этих клеток вследствие негативного влияния на них нарушения биосинтеза гема.
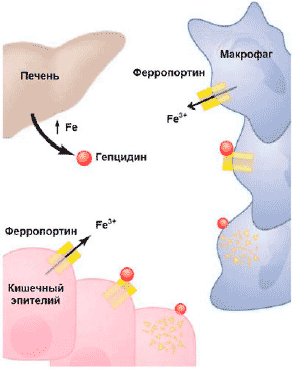
Рис 2. Механизм действия гепцидина: угнетение всасывание железа в кишечнике, замедление мобилизации железа из депо, способствуя его накоплению в макрофагах
Анемия вследствие гемодилюции (псевдоанемия)
Данная причина анемии связана с избыточным «разбавлением» крови и характерна для пациентов с повышенным объемом плазмы (ХСН, ХПН, беременность). Предполагается, что у многих больных ХСН анемия может быть вызвана гемодилюцией [12]. Однако, несмотря на увеличение общего объема плазмы у всех пациентов с систолической и у 71% с диастолической ХСН, истинный дефицит эритроцитов имеется у 88% больных анемией при диастолической ХСН и у 59% при систолической ХСН [13].
Анемия вследствие недостатка железа/витаминов
Еще 50 лет назад было показано непосредственное влияние железодефицита на ферментативные процессы, даже в отсутствии анемии [14]. Экспериментальные исследования на животных показали возможность непосредственного влияния железодефицита на диастолическую функцию, провоцирование сердечной недостаточности, фиброза миокарда, уменьшение уровня циркулирующего эритропоэтина, влияние на молекулярные сигнальные пути и активацию воспаления [15].
Железодефицитная анемия является самой распространенной формой в популяции, однако у пациентов кардиологического профиля уступает первенство АХЗ и составляет до 21% [16].
Распространенность железодефицитного состояния при ХСН во многом зависит от критериев определения. Если учитывать лишь снижение насыщения трансферина менее 16%, то его можно обнаружить у 78% анемичных и 61% неанемиченых больных ХСН, если к критериям добавить уровень ферритина 30-100 мг/л, то распространенность снизится до 20 и 15% соответственно [17]. В другом исследовании, где критериями железодефицита были значения ферритина менее 100 мг/л при насыщении трансферина менее 16%, нарушения выявлены у 61% анемичных и 43% неанемичных пациентов ХСН [18].
Таким образом, можно говорить о высоком распространении у больных ХСН как абсолютного (определяемого как уровень ферритина <100 мг/л и процента сатурации трансферина <20%), так и функционального дефицита железа (определяемого как уровень ферритина >100 мг/л и процента сатурации трансферина <20%), который в свою очередь ассоциирован с тромбоцитозом и может приводить к тромботическим осложнениям, прогрессированию атеросклероза и увеличению смертности [19]. Что дало основание для проведения исследований терапии внутривенными препаратами железа у больных ХСН.
Анемии, вызванные недостатком витамина В12 или фолиевой кислоты, сравнительно редки в кардиологической практике и характеризуются определенными изменениями периферической крови и костного мозга - мегалобластической анемией, которая диагностируется и подвергается терапии по стандартным методикам.
Дифференциальная диагностика при АХЗ и ЖДА
При АХЗ ретикулоцитарное число обычно нормальное или пониженное (редко - несколько повышенное). Эритроциты в мазке крови - нормоцитарные и нормохромные, у 20-40% больных отмечается микроцитоз (средний объем эритроцитов - MCV: <80 фл). Гипохромия (средняя концентрация Hb в эритроцитах - MCHC: 26-32 г/дл) выявляется чаще - у 40-70% пациентов с АХЗ.
Микроцитоз при АХЗ (если он наблюдается) не достигает такой степени, как при ЖДА: MCV <72 фл встречается редко, может определяться анизо- и пойкилоцитоз, но обычно изменения формы и величины эритроцитов не столь значительны, как при ЖДА. Характерны снижение уровня железа в сыворотке крови, насыщение железом трансферрина ниже нормы, причем степень гипоферремии зависит от тяжести основного заболевания. В костномозговом пунктате, окрашенном на содержание железа (образование берлинской лазури в реакции Перлса), число сидеробластов понижено до 5-20% от общего количества нормобластов (в норме 30-50%), напротив, число содержащих гемосидерин макрофагов повышено, за исключением случаев сочетания АХЗ с ЖДА. Сывороточный уровень ферритина у пациентов с АХЗ повышен, при сопутствующем дефиците железа он снижается, но никогда не бывает таким низким, как при ЖДА. Распознать дефицит железа, сочетающегося с АХЗ у 27% пациентов с хроническими воспалительными заболеваниями, довольно трудно. Дефицитом железа у таких больных можно считать уровень ферритина в сыворотке крови <30 мкг/л, об отсутствии дефицита свидетельствует его уровень >200 мкг/л.
Разграничение АХЗ и ЖДА имеет важное практическое значение: некорректная трактовка пациента с АХЗ как имеющего дефицит железа влечет за собой неэффективную терапию железом с риском развития осложнений (перегрузки железом, особенно при внутривенном введении). Показатели дифференциальной диагностики при АХЗ, ЖДА и их сочетаниях представлены в таблице.
Показатели дифференциальной диагностики при АХЗ и ЖДА
| Показатели | ЖДА | АХЗ |
| Сывороточное железо | Снижено | Снижено |
| ОЖСС | Повышена | Снижена или N |
| Средний корпускулярный объём | Снижен | Снижен (30%) |
| Насыщение трансферрина | Снижено | N или снижено |
| Сывороточный ферритин | Снижен | N |
| Железо костного мозга | Снижено или отсутствует | N |
| Тест с пероральным железом | Подъем hb | Нет подъема Hb |
Анемия при почечной недостаточности
У больных с хроническими заболеваниями почек наиболее важный вклад в развитие анемии вносят снижение продукции эритропоэтина вследствие уменьшения массы функциональных тканей почек и антипролиферативное действие уремических токсинов. Кроме того, развитие анемии может быть вызвано сокращением продолжительности жизни эритроцитов со 120 дней до 70-80 дней, а также потерей крови, ингибированием эритропоэза в результате хронического воспаления, недостатком свободного железа в организме и дефицитом нутриентов, побочным действием лекарств. По современным представлениям, в случае ХПН можно говорить о едином патогенетическом механизме с АХЗ [20].
У большинства пациентов с ХСН и анемией имеется хроническая болезнь почек (ХБП) различной степени, то есть снижение скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м2. Такое сочетание анемии, ХБП и ХСН D.S.Silverberg и соавт. предложили называть кардиоренальным анемическим синдромом, каждое из трех составляющих которого ухудшает течение остальных двух (рис. 3) [21].
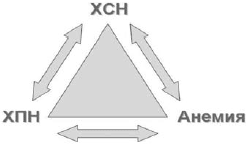
Рис 3. Взаимосвязь при кардиоренальном анемическом синдроме (модифицированна по [21])
Действие лекарств
Применительно к кардиологической практике можно выделить три основных лекарственных воздействия, которые могут провоцировать возникновение и поддержание анемии:
1. Непосредственное подавление костного мозга (вплоть до апластической анемии) могут вызывать следующие лекарственные препараты: НПВС, цитостатики, мерказолил, метамизол (анальгин).
2. Невозможность восстановления присутствующего в пище трехвалентного железа до двухвалентного (всасывающегося во много раз быстрее, нежели трехвалентное) в связи с относительной гипоацидностью (обусловленной сопутствующим применением антисекреторных или антацидных препаратов).
3. Ингибиторы ангиотензинпревращающего фермента и антагонисты к рецепторам ангиотензина могут уменьшать продукцию эритропоэтина и чувствительность к нему костного мозга, так как ангиотензин является мощным стимулятором синтеза эритропоэтина и эритропоэза [22].
Кроме того, необходимо помнить, что нитраты способны вызывать метгемоглобинемию и привести к снижению кислородной емкости крови, однако этот эффект наблюдается в основном при использовании очень высоких доз [23].
Анемия - фактор риска ССЗ
Наличие анемии у пациентов само по себе ассоциировано с пожилым возрастом, нарушением функции почек, сахарным диабетом, тяжелой сердечной недостаточностью, снижением переносимости физических нагрузок и низкими показателями качества жизни [24]. В этой связи наибольшую ценность представляют исследования, выполненные на больших выборках, позволяющие при анализе провести коррекцию на другие факторы риска.
Из исследований, проведенных на популяционном уровне, по данному вопросу можно выделить ARIC-study (Atherosclerosis Risk in Communities), в котором проводилось наблюдение более 6 лет за почти 14 000 пациентов без ССЗ [25]. При оценке анемии как фактора риска ССЗ оказалось, что пациенты со сниженным уровнем гемоглобина имели риск развития указанных заболеваний почти в 1,5 раза выше вне зависимости от всех остальных факторов риска ССЗ (рис. 4).
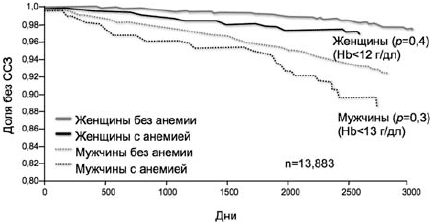
Рис 4. Кривые Каплана-Мейера для ССЗ у мужчин и женщин, стратифицированных по наличию или отсутствию анемии [25]
Анализ других работ по оценке популяционного риска анемии дал противоречивые результаты. Исследователи пришли к выводу о необходимости дополнительных изысканий для определенных рекомендаций в этой области [2].
Анемия и ИБС
Широко известно, что ряд некоронарных заболеваний, в патогенезе которых имеет место гемическая или тканевая гипоксия, может инициировать клинические проявления ИБС, оказывать отягчающее влияние на характер течения основного заболевания. Возможным механизмом представляется усиление симпатической активности и сердечного выброса за счет длительной индуцированной гипоксией вазодилятации, что приводит к гипертрофии левого желудочка и увеличению размеров сердца и, соответственно, к повышению потребления кислорода [26]. Также у пациентов с ИБС по сравнению со здоровыми отмечена сниженная толерантность миокарда к низким уровням гемоглобина [27].
Вопросы сочетания ИБС и анемий представлены в научной литературе немногочисленными источниками. При рассмотрении вопроса влияния анемии на исходы ИБС можно выделить три основных направления исследований:
Наличие анемии перед проведением чрескожного коронарного вмешательства у пациентов с инфарктом миокарда (ИМ) с подъемом сегмента ST достоверно увеличивает риск большого кровотечения как на протяжении 30 сут после ИМ, так и в течение 1 года [28]. Анализ более чем 45 000 случаев чрескожного коронарного вмешательства при ОКС и стабильной ИБС показал, что анемия является независимым фактором риска госпитальной летальности у мужчин и серьезных сердечно-сосудистых осложнений и у мужчин, и у женщин [7]. Повышенный риск неблагоприятных исходов также отмечается у пациентов со сниженным уровнем гемоглобина перед аортокоронарным шунтированием [29].
Сходные результаты показывают исследования, посвященные исходам ОКС в зависимости от наличия анемии, в которых снижение уровня гемоглобина признается значительным фактором риска прогрессирования ИБС, развития ХСН и нарушений ритма, а также смертности [30]. N.C.Meneveau и соавт., помимо признания анемии как независимого фактора риска смерти при ОКС, предлагают включить ее наравне с другими факторами в шкалу риска GRACE (Global Registry of Acute Coronary Events) для более точного прогноза [31].
Исследования, проведенные на популяционном уровне [32] и у больных ИБС [33], подтверждают наличие U-образной зависимости между уровнем гемоглобина и сердечно-сосудистой заболеваемостью и смертностью, т. е. высокий уровень гемоглобина (>13 г/дл) ассоциирован с плохим прогнозом, наряду с низким уровнем.
Анемия и ХСН
Факт увеличения общей и сердечно-сосудистой смертности при наличии анемии у больных с ХСН подтвержден в большом количестве исследований. Так, в ретроспективном исследовании SOLVD показано, что снижение гематокрита на 1% увеличивает общую смертность больных ХСН на 2,7% [34]. Исследование OPTIME продемонстрировало увеличение риска смерти или повторной госпитализации на 12% при уровне гемоглобина менее 12 г/дл [35]. При этом более тяжелый функциональный класс СН по NYHA ассоциировался с более низким уровнем гемоглобина и высоким уровнем креатинина. Имеются данные о наиболее худшем прогнозе относительно сердечно-сосудистой смертности при ЖДА по сравнению другими видами анемии [36].
Анемия при ХСН также является независимым фактором риска более тяжелого течения заболевания: высокого функционального класса, сниженной переносимости физических нагрузок, когнитивных нарушений, низкого качества жизни [37].
Анемия и гипертоническая болезнь
Данные о соотношениях анемии с гипертонической болезнью, несмотря на их широкое распространение, достаточно немногочисленны. Имеются указания на связь анемии с повышением артериального давления в ночные часы и среднего артериального давления (сумма диастолического давления плюс 1/3 пульсового) по данным суточного мониторирования [38], а также на достоверно более широкую распространенность нормоцитарной анемии у пациентов с неконтролируемым уровнем артериального давления - 20%, по сравнению с пациентами поддерживающих нормотонию - 16% (р=0,03) [39].
Лечение
Терапевтические мероприятия, направленные на устранение анемии, должны быть обращены, в первую очередь, на устранение этиологического фактора. В соответствие с этим пациенты должны проходить полноценное обследование для выяснения причины анемии. В рамках данного обзора мы остановимся на АХЗ и ЖДА, составляющих по отдельности или в сочетании подавляющее большинство анемий в кардиологической практике. В данных ситуациях в качестве основной терапии применяются пероральные и внутривенные препараты железа, а также препараты эритропоэтина.
Препараты железа
В случаях выявления устранимой причины ЖДА лечение должно быть направлено на устранение этиологического фактора (эрозивно-язвенные и опухолевые поражения ЖКТ, миома матки, энтериты, алиментарная недостаточность и др.). В этом случае, а также при наличии неустранимой причины непроходимо проводить патогенетическую терапию препаратами железа (ПЖ).
Необходимо отметить ошибочность мнения о возможности коррекции дефицита железа с помощью пищевых продуктов с высоким содержанием железа. Предвидя установление данного факта, врач Мелампас (Melampus) в Греции за 1500 лет до н. э. для избавления принца Ификласа Тезалия (Iphyclus of Thesaly) от полового бессилия, возникшего у него на почве постгеморрагической анемии, давал ему вино с ржавчиной, соскобленной с лезвия старого ножа [40].
В настоящее время мы имеем широкий выбор препаратов железа (ПЖ) для приема внутрь, которые назначаются в большинстве случаев (при отсутствии специальных показаний). Основные ПЖ в виде солей представлены сульфатом, глюконатом, хлоридом, фумаратом, глицинсульфатом. Среди ПЖ в виде железосодержащих комплексов, обладающих большей степенью абсорбции, имеются железо-полимальтозный комплекс, железо-сорбитоловый комплекс, протеин сукцинилат железа, железо-сахаратный комплекс.
Необходимо учитывать, что всасывание железа может уменьшаться под влиянием содержащихся в некоторых пищевых продуктах веществ - фитинов (рис, соя), фосфатов (рыба, морепродукты), танин (чай, кофе). Препараты железосодержащих комплексов (в частности, гидрокси-полимальтозный комплекс) лишены подобных недостатков, поскольку пищевые продукты и медикаменты не оказывают влияния на всасываемость железа в виде трехвалентной формы.
Оптимальная тактика ведения больных ЖДА предполагает насыщающую и поддерживающую терапию ПЖ. Длительность насыщающей терапии зависит от темпов прироста и сроков нормализации показателей гемоглобина, составляя в среднем 3-4 нед, при этом минимальная суточная доза свободного железа должна составлять не менее 100 мг (оптимальная 150-200 мг). Поддерживающая терапия показана в тех ситуациях, когда сохраняется или трудно устранима причина дефицита железа (меноррагии, беременность, патология кишечника).
Оценка результатов лечения:
1. Изменение содержания ретикулоцитов. Считается, что ретикулоцитарный криз появляется на 3-7 сут от начала лечения препаратами железа. Содержание ретикулоцитов может при этом возрастать до 10-20 промилле. Максимальная ретикулоцитарная реакция наступает на 7-10 сут от начала лечения.
2. Прирост гемоглобина начинается с 5 сут при правильном лечении. Если в течение этого периода прироста гемоглобина нет, то это говорит о плохом усвоении препаратов железа. Нормальным считается прирост гемоглобина 1% в сутки или на 0,15 г/сут.
3. Восстановление числа эритроцитов и цветного показателя.
В большинстве случаев для коррекции дефицита железа при отсутствии специальных показаний ПЖ следует назначать внутрь. Показания для внутривенного введения ПЖ у больных ЖДА определяется конкретной клинической ситуацией, в частности, основными являются: состоянием кишечного всасывания и переносимостью пероральных ПЖ.
При переводе на парентеральный прием обязательно надо контролировать уровень сывороточного железа. Без этого показателя вводить внутривенно препараты железа противопоказано (кроме массивной кровопотери). При переводе с перорального на парентеральный прием, пероральное железо должно быть отменено за 2-3 дня.
Несколько другой взгляд относительно пути введения препаратов железа при ХСН представлен в обзоре D.S.Silverberg и соавт. [41]. При сравнении применения пероральных и внутривенных форм ПЖ оказалось, что при отдельном применении, а также в сочетании с эритропоэтином пероральных форм у больных с ХСН не удается достичь того положительного эффекта, получаемого при внутривенном введении, вероятно, за счет блокирования всасывания железа гепсидином. Данное заключение стало возможно после ряда исследований в этой области, которые начались с в некотором смысле революционного подхода в лечении пациентов с ХСН и дефицитом железа, предложенного английскими исследователями, по аналогии с лечением у больных с почечной патологией - внутривенного введения препаратов железа вне зависимости от наличия анемии без эритропоэтина [42]. В данном исследовании, а также в двух других[43, 44] показано достоверное увеличение уровня гемоглобина, фракции выброса левого желудочка, функционального класса ХСН, качества жизни, функции почек, снижение натрийуретических пептидов, С-реактивного белка, а также уменьшение частоты госпитализаций.
В другом исследовании терапии внутривенным железом при ХСН у больных с дефицитом железа вне зависимости от наличия анемии показано улучшение функционального класса ХСН, потребления кислорода и общего состояния даже при отсутствии повышения гемоглобина [45]. Эти данные подтверждают возможность непосредственного влияния железа на митохондриальные процессы окисления. Учитывая существенные различия по клинико-фармакологическим параметрам между препаратами железа необходимо отметить, что в данных исследованиях применялось железо в форме гидроксидсахарозного комплекса (венофер), по применению которого у больных ХСН накоплена в настоящий момент наибольшая доказательная база.
На этом фоне интересным представляется появление в распоряжении врачей нового препарата железа в виде карбоксимальтозатного комплекса (феринъект), обладающего существенно более удобным режимом введения (1 раз в неделю) и лучшим профилем безопасности по отношению к другим препаратам железа. Данная форма железа изучалась в одном из недавних крупных исследований, аналогичном упомянутым выше, у пациентов с ХСН и дефицитом железа вне зависимости от наличия анемии -FAIR-HF, показавшем при 6-месячном наблюдении достоверный переход в более низкий функциональный класс ХСН и улучшение показателей качества жизни при применении внутривенного препарата железа вне зависимости от снижения уровня гемоглобина [46]. Результаты данной работы позволяют частично ответить на вопрос о первичной роли железодефицита по сравнению с наличием анемии в патогенезе ХСН и необходимости его максимально безопасной коррекции.
В настоящий момент отсутствуют полноценные данные о влиянии монотерапии внутривенными препаратами железа на смертность и другие неблагоприятные исходы ХСН при долговременном наблюдении, для окончательного решения этого вопроса необходимы длительные крупные исследования, по результатам которых будут внесены изменения в соответствующие рекомендации.
Эритропоэтины
Применение рекомбинантного эритропоэтина и его в 3 раза более длительно действующего деривата дарбепоэтина в кардиологии наиболее всего изучено у пациентов с ХСН. В нескольких небольших исследованиях применения эритропоэтина в качестве монотерапии или в сочетании с парентеральными препаратами железа было показано снижение смертности и частоты госпитализаций [47]. Наряду с этим показан положительный эффект от данной терапии на различные клинические и функциональные показатели: систолическую и диастолическую функцию правого и левого желудочка, дилатацию камер сердца, гипертрофию левого желудочка, функциональный класс сердечной недостаточности, переносимость физических нагрузок, потребление кислорода, калорийность потребляемой пищи, качество жизни, активность эндотелиальных прогениторных клеток [47]. Данные эффекты не могут полностью объяснены воздействием на эритропоэз и связываются с плеотропными эффектами эритропоэтина, в частности активацией эндотелиальной NO синтетазы и AKT (протеинкиназа В), которая медиирует фосфорилирование, приводя к длительной NO-зависимой вазодилатации [48].
Эритропоэтины, позволяющие увеличить уровень гемоглобина в среднем на 2 г/дл, считаются основными препаратами для коррекции выраженной анемии, в том числе из-за редкости возникновения побочных реакций. Однако данные полученные в онкологических исследованиях свидетельствуют о повышенной частоте сердечно-сосудистых неблагоприятных исходов (в основном за счет тромботических осложнений) при превышении уровня гемоглобина более 12 г/дл [49]. При этом стоит отметить, что дозы эритропоэтинов в данных исследованиях в несколько раз превышали, используемые при ХСН. С другой стороны, у пациентов с ХСН и ХПН не выявлено дополнительного преимущества повышения уровня гемоглобина выше 11-12 г/дл, более того отмечено повышенное количество неблагоприятных исходов при повышении уровня гемоглобина выше 13 г/дл, так называемая U-образная зависимость уровня гемоглобина и смертности [50]. В настоящий момент, в отсутствии официальных рекомендаций по целевому уровню гемоглобина при ХСН, большинство исследователей сходятся на значении 12 г/дл [47].
Заключение
В настоящее время существуют достоверные данные о необходимости активного выявления и коррекции анемии у пациентов кардиологического профиля. Особый интерес вызывает вопрос терапии анемии при длительно протекающей сердечно-сосудистой патологии, в частности ХСН. Накопленная доказательная база у данных больных по лечению анемии эритропоэтинами и/или препаратами внутривенного железа не позволяет однозначно определить целесообразность и безопасность такого подхода. Данные исследований по применению внутривенных препаратов железа в качестве монотерапии у больных ХСН и железодефицитом вне зависимости от наличия анемии могут существенно расширить показания для их применения при данной патологии. Этот и некоторые другие вопросы, как например, наличие универсального маркера ответа при терапии препаратами железа, целевых уровнях гемоглобина при различных заболеваниях и многие другие требуют своего разрешения в научных работах.
До получения результатов крупных исследований лучшим подходом остается считать применение пероральных препаратов железа у пациентов с умеренной ЖДА, а у больных с тяжелой анемией возможна комбинация внутривенного железа и препаратов эритропоэтина, что позволит уменьшить дозы и снизить частоту побочных эффектов. При ХСН даже только с дефицитом железа без анемии можно рассмотреть назначение внутривенных препаратов железа.
ЛИТЕРАТУРА
1. Lange J. Medicinalium Epistolarum Miscellanea./Basel, Switzerland,1554, Р 74-77
2. Pereira AA, Sarnak MJ. Anemia as a risk factor for cardiovascular disease. KidneylntSuppl 2003; S32-S39.
3. World Health Organization. Nutritional Anemias: Report of a WHO Scientific Group. Geneva: World Health Organization, 1968.
4. Dallman PR. et al. In: Iron Nutrition in Health and Disease. London, UK: John Libbey & Co; 1996; 65-74.
5. Sarnak M.J., Tighiouart H., Manjunath G., et al: Anemia as a risk factor for cardiovascular disease in The Atherosclerosis Risk in Communities (ARIC) study. J Am Coll Cardiol. 2002; 40: 27-33.
6. Lipgic E., Asselbergs F.W., van der Meer P., Tio R.A., Voors A.A., van Gilst W.H., Zijlstra F., van Veldhuisen D.J. Anaemia predicts cardiovascular events in patients with stable coronary artery disease. Netherlands Heart Journal. 2005; 13: 7/8: 254-258.
7. McKechnie R.S., Smith D., Montoye C. et al. Prognostic implication of anemia on in-hospital outcomes after percutaneous coronary intervention. Circulation. 2004 Jul; 20: 110 (3): 271-7.
8. Tang Y-D., Katz S.D. Anemia in Chronic Heart Failure: Prevalence, Etiology, Clinical Correlates, and Treatment Options. Circulation. 2006; 113: 2454-2461.
9. Cash J.M., Slars D.A. The anemia of chronic disease: spectrum of associated diseases in series of unselected hospitalized patients. Am. J. Med. 1989; 87: 638.
10. Ezekowitz J.A., McAlister F.A., Armstrong PW. Anemia is common in heart failure and is associated with poor outcomes: insights from a cohort of 12 065 patients with new-onset heart failure. Circulation. 2003 Jan 21; 107 (2): 223-25.
11. Weiss G., Goodnough L.T. Anemia of Chronic Disease. New. Eng. J. Med. 2005; 352: 10: 1011-1023.
12. Androne A.S., Katz S.D., Lund L., LaManca J., Hudaihed A., Hryniewicz K., Mancini D.M. Hemodilution is common in patients with advanced heart failure. Circulation. 2003; 107: 226-229.
13. Abramov D., Cohen R.S., Katz S.D., Mancini D., Maurer M.S. Comparison of blood volume characteristics in anemic patients with low versus preserved left ventricular ejection fraction. Am J Cardiol. 2008; 102: 1069-1072.
14. Beutler E., Larsh S.E., Gurney C.W. Iron therapy in chronically fatigued, nonanemic women: a double-blind study. Ann Intern Med. 1960; 52: 378-394.
15. Naito Y, Tsujino T, Matsumoto M., Sakoda T, Ohyanagi M., Masuyama T Adaptive response of the heart to long-term anemia induced by iron deficiency. Am J Physiol Heart Circ Physiol. 2009; 296:H585-H593.
16. Anand I.S. Anemia and chronic heart failure: implications and treatment options. J Am Coll Cardiol. 2008; 52: 501-11.
17. Murphy C.L., Fitzsimons E.J., Jardine A.J., Sattar N., Mcmurray J.J.V. Routine assessment of iron status in all patients with heart failure may identify those at risk of developing anemia. Eur J Heart Fail. 2007; 61: Suppl: 24.
18. Grzeslo A., Jankowska E.A., Witkowski T, Majda J., Petruk-Kowalczyk J., Banasiak W., Ponikowski P. Iron deficiency is a common finding in patients with stable chronic heart failure. Eur J Heart Fail. 22006; 5: 132.
19. Streja E., Kovesdy C.P, Greenland S., Kopple J.D., McAllister C.J., Nissenson A.R., Kalantar- Zadeh K. Erythropoietin, iron depletion, and relative thrombocytosis: a possible explanation for hemoglobin-survival paradox in hemodialysis. Am J Kidney Dis. 2008; 52: 727-736.
20. Weiss G. Iron metabolism in the anemia of chronic disease. Biochim Biophys Acta. 2009; 1790: 682-693.
21. Silverberg D.S., Wexler D., laina A., Steinbruch S., Wollman Y, Schwartz D. Anemia, chronic renal disease and congestive heart failure--the cardio renal anemia syndrome: the need for cooperation between cardiologists and nephrologists. Int Urol Nephrol. 2006; 38 (2): 295-310.
22. Орлов В.А., Гиляревский С.Р, Урусбиева Д.М., Даурбекова Л.В. Влияние побочных эффектов ингибиторов ангиотензинпревращающего ферменты на тактику лечения сердечно-сосудистых заболеваний. Российский кардиологический журнал. 2005; 3: 45 49.
23. Штрыголь С.Ю.Нитраты: побочное действие, его профилактика и коррекция. Провизор. 2003; 9: 45-48.
24. Groenveld H.F., Januzzi J., Damman K. et al. Anemia and mortality in heart failure patients: a systematic review and metaanalysis. J Am Coll Cardiol. 2008; 52: 818-27.
25. Sarnak M.J., Tighiouart H., Manjunath G. et al. Anemia as a risk factor for cardiovascular disease in The Atherosclerosis Risk in Communities (ARIC) study. J Am Coll Cardiol. 2002; 40: 27-33.
26. Metivier F., Marchais S.J., Guerin AP et al. Pathophysiology of anaemia: focus on the heart and blood vessels. Nephrol Dial Transplant. 2000; 15: Suppl 3: 14-8.
27. Carson J.L., Duff A., Poses R.M. et al. Effect of anaemia and cardiovascular disease on surgical mortality and morbidity. Lancet. 1996; 348: 1055-60.
28. Tsujita K., Nikolsky E., Lansky A.J. et al. Impact of anemia on clinical outcomes of patients with ST-segment elevation myocardial infarction in relation to gender and adjunctive antithrombotic therapy (from the HORIZONS-AMI trial). Am J Cardiol. 2010 May 15; 105 (10): 1385-94.
29. Kulier A., Levin J., Moser R., Rumpold-Seitlinger G., Tudor I.C., Snyder-Ramos S.A., Moehnle P, Mangano D.T.; Investigators of the Multicenter Study of Perioperative Ischemia Research Group; Ischemia Research and Education Foundation. Impact of preoperative anemia on outcome in patients undergoing coronary artery bypass graft surgery. Circulation. 2007 Jul 31; 116 (5): 471-9.
30. Zeidman A., Fradin Z., Blecher A., Oster H.S., Avrahami Y Mittelman M.Anemia as a Risk Factor for Ischemic Heart Disease. IMAJ. 2004; 6: 16-18.
31. Meneveau N., Schiele F., Seronde M.F., Descotes-Genon V., Oettinger J., Chopard R., Ecarnot F., Bassand J.P Anemia for Risk Assessment of Patients With Acute Coronary Syndromes Am J Cardiol. 2009; 103: 442- 447.
32. Gagnon D.R., Zhang T.J., Brand F.N. et al. Hematocrit and the risk of cardiovascular disease - the Framingham study: a 34-year followup. Am Heart J. 1994; 127: 674-82.
33. Reinecke H., Trey T, Wellmann J. et al. Haemoglobin-related mortality in patients undergoing percutaneous coronary interventions. Eur Heart J. 2003; 24: 2142-50.
34. Al-Ahmad A., Rand W.M., Manjunath G., Konstam M.A., Salem D.N., Levey A.S., Sarnak M.J. Reduced kidney function and anemia as risk factors for mortality in patients with left ventricular dysfunction. J Am Coll Cardiol. 2001 Oct; 38 (4): 955-62.
35. Felker G.M., Shaw L.K., Stough W.G., O'Connor C.M. Anemia in patients with heart failure and preserved systolic function. Am Heart J. 2006 Feb; 151 (2): 457-62.
36. Varma A., Appleton D.L., Nusca A., Lipinski M.J., Goudreau E., Cowley M.J., Wittkamp M., Vetrovec G.W., Abbate A. Iron deficiency anemia and cardiac mortality in patients with left ventricular systolic dysfunction undergoing coronary stenting. Minerva Cardioangiologica. 2010 February; 58 (1): 1-10.
37. Ghali J.K., Anand I.S., Abraham W.T., Fonarow G.C., Greenberg B., Krum H., Massie B.M., Wasserman S.M., Trotman M.L., Sun Y, Knusel B., Armstrong P; Study of Anemia in Heart Failure Trial (STAMINA-HeFT) Group. Randomized double-blind trial of darbepoetin alfa in patients with symptomatic heart failure and anemia. Circulation. 2008 Jan 29; 117 (4): 526-35.
38. Marketou M., Patrianakos A., Parthenakis F, Zacharis E., Arfanakis D., Kochiadakis G., Chlouverakis G., Vardas P Systemic blood pressure profile in hypertensive patients with low hemoglobin concentrations. Int J Cardiol. 2010 Jun 25; 142 (1): 95-6.
39. Paul B., Wilfred N.C., Woodman R., Depasquale C. Prevalence and correlates of anaemia in essential hypertension. Clin Exp Pharmacol Physiol. 2008; 35: 1461-1464.
40. Fairbanks V.F., Fahey, J.L., Beutler, E. Clinical Disorders of Iron Metabolism / Grune and Stratton, New York, London. 1971; 1-41.
41. Silverberg D.S., laina A., Schwartz D., Wexler D. Intravenous iron in heart failure: beyond targeting anemia. Curr Heart Fail Rep. 2011 Mar; 8 (1): 14-21.
42. Bolger A.P, Bartlett F.R., Penston H.S., O'Leary J., Pollock N., Kaprielian R., Chapman C.M. Intravenous iron alone for the treatment of anemia in patients with chronic heart failure. J Am Coll Cardiol. 2006 Sep 19; 48 (6): 1225-7.
43. Usmanov R.I., Zueva E.B., Silverberg D.S., Shaked M. Intravenous iron without erythropoietin for the treatment of iron deficiency anemia in patients with moderate to severe congestive heart failure and chronic renal insufficiency. J Nephrol. 2008; 21: 236-242.
44. Toblli J., Lombrana A., Duarte P, Di Gennaro F Intravenous iron reduces NT-pro-brain natriuretic peptide in anemic patients with chronic heart failure and renal insufficiency. J Am Coll Cardiol. 2007; 50: 1657-1665.
45. Okonko D.O., Grzeslo A., Witkowski T, Mandal A.K., Slater R.M., Roughton M., Foldes G., Thum T, Majda J., Banasiak W., Missouris C.G., Poole-Wilson P.A., Anker S.D., Ponikowski P Effect of intravenous iron sucrose on exercise tolerance in anemic and nonanemic patients with symptomatic chronic heart failure and iron deficiency FERRIC-HF: a randomized, controlled, observer-blinded trial. J Am Coll Cardiol. 2008; 51: 103-112.
46. Anker S.D., Comin Colet J., Filippatos G., Willenheimer R., Dickstein K., Drexler H., L Яscher T.F., Bart B., Banasiak W., Niegowska J., Kirwan B.A., Mori C., von Eisenhart Rothe B., Pocock S.J., Poole-Wilson PA., Ponikowski P; FAIR-HF Trial Investigators. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med. 2009 Dec 17; 361 (25): 2436-48.
47. Silverberg D.S., Wexler D., Iaina A., SchwartzD. Chronic Heart Failure: The Cardiorenal Anemia Syndrome Transfusion Alter Transfusion Med. 2009; 10 (4): 189-196.
48. Chong Z.Z., Kang J.Q., Maiese K. Erythropoietin is a novel vascular protectant through activation of Akt1 and mitochondrial modulation of cysteine proteases. Circulation. 2002; 106: 2973-2979
49. Bennett C.L., Silver S.M., Djulbegovic B.T et al. Venous thromboembolism and mortality associated with recombinant erythropoietin and darbepoetin administration for the treatment of cancer-associated anemia. JAMA. 2008; 299: 914-24.
50. KDOQI; National Kidney Foundation. KDOQI Clinical Practice Guidelines and Clinical Practice Recommendations for Anemia in Chronic Kidney Disease. Am J Kidney Dis. 2006; 47: 5: Suppl. 3: S11-145].
