Уникальные эффекты метформина в лечении метаболического синдрома
Статьи Профессор А.М. Мкртумян, Е.В. Бирюкова, Н.В. Маркина, М.А. ГарбузоваМГМСУ
Метаболический синдром (МС) собирательное понятие, которое объединяет группу заболеваний или патологических состояний, имеющих в основе своего развития общую причину [1].
Особый интерес к МС возник у ученых и различных специалистов после того, как G. Reaven (1988) ввел в клиническую практику понятие «синдром Х», объединяющий нарушение углеводного обмена, артериальную гипертензию и дислипидемию. Метаболический синдром – очень частое клиническое проявление, в среднем он встречается у каждого пятого среди взрослого населения развитых стран [8,13]. При этом частота МС с незначительным отставанием параллельна распространенности ожирения в популяции; наиболее уязвимыми этническими группами являются латиноамериканцы и выходцы из индийского субконтинента. МС чаще встречается у мужчин, у женщин его частота возрастает в постменопаузальном периоде [20,31,35].
Согласно критериям, разработанным в 2001 году комитетом экспертов Национальной образовательной программы по холестерину (NCEP ATPIII), МС диагностируется, если у пациента обнаруживается три и более из следующих признаков [30]:
- абдоминальное ожирение: окружность талии (ОТ) более 102 см у мужчин и более 88 у женщин;
- уровень триглицеридов ≥1,7 ммоль/л (≥150 мг/дл);
- ХС ЛПВП <1 ммоль/л (<40 мг/дл) у мужчин; <1,3 ммоль/л (<50 мг/дл) у женщин;
- артериальная гипертензия (АД≥130/85 мм рт.ст.) или лечение ранее диагностированной АГ;
- показатель глюкозы натощак ≥6,1 ммоль/л (≥110 мг/дл) или ранее диагностированный сахарный диабет 2 типа (СД2).
Новая редакция определения критериев МС была представлена в 2005 году на І Международном конгрессе по предиабету и метаболическому синдрому [31]. Принципиально новой позицией было утверждение абдоминального ожирения, как основного критерия диагностики МС с ужесточением ряда параметров: окружность талии ≥94 см для мужчин, ≥80 см для женщин; ХС ЛПВП <1,03 ммоль/л (40 мг/дл) для мужчин, <1,29 ммоль/л (50 мг/дл) для женщин; показатель глюкозы натощак ≥5,6 ммоль/л (100 мг/дл) или ранее диагностированный СД 2 типа (табл. 1).
Таблица 1. Определение метаболического синдрома у лиц белой расы Международной Федерацией диабета (2005)
| Центральное ожирение определяется, как окружность талии > 94 см у мужчин и > 80 см у женщин (у других этнических групп другие специфические особенности) и два из следующих четырех факторов: | |
| *или получают лечение по поводу этого состояния | |
В новых критериях МС самостоятельное место абдоминальному ожирению отведено не случайно. Существует немало клинических доказательств, демонстрирующих тесную связь между абдоминальным ожирением и комплексом гормональных и метаболических факторов риска, составляющих основу рассматриваемого синдрома [4,28,35]. Предложенные диагностические критерии довольно просты, удобны для применения в клинической практике и в первую очередь направлены на раннее выявление пациентов, имеющих высокий риск развития сердечно–сосудистых заболеваний (ССЗ) и СД 2 типа.
С каждым годом выявляются все новые аспекты сложной проблемы метаболического синдрома, дополняя объем понятия новыми составляющими. Так, он дополнен такими компонентами, как синдром ночного апноэ, эндотелиальная дисфункция, недостаточное снижение АД в ночное время. Кроме того, МС нередко сопутствуют такие заболевания, как синдром поликистозных яичников, гепатостеатоз, эректильная дисфункция и др. [22,32,35]. Предполагают, что хроническое воспаление низкой степени является дополнительным компонентом МС, а также существенным фактором развития атеросклеротического процесса при этом синдроме [8,11].
Патофизиологическим звеном, объединяющим комплекс различных нарушений, развивающихся на фоне МС, является резистентность к инсулину.
Изучение основных причин и последствий ИР является основополагающим для понимания патофизиологических механизмов развития МС. На чувствительность тканей к инсулину влияют различные факторы, в том числе возраст, избыточная масса тела и особенно распределение жировой ткани, дислипидемия, АГ, а так же курение, общее физическое состояние, тренированность организма и, наконец, семейный анамнез по СД 2 типа. Причинами развития ИР могут быть стрессы, гиподинамия, злоупотребление алкоголем, курение, травмы, повышение уровня контринсулярных гормонов. Наряду с этим существует и физиологическая ИР, которая характерна для пубертатного периода, беременности и пожилого возраста. Известно также, что ИР встречается более чем у 25% практически здоровых людей с нормальной массой тела. Концепция ИР распространяется на все биологические эффекты инсулина. Согласно современным представлениям наряду с традиционными метаболическими эффектами инсулину свойствен ряд других биологических действий, в том числе и антивоспалительное влияние (рис. 1).
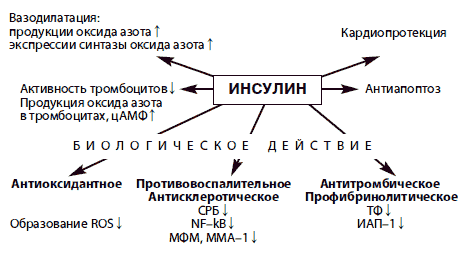
Рис. 1. Биологическое действие инсулина
СРБ – С–реактивный белок; ТФ – тканевой фактор; NF–kВ – нуклеарный фактор каппа–B; ИАП–1 – ингибитор активатора плазминогена; МФМ – миграционный фактор макрофагов; ММА–1 – внутриклеточная молекула адгезии 1
МС играет существенную роль в преждевременном развитии и ускоренном прогрессировании ССЗ, связанных с атеросклерозом, а также повышает риск острых макроваскулярных осложнений [4,12,27]. В популяционном исследовании была показана высокая частота субклинического атеросклероза у молодых пациентов МС (средний возраст – 32±3 года) [33]. Так, в группе больных МС толщина комплекса интима–медиа (ТКИМ) сонных артерий была достоверно больше по сравнению со здоровыми лицами.
МС ассоциируется с существенным повышением риска ишемической болезни сердца (ИБС), особенно среди мужчин в возрасте после 45 и женщин старше 55 лет [12,16]. Практически все компоненты, составляющие МС, являются независимыми факторами риска развития ССЗ, а сочетание нескольких компонентов существенно увеличивает опасность их развития. Так, в исследовании J. Park и соавт., включавшем 478 пациентов с ишемическим инсультом, МС был выявлен у 53,4% больных (критерии NCEP ATP III) [28]. Увеличение значения показателя ТКИМ сонных артерий имело прямую зависимость с увеличением числа компонентов МС. По данным мультивариационного анализа вероятность наличия интракраниального стеноза у больных МС была в 3,58 раза выше, чем у пациентов без МС [27].
Также в различных популяционных исследованиях доказано неблагоприятное влияние МС на общий прогноз жизни. Риск смерти от ССЗ у больных МС повышен в 3–4 раза, также высок риск внезапной кардиальной смерти [8,12]. В когортном 6–летнем исследовании J. Butler и соавт., включившем 3035 человек пожилого возраста, сравнивали частоту сердечно–сосудистых осложнений у больных МС и без МС (МС диагностирован у 38% пациентов) [4]. Смертность от кардиоваскулярных заболеваний составила у лиц с МС 5,1%, у пациентов без МС – 3,8%. Проанализировав данные 14699 участников исследования ARIC (Atherosclerosis Risk in Communities), Y. Hong и соавт. (2007) показали, что риск развития ИБС, общей и коронарной смертности возрастает по мере увеличения числа компонентов метаболического синдрома [16]. Кроме того, отмечено, что распространенность одновременно двух компонентов МС в общей популяции очень велика (51%).
Еще в 90–е годы прошлого столетия считалось, что МС – это удел людей преимущественно среднего и пожилого возраста. Однако ряд недавних исследований свидетельствует о том, что за последние два десятилетия МС демонстрирует устойчивый рост среди подростков и молодежи различных стран мира. По различным оценкам, распространенность МС среди подростков и юношества составляет около 10%, повышаясь до 22,1% при выраженном ожирении [8,35]. Существующие критерии МС для взрослых уже могут использоваться и для подростков старше 16 лет.
Стремительное увеличение распространенности МС в различных возрастных группах, сопровождающееся повышенным кардиометаболическим риском, обусловливает необходимость поиска эффективных современных подходов к фармакотерапии. Выбор ИР, ключевого патофизиологического звена МС, в качестве стратегической мишени лечения позволяет улучшить чувствительность к инсулину и позитивно воздействовать на другие составляющие МС (табл. 2). В этой связи эффективность фармакотерапии МС прежде всего следует оценивать с позиции предотвращения развития заболеваний, связанных с атеросклерозом и их осложнений.
Таблица 2. Кардиоваскулярные риски, ассоциированные с инсулинорезистентностью
| Показатель | Комментарии |
|---|---|
| Дислипидемия | ↑триглицеридов |
| ↓ХС ЛПВП | |
| ↓количества мелких плотных частиц ЛПНП | |
| Постпрандиальная гиперлипидемия | |
| Гемодинамические нарушения нервной системы | ↑активности симпатической |
| ↑почечной задержки натрия | |
| ↑АД | |
| Гипертрофия миокарда левого желудочка | |
| Нарушение гемостаза | ↑ингибитора активатора плазминогена–1 (ИАП–1) |
| ↑фибриногена | |
| ↓фактора VII | |
| Эндотелиальная дисфункция | ↑внутриклеточной молекулы адгезии 1 |
| ↑сосудисто–клеточной молекулы адгезии 1 | |
| ↑Е–селектина | |
| ↑асимметричного диметиларгинина | |
| ↑эндотелийзависимой вазодилатации | |
| Снижение способности синтезировать антиагреганты | |
| Снижение биологической активности оксида азота | |
| Кровоток | ↓капиллярного кровотока в мышцах, жировой ткани |
| Нарушение проницаемости сосудов | |
| Тромбоцитарная дисфункция | Снижение чувствительности к ингибирующему действию инсулина |
| ↑повышение агрегационной активности тромбоцитов | |
| Активация обмена арахидоновой кислоты (увеличение синтеза тромбоксана А2) | |
| Снижение рецепторного связывания простациклина (PGI2) | |
| Хроническое воспаление низкой степени | ↑С–реактивного белка |
| Примечание. ↑– увеличение, ↓– уменьшение | |
В целом имеющиеся данные свидетельствуют о высокой распространенности МС в России, недостаточном назначении лекарственной терапии и низкой ее эффективности. Однако и положительный результат лечения может сопровождаться побочными явлениями. Так, на практике больные МС часто обращаются к врачам различных специальностей, и они назначают фармакотерапию отдельных компонентов МС, не акцентируя внимание на необходимости снижать массу тела и не воздействуя на ключевое звено патогенеза – ИР. Закономерным следствием многокомпонентности изучаемого синдрома нередко является проблема полипрагмазии, что также приводит к низкой эффективности фармакотерапии, отчасти обусловленной плохой комплаентностью пациентов. Одновременное назначение нескольких препаратов создает ряд проблем. Так, больным нередко в дополнение к рекомендациям по изменению образа жизни назначают до 5–6 препаратов разных фармакологических групп, не учитывая при этом их негативное влияние на специфические метаболические расстройства, возможное отрицательное взаимодействие между препаратами, спектр нежелательных побочных явлений. И это при том, что часто не удается достаточно эффективно воздействовать на прогрессирование нарушений углеводного и других обменов, атеросклеротического процесса. В такой ситуации идеально было бы иметь препарат, который воздействовал бы на главный патофизиологический механизм синдрома. И тогда можно было бы, с одной стороны, повлиять сразу на несколько клинических проявлений и гормонально–метаболических нарушений, например, не только достичь целевых показателей АД, липидного спектра крови, но и снизить ИР и массу тела, а с другой – уменьшить количество лекарств, принимаемых пациентом.
В настоящее время препаратом первого выбора является метформин (Глюкофаж), который не только непосредственно воздействует на ИР, но и обладает рядом благоприятных кардиоваскулярных и метаболических эффектов (рис. 2). Результаты многочисленных экспериментальных и клинических исследований позволили раскрыть новые аспекты действия метформина, полнее оценить его практическую значимость, а также расширить показания к его назначению.
Рис. 2. Химическая структура метформина
Основным механизмом действия (препарат из группы бигуанидов, повышающий печеночную и периферическую чувствительность к эндогенному инсулину, не влияя на его секрецию) является снижение продукции глюкозы печенью [14,22,34]. Не оказывая прямых эффектов на β–клетки, Глюкофаж опосредованно улучшает секрецию инсулина, снижая глюкозотоксичность и концентрацию СЖК (липотоксичность). Первичный антигипергликемический эффект вызван снижением глюконеогенеза и гликогенолиза, а также продукции СЖК, окисления эндогенных жиров. Наряду с этим повышается поглощение глюкозы печенью, скелетными мышцами и жировой тканью, чему сопутствует перемещение транспортеров глюкозы из микросомов в клеточную мембрану.
Метформин замедляет процесс всасывания углеводов в желудочно–кишечном тракте, а также обладает анорексигенным действием [22]. Полагают, что один их механизмов анорексигенного действия препарата связан с его влиянием на метаболизм глюкогоноподобного пептида–1 (ГПП–1). Так, в работе Mannucci E. и соавт. У больных с ожирением до и после ОГТТ определяли уровни ГПП–1 (7–36) амида/(7–37) исходно и спустя 15 дней терапии метформином (2550 мг/сут.) [25]. Авторы не обнаружили изменений концентраций ГПП–1 у лиц контрольной группы. Вместе с тем у больных с ожирением терапия метформином сопровождалась существенным увеличением концентрации (7–36)амида/ (7–37) ГПП–1 на 30 и 60–й минутах теста при неизмененном базальном уровне пептида. В смешанной плазме (после 30 мин. инкубации при 37°С), а также в растворе буфера, содержащем дипептидил–пептидазу–4, метформин ингибировал деградацию ГПП–1.
Важным эффектом метформина является уменьшение или стабилизация массы тела, а также снижение отложения висцерального жира [5,8]. Согласно результатам экспериментальных исследований на животных моделях анорексигенный эффект метформина, по–видимому, связан с центральным действием препарата на уровне гипоталамических нейронов [6]. Модулируя экспрессию орексигенного нейропептида Y, препарат способствует снижению массы тела. В различных исследованиях установлено, что в зависимости от длительности приема метформина снижение массы тела у больных с МС составило от 0,5 до 4,5 кг [5,22].
Метформин обладает и рядом других метаболических эффектов, включая и влияние на жировой обмен [8,24,34]. Лечение препаратом благоприятно сказывается на метаболизме липидов плазмы в связи с гиполипидемическим и антиатерогенным действием метформина. Он обладает способностью снижать на 10–30% окисление СЖК. Снижая концентрацию СЖК (на 10–17%), метформин не только улучшает чувствительность тканей к инсулину, но и способствует коррекции нарушенной секреции инсулина [22,24].
В последние годы появилось много интересных данных о кардиоваскулярных эффектах метформина (Глюкофажа), которые свидетельствуют о значимой роли препарата в профилактике и замедлении прогрессирования сердечно–сосудистых заболеваний. Дополни тельные кардиопротективные эффекты связаны с влиянием метформина на липидный обмен, эндотелиальную функцию, сосудистую реактивность, систему гемостаза и реологию крови и др. [5,9,10].
Следует отметить, что, подавляя повышенную адгезию моноцитов к эндотелию сосудов, липоидоз, метформин влияет на пусковые механизмы развития атеросклеротического поражения [3,14]. Отмечено, что метформин снижает экспрессию рецепторов, которые вовлечены в процессы внутриклеточного накопления липидов [24]. N. Ouslimani и соавт. изучали влияние метформина на экспрессию рецепторов конечных продуктов гликозилирования (RAGE) и лептинокисляемого рецептора (LOX–1) [26]. RAGE и LOX–1 – мембранные рецепторы эндотелия, вовлеченные в развитие атеросклеротического поражения. Культуру эндотелиальных клеток аорты быка, как стимулированную в условиях высокой концентрации глюкозы (30 ммоль/л), так и нестимулированную, инкубировали в течение 72 ч с метформином в терапевтических концентрациях. Выявлено дозозависимое ингибирующее влияние метформина на экспрессию исследуемых рецепторов при любых условиях инкубации. Кроме того, эффекты метформина сопровождались снижением концентрации внутриклеточных реактивных кислородных частиц.
Метформин (Глюкофаж) подавляет процессы дифференциации моноцитов в макрофаги, активно секретирующие проатерогенные факторы. In vitro было показано ингибирующее влияние метформина на лейкоцит–эндотелиальное взаимодействие, а также экспрессию на поверхности эндотелия таких молекул адгезии, как внутриклеточная молекула адгезии 1, сосудисто-клеточная молекула адгезии 1 и Е–селектин [14,22]. Ряд экспериментальных работ свидетельствует об активном вмешательстве метформина в метаболизм липидов сосудистой стенки. Так, препарат ускоряет катаболизм липопротеинов низкой плотности (ЛПНП), способствуя их конверсии в ЛПВП, снижает аккумуляцию эфиров холестерина в аорте, увеличивает содержание фосфолипидов и уменьшает содержание сфингомиелина. Исследования in vivo и in vitro показали, что метформин ослабляет формирование атеросклеротических бляшек у кроликов и крыс, получавших пищу с высоким содержанием жира.
Наряду с этим метформин уменьшает пролиферацию гладкомышечных клеток (ГМК) сосудов. Следовательно, снижая отложение липидов в сосудистой стенке, уменьшая пролиферацию ГМК, нарушая адгезию, трансформацию моноцитов и способность захватывать липиды, метформин активно воздействует на ранние стадии развития атеросклероза. Следует отметить, что у больных МС метформин оказывает протективные кардиоваскулярные эффекты, связанные с влиянием на систему гемостаза, реологию крови, функцию эндотелия и сосудистую реактивность (табл. 3). Так, препарат обладает способностью не только тормозить агрегацию тромбоцитов, но и снижать риск образования тромбов [14,18,19]. Показано, что метформин снижает уровень тромбоцитарного фактора 4 и β–тромбоглобулина, являющихся известными маркерами активации тромбоцитов [24]. Антитромбическое действие метформина также включает снижение выработки молекул адгезии и фибриногена. В целом метформин уменьшает активацию тромбоцитов в местах повреждения сосудистой стенки [3,22].
Таблица 3. Влияние метформина на систему гемостаза и эндотелиальную функцию
| Параметр | Эффекты метформина |
|---|---|
| ИАП–1 | Подавление активности и снижение концентрации |
| Фактор VII | Снижение концентрации |
| Фибрин | Нарушение структуры и функции |
| С–реактивный белок | Снижение концентрации |
| Тромбоциты | Снижение агрегации и адгезии тромбоцитов |
| Уменьшение тромбоцитарного фактора 4 и β–тромбоглобулина | |
| Кровоток | Улучшение капиллярного кровотока в мышечной и жировой ткани |
| Улучшение релаксации сосудов | |
| Снижение проницаемости сосудови неоангиогенеза | |
| Увеличение гемодинамического ответа на L–аргинин |
Недавние исследования показали улучшение процессов фибринолиза под влиянием терапии препаратом, обусловленное снижением уровня ИАП–1, инактивирующего тканевой активатор плазминогена [1]. Кроме того, метформин обладает и непрямым механизмом снижения уровня ИАП–1. Адипоциты висцеральной жировой ткани продуцируют значительно больше ИАП–1, чем адипоциты подкожно–жировой клетчатки, а терапия метформином способствует уменьшению массы висцерального жира.
Вазопротективные эффекты метформина заключаются в нормализации цикла сокращения/рас слаб ления артериол, уменьшении проницаемости сосудистой стенки и торможении процессов неоангиогенеза [7,19,29]. Окислительный стресс, который вызван комплексным ослаблением антиоксидантной системы и повышенным синтезом свободных радикалов у больных МС, является одной из важных причин поддержания ИР. Известно, что метформин обладает антиоксидантной активностью, обусловленной торможением клеточных окислительных реакций, в том числе и окислительного гликозилирования белков [8,34].
Среди разнообразных эффектов метформина с точки зрения профилактики ССЗ первостепенное значение имеет влияние на кровоток. Известно, что метформин усиливает капиллярный кровоток в ряде органов, включая скелетные мышцы и жировую ткань [21,24]. В эксперименте с использованием животных моделей острой ишемии показано антиишемическое действие метформина. Так, применение этого лекарственного вещества у крыс приводило к значительному уменьшению площади некроза миокарда при ишемии, индуцированной длительной перевязкой левой коронарной артерии [19]. По–видимому, препарат воздействует на систему микроциркуляции посредством увеличения количества функционирующих капилляров в ишемизированной ткани.
В двойном слепом рандомизированном исследовании изучали влияние метформина на сосудистую реактивность у родственников больных СД 2 типа первой линии родства с МС без нарушения толерантности к глюкозе (средний возраст 38,3±7,6 года, индекс массы тела 36,3±2 кг/м²) [10]. Было отмечено, что в условиях реактивной гиперемии терапия метформином приводила к достоверному улучшению эндотелий–зависимой вазодилатации; при этом инфузия ацетилхолина 7, 5, 15 и 30 мкг/мин. не влияла на эндотелий–независимую вазодилатацию (инфузия нитропруссида натрия 2, 4 и 8 мкг/мин.).
В 2006 г. S. Jadhav и соавт. сообщили о том, что применение метформина в течение 8 недель у женщин с избыточной массой тела, нарушенной толерантностью миокарда к физической нагрузке (депрессии сегмента ST ниже 1 мм) и непораженными коронарными артериями по данным коронарографии сопровождалось улучшением эндотелий–зависимой вазодилатации [18]. У пациентов, получавших лечение метформином в дозе 1000 мг/сут., наряду со снижением массы тела и ИР при проведении парных велоэргометрических проб наблюдалось достоверное уменьшение числа отведений электрокардиограммы с депрессией сегмента ST ниже 1 мм, а также частоты эпизодов загрудинных болей.
В исследованиях K. Isoda и соавт. (2006 г.) показано, что метформин дозозависимо ингибировал высвобождение интерлейкина–6 (ИЛ–6), ИЛ–8, индуцированное ИЛ–1b, в ГМК сосудов, макрофагах и эндотелиоцитах человека [17]. Авторы полагают, что в основе этих процессов лежит снижение транслокации нуклеарного фактора транскрипции NF–каппа B (NF–kB). В этой работе также отмечено, что метформин подавлял индуцированную ИЛ–1b активацию провоспалительных фосфокиназ Akt, р38, не влияя при этом на активность фосфат иди линозитол–3–киназы. В условиях стрессовой гипергликемии метформин (20 мкмоль/л) подавлял в эндотелиоцитах фосфорилирование Akt–киназы, ответственной за активацию NF–kB. Следовательно, подавляя сигнальные пути образования NF–kB, метформин обладает прямым противовоспалительным действием на сосудистую стенку.
В работе D. An и соавт. кардиомиоциты инкубировали с пальмитиновой кислотой (1 ммоль/л) с метформином (1–5 ммоль/л) и без него, оценивали утилизацию субстратов и фосфорилирование АМФ–зависимой протеинкиназы (АМФП) и ацетил–коэнзим–карбоксилазы [2]. Через 16 часов инкубации с пальмитиновой кислотой развивался апоптоз кардиомиоцитов, который в дальнейшем блокировался метформином, использованным в концентрации 1 и 2 ммоль/л. Благоприятные эффекты метформина были обусловлены повышением фосфорилирования АМФП, окисления пальмитиновой кислоты, подавлением образования керамид и активности каспазы–3, активация которых ведет к необратимому распаду ДНК. Результаты исследования свидетельствуют о том, что под влиянием метформина уменьшается апоптоз миокардиоцитов, индуцированный липотоксичностью.
Благотворное влияние метформина может реализовываться также через увеличение образования NO [19,21]. Так, при инкубации культуры эндотелиальных клеток аорты быка с метформином (50–500 мкмоль/л) наблюдалось зависимое от дозы повышение фосфорилирования серина–1179 синтазы NO эндотелия, коррелирующее с белком теплового шока–90 [9]. Эти процессы сопровождались повышением активности синтазы NO эндотелия, а в дальнейшем и биоактивности NO. Кроме того, в условиях высокой концентрации глюкозы (30 ммоль/л) инкубация культуры эндотелиальных клеток аорты быка с метформином вызывала снижение избыточной экспрессии молекул адгезии, а также эндотелиального апоптоза, индуцированных гипергликемией. Результаты исследования показали, что, повышая активацию синтазы NO эндотелия опосредованно через АМФ–зависимую протеинкиназу и белок теплового шока–90, метформин улучшает эндотелиальную функцию. В другой экспериментальной работе, выполненной на крысах с избыточным отложением висцерального жира, вызванным пищей, богатой жирами, показано увеличение экспрессии эндотелиальной синтазы NO на фоне применения метформина [24].
В наши дни большое внимание уделяется активной профилактике СД 2 типа. Длительная и стойкая ИР предшествует клиническому проявлению СД 2 типа. Потеря β–клетками способности к гиперсекреции инсулина способствует развитию нарушенной толерантности к глюкозе, а затем и клиническому СД. Согласно мнению Laaksonen D.F. и соавт. риск развития СД 2 типа у пациентов с МС повышается в 7–9 раз по сравнению с индивидами, не имеющими МС [23]. В настоящее время в мире насчитывается свыше 300 млн. людей с НТГ [35]. Ежегодно у 4–9% пациентов с НТГ развивается СД 2 типа [33,34]. В крупнейшем исследовании DPP (Diabetes Prevention Program, 2002) было убедительно показано, что терапия метформином (850 мг два раза в сутки) может эффективно и безопасно предотвращать развитие СД 2 типа на 31% у пациентов с НТГ, особенно у пациентов с ИМТ более 25 кг/м² и имеющих высокий риск развития СД 2 типа [11].
За долгие годы применения в клинической практике метформин, являющийся диметилбигуанидом и абсорбирующийся в основном в тонком кишечнике, продемонстрировал высокую безопасность. Метформин практически не метаболизируется в организме и полностью выводится почками в неизмененном виде (период полувыведения 1,5–4,9 ч).
Противопоказаниями к назначению метформина являются нарушения функций почек (снижение клиренса креатинина ниже 50 мл/мин или концентрация креатинина крови более 132 ммоль/л у мужчин и более 123 ммоль/л у женщин), гипоксические состояния любой природы, а также злоупотребление алкоголем. Следует воздержаться от назначения препарата в период беременности и лактации [3,22].
Лечение препаратом инициируют с 500–850 мг, принимаемых в ужин или на ночь. В дальнейшем доза препарата увеличивается на 500–850 мг каждую 1–2 недели. Во избежание побочных явлений метформина (диарея, метеоризм, абдоминальный дискомфорт, металлический вкус во рту) необходима постепенная титрация дозы препарата. Максимальная рекомендованная доза у больных МС составляет 1500–1700 мг/сут. в режиме 2–3 приемов.
В заключение следует отметить, что в настоящее время рациональная терапия МС метформином (Глюкофажем), обладающим благоприятным спектром фармакологических эффектов, в сочетании с нефармакологическими методами является эффективным способом коррекции ИР и позволяет существенно повлиять на качество жизни пациентов и предотвратить возникновение опасных для жизни сердечно–сосудистых осложнений и СД 2 типа. При выборе препарата для пациентов с МС всегда нужно помнить о доказанных преимуществах метформина у такой категории больных.
Литература
