Эффект рамиприла на смертность и выживаемость больных острым инфарктом миокарда с клиническими признаками сердечной недостаточности
Статьи Опубликовано в "Рациональная Фармакотерапия в Кардиологии" 2007; №1 Группа исследователей AIREРезюме
Выживаемость больных острым инфарктом миокарда значительно улучшилась благодаря применению тромболитических средств, аспирина и бета-адреноблокаторов. Однако остается значительной группа больных, у которых несмотря на применение тромболитиков и аспирина развивается сердечная недостаточность. У этих пациентов отмечается высокий риск фатальных и нефатальных ишемических осложнений, аритмий и гемодинамических нарушений. Мы проверяли гипотезу о том, что лечение ингибитором ангиотензинпревращающего фермента (АПФ) рамиприлом приведет к увеличению выживаемости в этой группе больных высокого риска.
В 144 центрах в 14 странах в исследование были включены 2006 больных с клиническими признаками сердечной недостаточности после острого инфаркта миокарда. На 3-10-й день инфаркта миокарда их рандомизировалина две группы и назначали плацебо (990 больных) или рамиприл (1014 больных). Из исследования исключали больных тяжелой сердечной недостаточностью, рефрактерной к обычной терапии, которые нуждались в назначении ингибитора АПФ. Пациентов наблюдали в течение по крайней мере 6 месяцев (в среднем 15 месяцев).
В выборке intentionto-treat общая смертность у больных, получавших рамиприл (170 случаев смерти от любых причин; 17%), была значительно ниже, чем у больных группы плацебо (220 случаев; 23%). Относительный риск смерти снизился на 27% (95% доверительный интервал 11-40%; р=0,002). При анализе вторичных конечных точек, предусмотренных в протоколе, было выявлено значительное снижение риска смерти, тяжелой/рефрактерной сердечной недостаточности, повторного инфаркта миокарда или инсульта на 19% (95% ДИ 5-31%; р=0,008).
Пероральное применение рамиприла у больных с клиническими признаками преходящей или сохраняющейся сердечной недостаточности, начатое на 2-9-й день острого инфаркта миокарда, привело к значительному снижению общей смертности. Этот эффект проявлялся уже через 30 дней и был сопоставимым в различных подгруппах больных.
Lancet, 1993, 342, 821-8.
Введение
У больных с клиническими признаками сердечной недостаточности после инфаркта миокарда прогноз неблагоприятный даже, если симптомы ее проходят в течение первых 24 часов [ 1 -3]. В исследовании AIRE проверялась гипотеза о том, что лечение ингибитором АПФ рамиприлом может привести к увеличению выживаемости таких больных [4]. Риск развития фатальных и нефатальных сердечно-сосудистых осложнений после острого инфаркта миокарда зависит от степени повреждения желудочка, распространенности зоны ишемии и электрической нестабильности миокарда [5]. Учитывая разнообразие механизмов неблагоприятных исходов инфаркта миокарда, фармакотерапия, оказывающая благоприятное влияние на один из них, может вызвать ухудшение других нарушений, поэтому ее эффект на общую выживаемость может оказаться нейтральным или негативным [6-8]. В этом контексте показательны результаты исследования CONSENSUS II, в котором ингибитор АПФ эналаприл назначали в острую фазу инфаркта миокарда.
В настоящее время для лечения сердечной недостаточности после инфаркта миокарда широко используют диуретики. Их эффективность в лечении острой сердечной недостаточности убедительно доказана. Однако длительная терапия препаратами этой группы вызывает увеличение посленагрузки и потерю электролитов, а у многих больных несмотря на лечение продолжается ухудшение функции желудочков [9]. При трансмуральном инфаркте миокарда, особенно в случае неэффективности тромболизиса, наблюдается истончение пораженного участка желудочка [ 10]. В последующем у многих пациентов происходит ремоделирование сердца, которое характеризуется дилатацией левого желудочка и изменением его формы за счет гипертрофии жизнеспособного миокарда [11]. Ингибиторы АПФ снижают после-нагрузку не влияют на уровни электролитов и подавляют ремоделирование желудочка после инфаркта миокарда [9,11]. В нескольких крупных исследованиях продемонстрирована эффективность препаратов этой группы у больных хронической сердечной недостаточностью, которую не удавалось контролировать с помощью дигоксина и диуретиков, а также пациентов с угрозой ремоделирования сердца после острого инфаркта миокарда [ 12-15]. Однако в эти исследования не включали больных, которые были предметом нашего исследования. При планировании исследования AIRE мы предположили, что своевременно начатая терапия рамиприлом приведет к увеличению выживаемости больных острым инфарктом миокарда, относящихся к группе высокого риска (критериями риска служили клинические признаки преходящей или сохраняющейся сердечной недостаточности) [4,16]. Сопутствующая терапию ограничивать не планировалось, однако мы ожидали, что большинство пациентов будут получать диуретики и нитраты, а небольшое число — бета-адреноблокаторы (в связи с отсутствием абсолютных противопоказаний к их назначению). В исследовании CONSENSUS I была продемонстрирована высокая эффективность ингибитора АПФ у больных тяжелой сердечной недостаточностью (IV функционального класса по NYHA) [13]. Однако из этого исследования исключали пациентов, недавно перенесших инфаркт миокарда или нестабильную стенокардию. У нас также вызывали беспокойство возможные нежелательные эффекты ингибитора АПФ, особенно в остром периоде инфаркта миокарда [ 16]. В связи с этим мы рандомизировали только больных со стабильной гемодинамикой, у которых отсутствовали признаки сохраняющейся ишемии миокарда, не ранее второго дня после развития инфаркта миокарда. Из исследования исключали больных тяжелой сердечной недостаточностью (IV функционального класса по NYHA).
Рамиприл обладает высоким сродством к циркулирующему и тканевому АПФ [17,18]. Кроме того, он значительно усиливает эффекты брадикинина [17,18]. В исследовании AIRE проверялась гипотеза о том, что лечение рамиприлом, начинатое на 2-9-й день после развития инфаркта миокарда приведет к увеличению длительности жизни больных с клиническими признаками сердечной недостаточности. Рандомизацию на группы рамиприла и плацебо проводили блоками по 10 больных со стратификацией по центрам. Первичной конечной точкой была смерть от любых причин в выборке intention-to-treat.
Методы
Цель, дизайн, организация и критерии эффективности исследования AIRE были описаны ранее [4]. В 144 центрах в 14 странах в многоцентровое, международное, двойное слепое, рандомизированное, плацебоконтролируемое исследование были включены 2006 больных с острым инфарктом миокарда и клиническими признаками сердечной недостаточности.
В исследование включали пациентов в возрасте по крайней мере 18 лет, госпитализированных в отдаление интенсивной терапии или общетерапевтическое отделение с диагнозом острого инфаркта миокарда и клиническими признаками сердечной недостаточности, наблюдавшимися в любой срок после развития инфаркта и служившими достаточным основанием для назначения диуретиков или вазодилататоров по крайней мере на короткий срок. Острый инфаркт миокарда диагностировали на основании ЭКГ (изменения сегмента ST и зубца Т, характерные для инфаркта миокарда, в сочетании с патологическим зубцом Q или без него) и повышения активности миокардиальных ферментов (креатинфосфокиназы, аспартатаминотрансферазы и/или лактатдегидрогеназы или их миокардиальных изоферментов более чем в 2 раза по сравнению с верхней границей нормы). Сердечную недостаточность диагностировали на основании по крайней мере одного из следующих признаков: симптомы левожелудочковой недостаточности (застой крови в малом круге кровообращения или альвеолярный отек легких по крайней мере на одной рентгенограмме грудной клетки), симптомы отека легких (двусторонние влажные хрипы, распространяющиеся по крайней мере на 1/3 легочных полей, при отсутствии хронического заболевания легких), III тон в сочетании со стойкой тахикардией. Хотя клинические симптомы сердечной недостаточности были обязательным критерием включения в исследование, тем не менее, они могли быть преходящими и отсутствовать на момент рандомизации. Из исследования исключали больных тяжелой сердечной недостаточностью (IV функционального класса по NYHA), клапанными или врожденными пороками сердца, нестабильной стенокардией, противопоказаниями к назначению ингибиторов АПФ. Всем исследователям предлагали заполнять простую форму на каждого больного, поступающего с предполагаемым или определенным острым инфарктом миокарда, чтобы иметь представление о популяции, из которой происходил отбор пациентов.
В исследование включали пациентов с острым инфарктом миокарда и неблагоприятным прогнозом, которые нуждались хотя бы в кратковременном применении диуретиков или вазодилататоров в связи с наличием признаков дисфункции левого желудочка. Большинство врачей вряд ли стали бы применять кардиопротективные бета-блокаторы у пациентов этой группы. Однако ожидалось, что часть исследованной популяции составят больные без признаков дисфункции левого желудочка, которые будут получать бета-блокаторы, а еще одну часть — пациенты с тяжелой сердечной недостаточностью, нуждающиеся в лечении диуретиками и ингибиторами АПФ открытым методом. Врачи должны были принять решение о целесообразности включения пациентов в исследование и рандомизации на группы рамиприла и плацебо. Исследователям во всех случаях рекомендовали следовать обычным подходам к ведению своих пациентов.
Назначение терапии
Лечение начинали в стационаре на 3-10-й день после развития острого инфаркта миокарда. Первоначально пациенты получали рамиприл в дозе 2,5 мг или плацебо два раза в день. Если переносимость препарата была хорошей, то через 2 дня дозу увеличивали до 5 мг два раза в день. Если больные плохо переносили дозы более 5 мг, то после выписки они получали рамиприл в дозе 2,5 мг или плацебо два раза в день. В случае плохой переносимости стартовой дозы 2,5 мг применяли дозу 1,25 мг. При этом пациенты получали рамиприл в дозе 1,25 мг два раза в день в течение 2 дней, после чего дозу увеличивали до2,5 мг два раза в день, а затем до 5 мг два раза в день. В начале лечения и при изменении дозы АД измеряли до приема препарата и через 2, 4 и 6 часов после дозирования, а также регистрировали любые нежелательные явления. Если больной не мог принимать рамиприл в дозе по крайней мере 2,5 мг два раза в день или соответствующее плацебо, то лечение прекращали, однако наблюдение продолжали. Протокол исследования не предполагал применение рамиприла в дозе 1,25 мг два раза в день.
Наблюдение
Наблюдение больных предполагало сведение к минимуму возможного влияния на план обычного их ведения. Всех пациентов, в том числе прекративших исследуемую терапию, осматривали через 4 и 12 недель после рандомизации, а затем каждые 12 недель до конца исследования. При каждом визите регистрировали конечные точки, нежелательные явления, приверженность и сопутствующую терапию. Функцию почек (сывороточные электролиты, креатинин и мочевина) контролировали в соответствии с обычной клинической практикой. Во время исследования больные могли продолжать или начать любое лечение, за исключением ингибитора АПФ. Исследователям рекомендовали контролировать сывороточные уровни калия, особенно на фоне применения калийсберегающих диуретиков или препаратов калия.
Регистрация случаев смерти была прекращена 28 февраля 1993 года через 6 месяцев после завершения набора 2000 больных. Как можно быстрее после этой даты оценивали статус всех больных.
Размер выборки
В исследование требовалось включить 2000 больных на основании следующих гипотез: предполагаемая средняя длительность наблюдения 15 месяцев, прогнозируемая летальность в группе плацебо 20% через 15 месяцев, клинически значимое снижение общей летальности на 25%, ожидаемая летальность в основной группе 15% через 15 месяцев, статистическая сила по крайней мере 80% при 5% уровне значимости (двусторонний р, тест log-rank) [4].
Организация исследования
Ход исследования контролировался независимым комитетом, который имел доступ к слепому коду. Этот комитет проводил промежуточный анализ, а также отвечал за передачу информации о серьезных нежелательных явлениях контролирующим органам. Члены международного руководящего комитета регулярно встречались, чтобы оценить ход исследования, и оценивали вторичные конечные точки. Исполнительный комитет, в состав которого входили главный исследователь (председатель) и представители спонсора, менеджеры исследования и менеджер по анализу данных постоянно контролировали ход исследования и отвечали за работу координационного центра AIRE. Все конечные точки проверялись подкомитетом международного руководящего комитета. Независимая группа несла ответственность за аудит центров и выполнение правил GCP.
Статистический анализ
Первичной конечной точкой исследования была смерть от любых причин. Анализ выживаемости проводили с помощью метода Каплана-Мейера, а для сравнения двух групп (рамиприл и плацебо) использовали тест log-rank. Относительный риск и соответствующие 95% доверительный интервалы (ДИ) рассчитывали с помощью модели пропорционального риска Кокса с одним кофактором (проводимая терапия). Эффекты в подгруппах анализировали на основании взаимодействия с помощью модели пропорционального риска Кокса.
Вторичной конечной точкой служил срок до первого неблагоприятного исхода (смерть, развитие тяжелой/рефрактерной сердечной недостаточности, повторный инфаркт миокарда или инсульт). Анализ вторичной конечной точки проводили также, как первичной.
Плановый промежуточный анализ провели после регистрации 175 случаев смерти (половина от ожидаемых 350 случаев). Основанием для досрочного прекращения исследования служило достоверное снижение общей смертности (p<0,001). Кроме того, на начальном этапе исследования был проведен анализ безопасности после регистрации первых 40 случаев смерти. Результаты этого анализа не могли служить основанием для досрочного прекращения исследования, поэтому какая-либо поправка в окончательный анализ не требовалась.
Все статистические конечные точки были проверены подкомитетом международного руководящего комитета; процедуры описаны ранее [20].
Выборка больных
Исследование было начато в городе Лидс. В течение первого года (1989) были внесены две поправки в протокол, в соответствии с которыми рандомизировали большинство больных. В частности были расширены критерии включения (разрешалось включать больных с зубцом Q и без зубца Q) и уточнен протокол исследования (подчеркнуто, что в исследование можно было включать больных с преходящей сердечной недостаточностью после инфаркта миокарда). Исследование было расширено за счет включения дополнительных центров. Большинство больных были включены в него с апреля 1991 года по 27 августа 1992 года, когда был прекращен набор пациентов.
Скринингу были подвергнуты 52019 больных. Основной причиной их исключения было отсутствие достоверных признаков инфаркта миокарда у 21302 человек и отсутствие сердечной недостаточности у 16989. Среди оставшихся 13728 пациентов причинами исключения были смерть (2784), нестабильная стенокардия (2314), отказ от участия в исследовании или невозможность выполнения протокола (1962), планируемая терапия ингибитором АПФ (1404), тяжелая сердечная недостаточность (1329), почечная недостаточность (289), стойкая гипотония (279) и другие причины (1361). По нашим расчетам, признаки преходящей или сохраняющейся сердечной недостаточности имелись у 15-20% больных острым инфарктом миокарда, что позволяло включить их в исследование (из этого числа была рандомизирована половина пациентов).
Исключение одного центра
Во время исследования данные, полученные в одном центре, вызвали сомнения. После обсуждения с членами независимого комитета было решено исключить из исследованиях 20 больных, рандомизированных в этом центре, что было сделано до завершения исследования. Исключение этих пациентов не оказало существенного влияния на характеристики всей выборки и результаты исследования. Ниже приводятся результаты лечения у оставшихся 1986 пациентов.
Результаты
Исходные демографические данные
1004 больных были рандомизированы в группу рамиприла и 982 — в группу плацебо. Распределение больных на две группы в 14 странах были сбалансированным. В табл. 1 приведены демографические характеристики больных и информация о сопутствующих заболеваниях. Инфаркт миокарда в анамнезе имелся у 22,6% больных, а сердечная недостаточность — только у 8,2%. Срок от развития инфаркта миокарда до рандомизации составил 5,4+2,1 дня в группе рамиприла и 5,4+2,2 дня в группе плацебо. Исходно две группы были сопоставимы по всем характеристикам (табл. 1). В целом 58% больных получали тромболитические средства. Сопутствующая терапия была сопоставимой в двух группах.
Исследуемая терапия
Более 90% больных каждой группы, выписанных из стационара, продолжали прием исследуемых препаратов. В группе плацебо "более высокой дозы" достиг больший процент пациентов (табл. 1).
Таблица 1. Исходные характеристики больных и сопутствующая терапия
| Страна | Рамиприл (n=1004) |
Плацебо (n=982) |
В целом (n=1986) |
|---|---|---|---|
| Аргентина | 80(8%) | 70(7%) | 150(8%) |
| Австрия | 29(3%) | 31(3%) | 60(3%) |
| Бельгия | 37(4%) | 36(4%) | 73 (4%) |
| Дания | 33(3%) | 30(3%) | 63 (3%) |
| Финляндия | 26(3%) | 23 (2%) | 49 (2%) |
| Германия | 44 (4%) | 41 (4%) | 85 (4%) |
| Ирландия | 121(12%) | 130(13%) | 251(13%) |
| Италия | 25 (2%) | 23 (2%) | 48 (2%) |
| Люксембург | 9(1%) | 9(1%) | 18(1%) |
| Нидерланды | 76(8%) | 72(7%) | 148 (7%) |
| Южная Африка | 84(8%) | 82(8%) | 166(8%) |
| Швеция | 133(13%) | 128(13%) | 261(13%) |
| Швейцария | 5(0%) | 6(1%) | 11(1%) |
| Великобритания | 302(30%) | 301(31%) | 603 (30%) |
| Пол (мужчины) | 734 (73%) | 727 (74%) | 1461 (74%) |
| Возраст (лет) | |||
| Средний | 64,9 | 65,1 | 65,0 |
| Стандартное отклонение | 10,8 | 10,8 | 10,8 |
| Сопутствующие (перенесенные) заболевания, требующие лечения | |||
| Артериальная гипертония | 289(29%) | 265 (27%) | 554(28%) |
| Инфаркт миокарда | 230(23%) | 218(22%) | 448 (23%) |
| Стенокардия | 369(37%) | 339(35%) | 708(36%) |
| Аритмии | 69(7%) | 53(5%) | 122 (6%) |
| Сахарный диабет | 122(12%) | 118(12%) | 240(12%) |
| Сердечная недостаточность в анамнезе | 83 (8%) | 80 (8%) | 163 (8%) |
| Инфаркт миокарда | |||
| Передний | 601 (62%) | 550(59%) | 1151(61%) |
| Нижний | 361(38%) | 378(41%) | 739(39%) |
| Неопределенный | 421 | 54 | 96 |
| С зубцом Q | 599(62%) | 607(65%) | 1206 (63%) |
| Без зубца Q | 367(38%) | 329(35%) | 696(37%) |
| Неклассифицируемый | 38 | 46 | 84 |
| Срок от инфаркта до рандомизации (дни) | |||
| Средний | 5,4 | 5,4 | 5,4 |
| Стандартное отклонение | 2,1 | 2,2 | 2,2 |
| Доза исследуемого препарата при выписке | |||
| Умерли в стационаре | 34 | 46 | 80 |
| 0 мг | 89(9%) | 63(7%) | 152(8%) |
| 2,5 мг два раза в день | 132(14%) | 65(7%) | 197(10%) |
| 5,0 мг два раза в день | 749 (77%) | 808(86%) | 1557(82%) |
| Тромболизис | |||
| Да | 591(59%) | 551(56%) | 1142(58%) |
| Нет | 412(41%) | 429 (44%) | 841 (42%) |
| Нет информации | 1 | 2 | 3 |
| Сопутствующая терапия | |||
| Аспирин | 773 (77%) | 770(78%) | 1543 (78%) |
| Бета-блокатор | 236 (24%) | 207(21%) | 443 (22%) |
| Антагонист кальция | 159(16%) | 158(16%) | 317(16%) |
| Дигоксин | 124(12%) | 119(12%) | 243(12%) |
| Диуретик | 586(58%) | 602(61%) | 1188(60%) |
| Нитрат | 565(56%) | 544(55%) | 1109(56%) |
Наблюдение
Средняя длительность наблюдения составила 15 месяцев, а минимальная — 6 месяцев. Только 1 пациент выбыл из-под наблюдения (последний раз его осматривали через 12 месяцев после рандомизации).
Общая смертность
На рис. 1 изображена динамика общей смертности. Кривые выживаемости разошлись в начала лечения и продолжали расходиться до конца исследования. В группе рамиприла умерли 170 (17%) больных, а в группе плацебо — 222 (23%). Относительный риск смерти достоверно снизился на 27% (95% ДИ 11-40%; р=0,002).
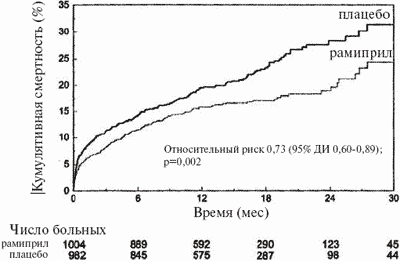
Рис. 1. Кривые общей смертности в выборке intention-to-treat
Большинство больных наблюдали в течение менее 18 месяцев. Кривые обрываются через 30 месяцев, учитывая небольшое число больных с длительным периодом наблюдения.
Вторичные конечные точки
В табл. 2 приведены результаты анализа общей смертности (первичной конечной точки) и вторичных конечных точек, подтвержденных подкомитетом по исходам [20]. Мы включали в анализ только первый подтвержденный исход: смерть, повторный инфаркт миокарда, инсульт или развитие тяжелой/рефрактерной сердечной недостаточности (табл. 2). Снижение риска развития вторичной конечной точки на 19% также было высоко статистически значимым (95% ДИ 5-31%;р=0,008).
Таблица 2. Результаты анализа первичных и вторичных конечных точек
| Рамиприл (n=1004) |
Плацебо (n=982) |
В целом (n=1986) |
|
|---|---|---|---|
| Первичная конечная точка | |||
| Смерть | 170(17%) | 222 (23%) | 392 (20%) |
| Вторичные конечные точки, подтвержденные комитетом по исходам | |||
| Тяжелая/рефрактерная сердечная недостаточность | 143(14%) | 178(18%) | 321(16%) |
| Повторный инфаркт миокарда | 81(8%) | 88 (9%) | 169(9%) |
| Инсульт | 25 (2%) | 17(2%) | 42 (2%) |
| Вторичная конечная точка (первый подтвержденный исход) | |||
| Смерть | 94(9%) | 118(12%) | 212(11%) |
| Тяжелая/рефрактерная сердечная недостаточность | 103(10%) | 133(14%) | 236(12%) |
| Повторный инфаркт миокарда | 68(7%) | 71(7%) | 139(7%) |
| Инсульт | 21(2%) | 15(2%) | 36 (2%) |
| Любой исход | 286(28%) | 337 (34%) | 623(31%) |
Отмена исследуемого препарата
Частота прекращения приема исследуемых препаратов, исключая умерших больных, приведена на рис. 2. В целом 352 больных досрочно прекратили терапию рамиприлом, а 318 — плацебо. Плохая переносимость была причиной прекращения лечения у 126 больных группы рамиприла и 68 больных группы плацебо, а развитие тяжелой/рефрактерной сердечной недостаточности — у 58 и 92 больных двух групп соответственно.
Серьезные нежелательные явления
В группе рамиприла доля пациентов, у которых наблюдались серьезные нежелательные явления, была ниже, чем в группе плацебо: 581 (58%) и 625 (64%)соответственно. Серьезные нежелательные явления включали в себя конечные точки исследованния (смерть, развитие тяжелой/рефрактерной сердечной недостаточности, повторный инфаркт миокарда и инсульт), а также возможные нежелательные эффекты лечения. Обмороки зарегистрировали у 24 (2,4%) и 17 (1,7%) больных групп рамиприла и плацебо соответственно, артериальную гипотонию — у 42 (4,2%) и 23 (2,3%). Частота почечной недостаточности была сопоставимой в двух группах: 15 (1,5%) и 12 (1,2%) соответственно. Стенокардия, которая в некоторых случаях могла ухудшиться после назначения ингибитора АПФ, была зафиксирована как серьезное нежелательное явление у 181 (18%) больного группы рамиприла и 171 (17%) больного группы плацебо.
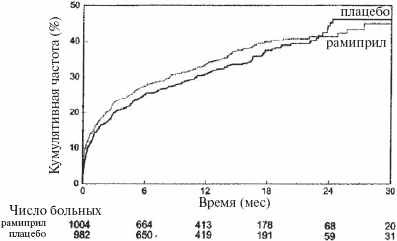
Рис. 2. Доля выживших больных, досрочно прекративших прием исследуемых препаратов
Больных, прекращавших лечение исследуемым препаратом, продолжали наблюдать.
Эффекты возраста, пола, отсрочки терапии и сопутствующей терапии
Эффекты рамиприла изучали также в нескольких подгруппах (рис. 3). Во всех случаях относительный риск был ниже 1, а взаимодействие не достигло статистической значимости при уровне 5%.
Обсуждение
Терапия рамиприлом, начатая на 2-9-й день острого инфаркта миокарда и продолжавшаяся в течение в среднем 15 месяцев, привела к значительному снижению общей смертности у больных с признаками сердечной недостаточности. Кривые выживаемости больных групп рамиприла и плацебо начали расходиться в течение нескольких недель после начала лечения и продолжали расходиться до конца исследования. Кроме того, отмечено значительное, хотя и менее выраженное снижение риска развития вторичной точки (срока до первого подтвержденного неблагоприятного исхода — смерти, развития тяжелой/рефрактерной сердечной недостаточности, повторного инфаркта миокарда или инсульта). Эти положительные результаты, полученные у всех рандомизированных пациентов, выглядят еще более впечатляющими, если учесть, что через 18 месяцев 40% больных (исключая умерших) не принимали исследуемый препарат, а большинство пациентов, досрочно прекративших прием плацебо, начали лечение ингибитором АПФ открытым методом.
Переносимость рамиприла была хорошей. После выписки из стационара более 90% больных продолжали его прием. Следует отметить, что исследование не предполагало наличие вводной фазы, которая позволила бы исключить пациентов, не переносящих рамиприл. Это повышает значение полученных данных для обычной клинической практики. Частота досрочного прекращения лечения исследуемым препаратом в течение последующих 2 лет в группе рамиприла была незначительно выше, чем в группе плацебо (случаи отмены препарата из-за легко выраженных нежелательных эффектов нивелировались снижением частоты развития тяжелой сердечной недостаточности, требовавшей назначения ингибитора АПФ открытым методом).
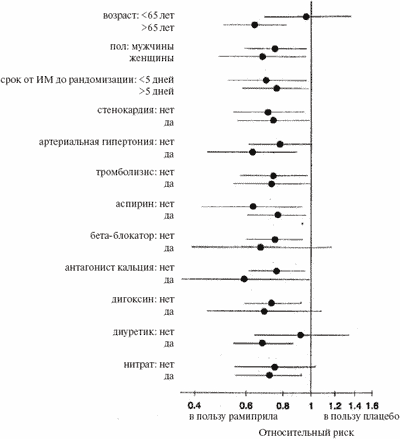
Рис. 3. Относительный риск смерти и 95% доверительные интервалы в различных подгруппах больных
Во всех случаях взаимодействие не достигло статистической значимости при уровне 5%
Результаты настоящего исследования целесообразно сопоставить с двумя другими исследованиями, в которых изучалось влияние ингибиторов АПФ на смертность больных инфарктом миокарда. В исследовании CONSENSUS II [8] в первые 24 ч рандомизировали всех больных с предполагаемым инфарктом миокарда, которым вводили внутривенно эналаприлат или плацебо, а затем назначали эналаприл или плацебо внутрь. Исследование было прекращено досрочно по решению этического комитета после того, как в него были включены около 6000 из планируемых 9000 больных. К этому моменту летальность больных в группе эналаприла была выше, чем в группе плацебо, хотя разница не достигла статистической значимости. Напротив, в исследование SAVE [15,21] был включен 2231 больной в первые 3-16 дней (в среднем 11) после острого инфаркта миокарда. Критериями отбора пациентов были отсутствие симптомов на момент рандомизации, снижение фракции выброса левого желудочка <40% по данным радионуклидного исследования и отрицательный результат пробы с физической нагрузкой. Тромболизис проводился только в 33% случаев, однако почти у 60% больных перед рандомизацией была выполнена коронарная ангиография, а у 25% - реваскуляризация миокарда. Перед началом исследования все больные получали пробную дозу каптоприла, а в исследование включали только пациентов, у которых переносимость препарата была хорошей. В течение в среднем 42 месяцев смертность снизилась на 19%. Снижение ее было отмечено только через 1 год после начала лечения. Этот результат контрастирует с данными нашего исследования, в котором увеличение выживаемости было отмечено на более раннем этапе и при значительно меньшей длительности наблюдения.
Ингибиторы АПФ в сочетании с диуретиками стали стандартом лечения застойной сердечной недостаточности. Во время исследования AIRE были опубликованы результаты двух крупных исследований — V-HeFTII[14] иSOLVD [13,32], в которых изучалось влияние препаратов этой группы на смертность больных хронической сердечной недостаточностью. В обоих исследованиях критерием включения служило снижение фракции выброса левого желудочка. Из них исключали пациентов, недавно перенесших инфаркт миокарда (в течение последних 1 -3 месяцев; у подавляющего большинства больных давность инфаркта была значительно выше). В исследование V-HeFT II [14] набирали больных, у которых причиной ограничения толератности к физической нагрузки была утомляемость/одышка, а не боль в груди. Как и в SAVE, из него исключали пациентов с признаками сохраняющейся ишемии миокарда. В исследовании SOLVD больные получали эналаприл в течение 1 недели, а затем плацебо в течение 2 недель. Пациентов рандомизировали только в случае хорошей переносимости препарата [13,22]. В исследованиях V-HeFT II [14] и SOLVD [13] лечение эналаприлом привело к снижению смертности больных сердечной недостаточностью. При изучении профилактического эффекта препарата в соответствующей части исследования SOLVD не было продемонстрировано статистически значимое увеличение выживаемости [22]. Хотя в исследовании SOLVD фракция выброса у больных, у которых изучались лечебный и профилактический эффекты ингибитора АПФ, отличалась только на 3%, тем не менее, смертность на фоне приема плацебо при отсутствии симптомов была в два раза ниже [13,22]. Исследователи AIRE были информированы о результатах исследований SOLVD и SAVE, так как предполагалось, что при наличии критериев включения в эти исследования будет эффективной терапия ингибитором АПФ.
Дизайн исследования AIRE учитывал изменяющуюся клиническую практику. К началу исследования было известно, что больные тяжелой сердечной недостаточностью (IV функционального класса по NYHA) характеризуются особенно неблагоприятным прогнозом. Хотя из исследования CONSENSUS I исключали больных, перенесших инфаркт миокарда менее 2 месяцев назад, тем не менее, тяжелая сердечная недостаточность служила критерием исключения из исследования AIRE, так как предполагалось, что большинство врачей сочтут необходимым назначить ингибитор АПФ таким пациентам [4,12]. Известны трудности классификации сердечной недостаточности по степени тяжести, поэтому врачи решали индивидуально, страдает ли больной тяжелой сердечной недостаточностью, являющейся основанием для назначения ингибитора АПФ открытым методом, или его можно включить в рандомизированное исследование. Вторичной конечной точкой исследования служило развитие тяжелой/рефрактерной сердечной недостаточности (обычно IV функционального класса по NYHA), требовавшей, по мнению врача, применения ингибитора АПФ открытым методом. Во время исследования было отмечено увеличения числа больных среднетяжелой сердечной недостаточностью, которым врачи предпочли назначить ингибитор АПФ, а не продолжать терапию исследуемым препаратом.
Ранний эффект рамиприла, проявившийся в первые несколько недель, сходен с эффектом эналаприла у больных тяжелой сердечной недостаточностью в исследовании CONSENSUS I. При плановом анализе, выполненном через 30 дней (до вскрытия слепого кода), разница выживаемости между группами рамиприла и плацебо практически достигла статистической значимости (р=0,053). При втором анализе смертности после 30 дней (что искажало результаты в пользу плацебо) обнаружено значительное снижение смертности в группе рамиприла (р=0,016).
На основании дополнительного анализа результатов исследований SOLVD [23] и SAVE [15] было высказано предположение о том, что терапия ингибитором АПФ позволяет предупредить развитие инфаркта миокарда. В исследовании AIRE при лечении рамиприлом была отмечена тенденция к снижению частоты повторного инфаркта миокарда, но она не достигла статистической значимости. Однако число подтвержденных случаев повторного инфаркта миокарда было небольшим, главным образом за счет более короткой длительности наблюдения по сравнению с таковой в SOLVD и SAVE. Благоприятная тенденция, зафиксированная в нашем исследовании, согласуется с результатами наблюдения в течение того же срока в последних двух исследованиях. Частота инсульта была выше в группе рамиприла, однако число случаев нарушения мозгового кровообращения было невелико, что не позволяло отвергнуть или подтвердить нежелательный эффект препарата. При лечении рамиприлом отмечено снижение частоты прогрессирования сердечной недостаточности и госпитализаций в стационар (данные не приводятся). Этого следовало ожидать с учетом механизма действия препарата и результатов других исследований, однако госпитализации не были первичной или вторичной конечной точкой исследования. Лечение рамиприлом привело к снижению частоты внезапной смерти (предположительно от аритмии) и смерти от прогрессирования сердечной недостаточности. Классификация причин смерти у больных сердечной недостаточностью представляет собой трудную задачу, а подходы, использованные в исследовании AIRE, были описаны ранее [20]. Результаты анализа причин смерти и нежелательных явлений, включая инсульт и инфаркт миокарда, также будут опубликованы отдельно.
40% больных не принимали диуретики на момент рандомизации. Это свидетельствовало о том, что у значительного числа пациентов сердечная недостаточность была преходящей. Хотя при специальном анализе была продемонстрирована сопоставимость эффекта рамиприла в различных подгруппах больных (рис. 3; отношение шансов во всех случаях было меньше 1), у больных, не получавших диуретики перед рандомизацией, польза лечения могла быть менее значительной, хотя следует подчеркнуть, что разница не была статистически значимой. Сходная тенденция была отмечена у больных в возрасте менее 65 лет. Благоприятный эффект рамиприла не зависел от применения тромболитических средств. Доля пациентов, которым проводился тромболизис, была сопоставимой с таковой в исследовании CONSENSUS II [8] и превышала таковую в исследовании SAVE [15]. Представляется вероятным, что критерии отбора в исследованиях CONSENSUS II и SAVE способствовали включению в них пациентов, у которых попытки реперфузии оказались безуспешными. Почти 80% больных принимали аспирин на момент рандомизации. Экспериментальные данные свидетельствуют о том, что ингибиторы АПФ и аспирин изменяют метаболизм простагландинов. У больных тяжелой сердечной недостаточностью отмечено взаимодействие этих препаратов [24]. В исследовании AIRE мы продемонстрировали четкий эффект рамиприла у больных, получавших аспирин, однако была отмечена тенденция к усилению его эффекта у пациентов, не принимавших аспирин.
Рамиприл дополнял действие бета-адреноблокаторов. Из большинства исследований препаратов этой группы, которые снижают заболеваемость и смертность после инфаркта миокарда, исключали пациентов с клиническими признаками сердечной недостаточности [25]. Исключением является исследование BHAT, в котором принимали участие пациенты с легкой сердечной недостаточностью или преходящими признаками нарушения кровообращения [26]. При ретроспективном анализе этой группы больных было показано, что пропранолол оказывает благоприятное влияние на выживаемость, хотя смертность оставалась высокой [26]. Не вызывает сомнения, что рамиприл дополняет эффекты стандартных средств.
Результаты многочисленных исследованиях, выполненных до [1] и после широкого внедрения в клиническую практику тромболитических агентов [27-29], свидетельствуют о том, что сердечная недостаточность развивается у 20% больных инфарктом миокарда. Рамиприл вызывает значительное снижение смертности у таких пациентов, а его эффект не зависит от сопутствующей терапии тромболитиками, бета-адреноблокаторами и нитрами внутрь. Важно отметить, что эффект препарата была сопоставимым у женщин и мужчин [30]. Клиницисты легко идентифицировали больных, у которых могла оказаться полезной терапия ингибитором АПФ рамиприлом.
Литература
1. Gottlieb S, MossAJ, McOermottM, Eberly S. Interrelation of left ventricular ejection fraction, pulmonary congestion and outcome in acute myocardial infarction. Am JCardiol1992; 69: 977-84.2. Killip T, Kimball JT. Treatmentofmyo< ;srdial infarction in a coronary care unit: a two year experience in 250 patienlS. Am J Cardiol 1967; 20: 457-64.
3. Bigger JT, Coromilas J, Weld FM, Reiffel JA, Rolmitzkey LM. Prognosis after recovery from acute myocardial infarction. Annu Rev Med 1984; 35: 127-47.
4. Hall AS, Winter C, Bogle SM, Mackintosh AF, Murray GO, Ball SG. The Acute Infarction Ramipril Efficacy (AIRE) Study: rationale, design, organization, and outcome definitions. J CardiovQ5c Pharmacol 1991; 18(suppI2): SI05-S109.
5. The Multicenter Postinfarction Research Group. Risk stratification and survival after acute myocardial infarction. N Engl J Med 1983; 309: 331-36.
6. The CAST Investigators. Preliminary repon: effect of encainide and f1ecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N EnglJ Med 1989;321:406-12.
7. The MDPIT research group. The effect of diltiazem on mortality and reinfarction after myocardial infarction. N Engl J Med 1988; 319: 385-92.
8. Swedburg K, Held P, Kjekshus J, et al. On behalf of the CONSENSUS II Study Group. Effects of early administration of enalapril on monality in patients with acute myocardial infarction. Results of the Cooperative North Scandinavian Enalapril Survival Study II (CONSENSUS II). N Engl J Med 1992; 327: 678-84.
9. Sharpe N, Murphy J, Smith H, Hannan S. Treatment of patients with symptomless left ventricular dysfunction after myocardial infarction. Lancet 1988; 334: 255-59.
10. HutchinsGM,BulkleyBH. Infarct expansion versus extension: two different complications of acute myocardial infarction. Am J Cardiol 1978; 41: 1127-32.
11. Pfeffer MA, Braunwald E. Ventricular remodeling after myocardial infarction. Circulation 1990; 81: 1161-72.
12. The CONSENSUS trial study group. Effects of enalapril on mortality in severe congestive hean failure; results of the Cooperative Nonh Scandinavian Enalapril Survival Study (CONSENSUS). N EnglJ Med 1987; 316: 1429-35.
13. The SOLVD Investigators. Effect of enalapril on survival in patients with reduced ejection fractions and congestive hean failure. N Engl] Med 1991; 325: 293-302.
14. CohnIN, Johnson G, Ziesche S, etal. A comparison of enalapril with hydralazine-isosorbide dinitrate in the treatment of chronic congestive hean failure. N Engl] Med 1991; 325: 303-10.
15. Pfeffer MA, Braunwald E, Moye LA, et al. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 1992; 327: 669-77.
16. Hall AS, Ball SG. ACE inhibitors after AMI. Lancet 1989; 337: 1527.
17. Bunning Ρ Kinetic properties of the angiotensin converting enzyme inhibitor ramipri-lat.] CardiovQ5c Pharmacol1987; 10 (suppl 7): S31-S35.
18. Erman A, Winkler J, Chen-Gal B, Rabinov M, Zelykovski A, Tadjer S, Shmueli J, Levi E, AkbaryA, Rosenfeld B. Inhibition of angiotensin convening enzyme by ramipril in serum and tissue of man. J Hypertens 1991; 9: 1057-62.
19. Linz W, Wiemer G, Scholkens BA. ACE-inhibition induces NOformation in cultured bovine endothelial cells and protects isolated ischaemic rat hearts. ] Mol Cell Cardiol1992; 24: 909--10.
20. Cleland JGF, Erhardt L, Hall AS, Winter C, Ball SG. Validation of primary and secondary outcomes and classification of mode of death among patients with clinical evidence of heart failure after myocardial infarction. A report from the Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. J CardiovQ5c Pharmacol (in press).
21. Moye LA, Pfeffer MA, Braunwald E, for the SAVE Investigators. Rationale, design and baseline characteristics of the survival and ventricular enlargement trial. AmJ Cardiol 1991; 68: 700790.
22. The SOL VO Investigators. Effect of enalapril on monality and the development of hean failure in asymptomatic patients with reduced left ventricular ejection fractions. N Engl J Med 1992; 327, 685-91.
23. Yusuf S, Pepine CJ, Garces C, et al. Effect of enalapril on myocardial infarction and unstable angina in patients with low ejection fractions. Lancet 1992; 340: 1173-78.
24. Hall O, Zeitler H, Rudolph W Counteraction of the vasodilator effects of enalapril by aspirin in severe heart failure.] Am Coli Cardiol 1992; 20: 1549-55.
25. Yusuf S, Peto R, Lewis J, Collins R, Sleight R Beta-blockade during and after myocardial infarction: an overview of the randomized trials. Prog Cardiovasc Dis 1985; 27 (5): 335-71.
26. Furberg CD, Hawkins CM, Lichstein E. Effect of propranolol in postinfarction patients with mechanical or electrical complications. Circulation 1984; 69 (4): 761-65.
27. The GISSI-2Investigators. GISSIS 2: a factorial randomised trial of a1teplase versus streptokinase and heparin versus no heparin among 12490 patients with acute myocardia] infarction. Lancet 1990; 336, 65-71.
28. The International Study Group. In-hospital mortality and clinical course of 20 891 patients with suspected acute myocardial infarction randomised between alteplase and streptokinase with Or without heparin. Lancet 1990; 336,71-75.
29. Stevenson R, Ranjadaylan K, Wilkinson P, Robens R, Timmis AD. Short and long term prognosis of acute myocardial infarction since introduction of thrombolysis. 8MJ 1993; 307: 349-53. 30 Lorell BH. ACE inhibitors after myocardial infarcton. N EnglJ Med 1993; 328: 966-67.
