Оценка эффективности сочетанного применения нефопама гидрохлорида и кетопрофена в лечении послеоперационного болевого синдрома у больных эндометриозом
СтатьиОпубликовано в журнале:
Журналъ акушерства и женскихъ болъзней. Том LXI, выпуск 6/2012
Ю. С. Полушин1,2, И. В. Вартанова1,2, В. Ф. Беженарь1, Ю. М. Коростелев1,2, И. В. Голубь1
1 ФГБУ НИИ акушерства и гинекологии им. Д. О. Отта СЗО РАМН, Санкт-Петербург; 2 СПбГУ, медицинский факультет Проведено исследование, направленное на оценку эффективности нового анальгезирующего средства центрального действия нефопама гидрохлорида (Акупан).
Включено 45 пациенток, которым выполнено лапароскопическое оперативное лечение эндометриоза различной степени тяжести.
Выявлено, что упреждающая анальгезия с использованием нефопама и кетопрофена наиболее эффективна у больных эндометриозом I–II степени тяжести. У больных эндометриозом III стадии применение нефопама и кетопрофена значительно повысило качество послеоперационного обезболивания и сократило потребность в наркотическом анальгетике.
У больных эндометриозом тяжелой степени (IV стадии) данная схема оказалось недостаточной.
Ключевые слова: акупан; нефопам; эндометриоз; послеоперационное обезболивание.
Актуальность проблемы
Несмотря на широкое внедрение малоинвазивных операций лапароскопическим доступом в гинекологическую практику, одной из главных проблем послеоперационного периода остается выраженный болевой синдром [7]. Вопреки достигнутому прогрессу в изучении механизмов боли и широкое применение различных методик, в большинстве медицинских учреждений всего мира неэффективная и неадекватная послеоперационная анальгезия отмечена в 40–70 % наблюдений. При этом интенсивную боль в послеоперационном периоде испытывают примерно 20–30 % больных, 15–20 % пациентов отмечают, что интенсивность боли превысила ожидаемый ими уровень, и данные показатели остаются неизменными в течение последних 40 лет [2, 5, 6, 8, 9].
В частности, неудовлетворительные результаты оперативного лечения больных эндометриозом в первую очередь связаны с развитием или усугублением боли. Операции, особенно при тяжелом эндометриозе, нередко проводят многократно [20]. Объем их от раза к разу может расширяться, а это само по себе чревато как усугублением имеющегося хронического болевого синдрома (ХБС) [16], так и его формированием. Даже после стандартных плановых гинекологических операций, таких, как диагностическая лапароскопия, цистэктомия, гистерэктомия, ХБС возникает у 17 % женщин без исходного болевого синдрома [12]. Аналогичное количество пациентов (20 %), включаемых в клинические отчеты по хронической боли, связывают ее именно с выполнением хирургического вмешательства [17]. Таким образом, существенную роль в формировании стойкой гиперальгезии играет как неадекватная анестезия, так и недостаточное послеоперационное обезболивание [10, 19].
Широко распространенная упреждающая анальгезия кетопрофеном, безусловно, повышает степень анестезиологической защиты при проведении целого ряда различных гинекологических оперативных вмешательств [4], однако не приводит к купированию послеоперационной боли у больных эндометриозом, особенно тяжелой степени [1]. Поэтому поиск новых методик анальгезии для улучшения качества послеоперационного обезболивания больных эндометриозом сохраняет свою актуальность. В частности, представляется интересной идея дополнения анальгезии кетопрофеном путем применения анальгетика центрального действия нефопама гидрохлорида (Акупан), который был зарегистрирован в России в 2011 г.
Цель исследования
Оценить эффективность применения нефопама гидрохлорида в составе мультимодальной анальгезии у больных, которым выполнено оперативное лечение эндометриоза различной степени тяжести.
Материал и методы
Исследование проведено в отделении анестезиологии и реанимации Научно-исследовательского института акушерства и гинекологии им. Д. О. Отта Северо-западного отделения РАМН. В проспективное исследование включено 45 пациенток, которым в отделении оперативной гинекологии ФГБУ НИИ акушерства и гинекологии им. Д. О. Отта СЗО РАМН проводили плановое оперативное лечение эндометриоза лапароскопическим доступом. Физический статус всех пациенток соответствовал I–II классу по шкале ASA. Критерии исключения для всех пациенток были одинаковы: возраст <18 лет; тахикардия (ЧСС ≥ 100 уд/мин); исходная брадикардия (ЧСС <60, предполагающая использование атропина в премедикации); традиционные противопоказания к применению нестероидных противовоспалительных препаратов; непереносимость нефопама гидрохлорида.
В зависимости от степени тяжести заболевания пациентки были разделены на три группы. В 1-ю группу вошли 15 человек с эндометриозом I–II стадии (1–15 баллов по шкале Американского общества фертильности R-AFS). 2-ю группу составили 15 больных эндометриозом III стадии (16–40 баллов по шкале R-AFS). 3-я группа состояла из 15 больных эндометриозом IV стадии (более 40 баллов по шкале R-AFS).
Для оценки психоэмоционального состояния пациенток тестировали по Госпитальной шкале тревоги и депрессии (HADS) и шкале Г. Айзенка в предоперационном периоде и на третьи сутки после операции.
Схема анестезиологического пособия во всех группах была однотипна. В качестве премедикации за 12–15 ч до операции всем пациенткам перорально назначали феназепам в дозе 1 мг и фамотидин (20 мг), за 30–40 мин внутримышечно вводили диазепам (10 мг).
Индукцию анестезии осуществляли болюсным внутривенным введением пропофола (2,5–3,0 мг/кг) и фентанила в дозе 2,5–3,5 мкг/кг (внутривенно), а миоплегию — рокурония бромидом в дозе 0,6 мг/кг. Поддержание анестезии обеспечивали ингаляцией севофлурана (до 1,5 %) и болюсным введением фентанила по 0,1 мг.
Искусственную вентиляцию легких (ИВЛ) проводили респиратором Drager Fabius Tiro в режиме с контролем по объему. Дыхательный объем подбирали из расчета 6–8 мл/кг должной массы тела, а частоту дыхания — с учетом показателей капнографа (для обеспечения нормокапнии).
Интраоперационный мониторинг включал неинвазивное измерение артериального давления (АД), ЧСС, ЭКГ, SpO2, температуры. Объективный мониторинг нейромышечной проводимости осуществляли в режиме TOF-стимуляции при помощи прибора CARESCAPE B650 на всех этапах операции. Капнографию проводили с помощью газоанализаторной приставки Vamos к наркозному аппарату Drager Fabius.
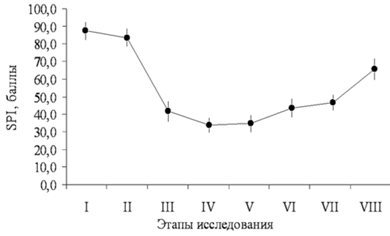
Для исключения эпизодов неадекватной ноцицептивной защиты в интраоперационном периоде использовали компьютеризированный метод обработки и оценки адекватности анестезии, включающий нейромониторинг на основе энтропии и хирургический плетизмографический индекс (SPI). Данная методика реализована в мониторе CARESCAPE B650 (General Electric Company).
Учитывая продолжительность оперативного вмешательства (40–170 мин) для профилактики гипотермии использовали согревающий матрац «Aquaterm», а также подогревали инфузионные растворы.
С целью достижения эффекта упреждающей анальгезии за 30 мин до окончания оперативного вмешательства внутривенно вводили кетопрофен в дозе 100 мг [4]. Нефопам вводили в соответствии с рекомендациями производителя в виде внутривенной инфузии (20 мг препарата в 100 мл физиологического раствора) длительностью 15 мин после завершения основного этапа операции [11].
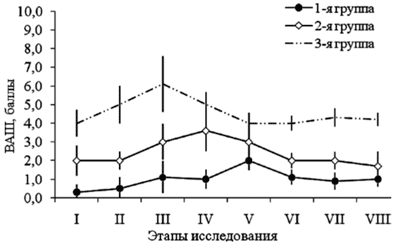
Оценку интенсивности болевого синдрома в периоперационном периоде проводили с помощью 10-балльной визуально-аналоговой шкалы (ВАШ) исходно (I этап), через 1 ч (II этап); через 2 ч (III этап); через 3 ч (IV этап); через 4 ч (V этап); через 6 ч (VI этап); через 24 ч (VII этап) и через 48 ч (VIII этап) после операции.
Послеоперационное обезболивание осуществляли комбинацией наркотических анальгетиков и нестероидных противовоспалительных средств (трамадол, кетонал) на основании оценки пациенткой выраженности болевого синдрома ≥3 баллов по ВАШ в покое и 4 баллов при движении [5].
В послеоперационном периоде контролировали основные физиологические параметры, отражающие степень компенсации жизненно важных систем организма — ЧСС, АД, частоту дыханий, SpO2. Кроме того, оценивали длительность седации по шкале Ramsay, выраженность послеоперационной мышечной дрожи и побочные эффекты, развитие которых могло быть связано с применением нефопама.
Статистическую обработку материала выполняли с использованием пакета программ SPSS 16.0. Нормальность распределения данных оценивали с помощью теста Шапиро–Уилка. Данные с нормальным распределением представлены в виде M ± m. Показатели с неправильным распределением представлены в виде медианы с 25 % и 75 % процентилями. Различия считали статистически значимым при р Результаты исследования и их обсуждение
Группы были сопоставимы по объему оперативного вмешательства (II класс по ASA), возрасту и весу. Однако частота выявления и степень выраженности хронического болевого синдрома (ХБС) была разной. Так, ХБС регистрировали всего у одной пациентки из 1-й группы, у 9 — из 2-й группы и у всех больных эндометриозом IV стадии (3-я группа) (табл. 1). Также в предоперационном периоде у пациенток регистрировали различный, в зависимости от тяжести заболевания, уровень тревоги, депрессии и нейротизма. Возможно, изменения личностной сферы были связаны с адаптацией организма к хронической боли.
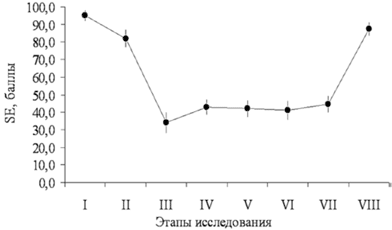
Существенных различий в интраоперационном периоде между группами не было. Показатель абсолютной энтропии (SE) во время операции у всех больных поддерживали в пределах 35–45 [3], что вместе со стабильной гемодинамикой свидетельствовало о высокой степени анестезиологической защиты от хирургического стресса (рис. 1).
Таблица 1
Общая характеристика пациенток исследуемых групп в предоперационном периоде1
| Признак | 1-я группа (n = 15) | 2-я группа (n = 15) | 3-я группа (n = 15) |
| Возраст | 24,3 (21,4-35,7) | 27,5 (23,7-10,1) | 29,8 (22,0-43,4) |
| Индекс массы тела | 23,5 (19,3-34,5) | 24,1 (18,5-32,5) | 22,8 (18,7-26,2) |
| Уровень тревожности по шкале HADS | 2,4 (1,5-5,1) | 4,6 (3,9-9,3) | 8,4 (5,5-16,8)* |
| Уровень депрессии по шкале HADS | 2,2 (1,9-1,8) | 4,5 (2,0-8,9) | 7,5 (4,5-15,3)* |
| Уровень нейротизма по Г. Айзенку, баллы | 4,5 (2,1-8,2) | 9,6 (6,2-12,4)0 | 13,7 (10,6-16,8)* |
| Болевой синдром (число пациенток) | 2 | 9 | 15 |
| Уровень боли по ВАШ | 2,0 | 2,5 (2,0-4,1) | 4,5 (3,2-7,0) |
| Длительность оперативного вмешательства, мин | 61,5 (40,5-86,4) | 80,5 (78,4-117,5) | 119,7 (90,5-180,9)* |
| 1 — данные представлены в виде медианы и интерквартильного размаха; * — статистически значимое отличие (р
Этапы: 1 — исходные данные; 2 — индукция анестезии; 3 — интубация; 4 — наложение карбоксиперитонеума; 5 — ревизия органов малого таза; 6 — травматичный этап операции; 7 — окончание операции; 8 — экстубация. В связи с тем, что анализ ЭЭГ позволяет определить лишь недостаточность гипнотического компонента анестезии, но сам по себе прямо не отражает степень антиноцицептивной защиты, с целью повышения качества мониторинга контролировали хирургический плетизмографический индекс (SPI) — новый параметр, реагирующий на гемодинамические реакции, вызванные ноцицептивной стимуляцией в условиях общей анестезии. SPI зависит от концентрации анальгетика в крови. Его использование позволяет сократить количество эпизодов неадекватности анестезии и гемодинамической нестабильности и регулировать потребление наркотических анальгетиков, а также способствует быстрому восстановлению пациента после анестезии [18]. В соответствии с рекомендациями, фентанил вводили при значении SPI более 50, или при появлении признаков неадекватности анестезии (среднее АД > 90 мм рт. ст., частота сердечных сокращений > 80 уд/мин). Одновременное использование энтропии и SPI-индекса облегчало индивидуальный подбор доз седативных препаратов и наркотических анальгетиков для каждой пациентки и позволяло исключать эпизоды как поверхностной, так и излишне глубокой анестезии. Это представляется очень важным, т. к. хорошо известно, что неэффективная защита боль-модулирующих систем от ноцицептивной стимуляции во время анестезии может лежать в основе формирования выраженного послеоперационного болевого синдрома [5, 8]. В раннем послеоперационном периоде у большинства пациенток (39 из 45) отмечали легкую седацию (2 балла по шкале седации Ramsey в течение 2–3 ч после операции). Вероятно, это было обусловлено центральным действием нефопама, основанном на ингибировании обратного захвата дофамина, норадреналина и серотонина на уровне синапсов. В 1-й группе, представленной пациентками с благоприятным психологическим фоном без хронического болевого синдрома, однократное применение 20 мг кетопрофена и 20 мг нефопама было вполне достаточным. Уровень боли по ВАШ составил 0–2 балла, необходимости в дополнительном обезболивании, в том числе применении наркотических анальгетиков не было (рис. 3). Особенно важно отметить, что через 24 ч и через 48 ч после операции (VII и VIII этапы исследования) пациентки не жаловались на боль.
Во 2-й группе (III стадия эндометриоза) появление болевых ощущений, требующее дополнительного назначения медикаментозных средств, отмечали 8 пациенток только через 3–6 ч после окончания операции. При этом необходимость в назначении наркотического анальгетика (трамадола) в сочетании с кетоналом у 6 пациенток возникала однократно, и только у 2 — дважды. У одной из них имел место плечелопаточный синдром, связанный с наложением карбоксиперитонеума, в то время как на боль в области послеоперационной раны жалоб не было. Несмотря на адекватность анестезиологической защиты и упреждающую анальгезию кетоналом и нефопамом, у пациенток 3-й группы ранний послеоперационный период все же сопровождался интенсивным болевым синдром. Так, у 9 из 15 больных тяжелым эндометриозом уровень боли всего через час после окончания оперативного вмешательства достигал 6 баллов. При этом жалобы на интенсивную боль пациентки предъявляли уже через 0,5 ч после окончания оперативного вмешательства. В связи с этим им приходилось в 2,6 раз чаще, чем во 2-й группе, назначать трамадол. Таким образом, у 60 % больных НГЭ IV стадии однократное применение кетопрофена и нефопама оказалось недостаточным. Из побочных эффектов, развитие которых можно было бы связать с применением нефопама, отметили потливость у трех пациенток (6,7 %). Аллергических реакций не было. Также применение нефопама не оказывало негативного влияния на гемодинамику. Рассматривая причины неадекватного обезболивания и повышенной потребности в послеоперационном введении анальгетиков у пациенток 3-й группы, необходимо принимать во внимание наличие ХБС в сочетании с психоэмоциональным состоянием пациенток (тревога, депрессия, невротические расстройства). Тесную связь между выраженностью болевого синдрома и личностной характеристикой индивидуума отмечают многие исследователи [13]. Примечательно, что именно психосоциальные факторы, особенно предчувствие трудного восстановления поcле операции, имеют прогностическую ценность в отношении развития боли. И напротив, факторы, связанные с операцией, включая оценку тяжести травмы, не столь существенны. Это значит, что наряду с периферической травмой в развитии болевого синдрома следует учитывать обстоятельства, связанные с регистрацией и усилением афферентного сигнала в ЦНС (посредством когнитивного и эмоционального компонентов) [12]. Полученные данные вполне объясняются современными представлениями о механизмах формирования боли, позволяющими считать, что наиболее адекватная анальгезия при травматичных вмешательствах может быть обеспечена только мультимодальной анальгезией. Известно, что интенсивность острого послеоперационного болевого синдрома является статистически значимым предиктором формирования послеоперационного болевого синдрома. И напротив, исключение эпизодов неадекватности анестезии и острой послеоперационной боли способствует снижению частоты формирования ХБС и улучшению качества жизни пациенток в послеоперационном периоде [14, 15]. В целом же применяемая схема анальгезии уменьшала нагрузку на средний медперсонал (за счет уменьшения частоты введения анальгетиков, сокращения времени работы с документацией, и улучшения качества обезболивания), а также позволяла проводить раннюю активизацию больных и ускорять перевод их из палаты интенсивной терапии в профильное отделение. Выводы Упреждающая мультимодальная анальгезия, основанная на сочетанном применении нефопама гидрохлорида с кетопрофеном обеспечивает адекватное устранение болевых ощущений в послеоперационном периоде у пациенток, которым при выполнении диагностической лапароскопии устанавливали НГЭ I–II стадии. Указанная схема позволяет значительно повысить качество послеоперационного обезболивания у больных НГЭ III стадии и сократить потребность в опиоидном анальгетике. Поиск новых компонентов мультимодальной анестезии, обеспечивающих продленный обезболивающий эффект в ближайшем послеоперационном периоде у больных эндометриозом тяжелой степени продолжает оставаться весьма актуальным.
Литература
Статья представлена Э. К. Айламазяном ФГБУ «НИИАГ им. Д. О. Отта» СЗО РАМН, Санкт-Петербург Evaluation of combined nefopam hydrochloride and ketoprofen in the treatment of postoperative pain in patients with endometriosisPolushin Y. S., Vartanova I. V., Bezhenar V. F., Korostelev Y. M., Golub I. V. Summary: Conducted a study to assess the effectiveness of a new centrally acting analgesic nefopam hydrochloride (Acupan). Included 45 patients who underwent laparoscopic surgical treatment of endometriosis of varying severity. Found that pre-emptive analgesia with nefopam and ketoprofen is more effective in patients with endometriosis, I–II severity. In patients with endometriosis stage III application ketoprofen and nefopam significantly improved the quality of postoperative analgesia and reduced the need for narcotic analgesics. In patients with severe endometriosis (IV stage), this scheme was inadequate. Key words: Acupan; nefopam; endometriosis; post-operative analgesia. | |||