Возможности ингаляционной антибактериальной терапии при обострении хронической обструктивной болезни легких
СтатьиЕ.И.Шмелев, М.Н.Нефедова, Ю.Л.Куницына
11 ГКБ, Центральный НИИ туберкулеза РАМН, Москва
Обострение хронической обструктивной болезни легких (ХОБЛ) - естественное и обязательное проявление прогрессирования заболевания. Большинство обострений ХОБЛ носят инфекционный характер, и по мере прогрессирования болезни, потребность в антибактериальной терапии для ее лечения возрастает. Назначение и эффективность антибиотиков системного действия при обострениях ХОБЛ в значительной мере ограничивается их нежелательными эффектами и увеличением числа резистентных штаммов основных микробных возбудителей к ним. К тому же с увеличением частоты использования антибактериального препарата соответственно возрастает риск возникновения побочных эффектов и формирования устойчивой флоры. До настоящего времени стандартом лечения инфекционных обострений ХОБЛ остается назначение системных антибактериальных препаратов. Поскольку основными источниками патогенной и условно-патогенной флоры являются ротоглотка и верхние дыхательные пути, то любое стрессовое воздействие может привести к ее активации, срыву компенсаторных механизмов и последующему обострению хронического бронхолегочного процесса. В связи с этим перспективным подходом к лечению обострений ХОБЛ является использование ингаляционного антибиотика фузафунгина (биопарокс) - препарата, обладающего широким спектром антибактериального действия и противовоспалительной активностью, важной особенностью которого является отсутствие к нему резистентности микроорганизмов, в том числе и перекрестной.
Действительно, согласно новому исследованию (R.Leclercq, MAuzou, 2005), спектр антибактериальной активности биопарокса распространяется на большинство возбудителей инфекций дыхательного тракта (табл. 1).
Таблица 1
Спектр антибактериальной активности биопарокса
|
Микроорганизмы |
MIC90 (мг/л) |
| Staphylococcus aureus | 32 |
| Метициллин-резистентные S. aureus | 32 |
| Метициллин-susceptible S. aureus | 32 |
| Streptococcus pyogenes | 32 |
| Streptococcus pneumoniae | 16 |
| Moraxella catarrhalis | 32 |
| Neisseria meningitidis | 16 |
| Candida albicans | 16 |
Также очень важным представляется тот факт, что биопарокс - это микронизировнный препарат, размер частиц которого в среднем составляет 0,78 микрона, и благодаря отсутствию гигроскопичности остается неизменным до и после ингаляции (A.Bouchikhi, 1987). Это свойство позволяет биопароксу в отличие от других немикронных спреев или аэрозолей проникать в наиболее отдаленные участки дыхательного тракта и оказывать терапевтическое действие даже на уровне бронхов (табл. 2).
Таблица 2
Отличия биопарокса от спреев и аэрозолей
| Характеристика | Биопарокс | Немикронный спрей или аэрозоль |
| Размер частиц | Сохраняется размер частиц 1 микрон: не гигроскопичен | Размер частиц вследствие гигроскопичности повышается до десятков и сотен микрон в зависимости от препарата |
| Средний диаметр распределения | Сконцентрирован | Несконцентрирован |
| Гомогенность | Монодисперсный | Полидисперсный |
| Проникновение | Глубоко до бронхиол | Не проникает в суженные дыхательные пути |
| Накопление | Прекрасное, независимо от типа дыхания | Частичное, зависит от типа дыхания |
| Терапевтическое действие | Строго местное, возможно повторное использование | При повторном применении возможно системное действие |
Противовоспалительное действие биопарокса основано на его выраженной способности ингибировать продукцию различных провоспалительных медиатров при сохранении способности макрофагов к фагоцитозу (рис. 1). В частности, доказано, что биопарокс в терапевтических концентрациях достоверно снижает:
Высокая эффективность биопарокса подтверждается большим количеством исследований. В частности, одним из наиболее ярких примеров является эпидемиологическое, ретроспективное, многоцентровое исследование VISION (O.Laссourreye и соавт., 2003). Результаты этого исследования показали, что применение биопарокса уменьшает частоту использования антибиотиков системного действия практически на 30% (см. рис. 1), что обеспечивает:
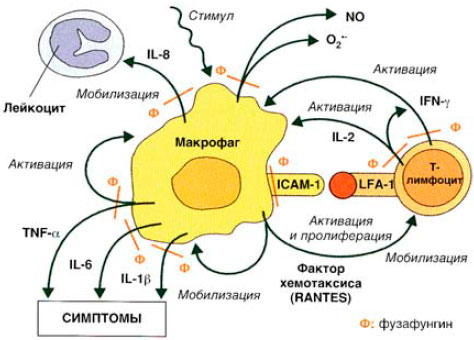
Рис. 1. Ингибирующее действие биопарокса на клетки и медиаторы воспаления.
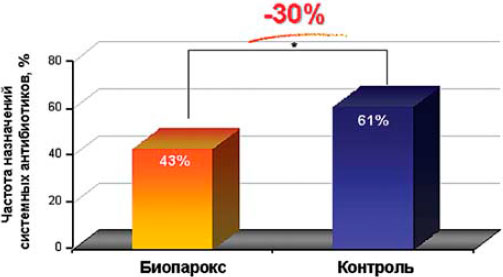
Рис. 2. Исследование VISION.
Подобные данные также получены в открытом многоцентровом исследовании, проведенном C.Le Jeunne (1987 г.), в котором участвовали 649 пациентов с хроническим бронхитом. Было показано, что применение биопарокса у пациентов снижает в 2 раза число обострений, а также уменьшает длительность употребления системных антибиотиков на 2/3.
Все изложенное послужило основанием для проведения собственного исследования по изучению эффективности биопарокса при острых респираторных заболеваниях на фоне ХОБЛ.
Цель исследования
Сравнительный анализ эффективности применения фузафунгина и системной антибактериальной терапии при лечении обострений ХОБЛ.
Материалы и методы
В исследование включены 56 больных ХОБЛ II стадии в фазе обострения, нуждающихся в проведении антибактериальной терапии. Стадию ХОБЛ определяли в соответствии с рекомендациями, изложенными в Федеральной программе по ХОБЛ. Все больные, включенные в исследование, получали систематическую бронходилатирующую терапию (М-холинолитики и _2-агонисты).
Средний возраст пациентов составил 61,21±9,32 года. Все больные были курящими, средний показатель пачка/лет составил 34,03±0,22 пачка/лет.
Методом рандомизации больные разделены на 2 группы: 28 человек получали терапию биопароксом в дозе 2 г в сутки (4 ингаляции через рот 4 раза в день) и 28 человек получали эмпирически назначенную терапию системными антибактериальными препаратами (САБ) защищенные пенициллины или цефалоспорины III поколения (6 человек - амоксиклав 2 г в сутки по 1000 мг 2 раза в сутки per os; 20 человек - цефатаксим по 3 г в сутки, по 1 г 3 раза в день парентерально внутримышечно). Антибактериальную терапию проводили в течение 10 дней.
Помимо антибактериальной терапии всем пациентам назначены муколитики и системные кортикостероиды парентерально либо, при объеме форсированного выдоха за первую секунду (ОФВ1) ≤50% - per os (20-30 мг преднизолона).
Пациентам обеих групп проводили ежедневный мониторинг динамики основных клинических симптомов обострения. Выраженность клинических симптомов, характеристику свойств мокроты оценивали по 3балльной шкале. Оценка изменений гемограммы, показателей цитологического исследования мокроты, функционального исследования легких и 6-минутной шаговой пробы, оценка индекса одышки по Малеру проведена в начале и конце лечения.
Одышка и кашель:
0 баллов - отсутствие симптомов.
1 балл - минимальное проявление признака, не ограничивающего активность пациента.
2 балла - выраженное проявление признака, ограничивающего активность пациента.
3 балла - симптом резко ограничивает активность пациента.
Аускультативная симптоматика (хрипы):
0 балла - отсутствие симптома.
1 балл - единичные сухие хрипы над легкими исчезающие при покашливании.
2 балла - небольшое количество сухих хрипов, не исчезающих при кашле.
3 балла - хрипы в большом количестве, не исчезающие при кашле.
Эффективность проводимой терапии оценивали по общепринятым критериям. В случае недостаточной эффективности фузафунгина к терапии подключали системные антибиотики.
Полученные данные обработаны с использованием как параметрических, так и непараметрических методов статистики.
Результаты
Основные клинические показатели у пациентов обеих групп оказались сопоставимы (рис. 3, табл. 1).
Таблица 1
Изменения выраженности основных клинических показателей (в баллах) в результате лечения
|
Симптом |
Биопароксом (основная группа) |
САБ (группа сравнения) | ||
| До лечения | После лечения | До лечения | После лечения | |
| Кашель | 2,81±0,11 | 1,32±0,18* | 2,72±0,15 | 1,02±0,10* |
| Одышка | 2,08±0,10 | 1,74±0,18* | 2,52±0,13 | 0,72±0,10* |
| Характер мокроты | 2,78±0,12 | 0,88±0,17* | 2,82±0,13 | 0,72±0,15* |
| Хрипы | 1,82±0,11 | 1,01±0,10* | 2,03±0,12 | 0,87±0,11* |
| Частота дыхательных движений | 27,1±0,3 | 22,6±0,20* | 26,2±0,20 | 20,5±0,10* |
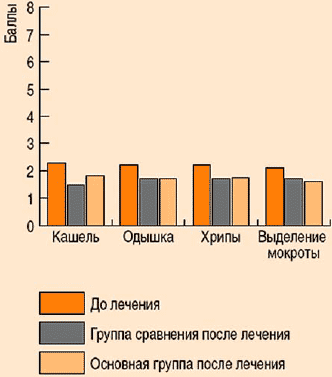
Рис. 3. Динамика симптомов у больных с обострением ХОБЛ на фоне лечения биопароксом (основная группа) и САБ (группа сравнения).
1. Наибольшая выраженность изменений респираторной симптоматики отмечена по показателям изменений характеристики мокроты: в группе пациентов, получавших терапию биопароксом, так же как и у пациентов группы терапии САБ, степень "гнойности" мокроты сократилась в 3 раза (с 2,78±0,12 до 0,88±0,17, p<0,05 - в группе биопарокса; с 2,82±0,13 до 0,72±0,10, p<0,05 -в группе САБ).
2. В меньшей степени изменялась интенсивность кашля: в 2 раза (с 2,81±0,11 до 1,32±0,18, p<0,05 в группе биопарокса; с 2,72±0,15 до 1,02±0,10, p<0,05 - в группе САБ).
3. Регрессия выраженности одышки была не столь существенна: уменьшение в 1,2 раза у пациентов получавших Биопарокс (с 2,08±0,10 до 1,74±0,18, p<0,05) и в 1,59 раза в группе САБ (с 2,52±0,13 до 0,72±0,10, p<0,05), что объяснимо значимостью необратимого компонента бронхиальной обструкции у больных ХОБЛ II стадии.
4. При анализе аускультативной симптоматики у пациентов исследуемых групп количество сухих хрипов сократилось без существенных различий по этому показателю между группами лечения: в группе биопарокса c 1,82±0,11 до 1,01±0,10, p<0,05; в группе терапии САБ с 2,03±0,12 до 0,87±0,11, p<0,05, что также подтверждалось показателями функционального исследования легких (функция внешнего дыхания - ФВД), которые не различались в группах лечения биопароксом и САБ.
Лейкоцитоз периферической крови является ярким показателем активности воспалительного процесса. В результате проведенного лечения отмечено достоверное снижение данного показателя и нормализация количества лейкоцитов в обеих группах: в группе лечения биопароксом с 9,1 х 109/л±0,1 до 6,7 х 109/л±0,1 (p<0,05), в группе САБ с 10,1 х 109/л±0,1 до 8,6 х 109/л±0,2 (p<0,05).
Оценка влияния антибактериальной терапии на функциональное состояние больных ХОБЛ проводилась в динамическом контроле за показателями ФВД: форсированной емкости легких (ФЖЕЛ), ОФВ1, ОФВ1/ФЖЕЛ (модифицированного индекса Тиффно); теста толерантности физической нагрузки (6-минутной шаговой пробы), а также по степени выраженности одышки по шкале Малера (табл. 2). Как и при анализе изменений основной клинической симптоматики обострения ХОБЛ, отмечена прямая корреляция регрессирования бронхообструктивного синдрома с повышением толерантности к физическое нагрузки и сокращением степени выраженности одышки у пациентов обеих групп, как при лечении Биопароксом, так и в группе терапии САБ, причем никаких существенных отличий между группами не замечено (рис. 4).
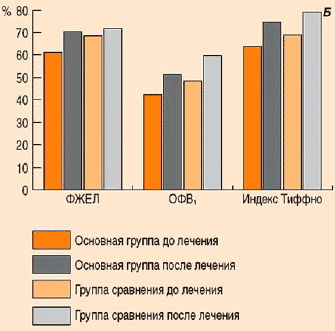
Рис. 4. Динамика показателей ФВД у больных с обострением ХОБЛ на фоне лечения биопароксом (основная группа) и САБ (группа сравнения).
Таблица 2
Изменения выраженности основных функциональных показателей в результате лечения
|
Показатель |
Биопароксом (основная группа) |
САБ (группа сравнения) | |||
| до лечения | после лечения | до лечения | после лечения | ||
|
ФВД в % | ФЖЕЛ | 61,2±0,3 | 70,3±0,2** | 68,4±0,20 | 70,8±0,30** |
| ОФВ1 | 42,2±0,4 | 51,3±0,5* | 48,6±0,30 | 59,7±0,40* | |
| ФЖЕЛ/ОФВ1 | 63,7±0,2 | 74,8±0,3* | 68,8±0,10 | 79,3±0,20* | |
|
Шаговая проба (в метрах) |
250,6±2,8 |
402,0±3,9* |
245,7±2,6 |
480,0±3,4* | |
|
Индекс одышки по Малеру | 4,65±0,10 | 5,9±0,20* | 4,45±0,30 | 6,1±0,20* | |
Переносимость антибактериальной терапии у пациентов, принимавших биопарокс, была хорошей. Побочные эффекты терапии в группе лечения фузафунгином отмечены всего лишь у 8 пациентов, что, однако, не потребовало отмены препарата ни в одном случае и не повлияло на его эффективность. В группе системной антибактериальной терапии у 4 больных развился фарингомикоз легкой степени тяжести (на 4-6-й день лечения), что потребовало назначения антимикотических препаратов.
Клиническая эффективность проведенной терапии (купирование инфекционного обострения и стабилизация заболевания) была достигнута у 21 (80,8%) пациента 1-й группы и у 24 (92%) пациентов 2-й группы. В группе терапии фузафунгином у 5 (19,2%) больных отмечено отсутствие клинической эффективности терапии в течение 3 дней, что выражалось сохранением лихорадки, интенсивности кашля, одышки, "гнойности" мокроты. Этим пациентам присоединяли к лечению САБ - цефалоспорин III поколения. Дальнейшая терапия у этих больных признана клинически эффективной и закончилась разрешением инфекционного эпизода.
Таким образом, применение как биопарокса, так и системной антибактериальной терапии позволяет эффективно купировать инфекционное обострение ХОБЛ II стадии. При этом эффективность применения ингаляционного биопарокса в 4 случаях из 5 не уступает классической терапии системными антибиотиками, что позволяет рассматривать биопарокс как альтернативу последним.
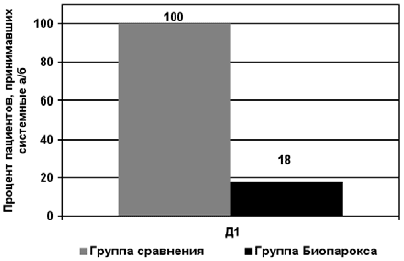
Рис. 5. Частота применения САБ в группах терапии.
Применение биопарокса существенно уменьшает потребность в проведении системной противомикробной терапии, что значительно снижает лекарственную нагрузку на организм пациента и позволяет избежать многих побочных эффектов системных препаратов.
Полученные результаты демонстрируют не только клиническую (конечную) эффективность биопарокса при обострении ХОБЛ, но и значимость флоры верхних дыхательных путей, на которую в первую очередь действует фузафунгин. В этом случае возможность ограничения применения САБ - положительное явление, открывающее новое направление в лечении обострений ХОБЛ.
ЛИТЕРАТУРА
1. Хронические обструктивные болезни легких. Федеральная программа. М., 2003.
2. Клинические рекомендации. Хроническая обструктивная болезнь легких. Под ред. ЧучалинаАГ. М.: Издательство "Атмосфера", 2003.
3. Шмелев ЕИ. Хроническая обструктивная болезнь легких. М., 2003.
4. Global Initiative For Chronic Obstructive Lung Disease. WHO, updated 2003.
5. Bouchikhi A, Becquemin MH, Harpey C et al. Fusafungine: aerosol dropletfeatures and total deposition in obstructive and healthy subjects' airwais. Jaerosol Med 1988; 3 (1): 246.
6. Samolinski B. Influence of fusafungine upon viral and bacterial infections. Med Sci Monit 1997; 3: 736-43.
