Афала в лечении пациентов с аденомой предстательной железы: эффективность и безопасность
Статьи Опубликовано в журнале:«УРОЛОГИЯ»; № 6; 2012; стр. 52-57.
М. Э. Григорьев
Кафедра урологии и оперативной нефрологии ГБОУ ВПО "Российский национальный исследовательский медицинский университет им. Н.И. Пирогова" Минздравсоцразвития России, Москва
В ходе двойного слепого плацебо-контролируемого рандомизированного клинического исследования с участием 94 пациентов оценивались эффективность и безопасность отечественного препарата афала в лечении пациентов с симптомами аденомы предстательной железы (АПЖ) /— II стадий. Показано, что 6-месячный курс терапии афалой в дозе 2 таблетки 4 раза в день приводил к значимому снижению степени выраженности нарушений мочеиспускания, оцениваемых с помощью суммарного балла IPSS, по отношению к исходному показателю и по сравнению с плацебо-терапией. Наиболее выраженные терапевтические эффекты препарата зарегистрированы в отношении ирритативной симптоматики АПЖ. Максимальная скорость мочеиспускания по данным урофлоуметрии через 6 мес. лечения возрастала более чем на 50%. Значимая клиническая эффективность сохранялась не только на протяжении всего 6-месячного курса терапии, но и спустя 3 мес. после его окончания. Длительная терапия не оказывала влияния на концентрацию общего, свободного и комплексного простатспецифического антигена, уровень тестостерона (общего и свободного), дигидротестостерона и пролактина в крови. Отсутствие нежелательных эффектов, отклонений биохимических показателей, изменений в клинических анализах крови и мочи подтверждало безопасность 6-месячной терапии.
Ключевые слова: аденома предстательной железы; расстройства мочеиспускания; консервативное лечение; афала
AFALA IN THE TREATMENT OF PATIENTS WITH BPH: EFFICACY AND SAFETY
M.E. Grigoriev
The double-blind, placebo-controlled, randomized clinical trial involving 94 patients has evaluated the efficacy and safety of domestic preparation afala in patients with symptoms of I-II stages benign prostatic hyperplasia (BPH). It was shown that a 6-month course of treatment with afala at a dose of 2 tablets 4 times a day resulted in a significant reduction in the severity of urinary disorders, estimated by total IPSS score, relative to baseline values and compared to placebo therapy. The most pronounced therapeutic effects of the drug were registered in respect of irritative symptoms of BPH. According uroflowmetry, peak flow rate after 6 months of treatment was increased by more than 50%. Significant clinical benefit persisted not only within the 6-month course of therapy, but 3 months after. Long-term therapy had no effect on the concentration of total, free and complex PSA, testosterone (total and free), dihydrotestosterone, and prolactin in the blood. Absence of adverse effects, biochemical abnormalities, changes in clinical blood and urine confirmed the safety of 6-month therapy.
Key words: prostatic adenoma, urination disorders, conservative treatment; afala
Введение. Накопленный в мировой практике опыт изменил взгляды урологов на вопросы, касающиеся наблюдения и лечения пациентов с аденомой предстательной железы (АПЖ). Последние научные разработки свидетельствуют о том, что во многих случаях достаточно сложно установить непосредственную связь между симптомами заболевания и гиперплазией простаты [1]. Клинические проявления АПЖ ассоциированы с увеличением железы, наличием инфравезикальной обструкции, проявляются обструктивными и ирритативными симптомами, как правило, являющимися поводом для обращения к врачу и назначения медикаментозной терапии. Согласно последним клиническим рекомендациям Европейской ассоциации урологов (2011), для лечения ненейрогенных расстройств мочеиспускания и симптомов, связанных с АПЖ, используются как традиционные, так и новые методы терапии. Необходимость назначения больным АПЖ лекарственных средств на длительный срок ставит вопросы безопасности и переносимости лечения на первый план, в связи с чем приоритетным направлением медицины становятся разработка и клиническое испытание используемых препаратов.
В 2001 г. в нашей стране зарегистрирован и разрешен к применению отечественный препарат афала, созданный на основе антител к простатспецифическому антигену (анти-ПСА). В течение 10 лет проводились клинические исследования его эффективности и безопасности [2—12], одно из которых проходило на базе урологической клиники РНИМУ им. Н.И. Пирогова (2008-2010). Целью двойного слепого плацебо-контролируемого рандомизированного клинического исследования (КИ) была оценка влияния афалы на выраженность симптомов заболевания, показатели урологического обследования, качество жизни пациентов, уровень ПСА и половых гормонов в процессе 6-месячного курса терапии.
Материалы и методы. В КИ приняли участие 94 пациента с верифицированным на основании результатов клинико-инструментального обследования диагнозом АПЖ I (компенсированная) и II (субкомпенсированная) стадии согласно клинической классификации этого заболевания [13]. Все пациенты соответствовали следующим критериям включения: возраст от 45 до 75 лет; суммарный балл выраженности симптоматики АПЖ в соответствии с Международной системой оценки заболеваний простаты (International Prostate Symptom Score - IPSS) от 10 до 20; максимальная скорость потока мочи (Qmax) по результатам урофлоуметрии от 5 до 15 мл/с; объем предстательной железы по данным трансректального ультразвукового исследования (ТРУЗИ) — более 30 см3, объем остаточной мочи — не более 150 мл. В исследование не включали пациентов с острыми инфекционными заболеваниями мочеполовой системы, новообразованиями, декомпенсированными заболеваниями, предшествовавшими оперативными вмешательствами на предстательной железе или мочевом пузыре, наличием показаний к оперативному лечению.
После включения в КИ пациентов рандомизировали в группу приема афалы (n=61) или плацебо (n=33) по 2 таблетки 4 раза в день вне связи с приемом пищи. Продолжительность лечения составила 6 мес., последующего наблюдения — 3 мес. В течение всего КИ пациент мог получать терапию сопутствующих заболеваний, за исключением препаратов, оказывающих влияние на функцию предстательной железы и/или мочевого пузыря.
Первичной конечной точкой исследования было уменьшение выраженности симптоматики заболевания по данным суммарного балла по шкале IPSS к окончанию курса лечения. Вторичные конечные точки — влияние терапии на максимальную скорость мочеиспускания, качество жизни, сексуальную активность пациентов, уровень различных форм ПСА и гормонов (тестостерона, дигидротестостерона, пролактина) в сыворотке крови.
Исследуемые группы были сопоставимыми по исходным социально-демографическим и клиническим характеристикам. Средний возраст пациентов группы афалы составил 66,2±6,9 года (от 46 до 75 лет), группы плацебо - 65,8±6,7 (от 51 года до 75 лет); давность заболевания - 7,4±4,34 и 7,7±5,15 года соответственно. Все пациенты имели характерные обструктивные и ирритативные симптомы заболевания. Большинство больных предъявляли жалобы на прерывистость струи мочи (63%; n=53), ощущение неполного опорожнения мочевого пузыря (66%; n=55), повышенную частоту мочеиспускания (69%; n=58), невозможность быстро начать мочеиспускание (71%; /2=60), учащенное мочеиспускание ночью (79%; /2=66); почти все пациенты отмечали ослабление струи мочи (98%; /2=82). Среди сопутствующих заболеваний в исследуемых группах отмечены артериальная гипертензия (70%), ишемическая болезнь сердца (69%); сахарный диабет (10%); бронхиальная астма (5%), гастрит (5%). Предшествовашая терапия АПЖ 50% пациентов включала а-адреноблокаторы (омник, зоксон, сетегис, артезин), 43% - средства, влияющие на обмен веществ в предстательной железе (витапрост, тыквеол, простамол).
В процессе лечения пациенты наносили врачу по 6 ежемесячных плановых визитов, в ходе которых выполнялись клинико-инструментальные и лабораторные исследования, оценивалась эффективность и безопасность терапии. Через 3 мес. после окончания лечения на визите follow-up проведено отсроченное обследование.
Шесть пациентов группы афалы и четыре — группы плацебо были досрочно исключены из исследования из-за их нежелания продолжать участие в нем. В окончательный анализ вошли результаты наблюдения 84 пациентов, завершивших участие в КИ согласно протоколу; в анализ по оценке безопасности — данные всех 94 включенных в КИ пациентов.
Обработка результатов исследования проведена с использованием статистического пакета SAS-9.2.
Применялись методы параметрической (для непрерывных и интервальных переменных) и непараметрической (частотный анализ по категориальным переменным) статистики.
Результаты. Изменение выраженности симптоматики заболевания по данным суммарного балла опросника IPSS в процессе лечения (визиты 1—6) по сравнению с исходным состоянием (визит -1) представлено на рис. 1. Если первоначальное среднее значение по шкале IPSS в сравниваемых группах было одинаковым (15,0±3,3 и 15,3±4,2 балла в группе афалы и плацебо соответственно), то последующие оценки по шкале IPSS свидетельствовали о более выраженной положительной динамике показателя в группе активного препарата. В течение 6-месячного курса лечения суммарный балл по шкале IPSS в группе афалы снизился до 11,5±5,4 (против 12,9±6,4 в группе плацебо). Ковариационный дисперсионный анализ ANCOVA ежемесячных оценок выраженности симптомов по шкале IPSS с включением факторов Визит и Препарат свидетельствовал о значимости их взаимодействия: показатели групп афалы и плацебо достоверно различались в процессе лечения (F5/405=2,52; p=0,047). Оценка относительного снижения суммарного балла по шкале IPSS в исследуемых группах с помощью двуфакторного дисперсионного анализа ANOVA, учитывавшего факторы Визит и Препарат, также продемонстрировала статистическую значимость обоих исследуемых факторов, что свидетельствовало о более выраженной клинической эффективности афалы по сравнению с плацебо (Препарат: F1=14,0; p=0,0002; Визит: F5=3,2; p=0,008).
Рис. 1. Динамика суммарного балла по опроснику IPSS в исследуемых группах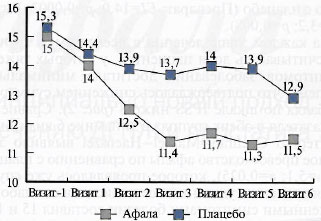
На каждом этапе лечения в исследуемых группах рассчитывалась доля пациентов, у которых тяжесть симптомов заболевания достигала минимальной степени, что подтверждалось снижением суммарного балла по шкале IPSS ниже 8 (рис. 2). Сравнение показателя в обеих группах в динамике 6 визитов по критерию Cochran—Mantel—Haenszel выявило значимое превосходство афалы по сравнению с плацебо (Х2(1)=5,1; p=0,025), которое проявлялось уже спустя месяц лечения: удельный вес пациентов со слабовыраженными симптомами болезни составил 15 и 10% соответственно. К окончанию курса терапии это соотношение увеличилось до 24 и 14% соответственно. Более того, результаты последующего наблюдения с оценкой обструктивной и ирритативной симптоматики свидетельствовали о стойком последействии проведенного лечения: на визите follow-up; доля участников исследования, имевших легкую степень симптоматики заболевания, в группе афалы сохранилась практически на прежнем уровне (22%), в то время как в группе плацебо этот показатель снизился в 2 раза и составил всего 7% (рис. 2).
Рис.2. Доля пациентов с величиной суммарного балла по шкале IPSS менее 8 в динамике наблюдения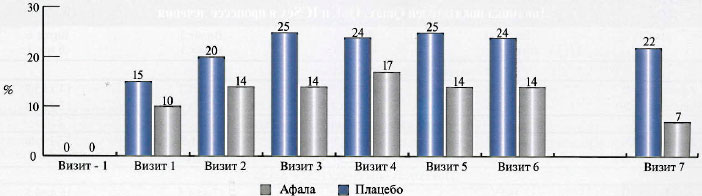
Прием афалы способствовал снижению степени тяжести субъективных и объективных симптомов АПЖ в процессе лечения. Наиболее значимыми были изменения выраженности ирритативной симптоматики. Результаты анализа с применением критерия х2 в модификации Cochran—Mantel—Haenszel демонстрировали, что афала статистически значимо превосходила плацебо по влиянию на такие симптомы, как "повышенная частота мочеиспусканий" (х2(1)=4,3; р<0,04), "учащенное мочеиспускание ночью" (х2(1)=8,1; p<0,005), "болезненное мочеиспускание" х2(1)=12,9; p<0,001), "подтекание мочи каплями" х2(1)=6,3; p<0,012). Терапия исследуемым препаратом способствовала значимому уменьшению доли пациентов, отмечающих "невозможность быстро начать мочеиспускание" х2(1)=20,5;p<0,001), "чувство неотложности мочеиспускания" х2(1)=11,8; /p<0,001). Кроме того, статистически значимые отличия были получены в отношении обструктивной симптоматики: "ослабление струи мочи" (х2(1)=21,9; /К0,001) — по сравнению с исходным состоянием, "ощущение неполного опорожнения мочевого пузыря" (х2(1)= 14,7;p<0,001) - при сравнении с плацебо-терапией. Следствием снижения степени выраженности дизурии было значимое улучшение ночного сна к окончанию терапии х2(1)=9,8; p<0,002).
По истечении 3 мес. приема афалы параллельно с уменьшением выраженности симптомов АПЖ повышалась максимальная скорость мочеиспускания (+2,9 мл/с; +30,2%), за 6 мес. лечения среднее значение Qmax возросло от исходных 9,3±2,9 мл/с до 14,1 ±5,7 мл/с (+4,8 мл/с; +51,6%) (табл. 1). Однако значимых различий (из-за малочисленности выборки пациентов) по сравнению с группой плацебо к окончанию курса терапии зарегистрировать не удалось. При оценке изменений среднего объема остаточной мочи и индекса качества жизни (QoL) была получена аналогичная, но статистически незначимая динамика: к концу периода терапии до 18,9% снизился удельный вес пациентов, у которых по результатам ТРУЗИ определялась остаточная моча; индекс QoL возрос более чем на 20%.
Таблица 1
Динамика показателей Qmax, QoL и ICSex в процессе лечения
| Группа | Визит -1 (скрининг) | Визит 1 (1 мес.) | Визит 3 (3 мес.) | Визит 6 (6 мес.) |
| Qmax, мл/с | ||||
| Афала (n=54) | 9,3±2,9 | 10,8±5,2 | 12,2±5,2 | 14,1 ±5,7 |
| Плацебо (n=29) | 8,8±3,3 | 10,3±6,2 | 11,4±6,5 | 13,2±7,4 |
| Индекс качества жизни (QoL), баллы | ||||
| Афала (n=55) | 3,5± 1,3 | 3,3±1,3 | 2,8± 1,3 | 2,7± 1,46 |
| Плацебо (n=29) | 3,4±1,3 | 3±1,3 | 3±1,4 | 2,6±1,4 |
| Показатель опросника ICSex, баллы | ||||
| Афала (n=53) | 18±5 | 17,6±4,2 | 17,4±4,5 | 16,4±4,5 |
| Плацебо (n=29) | 17,9±5,8 | 17,5±5,2 | 17,2±5 | 16,7±4,2 |
Установлено, что афала не оказывала негативного влияния на состояние сексуальной функции пациентов. Напротив, оценка ответов на вопросы опросника International Sexual Function Questionnarie (ICSex) [14] в группе активного препарата имели слабоположительную динамику, которая не достигала статистически значимых отличий от результатов плацебо-терапии (табл. 1).
Лабораторный мониторинг, проводимый 1 раз в 3 мес, свидетельствовал об отсутствии влияния приема афалы на содержание различных форм ПСА (общего, свободного и комплексного) в течение всего периода лечения. Концентрация общего и свободного тестостерона, дегидротестостерона и пролактина сыворотки крови колебалась в пределах нормальных значений (табл. 2).
Таблица2
Содержание различных форм ПСА и гормонов в сыворотке крови на фоне терапии
| Группа | Визит-1 (скрининг) | Визит 3 (3 мес.) | Δ 3 мес. от исходного, % | Визит 6 (6 мес.) | Δ 6 мес. от исходного, % |
| ПСА общий, нг/мл | |||||
| Афала | 1,7±1,1 | 1,8± 1,3 | 5,9 | 1,9± 1,4 | 11,8 |
| Плацебо | 1,6± 1,23 | 1,5± 1,2 | -6,3 | 1,5±1,2 | -6,3 |
| ПСА свободный, нг/мл | |||||
| Афала | 0,5±0,3 | 0,5±0,4 | - | 0,5±0,4 | - |
| Плацебо | 0,4±0,3 | 0.4±0,3 | - | 0,4±0,3 | - |
| ПСА комплексный, нг/мл | |||||
| Афала | 1,2±0,9 | 1,2±0,9 | - | 1,3±1,1 | 8,3 |
| Плацебо | 1,1±1 | 1,1±1 | - | 0,9±1 | -18,2 |
| Тестостерон общий, нг/мл (2,8—8) | |||||
| Афала | 4,2±1,7 | 4,1 ±1,6 | -2,4 | 4,3±1,9 | 1,6 |
| Плацебо | 4,5±2,1 | 4,9±1,8 | 15 | 4,8±1.9 | 14 |
| Тестостерон свободный, нг/мл (6,2—28,1) | |||||
| Афала | 6,0±2,2 | 7,1 ±3,2 | 19,3 | 8,3±3,8 | 38,9 |
| Плацебо | 7,7±2,8 | 10±5,5 | 55 | 8,1 ±3,9 | 13,1 |
| Дигидротестостерон, пг/мл (250—990) | |||||
| Афала | 597,9±415,8 | 645,7±504,3 | 8 | 714,9±633,2 | 19,6 |
| Плацебо | 549,5±299,6 | 744,6±766 | 10,4 | 633,7±418,4 | 13,4 |
| Пролактин, мкг/л (2,58—18,12) | |||||
| Афала | 9,9±9,2 | 9,8±4,8 | -1,8 | 10,4±6,1 | 4,3 |
| Плацебо | 9±4 | 8,9±4 | 2,1 | 9,2±5,3 | 7,4 |
В ходе исследования не было зарегистрировано нежелательных эффектов либо отклонений биохимических показателей, изменений в клинических анализах крови и мочи, связанных с проводимой терапией, что наряду с показателями уровней ПСА и гормонов подтверждало безопасность проводимой в течение 6 мес. терапии.
Обсуждение. Результаты исследования демонстрируют, что лечение афалой в дозировке 2 таблетки 4 раза в день в течение 6 мес. эффективно и безопасно для пациентов с АПЖ I—II стадий.
Эффективность терапии афалой проявилась в значимом снижении степени выраженности нарушений мочеиспускания по отношению к исходному показателю и по сравнению с плацебо-терапией. Уменьшая выраженность дизурии, прием афалы приводил к увеличению доли пациентов со слабой выраженностью симптомов АПЖ (суммарный балл по шкале IPSS<8) к окончанию периода лечения. Наиболее выраженные терапевтические эффекты препарата зарегистрированы в отношении ирритативной симптоматики АПЖ.
Максимальная скорость мочеиспускания по данным урофлоуметрии через 6 мес. лечения афалой возрастала более чем на 50% (+4,8 мл/с). Из-за малочисленности выборки пациентов, участвовавших в данном исследовании, значимых различий по сравнению с группой плацебо выявить не удалось. Однако стоит отметить, что аналогичные результаты дает терапия а-адреноблокторами. Для сравнения: 4-месячный прием тамсулозина приводит к увеличению Qmax на 4,9—5,2 мл/с [15], а 6 мес. лечения теразозином — на 2,6—2,9 мл/с [16].
Проведенное исследование показало, что курс лечения афалой имеет стойкое последействие: результаты отсроченного обследования свидетельствовали о надежном восстановлении функциональных нарушений со стороны нижних мочевыводящих путей. Значимая клиническая эффективность препарата, зарегистрированная на первом после начала терапии визите, сохранялась не только на протяжении всего 6-месячного курса терапии, но и спустя 3 мес. после его окончания.
Отмеченные эффекты терапии, очевидно, являются следствием модулирующего воздействия анти-ПСА на функциональную активность молекулы-мишени — калликреина 3 (KLK3) — компонента калликреин-кининовой системы, играющего важную роль в регуляции различных процессов на клеточном, тканевом и органном уровнях [17]. Показано влияние KLK3 на внутрисосудистую коагуляцию, формирование эндотелиоцитов, тканевую перфузию, оксигенацию клеток, функции инсулиноподобных факторов роста (IGF-I, IGF-II) и связывающих их белков (IGFBP-II, IGFBP-III), пролиферацию Т-лимфоцитов и созревание дендритных клеток, секрецию у-интерферона NK-клетками и др. [18— 24]. Положительное влияние препарата на пациентов с АПЖ связано прежде всего с улучшением гемоциркуляции и трофических процессов в предстательной железе и нижних отделах мочевыводящих путей [2,4, 10], что опосредованно сказывается на клинических проявлениях заболевания.
Позитивная динамика в симптоматике АПЖ сопровождалась улучшением качества жизни пациентов (увеличением индекса QoL на 23% за полгода), нормализацией ночного сна. Длительный прием афалы, по мнению пациентов (опросник ICSex), не имел негативных последствий и не влиял на их сексуальную функцию.
Важным моментом исследования была оценка влияния 6-месячной терапии афалой на показатели ПСА и гормонального профиля. Содержание общего, свободного и комплексного ПСА в крови оставалось в пределах нормы в течение всего периода лечения, что является значимым показателем безопасности терапии. Отсутствие изменений концентрации ПСА на фоне длительного приема афалы позволяет проводить динамическое наблюдение пациентов с АПЖ и мониторинг уровня ПСА с целью ранней диагностики рака простаты по общепринятым стандартам в отличие, например, от терапии ингибиторами 5а-редуктазы [25, 26]. Шестимесячный прием афалы не оказывал клинически значимого негативного влияния на гормональный статус пациентов, включая уровни тестостерона (общего и свободного), дигидротестостерона, пролактина, что также является показателем безопасности терапии.
Заключение. Таким образом, апробированная в ходе данного исследования схема лечения может быть рекомендована для применения в клинической практике. Постепенное развитие клинического эффекта обусловливает целесообразность длительного курсового приема афалы, а стойкое последействие свидетельствует о значимом корригирующем влиянии препарата на уродинамику нижних мочевыводящих путей. Результаты исследования подтвердили, что афала является эффективным, безопасным и надежным лекарственным средством в лечении пациентов с АПЖ I—II стадий.
ЛИТЕРАТУРА:
1. Guidelines on the Treatment of Non-neurogenic Male LUTS. M. Oelke, A. Bachmann, A. Descazeaud, M. Emberton, S. Gravas, M.C. Michel, J. N'Dow, J. Nordling, J.J. de la Rosette. European Association of Urology 2011
2. Борисов В. В., Ткачук В.Н. Опыт клинического применения препарата афала в лечении больных хроническим абактериальным простатитом // Сборник трудов I съезда Белорусской ассоциации урологов. Минск, 2008, С. 160—161.
3. Боровская Т.Г., Фомина Т.И., Лоскутова О.П., Эпштейн О. И. Афала — новый препарат для лечения заболевания предстательной железы // Тез. докл. IX Российского национального конгресса "Человек и лекарство". М., 2002. С. 587.
4. Горпинченко И.И., Гурженко Ю.Н., Корниенко А.М. и др. Исследование клинической эффективности препарата афала в лечении мужчин с хроническим абактериальным простатитом, осложненным нарушениями мочеиспускания. Здоровье мужчины. 2009; 1 (28):90—93.
5. Гудков А.В. Опыт длительного применения афалы при доброкачественной гиперплазии предстательной железы. Бюл. экспер. биол. Приложение. 2009; 148(8):57—60.
6. Мартюшев-Поклад А.В., Хейфец И.А., Фролов М.Ю., Мухин А.Б., Савельева К.В., Тарасов С.А., Дугина Ю.Л., Сергеева С.А., Эпштейн О. И. Клиническое исследование афалы — нового препарата на основе антител для лечения доброкачественной гиперплазии предстательной железы // Тез. докл. IV Международного конгресса "Доказательная медицина -основа современного здравоохранения". Хабаровск, ИПКСЗ. 2005:167-168.
7. Мухин А.Б., Фролов М.Ю. Клиническая эффективность препарата Афала в качестве средства лечения доброкачественной гиперплазии предстательной железы // Тез. докл. Третьей Международной конференции "Клинические исследования лекарственных средств". М., 2003:282—284.
8. Неймарк А.И., Яковец Я.В., Симашкевич А.В. и др. Применение препарата афала в урологической практике. Урология. 2009;3:67-70.
9. Павлов В.Н., Удут В.В., Савельева К.В. и др. Результаты мультицентрового клинического исследования эффективности и безопасности афалы при доброкачественной гиперплазии предстательной железы. Сборник материалов XIV Российского национального конгресса "Человек и лекарство". М., 2007:773.
10. Ткачук В.Н. Применение афалы в лечении хронического абактериального простатита. Бюллетень экспериментальной биологии и медицины. Приложение. 2009; 148(8):61—63.
11. Dugina J., Savelieva K.V., Sergeeva S.A. et al. A novel Antibody-based Therapeutic for Benign Prostate Hyperplasia: Results of a Randomized Clinical Trial. Can. J. Clin. Pharmacol. 2008; 15(3):e432—433.
12. Martyushev-Poklad A., Petrov V, Dugina J. et al. A novel oral antibody therapeutic for treatment of BPH: primary findings of a controlled clinical trial. In. Proceedings of the VIIIth International Congress of Andrology, Medimond, Bologna, Italy. 2005a: 183-188.
13. Руководство по урологии: в 3 т. / Авдошин В. П., Асламазов Э.А., Горюнов В.Г. и др. Под ред. акад. РАМН Н. А. Лопаткина. М.: Медицина, 1998. Т. 3.
14. Frankel S.J., Donovan J.L., Peters T.J. et al. Sexual dysfunction in men with lower urinary tract symptoms. J. Clin. Epidemiol. 1998;51:677-685.
15. Chung J.W., Choi S.H., Kim B.S. Efficacy and Tolerability of Tamsulosin 0.4 mg in Patients with Symptomatic Benign Prostatic Hyperplasia. Korean J. Urol. 2011;52:479-484.
16. Hytrin (Terazosin Hydrochloride) - Description and Clinical Pharmacology.
17. Lawrence M.G., Lai J., Clements J. Lawrence M.G. et al Kallikreins on steroids: structure, function, and hormonal regulation of prostate-specific antigen and the extended kallikrein locus. Endocr Rev. 2010;31 (4):407—446.
18. Volkel Т., Heidtmann H.H., Muller R. et al. Engineering of human coagulation factor X variants activated by prostate-specific antigen. Mol. Biotechnol. 2005;29( 1): 19—30.
19. Heidtmann H.H., Nettelbeck D.M., Mingels A. et al. Generation of angiostatin-like fragments from plasminogen by prostate-specific antigen. Br. J. Cancer. 1999;81 (8): 1269— 1273.
20. Koistinen H., Wohlfahrt G., Mattsson J. et al. Novel small molecule inhibitors for prostate-specific antigen. Prostate. 2008;68:1143— 1151.
21. Sun X.Y., Donald S.P., Phang J.M. Testosterone and prostate-specific antigen stimulate generation of reactive oxygen species in prostate cancer cells. Carcinogenesis. 2001;22:1775-1780.
22. Roddam A.W., Allen N.E., Appleby P. et al. Insulin-like Growth Factors, Their Binding Proteins, and Prostate Cancer Risk: Analysis of Individual Patient Data from 12 Prospective Studies. NIH-PA Author Manuscript. Ann Intern Med. 2008;149(7):461-W88.
23. Oliver S.E., Barrass B., Gunnell D.J. et al. Serum Insulin-Like Growth Factor-I Is Positively Associated with Serum Prostate-Specific Antigen in Middle-Aged Men without Evidence of Prostate Cancer. Cancer Epidemiol Biomarkers Prev 2004;13:163-165.
24. Kodak J.A., Mann D.L., Klyushnenkova E.N. et al. Activation of innate immunity by prostate specific antigen (PSA). Prostate. 2006; 66:1592-1599.
25. Пушкарь Д.Ю., Бормотин А.В., Раснер П.И. АВОДАРТ® (дутастерид) - новый ингибитор 5-альфа-редуктазы I и II типов. Фарматека. 2006;5(120).
26. Gravas S., Oelke М. Current status of 5a-reductase inhibitors in the management of lower urinary tract symptoms and BPH. World J Urol. 2010;28: 9-15.
