Болезнь Паркинсона как нейропсихиатрическое заболевание
Статьи Опубликовано в журнале:«НЕВРОЛОГИЯ/РЕВМАТОЛОГИЯ»; № 2; 2011; стр. 18-22.
О.С.Левин
ГОУ ДПО Российская медицинская академия последипломного образования, Москва
В «Эссе о дрожательном параличе» Дж.Паркинсон (J.Parkinson) в 1817 г. блестяще описал двигательные нарушения у наблюдаемых им пациентов, попутно указав, что «их чувства и интеллект не страдают». Вместе с тем, у больного, которого Паркинсон имел возможность наблюдать длительно, он отметил признаки меланхолии. Таким образом, аффективные нарушения отмечены уже в первом описании заболевания.
Структура и частота аффективных нарушений
Спектр аффективных нарушений при болезни Паркинсона (БП) широк и включает:
Аффективные нарушения (прежде всего депрессия или тревога) могут проявляться уже на ранней стадии, оказывая негативное влияние на качество жизни больных в течение всего заболевания [1, 2].
Депрессия
Депрессия - одно из самых частых нейропсихиатрических проявлений БП. По данным разных исследований, частота депрессии у больных с БП варьирует в широких пределах от 4 до 76% в среднем у 40% пациентов [3, 4].
Симптомы депрессии могут предшествовать моторным проявлениям БП, к тому же их выраженность не коррелирует с тяжестью последних, поэтому угнетенное настроение нельзя считать лишь психологической реакцией на тяжелое инвалидизирующее заболевание, хотя данный фактор может иметь значение, особенно на ранних стадиях заболевания. Основной причиной депрессии при БП, по-видимому, служат нейрохимические изменения, связанные с недостаточностью серотонинергической, норадренергической и дофаминергической (мезолимбической), а возможно, и холинергической систем [5].
Клинически депрессия при БП проявляется угнетенным настроением, ангедонией (утратой способности получать удовольствие от ранее субъективно приятных событий или действий), чувством вины и жизненного краха, низкой самооценкой, пессимистической оценкой прошлого и будущего, повышенной тревожностью и раздражительностью, быстрой утомляемостью, суицидальными намерениями. В целом структура симптомов депрессии при БП отличается от проявлений первичной депрессии - в частности, меньшей представленностью печали, чувства вины, самобичевания. Нечасто при БП встречаются и суицидальные попытки. С другой стороны более выраженными когнитивными нарушениями и раздражительностью [6]. У больных с моторными флуктуациями выраженность депрессии может усиливаться в период прекращения действия очередной дозы препарата леводопы, в части случаев на фоне моторных флуктуаций отмечаются закономерные колебания между депрессией и маниакальным состоянием.
По мере прогрессирования заболевания клиническая структура депрессии может претерпевать изменения - в ней все более значимое место занимают симптомы апатии.
Депрессия служит одним из основных факторов снижения качества жизни пациентов и ухаживающих за ними лиц и может быть причиной кажущейся резистентности к противопаркинсонической терапии. Трудности диагностики депрессии во многом определяются тем, что некоторые двигательные проявления БП напоминают классические проявления депрессии (маскообразное лицо, психомоторная заторможенность, снижение массы тела, нарушения сна). Эти моторные проявления «маскируют» симптомы депрессии, и она может остаться нераспознанной. В связи с этим клиницисты должны иметь высокую степень настороженности в отношении возможной депрессии у всех пациентов с БП, независимо от стадии и длительности заболевания.
Для скрининга депрессии можно использовать краткую (15-пунктную) версию Гериатрической шкалы депрессии (ГШД-15): если по этой шкале пациент набирает 5 баллов и более, то необходим тщательный клинический осмотр, в процессе которого диагноз депрессии может быть подтвержден или отвергнут. Клинически значимый синдром депрессии, по данным психиатрического обследования, выявляется лишь у 30-60% пациентов, имеющих высокую оценку по ГШД.
При выявлении депрессии важно определить, не связана ли она с колебаниями эффекта препаратов леводопы в течение дня (флуктуациями): симптомы депрессии нередко возникают в периоде «выключения» и при коррекции флуктуаций могут существенно ослабляться. Важно исключить и другие причины вторичной депрессии (для этого необходимы клинический анализ крови, печеночные тесты, уровень в крови тестостерона и гормонов щитовидной железы, тщательное выяснение лекарственного анамнеза) [7].
Одним из первых шагов в лечении депрессии является изменение противопаркинсонической терапии, которая предполагает коррекцию моторных флуктуаций и назначение агонистов дофаминовых рецепторов - АДР (прамипексола, пирибедила). Действуя через дофаминовые рецепторы D3-типа, локализованные в лимбической системе, АДР способны уменьшать выраженность симптомов депрессии, особенно на ранней стадии заболевания. Норадренергический эффект пирибедила может оказывать дополнительное позитивное влияние на симптомы депрессии. У больных с умеренно выраженной депрессивной симптоматикой антидепрессивный эффект АДР сопоставим с действием селективных ингибиторов обратного захвата серотонина (СИОЗС). Если коррекция противопаркинсонической терапии не привела к достаточному ослаблению симптомов депрессии, показано назначение антидепрессантов.
В целом эффективность антидепрессантов при БП с депрессией ниже, чем у пациентов с первичной депрессией. В контролируемых исследованиях у пациентов с БП доказана эффективность лишь трициклических антидепрессантов. У части больных, преимущественно молодого возраста, с выраженным тремором покоя, слюнотечением, симптомами гиперактивного мочевого пузыря, нарушением сна назначение трициклических антидепрессантов (например, амитриптилина или кломипрамина) может быть оправданно, однако у больных, нуждающихся в применении антидепрессантов, трициклические препараты могут вызывать неприемлемые побочные эффекты, включая усугубление когнитивных нарушений, провоцирование психотических расстройств, ортостатической гипотензии, дневной сонливости, и могут рассматриваться как препараты второго выбора [3, 4].
В связи с этим более безопасными у пожилых являются СИОЗС (например, сертралин или циталопрам). Дополнительным доводом в пользу этих препаратов могут быть сопутствующие тревожные расстройства. Альтернативой могут быть также ингибиторы обратного захвата серотонина и норадреналина (СИОЗСН) (например, венлафаксин) или агомелатин (вальдоксан), который способствует восстановлению нормального суточного ритма сон-бодрствование. К препаратам второго выбора могут быть отнесены миансерин и миртазапин, показанные прежде всего у пациентов с выраженным нарушением сна, а также ингибитор моноамирноксидазы (МАО) типа А моклобемид, чаще применяемый при наличии более выраженного апатического компонента. У пациентов с БП следует избегать неселективных ингибиторов МАО, так как при одновременном приеме леводопы возникают предпосылки к развитию гипертонических кризов. Следует соблюдать осторожность при комбинации антидепрессантов с ингибитором МАО типа В селегилином в виду угрозы серотонинового синдрома. При применении другого ингибитора МАО В разагилина не рекомендуется использовать два препарата из группы СИОЗС (флуоксетин и флувоксамин).
У недементных больных наиболее эффективный метод коррекции депрессивной симптоматики - сочетание антидепрессантов с АДР У больных с депрессией и деменцией показано дополнительное назначение ингибиторов холинэстеразы (ИХЭ), при сопутствующих психотических нарушениях - атипичные нейролептики. Нефармакологическое лечение депрессии при БП включает психотерапию (наиболее эффективна когнитивно-поведенческая терапия) и транскраниальную магнитную стимуляцию (ТМС). Эффективность ТМС при депрессии у больных с БП предстоит подтвердить в контролируемых исследованиях. В резистентных случаях последним ресурсом остается электросудорожная терапия [3, 4].
Алгоритм лечения депрессии у больных БП представлен в табл. 1.
Таблица 1
Алгоритм лечения депрессии при БП
| Шаг 1 | Диагностика депрессии с помощью скрининговой шкалы (ГШД15≥5) и клинического исследования (!). Оценка сопутствующих факторов (тяжесть заболевания, связь с лекарственными флуктуациями, когнитивными нарушениями, особенностями личности и т.д.) |
| Шаг 2 | Оптимизация противопаркинсонической терапии: уменьшение выраженности двигательного дефекта, коррекция флуктуаций, назначение агонистов D2/Dз-рецепторов (прамипексол, пирибедил), рациональная психотерапия |
| Шаг 3 | При сохранении признаков депрессии: СИОЗС (например, сертралин) или СИОЗСН (например, венлафаксин), в том числе в комбинации с АДР. При получении эффекта длительный прием антидепрессанта не менее 6 мес |
| Шаг 4 | Через 6 нед: при регрессе симптомов продолжить прием антидепрессанта в избранной дозе, при частичном улучшении -увеличить дозу до максимальной, в отсутствие эффекта - назначить антидепрессант из другой группы (например, трициклический антидепрессант, миртазапин или моклобемид) |
| Шаг 5 | Через 3 мес при наличии эффекта продолжить прием антидепрессанта, при частичном улучшении - добавить антидепрессант из другой группы или вспомогательные средства (АДР, нормотимик, например, карбамазепин, при деменции - ИХЭ или мемантин, при психозе - атипичный нейролептик) |
| Шаг 6 | Через 6 мес: при наличии стойкого эффекта рассмотреть вопрос о целесообразности пробной отмены антидепрессанта, при частичном улучшении или неэффективности - использовать комбинацию 2 антидепрессантов, добавить вспомогательные средства; транскраниальная магнитная стимуляция |
| Шаг 7 | Рассмотреть вопрос о целесообразности электросудорожной терапии |
Тревога
Тревога у больных с БП наблюдается в 40% случаев и может возникать в рамках панического синдрома, фобических расстройств, генерализованного тревожного расстройства. Она может отмечаться в структуре симптомов депрессии либо представлять собой самостоятельное расстройство. Как и депрессия, тревожные расстройства могут предшествовать моторным проявлениям БП. Повышенная тревожность - одна из характерных черт так называемой паркинсонической личности.
У больных с моторными флуктуациями уровень тревожности нередко колеблется в зависимости от фазы действия препарата леводопы. Иногда симптомы тревоги развиваются при относительной передозировке дофаминергических средств [4].
Лечение тревоги включает психотерапевтические мероприятия, применение СИОЗС, короткие курсы бензодиазепинов (например, алпразолама или клоназепама). Следует учитывать, что при применении бензодиазепинов повышается риск падений, могут усугубляться когнитивные, вегетативные нарушения, нарушения сна и даже ограничение подвижности.
Апатия
Апатия - одно из самых частых аффективных расстройств при БП, характеризующееся утратой мотивации, интереса к окружающему, снижением инициативы, эмоциональной тупостью, индифферентностью. Ее частота колеблется от 7 до 70%. Она может возникать в структуре депрессии, но нередко отмечается независимо от нее (не менее чем у 14% больных). Симптомы апатии могут быть выражены уже в дебюте заболевания, однако по мере прогрессирования заболевания они имеют тенденцию к нарастанию. Основные признаки апатии:
В отличие от депрессии, для апатии как самостоятельного синдрома не характерны тоскливый и тревожный аффекты. Тем не менее симптомы депрессии и апатии широко перекрываются, что нередко приводит к ошибочным диагностическим заключениям и неправильной терапии. Так, например, ангедония может наблюдаться как при депрессии, так и при апатии (но вряд ли ее можно рассматривать как самостоятельное расстройство!). Дифференциально-диагностические признаки депрессии и апатии представлены в табл. 2. Отмечена корреляция тяжести апатии с повышенной дневной сонливостью, хронической усталостью, выраженностью когнитивной дисфункции, но не с уровнем двигательных нарушений. Предполагают, что в развитии апатии играет роль нарушение дофаминергической иннервации прилежащего ядра. Тем не менее признаки апатии плохо поддаются лечению дофаминергическими препаратами, что указывает на участие других нейромедиаторных систем, прежде всего норадренергической и холинергической [6].
Таблица 2
Дифференциальная диагностика депрессии и апатии
| Признак | Апатия | Депрессия |
| Угнетенное настроение (тоска) | - | ++ |
| Ангедония | + | ++ |
| Снижение интереса к происходящему/безучастность | ++ | + |
| Психомоторная заторможенность | + | + |
| Низкая мотивация/утрата инициативы | ++ | + |
| Чувство вины, безнадежности, мысли о смерти | - | + |
| Критика | - | + |
| Тревога | - | + |
| Вегетативные симптомы | - | + |
| Когнитивные нарушения | ++ | + |
| Лечение | ИХЭ, дофамино- и норадреномиметики | Антидепрессанты |
С нейроанатомической точки зрения эмоциональный компонент апатии может быть связан с дисфункцией орбитофронтальной коры, а ее когнитивный компонент - с дисфункцией дорсолатеральной префронтальной коры. Апатия также связана с дофаминергической денервацией миндалины.
Апатия относительно резистентна к существующим психофармакологическим воздействиям. Некоторую пользу могут принести ингибиторы холинэстеразы (например, галантамин или ривастигмин). При гипоандрогенемии у мужчин возможно применение тестостерона [4].
Поведенческие нарушения как осложнения дофаминергической терапии
На фоне длительной дофаминергической терапии примерно у 10% пациентов с БП развиваются сложные нарушения поведения, которые обозначаются как импульсивно-компульсивные расстройства. Они представлены тремя синдромами: синдромы нарушения импульсного контроля, синдромы дофаминовой дизрегуляции, сложное стереотипное поведение.
Синдромы нарушения импульсного контроля характеризуются патологическим пристрастием к азартным играм (лудиомания), совершению бессмысленных покупок в магазинах (компульсивный шопинг), часто приводящему к значительным финансовым потерям, а также гиперсексуальностью (сексуальной расторможенностью) и булимией. Все эти расстройства поведения объясняются утратой способности подавлять сильные внешние импульсы в связи с нарушением внутреннего контроля.
Синдром дофаминовой дизрегуляции проявляется бесконтрольным (компульсивным) приемом препаратов леводопы и других дофаминергических средств. На пике дозы у таких пациентов возникают особый душевный подъем, эйфория или маниакальные проявления. При этом пациенты принимают следующую дозы леводопы, когда чувствуют малейшую дисфорию, связанную с ослаблением действия предыдущей дозы. В результате суточная доза леводопы оказывается явно избыточной, однако пациенты, нередко испытывающие дискинезии, категорически отказываются снижать дозу и предпринимают все усилия, чтобы достать дополнительное количество препарата. По своим клиническим характеристикам данный синдром приближается к синдрому зависимости от психофармакологических средств. В основе синдрома дофаминовой дизрегуляции лежит дисфункция системы положительного подкрепления, связанная с денервацией прилежащего ядра и развитием денервационной гиперчувствительности его нейронов.
Пандинг является вариантом поведенческих стереотипий, проявляется бессмысленной сортировкой или раскладыванием тех или иных предметов в течение длительного времени. Различные формы импульсивно-компульсивных нарушений чаще развиваются у мужчин с ранним дебютом заболевания, страдающих депрессией. На фоне применения АДР данные расстройства возникают в несколько раз чаще, чем на фоне применения одной леводопы. Данное осложнение является класс-эффектом АДР и неспецифично для какого-либо одного препарата из данной группы, тем не менее у отдельных больных замена одного препарата на другой может приводить к регрессу симптомов.
Импульсивно-компульсивные нарушения можно рассматривать как «обратную сторону монеты» по отношению к апатии, поскольку они связаны с избыточной дофаминергической стимуляцией миндалины и тесно связанного с ней прилежащего ядра.
Лечение импульсивно-компульсивных нарушений предполагает объяснение пациенту АДР и его семье сути состояния, установление строгих правил поведения для пациента и его родственников, психологическую поддержку больного, упрощение схемы дофаминергической терапии. Если больной принимает, то в зависимости от ситуации его либо следует полностью отменить, либо существенно снизить его дозу, либо заменить на другой агонист. Одновременно могут быть назначены амантадин и атипичный нейролептик, а при наличии сопутствующей депрессии - антидепрессант. Атипичный нейролептик особенно показан при компульсивном поведении, однако описаны случаи, когда пандинг усиливался после назначения кветиапина. С другой стороны, пандинг иногда удается уменьшить с помощью кломипрамина или СИОЗС. В некоторых случаях полезно функциональное нейрохирургическое вмешательство (глубокая мозговая стимуляция), позволяющее оптимизировать схему противопаркинсонической терапии [4].
Нарушение распознавания эмоциональных состояний
Проведенное нами исследование и данные других авторов показали, что пациенты с БП часто ошибаются в интерпретации эмоциональных состояний изображенных людей. При этом выявлялась отчетливая тенденция к негативной оценке. Так, выражение безразличия и спокойствия рассматривалось как проявление страдания и скорби, а выражение удовольствия расценивалось как безразличие. Нарушение узнавания эмоциональных состояний было более выражено у пожилых больных и при наличии более выраженных двигательных и когнитивных расстройств. Уровень узнавания положительных эмоций позитивно коррелировал с выраженностью тревожности, не зависел от выраженности депрессивной симптоматики и наиболее тесно был связан со степенью апатии. С функциональной точки зрения нарушение распознавания эмоциональных состояний, также может отражать разобщение когнитивных и аффективных процессов с нейроанатомической - нарушение связей нижневисочной коры и миндалины. С нейрохимической точки зрения ослабление способности к распознаванию эмоциональных состояний при БП может быть связано с дофаминергической, норадренергичесой и, возможно, холинергической денервацией лимбических структур.
Аффективные нарушения после стереотаксических оперативных вмешательств на базальных ганглиях
В последнее десятилетие оперативное вмешательство на базальных ганглиях по типу глубокой стимуляции мозга стало одним из наиболее эффективных методов лечения тяжелых флуктуаций и дискинезий, а также резистентного к фармакотерапии тремора. Индивидуально подобранные параметры стимуляции позволяют добиться существенного регресса не только симптомов паркинсонизма, но и некоторых немоторных проявлений заболевания. Хотя в целом влияние глубокой стимуляции мозга на аффективный статус пациента является скорее позитивным, у некоторых больных симптомы депрессии, тревоги и апатия усиливаются или появляются заново.
По данным S.Thobois и соавт. (2010 г) из 63 больных с БП, которым проводилась хроническая стимуляция субталамического ядра, апатия развилась у 34 спустя в среднем 4,7 мес (у разных больных - от 2 до 7 мес; рис. 1), причем в 1/2 случаев она регрессировала к 12-му мес. Симптомы депрессии развились лишь у 17 больных, в среднем через 5,7 месяцев, как правило, на фоне ранее появившихся признаков апатии.
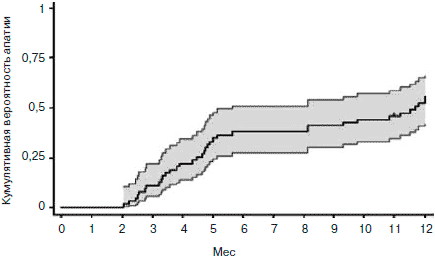
Рис. 1. Отставленное развитие апатии после начала стимуляции субталамического ядра и снижения дозы дофаминергических средств (по S.Thobois и соавт., 2010).
Состояние двигательных функций после операции существенно улучшилось, что позволило резко снизить дозу дофаминергической терапии в первые 2 нед после начала стимуляции на 82% (первоначалальная доза противопаркинсонических средств в пересчете на леводопный эквивалент составила 1617 мг, через 1 мес после начала стимуляции она снизилась до 288 мг). К концу 12 мес доза повысилась до 440 мг, за счет добавления АДР у 1/3 больных. Различий в дозе дофаминергических средств между пациентами с апатией и без апатии не отмечено.
Апатия чаще развивалась у пациентов, имевших исходно более выраженные немоторные флуктуации и тревогу, что указывает на их связь с мезокортиколимбической денервацией (рис. 2). Этот вывод был подтвержден данными позитронно-эмисионной терапии, согласно которым пациенты с послеоперационной апатией, тревогой и депрессией имели исходно более выраженную мезокортиколимбическую денервацию с вторичной дисфункцией префронатльных отделов мозга [8].
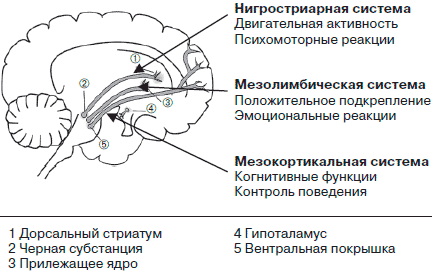
Рис. 2. Три основные дофаминергические системы.
Эффективность препарата Проноран® при послеоперационной апатии
Назначение препарата Проноран® (пирибедил) 12 пациентам с апатией, развившейся на фоне хронической стимуляции субталамического ядра, привело к статистически достоверному улучшению их аффективного статуса (табл. 3)
Таблица 3
Динамика аффективных нарушений на фоне приема пирибедила у пациентов, находящихся на хронической стимуляции субталамического ядра
| Параметр | Т0 (показаны средние значения) | Т12 (показаны средние значения) |
| Доза леводопы | 183 мг/сут | 225 мг/сут |
| Доза пирибедила | 0 | 242 мг/сут |
| UPDRS III | 18,9 | 18,2 |
| Апатия (оценка по шкале Starkstein) | 20,9 | 12,5* |
| Депрессия (оценка по шкале Бека) | 15,8 | 9,6** |
| Тревога (оценка по шкале Бека) | 11,3 | 5,6** |
Механизм действия пирибедила может быть связан не только с усилением дофаминергических влияний на лимбические структуры (за счет стимуляции D3-рецепторов), но и с усилением норадренергических влияний на лимбическую систему (за счет блокады пресинаптических α2-адренорецепторов).
Немоторный гиподофаминергический синдром
Частое выявление депрессии, апатии и тревоги у пациентов с ранней стадией БП, развитие этих симптомов в периоде «выключения» у пациентов с флуктуациями, нередкое их появление после оперативного вмешательства на фоне резкого снижения дозы дофаминергических средств, а также их регресс на фоне применения дофаминергических препаратов указывают на гиподофаминергическую природу этих расстройств. Апатия, депрессия и тревога тесно связаны с болевыми проявлениями, чувством усталости, дизрегуляторным когнитивным синдромом. Безусловно, каждое из этих проявлений имеет сложный гетерогенный характер и может быть связано с разными механизмами, тем не менее их сочетание нередко указывает на необходимость усиления дофаминергической терапии. В тех случаях, когда симптомы апатии или депрессии возникают в отсутствие выраженных когнитивных нарушений, одним из препаратов выбора может быть препарат Проноран®, преимущества которого связаны с возможностью влияния не только на дофаминергическую, но и на норадренергическую систему.
ЛИТЕРАТУРА
1. Глозман ЖМ., Левин О.С. Психические расстройства при экстрапирамидных заболеваниях. В кн: Экстрапирамидные расстройства. Руководство по диагностике и лечению. Под ред. ВНШтока и др. М.: Медпресс-информ, 2002; с.56-73.
2. Ardouin C, Chereau I, Llorca PM et al. Assessment of hyper- and hypodopaminergic behaviours in Parkinson’s disease. Rev Neurol 2009; 165: 845-56.
3. Левин О.С. Психические расстройства при болезни Паркинсона и их коррекция. В кн: Экстрапирамидные расстройства. Руководство по диагностике и лечению. М.: Медпресс-информ, 2002.
4. Ardouin C, Lhomme E, Thobois S et al. Piribedil improves apathy, depression and anxiety in Parkinson’s disease. Mov Disord 2009; 24 (Suppl. 1): S233.
5. Яхно Н.Н., Преображенская И.С. Проноран в лечении больных с ранними стадиями болезни Паркинсона. Неврол. журн. 2004; с. 34-8.
6. Глозман Ж.М., Левин О.С., Лычева НА. Нарушение эмоциональной памяти и способности к распознаванию эмоциональных состояний у больных с болезнью Паркинсона. Физиология человека. 2003; 6:55-60.
7. Левин О.С., Федорова Н.В. Болезнь Паркинсона. М., 2006.
8. Thobois S, Ardouin C, Lhomme E et al. Non-motor dopamine withdrawal syndrome after surgery for Parkinson’s disease: predictors and underlying mesolimbic denervation. Brain 2010; 133: 1111-27.
9. Левин О.С., Смоленцева ИГ., Цередсодном Б. и др. Влияние дофаминергической терапии на нейропсихологические функции у больных болезнью Паркинсона. Неврол. журн. 2004; 3:31-7.
10. Левин О.С. Диагностика и лечение депрессии при болезни Паркинсона. Атмосфера. 2006; 2:114-21.
11. Левин О.С. Когнитивные нарушения при болезни Паркинсона. М., 2008.
12. Aarsland D, Andersen K, Larsen JP et al. Prevalence and characteristics of dementia in Parkinson disease: an 8-year prospective study. Arch Neurol 2003; 60:387-92.
13. Aarsland D, Bronnik K, Eht U et al. Neuropsychiatric symptoms in patients with Parkinson disease and dementia: frequency, profile and associated care giver stress. J Neurol Neurosurg Psychiatry 2007; 78: 36-42.
14. Aarsland D, Marsh L, Schrag А Neuropsychiatric Symptoms in Parkinson’s Disease Movement Disorders 2009; 24:2175-86.
15. Dubois B. Resultats cognitife de l’eude Parkinson CONTROL. Drugs in Focus 2004; p. 19-22.
16. Pedersen KD, Alves G, Brнnnick K et al. Apathy in drug-naхve patients with incident Parkinson’s disease: the Norwegian ParkWest study. J Neurol 2009; DOI 10.1007/s00415-009-5297-x.
17. Robert P, Onyike СU, Leentjens AFG et al. Proposed diagnostic criteria for apathy in Alzheimer’s disease and other neuropsychiatric disorders. Eur Psychiatry 2009; 24:98-104.
