Практика применения новых наружных средств в лечении атопического дерматита у детей
СтатьиОпубликовано в журнале:
Клиническая дерматология и венерология, 1, 2010 Н.Г. Короткий1, Б.Н. Гамаюнов, А.А. Тихомиров2
Российский государственный медицинский университет, Российская детская клиническая больница, Москва
The practice of application of new topical agents to the treatment of atopic dermatitis in children
N.G. Korotky, B.N. Gamayunov, A.A. Tikhomirov State federal facility "Russian State Medical University", Moscow
Ключевые слова: атопический лерматит, наружная терапия, пелиатрическая практика, крем унилерм. Key words: atopic dermatitis, external therapy, pediatric practice, uniderm cream.
Среди всего многообразия средств для наружной терапии кортикостероидные препараты являются наиболее востребованными в силу быстроты развития и выраженности противовоспалительного действия. Можно отметить, что топические препараты глюкокортикостероиды (ГКС) являются одними из самых часто назначаемых пациентам с аллергодерматозами [1].
Доля аллергических поражений кожи в структуре детских заболеваний неуклонно увеличивается. Особенно тревожным является значительный рост аллергических болезней кожи с хроническим и рецидивирующим течением, торпидных к традиционной, в том числе наружной терапии. Среди аллергодерматозов у детей наиболее часто встречается атопический дерматит (АД) [2].
Проблема АД приобретает в последние годы все большее медико-социальное значение, распространенность заболевания неуклонно растет, составляя по некоторым данным в различных странах мира от 6 до 25%, а в России — до 35%. Кроме того, АД является фактором риска развития бронхиальной астмы у детей, поскольку поливалентная сенсибилизация, формирующаяся при АД, сопровождается не только локальным воспалением кожи, но и системным иммунным ответом с вовлечением в процесс различных разделов респираторного тракта [2, 3].
В настоящее время общепризнанна иммунологическая концепция патогенеза АД, основанная на понятии атопии как генетически обусловленной способности организма к выработке высокой концентрации общего и специфических антител класса IgE в ответ на действие аллергенов окружающей среды. Клинически АД характеризуется кожным зудом, возрастным полиморфизмом высыпаний, определенной локализацией, стадийностью и хроническим течением [2,4].
Ведущим механизмом развития АД является изменение соотношения между Т-хелперами первого (Thl) и Т-хелперами второго (Тп2) порядка в пользу последних, что приводит к изменению профиля их цитокиновой секреции и повышенной продукции общего и специфических антител класса IgE, которые фиксируются при помощи Fc-фрагментов к специфическим рецепторам на мембранах тучных клеток и базофилов. При повторном поступлении антиген распознается фиксированными на тучной клетке антителами, происходит активация тучной клетки с высвобождением преформированных медиаторов аллергии — гистамина, серотонина, кининов, которые обусловливают развитие ранней фазы аллергического ответа, проявляющейся у больных АД интенсивным зудом и гиперемией [4].
Затем воспалительный процесс приобретает хроническое течение, что определяется следующими механизмами. Т-клетки памяти способны мигрировать в кожу с последующей экспрессией на кератиноцитах, клетках Лангерганса и эндотелиоцитах, что поддерживает местную активацию Т-клеток. Повторное или постоянное воздействие аллергена вызывает как немедленную, так и позднюю фазы аллергического ответа, а также клеточную пролиферацию по Th-2 типу. В свою очередь клетки Th-2 продуцируют цитокины, которые, с одной стороны, обеспечивают постоянное повышение уровня IgE, а с другой, стимулируют эозинофилы, тучные клетки и макрофаги к высвобождению различных медиаторов воспаления [4].
Поддерживает хроническое течение АД и так называемый зудорасчесный цикл, поскольку зуд является его постоянным симптомом. Кератиноциты, повреждаемые при расчесывании кожи, высвобождают цитокины и медиаторы, которые привлекают клетки в места воспаления в коже. Все это вместе приводит к реализации аллергического воспаления с преимущественной локализацией в коже [4].
Однако воспалительные поражения кожи при АД могут развиваться без участия IgE, тем более что, по данным литературы, приблизительно у 25% больных АД уровень IgE не превышает норму. Безусловно, важную роль играют нейропептиды и лейкотриены, тучные клетки, эозинофилы, кератиноциты, нарушение барьерной функции эпидермиса. Тучные клетки, выделяющие при дегрануляции гистамин, протеазы, простагландины, лейкотриены, серотонин, расположены вблизи окончаний чувствительных нервов в коже и стимулируются не только интерлейкином (ИЛ-) 4, но и нейропептидами, при этом прослеживается возможность психического влияния на манифестацию АД. Эти факторы рассматриваются как особо важные неспецифические механизмы в патогенезе АД [4].
Таким образом, в развитии атопического дерматита участвуют не только иммунные, но и неспецифические (неиммунные) механизмы. Они вместе и определяют своеобразие реакции кожи на действие причинных факторов, выражающееся в особенностях иммунного ответа и гиперреактивности [5].
Секрет успешного применения топических ГКС в лечении АД заключается в их многообразном влиянии на процессы воспаления в коже [6].
Наиболее важными эффектами ГКС являются:
— увеличение связывания гистамина и серотонина в коже и уменьшение чувствительности нервных окончаний к нейропептидам и гистамину;
— угнетение синтеза ИЛ-4, ИЛ-5, ИЛ-13, у-интерферона и других цитокинов;
— уменьшение активности фосфолипазы А2 и продукции эйкозаноидов, а также снижение экспрессии молекул клеточной адгезии и чувствительности эндотелия к медиаторам аллергии;
— торможение миграции эозинофилов и пролиферации Т-лимфоцитов; снижение сосудистой проницаемости и нарушений микроциркуляции.
Однако, несмотря на все положительные эффекты топических ГКС, не следует забывать, что при неправильном их применении велика возможность развития как местных, так и системных побочных эффектов. К числу местных побочных эффектов, встречающихся при использовании наружных ГКС, относятся атрофия кожи; акнеформная сыпь, фолликулиты; периоральный дерматит; телеангиэктазии; стрии; гипертрихоз; присоединение вторичной инфекции.
Возможны также и системные побочные эффекты, такие как подавление функции коркового вещества надпочечников, задержка роста, синдром Иценко—Кушинга и др., которые, однако возникают очень редко.
В педиатрической практике при назначении отдается предпочтение негалогенизированным препаратам ГКС последнего поколения. Они обладают высокой эффективностью и безопасностью, возможностью применения 1 раз в сутки, в том числе у детей раннего возраста.
С целью оценки клинической эффективности, переносимости и безопасности мы изучали результаты применения крема Унидерм («Акрихин», Россия) в наружной терапии АД различной степени тяжести у детей в возрасте от 6 мес. до 17 лет. Нами были поставлены следующие задачи исследования:
- 1. Оценить безопасность, переносимость и терапевтический эффект крема Унидерм при лечении 30 детей с АД.
2. На ограниченной группе пациентов (п=10) изучить влияние крема Унидерм (мометазона фуроат) на функцию гипоталамо-гипофизарно-надпочечниковой системы (определение уровня кортизола в плазме крови до, через 1 и 2 нед. ежедневного применения крема Унидерм). - В данное исследование были включены 30 детей с различными клиническими формами АД (эритематозная,эритематозно-сквамознаяиэритематозно-сквамозная с лихенификацией) легкой, средней и тяжелой степени тяжести в возрасте от 6 мес. до 17 лет — 14 девочек и 16 мальчиков (табл. 1).
У всех детей был подтвержденный АД в состоянии обострения кожного процесса с легкой, средней или тяжелой степенью тяжести заболевания. Длительность заболевания у наблюдаемых детей колебалась от 5 мес до 16 лет.
В исследование не включали пациентов, не соответствующих указанному возрасту, а также пациентов, соответствующих критериям включения, но получающие системную и местную терапию основного заболевания следующими препаратами: ГКС (преднизолон, дексаметазон и др.); цитостатиками (циклоспорин); любыми топическими ГКС и их комбинациями, а также увлажняющими местными средствами менее чем за 7 дней до момента включения в исследование.
Крем Унидерм наносили на пораженные участки кожи 1 раз в день. Допускалось прекращение использования препарата в сроки после окончания 1-й или 2-й нед. от начала лечения при достижении у больного полной клинической ремиссии.
Таблица 1. Характеристика обследованных больных
|
Возраст |
Девочки |
Мальчики |
Всего |
|
От 6 мес. до 5 лет |
3 |
5 |
8 |
|
От 6 до 10 лет |
5 |
6 |
11 |
|
От 11 до 17 лет |
4 |
7 |
11 |
|
Всего больных |
12 |
18 |
30 |
Таблица 2. Распределение больных АД на группы
в зависимости от значения коэффициента SCORAD (kS) при первичном осмотре
|
Группы больных |
Степень тяжести заболевания (kS) |
Среднее значение (kS) |
Число больных |
|
1-я |
Легкая/ 0—20 |
17,4 |
9 |
|
2-я |
Средняя/20—40 |
27,2 |
11 |
|
3-я |
Тяжелая/ >40 |
64,5 |
10 |
|
Итого |
|
|
30 |
У 10 пациентов с тяжелой степенью тяжести АД крем Унидерм применяли ежедневно в течение 2 нед. До начала исследования, через 1 и 2 нед. наружной терапии у этих же больных брали кровь (определение уровня кортизона в плазме) для оценки влияния крема Унидерм на функцию гипоталамо-гипофизарно-надпочечниковой системы (системная безопасность).
Общая продолжительность исследования составила 3 нед. и включала первичный клинический осмотр с контрольными осмотрами через 1,2 и 3 нед. от начала лечения.
Кроме того, в процессе терапии больные по показаниям получали антигистаминные препараты, седативную микстуру, туширование расчесов 5% раствором перманганата калия или 1% раствором метиленового синего. В наружной терапии применялся только крем Унидерм.
Для объективной оценки степени тяжести течения заболевания и эффективности проводимой терапии у наблюдаемых детей мы использовали коэффициент SCORAD (kS). Этот коэффициент объединяет площадь поражения кожи, степень выраженности объективных (эритема, образование папул/ везикул, мокнутие, экскориации, лихенификация, сухость кожи) и субъективных (зуд кожи и/или нарушение сна) симптомов. При максимальной распространенности процесса и выраженности объективных и субъективных симптомов SCORAD= 103, а в их полное отсутствие SCORAD=0.
Используя коэффициент SCORAD (kS), объективно оценивали степень тяжести кожного процесса у каждого обследуемого ребенка: 0 < kS < 20 — легкая степень, 20 < kS < 40 — средняя степень, kS > 40 — тяжелая степень заболевания.
Для определения коэффициента SCORAD (kS) применяли специально разработанную компьютерную программу Калькулятор SCORAD.
На каждого больного была заведена индивидуальная карта, в которой оценивалась динамика кожного процесса в ходе исследования (kS до и после применения крема Унидерм).
Эффективность терапии оценивали по следующим параметрам: клиническая ремиссия, значительное улучшение, улучшение, без эффекта, ухудшение и отражали в виде графика изменения среднего значения SCORAD во времени на 8, 15 и 22-й дни от начала исследования для каждой степени тяжести заболевания. По горизонтали отмечали время лечения в днях, а по вертикали — среднее значение SCORAD (рис. 1).
Рис. 1. Динамика среднего значения kS у детей, страдающих атопическим дерматитом, в процессе 3-недельного исследования крема Унидерм.
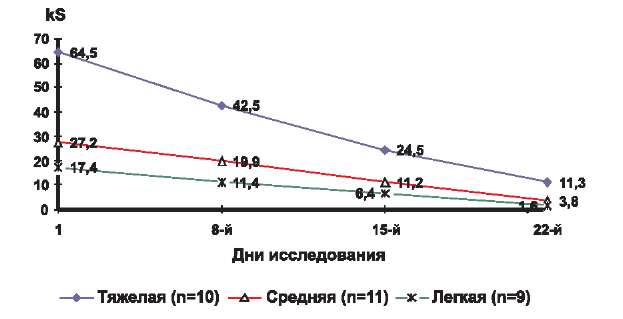
В соответствии с полученными значениями коэффициента SCORAD на первичном осмотре до начала лечения кремом Унидерм мы разделили всех участвовавших в исследовании детей (п=30) на 3 группы по степени тяжести течения кожного процесса (табл. 2).
В 1-ю группу — с легкой степенью тяжести течения заболевания (kS до 20) — вошли 9 больных со средним значением kS в целом по группе 17,4.
Во 2-ю группу вошли 11 пациентов со средней степенью тяжести кожного процесса. Среднее значение kS в целом по группе равно 27,2.
В 3-ю группу объединили 10 детей с тяжелым течением заболевания (kS > 40). Среднее значение kS в этой группе равнялось 64,5.
Клиническая картина АД у больных 1-й группы характеризовалась ограниченной площадью поражения кожных покровов. Патологический процесс локализовался в локтевых сгибах, подколенных ямках, периоральной области и был представлен слабо выраженной эритемой, единичными мелко папулезными элементами, экскориациями, умеренно выраженной сухостью кожи и мелко пластинчатым шелушением. Кроме того, отмечался незначительный зуд кожи и лихенификация в очагах поражения.
Среди преобладающих симптомов у пациентов 2-й группы мы выделили более интенсивный зуд кожи по сравнению с таковым в предыдущей группе больных, в ряде случаев сопровождающийся нарушением сна. Кожный процесс носил распространенный характер и локализовался на коже лица (периорбитальная и периоральная области), передней поверхности шеи, локтевых сгибах, сгибательной и разгибательной поверхностях лучезапястных суставов, подколенных ямках. Отмечалась более выраженная острота воспалительной реакции: умеренно выраженные эритема и отек, папулезные элементы ярко-красного цвета, серозно-геморрагические корочки, экскориации, трещины на фоне очагов лихенефикации, выраженной сухости кожи и значительного шелушения, как в очагах АД, так и на не пораженной коже.
У 10 детей, составивших 3-ю группу, патологический процесс локализовался на коже лица, передне- и заднебоковых поверхностей шеи, туловища, верхних и нижних конечностей, где на фоне значительно выраженной отечной эритемы отмечались многочисленные папулезные элементы, серозногеморрагические корочки, экскориации, трещины. При слиянии папулезных элементов отмечалась выраженная лихенификация кожи. Больные жаловались на интенсивный зуд кожи, который у 2 пациентов сопровождался выраженным нарушением сна.
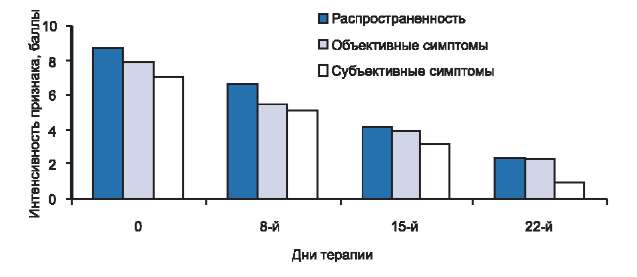
Из 10 детей с тяжелым течением заболевания (3-я группа) на 8-й день терапии мы отметили значительное уменьшение зуда и нормализацию сна у 2, а также уменьшение эритемы, папулезных элементов, экскориаций и площади поражения у всех 10, при этом kS снизился на 35% от исходного и составил 42,5 (см. рис. 1). К 15-му дню лечения у всех больных отмечалось дальнейшее уменьшение эритемы, отека, папулезных элементов, экскориаций и площади поражения, а также уменьшение сухости и зуда кожи, при сохранении умеренно выраженной лихенификации кожи в очагах поражения. При этом значение kS равнялось 24,5, что соответствует снижению показателя на 62%. На 22-й день терапии у детей этой группы kS составил 11,3 и снизился более чем на 80% от исходного уровня. Таким образом, нами отмечен переход тяжелого течения заболевания в легкую степень тяжести. Результат лечения расценен как клиническая ремиссия у 3 больных, значительное улучшение у 4 и улучшение у 3. У пациентов со значительным улучшением сохранялась легкая эритема или лихенификация кожи, а у больных с улучшением наблюдалось уменьшение распространенности кожного процесса (площадь поражения), интенсивности объективных (эритема, папулы, расчесы, лихенизация, ксероз) и субъективных (кожный зуд, нарушение сна) симптомов (рис. 2).
Рис. 2. Динамика распространенности, объективных и субъективных симптомов у больных с тяжелой степенью тяжести атопического дерматита в процессе исследования.
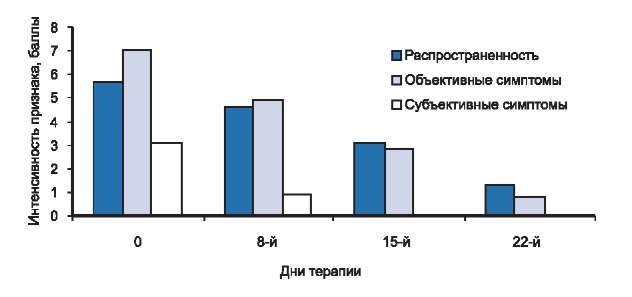
Из 11 детей со средней степенью тяжести заболевания у всех, начиная с первой недели лечения, мы отмечали положительную постоянную динамику, проявляющуюся в постепенном уменьшении зуда кожи, островоспалительных явлений, шелушения и сухости (см. рис. 1). Так, на 8-й день терапии у большинства пациентов отсутствовали жалобы на кожный зуд и нарушение сна, при этом kS, снизившись более чем на 26%, составил 19,9, что соответствовало легкой степени тяжести заболевания. К концу 2-й недели лечения отмечалась выраженная положительная динамика основных объективных симптомов и распространенности АД. У пациентов данной группы лечения отсутствовали экскориации, отмечались легкой степени выраженности эритема, папулезная инфильтрация, шелушение кожи. Таким образом, на 15-й день терапии kS уменьшился на 58% до 11,2. На момент окончания исследования (22-й день терапии) клиническая ремиссия была констатирована у 5 пациентов, значительное улучшение — у 5 и улучшение — у одного. В среднем по группе в процессе лечения kS снизился на 86% — с 27,2 до 3,8. У пациентов с клинической ремиссией проявлений АД не было, у больных со значительным улучшением на ограниченных участках кожи сохранялась легкая эритема или лихенификация. Пациент с улучшением не предъявлял жалоб на кожный зуд или нарушение сна, при этом у него сохранялись легкая эритема и лехенификация кожи подколенных сгибов (рис. 3).
Рис. 3. Динамика распространенности, объективных и субъективных симптомов у больных со средней степенью тяжести атопического дерматита в процессе исследования.
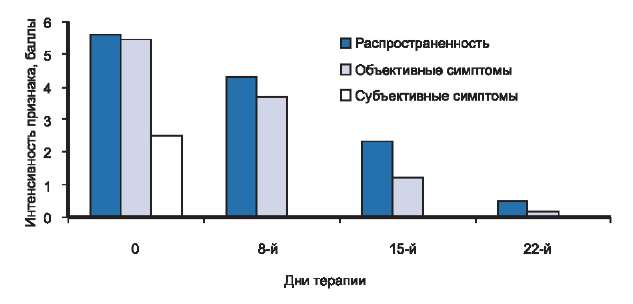
У всех 9 детей с легкой степенью тяжести заболевания мы отмечали выраженную положительную динамику кожного процесса, начиная с первых дней терапии кремом Унидерм (см. рис. 1). Уже с первых дней лечения у больных отсутствовали жалобы на кожный зуд, проявления заболевания были ограниченными, а их интенсивность уменьшилась. На 8-й день исследования kS уменьшился более чем на 34% и составил 11,4. К 15-му дню терапии наблюдалось уменьшение площади поражения, сухости, шелушения, разрешение островоспалительных явлений в очагах поражения. При этом kS, снизившись более чем на 62% от исходного, был равен 6,4. На 22-й день терапии клиническая ремиссия была констатирована у 7 человек, значительное улучшение — у 2. В среднем по группе kS снизился в процессе лечения более чем на 90% с 17,4 до 1,6. У большинства пациентов на момент окончания исследования проявлений АД не было, а у 2 больных сохранялась едва заметное шелушение в очагах поражения (рис. 4).
Рис. 4. Динамика распространенности, объективных и субъективных симптомов у больных с легкой степенью тяжести атопического дерматита в процессе исследования.
Обобщая результаты 3-недельного исследования крема Унидерм в терапии детей, больных АД легкой, средней и тяжелой степени тяжести, мы констатировали клиническую ремиссию у 15 детей (50,0%), значительное улучшение — у 11 (36,7%), улучшение — у 4 (13,3%) (табл. 3). Случаев развития побочных эффектов, осложнений, а также отсутствия клинического эффекта и/или ухудшения в течении заболевания на фоне наружной терапии кремом Унидерм не наблюдали.
Таблица 3. Клиническая эффективность применения крема Унидермв терапии детей, больных АД
|
Результат лечения |
Степень тяжести заболевания |
Всего детей |
||
|
легкая (и=9) |
средняя (л=11) |
тяжелая (и=10) |
||
|
Клиническая ремиссия |
7 |
5 |
3 |
15 |
|
Значительное улучшение |
2 |
5 |
4 |
11 |
|
Улучшение |
- |
1 |
3 |
4 |
|
Без изменений |
— |
|
— |
— |
|
Ухудшение |
|
|
|
_ |
|
Всего детей |
9 |
11 |
10 |
30 |
Переносимость крема Унидерм среди разных возрастных групп детей, больных АД, на протяжении всего курса лечения оценена нами как очень хорошая у 28 человек (93,3%) и как хорошая — у 2 (6,7%).
Для оценки системной безопасности у 10 детей с тяжелой степенью тяжести АД, ежедневно применявших крем Унидерм на очаги поражения 1 раз в день в течение 14 дней, определяли уровень эндогенного кортизола в сыворотке крови до начала лечения, а также после 1-й и 2-й недели его использования. Кровь для исследования брали у всех больных в одно и то же время — 8 ч. утра.
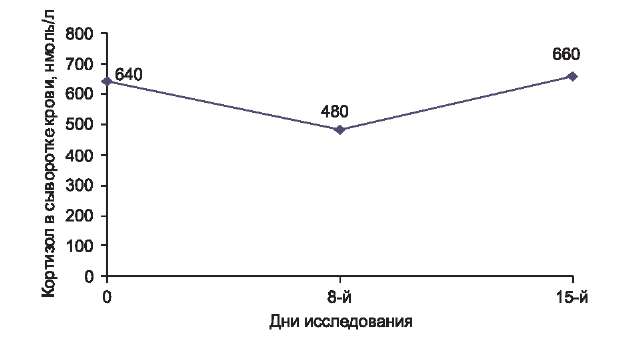
Уровень эндогенного кортизола в сыворотке крови у каждого из 10 обследуемых больных (табл. 4), а также его среднее значение для всех 10 пациентов (рис. 5) находились в пределах нормы (норма 230— 750 нмоль/л); следовательно, крем Унидерм не подавляет систему гипоталамус—гипофиз—надпочечники, что характеризует его высокую системную безопасность.
Таблица 4. Уровень эндогенного кортизола в сыворотке крови и его среднее значение у 10 больных с тяжелой степенью тяжести атопического дерматита, применявших крем Унидерм1 раз в день ежедневно в течение 2 нед
|
Показатель |
Уровень эндогенного кортизола в сыворотке крови, нмоль/л |
||
|
до начала лечения |
через 1 нед. применения |
через 2 нед. |
|
|
№ пациента: |
|
|
|
|
1 |
653 |
545 |
642 |
|
2 |
722 |
463 |
713 |
|
3 |
611 |
538 |
678 |
|
4 |
489 |
529 |
541 |
|
5 |
713 |
472 |
694 |
|
6 |
632 |
521 |
675 |
|
7 |
587 |
384 |
622 |
|
8 |
704 |
512 |
715 |
|
9 |
595 |
396 |
638 |
|
10 |
694 |
440 |
682 |
|
Средний уровень кортизола |
640 |
480 |
660 |
Рис. 5. Средний уровень кортизола в сыворотке крови у 10 больных с тяжелой степенью атопического дерматита, применявших крем Унидерм1 раз в день ежедневно в течение 2 нед. Норма 230—750 нмоль/л.
Таким образом, в ходе 3-недельного исследования были продемонстрированы высокая клиническая эффективность, высокая системная безопасность и отличная переносимость крема Унидерм при лечении АД у детей разных возрастных групп с легкой, средней и тяжелой степенью тяжести, что позволяет рекомендовать его к более широкому использованию в детской дерматологической практике как средства выбора для наружного лечения у пациентов с АД.
ЛИТЕРАТУРА
1. Бакстон П.К. Дерматология. М.: Бином 2005; 158.
2. Смирнова Т.И. Современная концепция лечения атопического дерматита у детей. Consilium medicum. Частные вопросы педиатрии/дерматология 2006; 8:1.
3. SpergelJ.M., Poller A.S. Atopic dermatitis and the atopic march. j Allergy Clin Immunol 2003; 112 (6 Suppl.): 118-27.
4. Тихомиров A.A., Короткий Н.Г., Томатное Б.Н. Современные аспекты патогенеза и лечения атопического дерматита у детей. Леч. врач 2007; 5: 56—61.
5. Короткий Н.Г., Тихомиров АЛ. и др. Атопический дерматит у детей. Тверь: Триада 2003; 238.
6. Barton В.Е., Jakway J.P., Siegel V.I. Cytokine Inhibition by a Novel Steroid, Mometasone Furoate, Immunopharmacol Immunotoxicol 1991; 13:3:251-261.
