Систематический анализ молекулярно-физиологических эффектов синергидного воздействия железа, марганца и меди на соединительную ткань
СтатьиГИНЕКОЛОГИЯ I ТОМ 14 | №6
Н.В.Керимкулова1,2, И.Ю.Торшин1, О.А.Громова1,2, В.Н.Серов5, Н.В.Никифорова2 'Российский сателлитный центр Института микроэлементов ЮНЕСКО, Москва 2ГБОУ ВПО Ивановская государственная медицинская академия Минздрава РФ 5ФГБУНаучный центр акушерства, гинекологии и перинатологии им. акад. ВИ.Кулакова Минздрава РФ
Резюме
В настоящей работе проведен систематический анализ воздействия железа и его синергистов, меди и марганца, на структуру соединительной ткани. Проведен биоинформационный анализ молекулярных механизмов, ответственных за поддержку этих физиологических процессов. В целом данные молекулярно-биологических, экспериментальных и клинических исследований указывают на важность использования органических препаратов железа, меди и марганца в профилактике и терапии патологий соединительной ткани.
Ключевые слова: беременность, дисплазия соединительной ткани, анемия, железа глюконат,медь, марганец, Тотема®.
Systematic analysis of molecular and physiological synergic effects of iron, manganese and copper on connective tissue
Summary
The present article provides systematic analysis of exposure of iron and its synergists copper and manganese on structure of connective tissue. The bio-information analysis of molecular mechanisms was made which are responsiblefor support of the physiological processes. In general, data from molecular-biological, experimental and clinical studies shows significance of use of organic iron, copper and manganese preparations in prophylaxis and therapy of connective tissue disorders.
Key words: pregnancy, connective tissue dysplasia, anemia, ferrous gluconate, copper, manganese, Tothema®
Cведения об авторах
Керимкулова Надежда Вячеславовна - канд. мед. наук, доцент, зав. каф. акушерства, гинекологии и неонатологии педиатрического фак-та ГБОУВПО ИвГМА
Торшин Иван Юрьевич - канд. хим. наук, науч. конс. РСЦИнститута микроэлементов ЮНЕСКО
Громова Ольга ААлексеевна - д-р мед. наук, проф. каф. фармакологии и клин. фармакологии ГБОУВПО ИвГММА, науч. конс. РСЦ Института микроэлементов ЮНЕСКО. E-mail: unesco.gromova@gmail.com
Серов Владимир Николаевич - проф., акад. РААМН, президент Российской ассоциации акушеров-гинекологов, ФГБУ НЦАГиП им. акад. В.И.Кулакова
Никифорова Надежда Владимировна - асс. каф. акушерства и гинекологии и неонатологии педиатрического фак-та ГБОУВПО ИвГМА
Введение
Соединительная ткань (СТ) является одним из четырех основных типов ткани в традиционных классификациях и составляет более 50% массы тела. Повсеместная распространенность СТ в организме позволяет предположить чрезвычайно широкий круг проявлений патологии СТ. Действительно, дисплазии СТ (ДСТ) представляют собой разнородную группу заболеваний, общим компонентом которых являются абнормальные структурные и функциональные изменения состояния CT в разных органах - нарушения строения хряща, сколиозы позвоночника, склонность к вывихам, гиперэластичность, истончение, склонность к травматизации кожи, расширение вен и многое другое [1-3].
Беременность - своего рода тест на состоятельность СТ женщины. Характерными изменениями СТ при беременности являются остеопения, усиление имеющихся проявлений сколиоза и плоскостопия, варикозное расширение вен, появление геморроидальных узлов во II—III триместрах, стрий на бедрах и груди. Особо следует отметить, что недостаточность соединительнотканного каркаса шейки матки приводит к преждевременным родам, а связочного аппарата тазового дна - к разрывам промежности во время родов и пролапсам гениталий.
Бороться с уже сформировавшейся ДСТ чрезвычайно трудно. Важным направлением в этой области является персонализированная микронутриентная коррекция ДСТ, в том числе преконцептуальная (I триместр). Проведенные нами ранее исследования показали, что, например, магний оказывает значительное влияние на все структурные компоненты СТ [4]. Применение препаратов органического магния весьма успешно в терапии такой формы ДСТ, как, например, пролапс митрального клапана [5].
Проведенный анализ также указал на перспективы использования и ряда других микронутриентов, а также витаминов в профилактике и терапии ДСТ: цинк, медь, марганец, железо, аскорбиновая кислота, омега-3 полиненасыщенные жирные кислоты и витамин D. Для полного понимания качественного и количественного обеспечения микронутриентами для поддержания структуры СТ необходимо построение полной патофизиологической модели развития дисплазий на основе систематического анализа молекулярных механизмов метаболизма СТ. Проведение такой фундаментальной работы является одним из важнейших направлений исследований профилактики и терапии ДСТ у беременных.
В настоящей работе последовательно рассмотрены взаимосвязи молекулярно-клеточной биологии СТ с патофизиологией ДСТ и железодефицитной анемией, роли железа в поддержании структуры СТ, функции меди и марганца как синергистов железа и как коферментов, непосредственно оказывающих влияние на СТ. Систематическое рассмотрение соответствующих белков проводилось с использованием современной биоинформационной технологии - метода функциональных взаимосвязей [6].
Молекулярноклеточная биология СТ и патофизиология ДСТ
Термин «соединительная ткань» принадлежит, в основном, к области физиологии и биомедицины. С молекулярно-биологической точки зрения принято говорить о внеклеточной матрице (ВКМ), представляющей собой сложную сеть, которая сформирована многочисленными структурными макромолекулами, такими как протеогликаны, коллагены и эластин (рис. 1). Взаимодействуя друг с другом и клетками, они поддерживают структурную целостность тканей [7]. ВКМ обеспечивает организованную среду, в пределах которой клетки других типов могут закрепляться, перемещаться и взаимодействовать друг с другом. Все макромолекулы, составляющие ВКМ, производятся клетками в матрице. В большинстве СТ матричные макромолекулы синтезируются фибробластами, а в специализированных типах СТ, таких как, например, хрящ и кость, хондробластами и остеобластами.
Рис. 1. Молекулярные компоненты СТ.
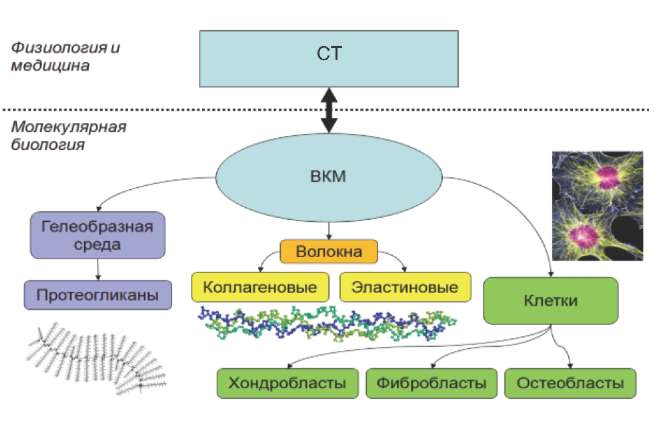
Сложная многокомпонентная структура СТ указывает на многообразие механизмов, посредством которых может развиться патология (дисплазия) СТ. Термин «дисплазия» обозначает абнормальный рост/развитие ткани или органа вообще, так что дисплазия, обнаруженная на клиническом уровне, может соответствовать многочисленным изменениям в структуре ткани. В случае СТ дисплазия может происходить вследствие:
• нарушений синтеза протеогликанов;
• ускоренной деградации протеогликанов;
• абнормального синтеза коллагена;
• нарушений структуры коллагеновых волокон вследствие недостаточной поперечной сшивки;
• чрезмерной деградации коллагена;
• аналогичных аномалий, связанных с эластиновыми волокнами;
• отмирания клеток СТ из-за недостаточной обеспеченности нутриентами и кислородом;
• разрушения ткани посредством аутоиммунных реакций;
• других не изученных на сегодняшний день механизмов.
ЖДА и состояние СТ
Несмотря на взаимосвязь повсеместно распространенной ЖДА и нарушений строения хряща и костей, установленную в ходе многочисленных экспериментальных и клинических исследований, эти патологии по-прежнему рассматриваются как этиологически разрозненные. Несмотря на известное участие железа в метаболизме коллагена, роли железа в формировании СТ не уделяется достаточного внимания. Тем не менее совершенно очевидно, что анемия будет приводить к недостаточной обеспеченности фибробластов кислородом и нутриентами, что снижает выживаемость клеток СТ.
Согласно данным эксперимента ЖДА приводит к нарушению минерализации и увеличению резорбции кости. Железодефицитная диета с нормальным содержанием кальция и фосфора в течение 40 дней приводила к снижению уровней N-концевого пропептида проколлагена, что указывает на уменьшение формирования костного матрикса. Увеличение уровней сывороточного гормона паращитовидных желез, тартрат-стойкой кислой фосфатазы и продуктов распада С-концевого пептида коллагена в сыворотке указывает на увеличение резорбции кости на фоне ЖДА. Кроме того, процесс минерализации кости также страдает от дефицита железа, на что указывает значительное снижение содержания кальция и фосфора в бедренных костях при ЖДА [8].
Экспериментальная ЖДА приводит к неблагоприятным изменениям в синовиальной оболочке и хряще. Снижение обеспеченности СТ кислородом приводит к следующим морфологическим изменениям: гиперплазии ворсинок с увеличением секреторных везикул B-синовиоцитов с фрагментацией костной трабекулы суставов, увеличению числа областей с преждевременной остановкой роста хряща, увеличенной неравномерности профиля толщины и структуры суставного хряща [9].
По данным крупных клинико-эпидемиологических исследований, анемия способствует значительному повышению риска остеопороза и переломов. В лонгитудинальном исследовании 5286 человек (2511 мужчин и 2775 женщин 55-74 лет) наблюдались в течение 8 лет. Низкие уровни гемоглобина были связаны с когнитивными нарушениями и более низкой костной массой. За время наблюдения у 235 мужчин и 641 женщины был установлен хотя бы один перелом (исключая переломы позвоночника). Уменьшение содержания гемоглобина в крови на одно стандартное отклонение соответствовало повышению риска переломов на 30% у мужчин (p<0,001) и на 8% у женщин (p=0,07). У мужчин с легкой анемией (гемоглобин менее 130 г/л) риск переломов был повышен в 2 раза по сравнению с пациентами с нормальным уровнем гемоглобина [10].
В исследовании «Инициатива женского здоровья» (WHI, США) 160 080 женщин в постменопаузе, средний возраст 63,2±7,2 года, наблюдались в среднем в течение 8 лет. ЖДА была определена на момент начала исследования как уровень гемоглобина менее 120 г/л, наличие переломов фиксировалось в амбулаторных картах. Страдали анемией 8739 участниц (5,5%). С поправкой на возраст частота переломов бедра на 10 тыс. человек составила 21 пациентка в год у женщин с анемией и 15 пациенток в год у женщин без анемии. После поправок на другие факторы риска анемия соответствовала 38% (95% доверительный интервал - ДИ -13-68%) повышению риска переломов бедра и 30% (95% ДИ 9-55%) - позвоночника [11].
Для выявления возможных диетарных причин потери костной массы в перименопаузе при отсутствии заместительной гормональной терапии и выраженной патологии СТ у 43 пациенток в течение 11-14 лет ежегодно проводилось измерение минеральной плотности костей позвонков L2-L4. В течение срока наблюдения несколько раз была проведена оценка диетарного потребления макро- и микронутриентов (углеводов, жиров, белков, клетчатки, кальция, магния, железа, фосфора, меди, цинка и витаминов). Результаты регрессионного анализа полученных данных показали, что высококалорийное питание (избыток углеводов, насыщенных животных жиров), также как и гипербелковая диета, приводили к значимому снижению минеральной плотности костей (p=0,0003). В то же время более высокое потребление железа соответствовало повышенной минеральной плотности костей (p=0,002) [12].
Отметим, что фолат- и витамин В12-зависимая пернициозная анемия также являются значимыми факторами риска развития остеопороза. Наблюдения 131 пациента с анемией в течение 10 лет показали, что риск переломов проксимального отдела бедренной кости был повышен в 1,9 раза, переломов позвоночника - в 1,8 раза, а также переломов дистального отдела предплечья - в 3 раза по сравнению с популяционным контролем [13].
Следует отметить, что с 1930-х годов известно, что причиной ЖДА является не только дефицит железа. Проводимые в то время фармакологические исследования по подбору наиболее эффективных пропорций Fe:Cu:Mn показали, что увеличение соотношения Fe:Cu в препаратах соответствует более высокой терапевтической эффективности (Hart, 1937).
Железо и СТ
Хронический дефицит железа, по данным эксперимента, приводит к задержке созревания коллагена в бедренной кости и нарушениям фосфорно-кальциевого метаболизма. Гистологическое исследование показало ряд дистрофических нарушений в костной ткани [14]. Изменения в содержании трансферрина, церулоплазмина, железа и меди в сыворотке крови коррелируют со скоростью заживленияран [15].
Непосредственное воздействие железа на СТ связано с его участием в метаболизме коллагена. Коллагены - одни из наиболее обильных белков во ВКМ и СТ, придающие ей прочность и долговечность. Каждое коллагеновое волокно несколько микрометров в диаметре и состоит из тысяч индивидуальных полипептидных цепей коллагенов, плотно упакованных вместе. Коллагены различаются по их положению в ткани и своему функциональному значению:
• Коллаген I (гены COL1A1, COL1A2) - основной компонент кости, который также присутствует в шрамах, сухожилиях и хрящах.
• Коллаген II (ген COL2A1) - основной компонент хряща.
• Коллаген III (ген COL3A1) формирует ретикулярные волокна, которые держат вместе ВКМ.
• Коллаген IV (гены COL4A1, COL4A2, COL4A3, COL4A4, COL4A5, COL4A6) формирует базальную ламину, на которой держится эпителий.
Коллагеновые болезни могут возникать не только вследствие генетических дефектов в генах коллагенов, но также вследствие генетических дефектов генов, кодирующих белки биосинтеза, биохимических модификаций, секреции и ремоделирования коллагенов (рис. 2). Эти посттрансляционные модификации зависят от аскорбиновой кислоты и железа и принципиально необходимы для правильной сборки полипептидных цепей коллагена в коллагеновые фибриллы.
Рис. 2. Биохимические модификации коллагена [7].
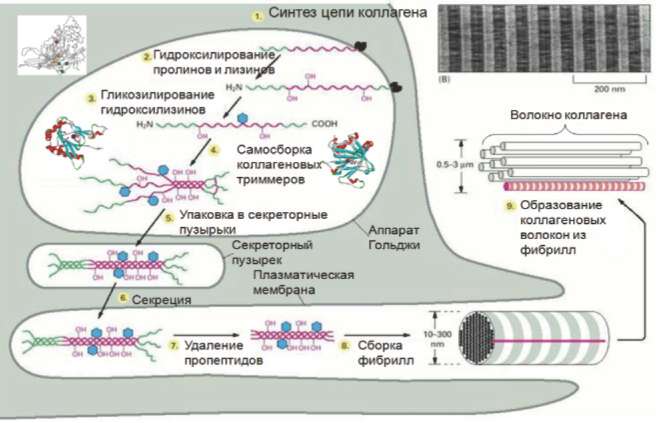
Железо, являясь кофактором ряда биосинтетических ферментов, участвует в гидроксилировании определенных остатков пролина и лизина в коллагене, что необходимо для образования и секреции тройной спирали коллагена [16]. Гидроксилирование коллагена поддерживается лизилгидроксилазами, и мутации в соответствующих генах приводят к таким формам дисплазии, как болезнь Элерса-Данло [17, 19], и метаболическим нарушениям костной ткани [18].
Железо является составной частью активного центра фермента лизилгидроксилазы-1 (ген PLOD1), который гидроксилирует лизины коллагенов в последовательностях Lys-Gly. Гидроксилизины служат сайтами присоединения карбогидратных остатков, что имеет важное значение для стабилизации межмолекулярных поперечных связей коллагена. Дефекты в гене PLOD1 являются причиной развития болезни Элерса-Данло типа 6 (MIM 225400).
Лизилгидроксилаза-3 (PLOD3) - многофункциональный фермент, который также обладает и галактозилтрансферазной активностью. Под ее влиянием после гликозилирования образуются тройные спирали коллагенов, которые затем упаковываются в секреторные пузырьки, и транспортируются наружу клетки. Дефекты в гене PLOD3 являются причиной недостаточности лизилгидроксилазы-3(МШ 612394) - заболевания СТ, также известного как «хрупкость костей с контрактурами артериального разрыва и глухотой». Синдром характеризуется врожденными пороками развития многих органов, связанных с нарушениями метаболизма ряда коллагенов (прежде всего коллагена II типа COL2A1). Следует отметить, что даже при отсутствии врожденного генетического дефекта активность фермента лизилгидроксилазы-3 значительно снижается при обычном дефиците железа, которое участвует в формировании активного центра фермента.
Пролилгидроксилаза-1 (ген LEPRE1) участвует в синтезе хондроитин сульфат протеогликанов, гидроксилируя остатки пролинов в последовательностях Pro-Gly коллагенов, в частности коллагенов IV и V. Дефекты в гене LEPRE1 являются причиной генетического заболевания «несовершенный остеогенез типа 8» (MIM 610915), которое характеризуется непропорционально низким ростом, тяжелым остеопорозом, укорочением трубчатых костей, белыми склерами и короткой бочкообразной грудной клеткой [20]. Для активности данного фермента принципиально необходимы ионы Fe2+.
В то же время избыток железа, обусловленный нарушениями гомеостаза или сверхизбыточным его поступлением в организм, ингибирует метаболизм остеобластов. Например, перегрузка железом при гемохроматозе связана с остеопенией и остеопорозом вследствие того, что клеточное деление и дифференциация остеобластов затруднены [21]. Качественная и количественная оценка отложений железа у 20 пациентов с ревматоидным артритом показала более высокие уровни отложений железа в СТ и синовиальной жидкости у пациентов по сравнению с контрольной группой. Установлено более глубокое проникновение избыточного железа в СТ [22].
Следует отметить, что фармакологическая форма, в которой применяется железо, в значительной степени определяет интенсивность образования нежелательных отложений железа. Экспериментальные исследования и исследования клеток человека в культуре показали, что препараты неорганического железа (хлорид) ведут к перегрузке макрофагов железом, это приводит к воспалению через повышение уровней фактора некроза опухолей и секрецию гидроксильных радикалов. Кроме того, железо, вводимое в составе неорганических препаратов, инициирует программу клеточного старения фибробластов [23] и ускоряет апоптоз эндотелиальных клеток [24], что приводит к ухудшению заживления ран и быстрому старению кожи.
Медь и марганец как синергисты железа
Медь и марганец являются эссенциальными синергистами железа, необходимыми для поддержания гомеостаза железа, физиологического распределения в тканях и осуществления его биологических ролей. Проведенный ранее
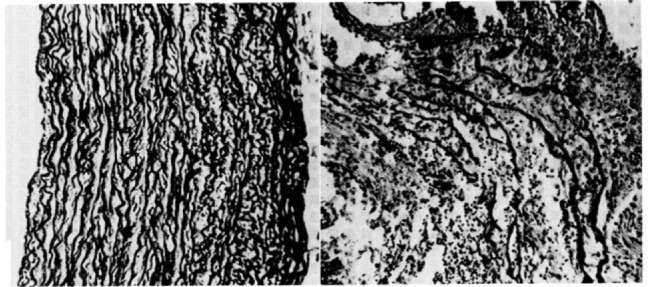
Примечание. Слева - контроль (нормальные уровни меди), справа -ткань животных, выросших в условиях дефицита меди. Следует обратить внимание на фрагментацию эластичных ламин и накопление материала между ламинами.систематический анализ показал существующий спектр микронутриентов (витамины В2, В6, С, цинк, медь, марганец, молибден), необходимых для полноценного усвоения железа организмом и проявления биологических эффектов данного элемента [25].
Марганец необходим для поддержания активности ферментов серинтреонин-фосфатазы - S/T-фосфатазы (внутриклеточная передача сигнала), гуанилатциклаз (передача сигнала от окиси азота, NO), ион-транспортеров (контроль распределения железа в организме) и митохондральной пептидазы (импорт белков гомеостаза железа в митохондрии).
S/T-фосфатазы (гены PPP1CA, PPP2CA, PPP2CB, PPP4C, PPP5C, PPP6C и т.д.) - марганецзависимые ферменты, гидролизующие фосфорилированные формы остатков серина и треонина белков. Так как фосфорилирование и дефосфорилирование аминокислотных остатков повсеместно используются в клетке как способы передачи сигнала, фосфатазы модулируют передачу самых разных сигналов, имеющих принципиальное значение для выживания клетки. Например, активность S/T-фосфатазы-! необходима для деления клетки, метаболизма гликогена, мышечного сокращения и синтеза белка. Поскольку марганец и железо необходимы для активности S/T-фосфатаз, то их дефицит приведет к замедлению роста клеток, в том числе эритроцитов.
Марганецзависимая митохондральная пептидаза (ген MIPEP) регулирует импорт белков гомеостаза железа (феррохелатаза и др.) в митохондрии. Функцией этой пептидазы является протеолиз («отрезание») полипептидов импортируемых белков, что приводит к приобретению этими белками полной биологической активности. Этот фермент является регулятором уровней железа: фермент стимулирует поглощение железа митохондриями, так что падение активности фермента приводит к потере митохондриями запасов железа [26]. Активность фермента стимулируется ионами марганца, магния и кальция.
Медь - интегральный компонент ферментов так называемой дыхательной цепи, непосредственно вовлеченных в усвоение молекулярного кислорода. Медь необходима для поддержания активности таких ферментов, как цитохром С-оксидаза («клеточное дыхание»), супероксиддисмутаза (антиоксидантная защита), металлоредуктаза STEAP (восстановление прооксидантного трехвалентного железа до двухвалентного) и белок гефестин (взаимопревращения двух- и трехвалентного железа). В эксперименте дефицит меди непосредственно приводил к ЖДА вследствие нарушения абсорбции железа [27].
Цитохром С-оксидаза (гены MTCO1, MTCO2) - медьзависимый компонент дыхательной цепи, катализирующий восстановление молекулярного кислорода до воды. В ходе этого процесса перенос электронов и протонов способствует синтезу аденозинтрифосфорной кислоты в митохондриях. Электроны переносятся через гем и атом меди, являющиеся кофакторами цитохрома С-оксидазы. Падение активности цитохрома С-оксидазы (вследствие генетических дефектов или глубокого дефицита железа и меди) приводит к идиопатической сидеробластической анемии (OMIM 516030) [28] и миоглобинурии (OMIM 550500).
Медь, цинксупероксиддисмутазы (гены SOD1, SOD2) -ферменты антиоксидантной защиты организма. Деградируя пероксидный и надпероксидный анионы, супероксид-дисмутазы наряду с каталазой обеспечивают защиту организма от высокореактивных форм кислорода, способствуют нормализации процессов воспаления. Активность супероксиддисмутаз также влияет на гемолиз, анемию и клеточный гомеостаз железа [29].
Металлоредуктазы типа STEAP необходимы для эффективной абсорбции железа посредством трансферрина. Они восстанавливают токсическое железо Fe3+ в биологически полезное двухвалентное Fe2+ и регулируют поглощение железа и меди клетками-предшественниками эритроцитов. Недостаток активности металлоредуктазы STEATP4 увеличивает уровни провоспалительных цитокинов и связан с повышением риска артрита [30].
Участие меди в метаболизме СТ
Дефицит меди (диагнозы по Международной классификации болезней 10-го пересмотра Е61.0 «Недостаточность меди», Е83.0 «Нарушение обмена меди») приводит не только к развитию анемии. У беременных характерными симптомами дефицита меди являются расширение вен, глюкозотолерантность, остеопороз, бледность кожи, витилиго, высыпания, депигментация и очаговое выпадение волос. У плода дефицит меди проявляется повышением демиелинизации нервных клеток, пороками развития сердечнососудистой системы и скелета.
Медь, как и железо, участвует в модификации определенных лизиновых остатков коллагена и эластина, что имеет важное значение для формирования коллагеновых и эластиновых фибрилл. По результатам эксперимента недостаток меди ухудшает формирование сшивок коллагена и приводит к тяжелой патологии костей, легких и сердечнососудистой системы [16] (рис. 3).
Рис. 3. Гистологическое исследование аорты цыплят в условиях дефицита меди [16].
Медь играет ключевую роль в ангиогенезе, синтезе и стабилизации белков ВКМ кожи. В эксперименте топическое применение оксида меди на ранах у моделей диабета привело к повышению экспрессии проангиогенных плацентарного фактора роста, гипоксияиндуцируемого фактора-1 -а, фактора роста эндотелия сосудов (VEGF), что было связано с повышением интенсивности образования кровеносных сосудов (p<0,05) и улучшением заживления ран (p<0,01) [31]. Топическое применение меди в комплексе с пептидами в течение 7 дней приводило к значительному снижению среднего размера раны и ускорению заживления ран по сравнению с группой на оксиде цинка [32].
VEGF является одним из наиболее распространенных, эффективных и долгосрочных молекулярных сигналов ангиогенеза в ранах. Экспрессия VEGF зависит от уровней меди: в физиологически значимых концентрациях медь индуцирует экспрессию VEGF через сигнальные пути гипоксии и ускоряет заживление ран [33].
Еще одним из возможных объяснений ангиогенного эффекта меди является взаимодействие ионов меди с белком ангиогенином. Ангиогенин стимулирует васкуляризацию тканей: связываясь с актином на поверхности эндотелиальных клеток, ангиогенин претерпевает эндоцитоз, перемещается в ядро, где активирует экспрессию соответствующих генов [34]. Проангиогенная активность белка зависит от концентрации ионов меди, которые связываются с доменом взаимодействия с эндотелиальными клетками [35] и модулируют сродство ангиогенина к эндотелиальным клеткам. В эксперименте наблюдалось четырехкратное увеличение связывания ангиогенина с эндотелием в присутствии ионов меди [36].
Одним из факторов, способствующих потере костной массы, является субклинический дефицит цинка и меди, возникающий вследствие уменьшенного потребления или нарушений всасывания этих микроэлементов в организме. Цинк и медь - принципиально важные кофакторы ферментов, участвующих в синтезе разных молекулярных компонентов матрикса костной ткани. Совместный прием препаратов меди/цинка с препаратами кальция может способствовать значительному снижению всасывания цинка и меди вследствие фармакокинетического антагонизма [37].
Медь, являясь кофактором фермента лизилоксидазы (ген LOX), имеет важное значение для формирования внутри- и межмолекулярных поперечных связей в коллагене. Недостаток меди у человека и животных связан с нарушениями роста, остеогенеза и хрупкостью костей, что во многом обусловлено недостаточным количеством этих поперечных сшивок [38]. В эксперименте дефицит меди приводил к нарушению структуры коллагена и снижению таких механических свойств кости, как устойчивость к скручиванию и угловой деформации (p<0,05) [39, 40].
Трехмерная сеть СТ поперечнополосатых мышц состоит в основном из нитей коллагена. У животных на медьдефицитной диете структура этой сети нарушается вследствие снижения активности лизилоксидазы, что способствует возникновению гипертрофии миокарда и склонной к разрыву аневризмы желудочков. Сканирующая и просвечивающая электронная микроскопия скелетных и сердечной мышц указала как на грубые, так и на микроскопические повреждения трехмерной сети СТ. Световая микроскопия с иммуногистохимическим окрашиванием антителами против лизилоксидазы показала наличие сравнимых уровней фермента как при дефиците, так и при достаточной обеспеченности медью. В то же время активность фермента на фоне дефицита меди резко снижена. Таким образом, именно снижение активности, а не уровней лизилоксидазы является причиной нарушений структуры сети СТ[41].
Марганец и структура СТ
Марганец - эссенциальный микроэлемент и кофактор более 200 белков, участвующих в столь разнообразных процессах, как кроветворение, иммунитет, энергетический метаболизм и метаболизм СТ. При недостаточном потреблении марганца и нарушениях гомеостаза этого элемента возникает дефицит марганца (рубрикация Е61.3 по Международной классификации болезней 10-го пересмотра). К клиническим симптомам марганцевого дефицита у беременных относятся дерматиты, инсулинорезистентность, жировой гепатоз, остеопения; последствия дефицита марганца для плода включают нарушения образования хрящевой ткани, аномалии развития скелета.
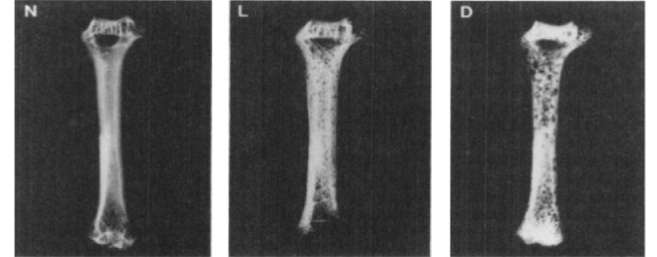
Исследования влияния марганца на развитие и структуру СТ проводятся с первой половины XX в. [42]. В эксперименте эффекты долгосрочного дефицита марганца и меди в диете включают снижение минерализации в сочетании с увеличением резорбции кости [43]. Хронический дефицит марганца и меди приводит к снижению активности строящих кость остеобластов, увеличению резорбции костного матрикса и, следовательно, снижению плотности и массы костей. Недостаточность потребления меди и марганца приводит к значительному снижению содержания кальция в костях (180 мг/г, дефицит Mn/Cu и 272 мг/г, контроль). Рентгенограммы плечевых костей указали на присутствие многочисленных очагов повреждения кости как при сочетанном дефиците Mn/Cu, так и при глубоком дефиците марганца (рис. 4) [43].
Рис. 4. Рентгенограммы плечевой кости при разном содержании меди и марганца в диете.
Дефицит марганца снижает ангиогенез, что способствует ухудшению заживления ран у больных сахарным диабетом. Снижение экспрессии марганцевой супероксид-дисмутазы снижает время заживления ран и ангиогенеза на модели диабета [44]. Подобный эффект имеет и снижение активности фермента вследствие дефицита марганца, образующего активный центр.
В эксперименте диетарный дефицит марганца в течение 25 дней приводил к снижению содержания марганца в кости до 2% от контрольной группы (рис. 5). При этом 88% животных проявляли выраженные признаки остеопороза, причем значительно снижалось поглощение SH-групп для синтеза уроновых гликозаминогликанов СТ вследствие снижения активности ряда марганецзависимых гликозил-трансфераз. Восстановление марганца в диете приводило к быстрому возрастанию его содержания в кости [45].
Рис. 5. Динамика содержания марганца в кости при дефиците микроэлемента в диете.
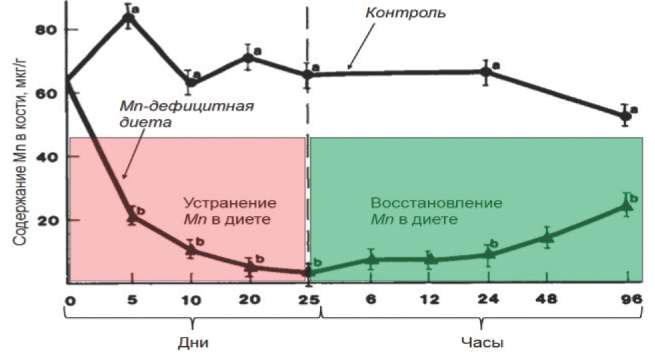
Примечание. N - нормальные уровни марганца и меди в диете; L - диета с сочетанным дефицитом марганца и меди; D - диета, в которой полностью отсутствует марганец при нормальной обеспеченности медью [43].
Дефицит марганца приводит к резкому сокращению содержания мукополисахарида хрящей [46]. В эксперименте отрицательные эффекты воздействия дефицита марганца на качество СТ могут быть быстро скомпенсированы добавлением марганца в диету. Пищевые добавки марганца уже в небольших количествах (2,5-5,0 мг/кг корма) улучшают кальцификацию и плотность кости [47]. При этом относительная биодоступность органической формы марганца (комплекс с метионином) была на 20% выше биодоступности неорганического сульфата марганца и на 70% выше биодоступности неорганического оксида марганца(II) [48].
Эффекты марганца на СТ обусловлены воздействием дефицита марганца на структуру так называемой гелеобразной среды, которая образована протеогликанами - чрезвычайно растянутыми полипептидными цепями с многочисленными полисахаридными цепями глюкозаминогли-канов, присоединенных посредством ковалентных связей. Многочисленные цепи протеогликанов прикрепляются к особому виду глюкозаминогликана - полимеру гиалуроновой кислоты, называемому гиалуронаном. Нити гиалуронана скрепляют структуру геля в единое целое, и такой полисахаридный «гель» может противостоять сжатию и растяжению и в то же время обеспечивать быструю диффузию питательных веществ, строительных материалов и гормонов между кровью и клетками СТ. Механически структура геля усилена посредством коллагеновых и эластиновых волокон.
Установлено по меньшей мере три разновидности марганецзависимых ферментов, которые принимают участие в синтезе глюкозаминогликанов и других углеводных компонентов протеогликанов. К этим ферментам относятся галактозилксилозил глюкуронозилтрансферазы, р-галактозилтрансферазы и N-ацетилгалактозаминил-трансферазы.
Марганецзависимые галактозилксилозилглюкуронозил-трансферазы (гены B3GAT1, 2, 3) играют важную роль в биосинтезе таких гликозаминогликанов СТ, как хондроитин сульфат, дерматан сульфат, гепаран сульфат и гепарин. Цепи этих глюкозаминогликанов содержат полисахаридную последовательность глюкоза-галактоза-ксилоза. Последняя стадия синтеза этого структурного фрагмента -присоединение глюкоуронилового остатка - осуществляется глюкуронозилтрансферазой-1 [49]. При нормальном содержании уровни экспрессии этих ферментов прямо пропорциональны уровням синтезируемых глюкозаминогликанов. При дефиците марганца активность глюкуронозилтрансфераз падает и синтез глюкозаминогликанов значительно снижается.
Марганецзависимые р-галактозилтрансферазы (гены B4GALT1, 2, 3, 4, 5, 6, 7) участвуют в биохимических модификациях и присоединении глюкозаминогликанов, активность этих ферментов оказывает значительное влияние на структуру ВКМ СТ. Например, дефицит ксилозил-р-1,4-га-лактозилтрансферазы-7 (ген B4GALT7) связан с одной из форм синдрома Элерса-Данло (склонность к вывихам, хрупкая или гиперэластичная кожа, хрупкие кровяные сосуды и т.д., номер по OMIM 130000) [50]. Активность р-галактозилтрансфераз резко падает при дефиците марганца, образующего активные центры этих ферментов.
Марганецзависимые N-ацетилгалактозаминилтрансферазы (гены GALNT1, 2... 15) необходимы для синтеза глюко-заминогликана хондроитин сульфата. Хондроитин сульфат состоит из повторяющих дисахаридных последовательностей N-ацетилгалактозаминовых и глюкоуроновых остатков, и данный фермент присоединяет N-ацетилгалак-тозамины к растущей полисахаридной цепи глюкозаминогликана. Марганецзависимые N-ацетилгалактозаминил-трансферазы необходимы для нормальной оссификации и метаболизма других компонентов СТ [51], и активность этих ферментов критически важна для нормального развития хряща [52]. Дефицит марганца приводит к разрушению конформации активного центра и резкому падению активности фермента.
Заключение
В настоящей работе был проведен систематический анализ молекулярно-физиологических эффектов воздействия железа, меди и марганца на структуру СТ разных органов. Эти три элемента оказывают синергидное воздействие на эффективную компенсацию ЖДА, что весьма важно для выживания фибробластов и других типов клеток, синтезирующих компоненты и поддерживающих структуру СТ. Специфические эффекты воздействия железа и меди на СТ включают синтез и сборку коллагена (образование поперечных сшивок коллагеновых полипептидов), а марганца - синтез глюкозаминогликанов, образующих гелеобразную основу СТ (рис. 6).
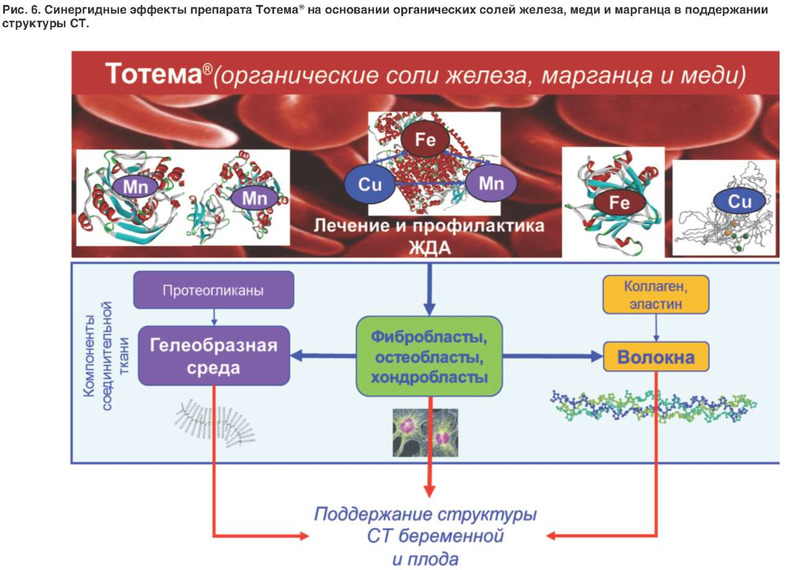
Синергидному эффекту воздействия железа, меди и марганца на структуру СТ должно уделяться больше внимания в повседневной клинической практике. Крупномасштабные клинические исследования бесспорно доказали взаимосвязь между анемией и связанным с остеопенией/остеопорозом риском переломов. Очевидно, что препаратом выбора для женщин, имеющих одновременно ЖДА и признаки ДСТ, должен быть препарат, включающий не только органическую форму железа, но и органические формы синергидных железу меди и марганца (например, препарат Тотема® - сочетанная форма глюконата железа с глюконатом меди и глюконатом марганца; см. рис. 6). Препарат имеет доказательную базу применения у беременных и детей, а также характеризуется очень хорошей переносимостью. Так, применение препарата Тотема® у 86 женщин с ЖДА (гемоглобин 88-100 г/л, сывороточное железо -8-12 мкмоль/л, цветной показатель - 0,8-0,9), страдающих миомой матки, показало эффективность терапии при отсутствии побочных эффектов даже при проведении очень короткого курса (5-10 дней). Уровень гемоглобина повысился на 12-15 г/л, уровень сывороточного железа - на 4-8 мкмоль/л [53]. Сравнение данных метаанализа 30 исследований Тотема® (1077 пациентов) с метаанализами переносимости других препаратов показало высокую безопасность применения Тотема®. Частота побочных явлений составила всего 10,4%. Отказ от лечения - 1,1%. Тотема® в 2-3 раза лучше переносится, чем сульфат железа II (частота побочных эффектов 20-34%), и имеет сравнимую переносимость с полимальтозным комплексом гидроксида железа III (14,9%) и протеинсукцинилатом железа III (9,4%). При применении препарата Тотема® в 19 раз реже возникают запоры, чем при использовании сульфата железа II, и в 10 раз реже, чем при приеме полимальтозного комплекса гидроксида железа III. Это еще одно очень важное преимущество препарата Тотема® для применения у беременных женщин, которые довольно часто страдают запорами [54].
Кроме использования прямых синергистов железа (марганец, медь) персонализированная программа ведения таких беременных может дополняться магнием, стандартизированными омега-3 полиненасыщенными жирными кислотами и витамином D - необходимыми для синтеза СТ и регуляции процессов разрешения воспаления.
Литература
1. Нечаева ГИ., Яковлев ВМ., Громова ОА и др. Дисплазии соединительной ткани у детей и подростков. Инновационные стационар-сберегающие технологии диагностики и лечения в педиатрии. М.: Союз педиатров России, 2009.
2. Mikhailova AV, Smolenskii AV. Clinicalfeatures and physicalfitness parameters in athletes with cardiac connective tissue dysplasia syndrome. Klin Med (Mosk.) 2004; 82 (8): 44-8.
3. Zakhar'ian AL, Zakhar'ian EA The severity of varicose vein disease of the lower extremities in various degree of the connective tissue dysplasia syndrome. Klin Khir 2005; 8:42 -4.
4. Торшин И.Ю., Громова ОА Молекулярные механизмы магния и дисплазии соединительной ткани. Рос.мед. журн. 2008:263-9.
5. Domnitskaia TM, D'iachenko AV, Kupriianova OO, DomnitskiiMMV. Clinical value of the use of magnesium orotate in adolescents with syndrome of cardiac connective tissue dysplasia. Kardiologiia 2005; 45 (3): 76-81.
6. Torshin IYu. Bioinformatics in the post-genomic era: sensing the change from molecular genetics to personalized medicine. Nova Biomedical Books, NY, USA, 2009. In «Bioinformatics in the Post-GenomicEra» series.
7. Alberts B,Johnson A, LewisJ et al. Molecular Biology of the Cell, 4th edition, Garland Science, 2002.
8. Diaz-Castro J, Lopez-Frias MR, Campos MS et al. Severe nutritional iron-deficiency anaemia has a negative effect on some bone turnover biomar-kers in rats. Eur JNutr 2011.
9. Fadda M, Zirattu G, Espa E, Orani G.Morphological aspects of the synovial membrane and femoral epiphyseal cartilage in experimentally induced chronic anemia. Ital J Orthop Traumatol 1992; 18 (2): 271-7.
10. Jorgensen L, Skjelbakken T, Lochen ML et al. Anemia and the risk ofnon-vertebral fractures: the Tromso Study. Osteoporos Int 2010; 21 (10):1761-8.
11. Chen Z, Thomson CA, Aickin M et al. The relationship between incidence of fractures and anemia in older multiethnic women. J Am Geriatr Soc 2010;58 (12): 2337-44 doi.
12. Abraham R, WaltonJ, Russell L et al. Dietary determinants of postmenopausal bone loss at the lumbar spine: a possible beneficial effect of iron. Osteoporos Int 2006; 17 (8): 1165-73.
13. Goerss JB, Kim CH, Atkinson EJ et al. Risk of fractures in patients with pernicious anemia. J Bone Miner Res 1992; 7 (5): 573-9.
14. Smoliar VI. Effect of iron-deficient diets on the formation of bone tissue. VoprPitan 1984; (5): 55-915. Mamedov LA, Kosaganova NIu, Rikhireva GT et al. Changes in the content of transferrin, ceruloplasmin, iron, and copper in blood serum and granulation tissue in wound healing in an experiment. Patol Fiziol Eksp Ter 1988; 4:58-61.
16. O'Dell BL. Roles for iron and copper in connective tissue biosynthesis. Philos TransR SocLondBBiolSci 1981; 294 (1071):91-104.
17. Yeowell HN, Walker LC. Ehlers-Danlos syndrome type VI results from a nonsense mutation and a splice site-mediated exon-skipping mutation in the lysyl hydroxylase gene. ProcAssocAm Physicians 1997; 109 (4): 383-96.
18. Van der Slot AJ, Zuurmond AM et al. Identification of PLOD2 as telopep-tide lysyl hydroxylase, an important enzyme in fibrosis. J Biol Chem 2003; 278 (42):40967-72.
19. Ha VT, Marshall MK, Elsas LJ et al. A patient with Ehlers-Danlos syndrome type VI is a compound heterozygote for mutations in the lysyl hydro-xylase gene. J Clin Invest 1994; 93 (4): 1716-21.
20. Cabral WA, Chang W, Barnes AM et al. Prolyl 3-hydroxylase 1 deficiency causes a recessive metabolic bone disorder resembling lethal/severe osteogenesis imperfecta. Nat Genet 2007; 39 (3): 359-65.
21. Yamasaki K, Hagiwara H. Excess iron inhibits osteoblast metabolism. Toxicol Lett 2009; 191 (2-3): 211-5. Epub 2009
22. Giordano N, Vaccai D, Cintorino M et al. Histopathological study of iron deposit distribution in the rheumatoid synovium. Clin Exp Rheumatol 1991;9 (5):463-7.
23. Sindrilaru A, Peters T, Wieschalka S et al. An unrestrained proinflamma-tory M1 macrophage population induced by iron impairs wound healing in humans and mice. J Clin Invest 2011; 121 (3): 985-97 doi.
24. Jacob AK, Hotchkiss RS, DeMeester SL et al. Endothelial cell apoptosis is accelerated by inorganic iron and heat via an oxygen radical dependent mechanism. Surgery 1997; 122 (2): 243-53.
25. Торшин И.Ю., Громова ОА, ХаджидисАК Систематический анализ молекулярных механизмов воздействия железа, меди, марганца в патогенезе железодефицитной анемии. Клин. фармакология.2010; 3.
26. Branda SS, Yang ZY, Chew A, Isaya G. Mitochondrial intermediate peptidase and the yeast frataxin homolog together maintain mitochondrial iron homeostasis in Saccharomyces cerevisiae. Hum Mol Genet 1999; 8 (6): 1099-110.
27. Reeves PG, DeMars LC. Copper deficiency reduces iron absorption and biological half-life in male rats. J Nutr2004; 134 (8): 1953-7.
28. Broker S, Meunier B, Rich P et al. MtDNA mutations associated with si-deroblastic anaemia cause a defect of mitochondrial cytochrome c oxi-dase. Eur J Biochem 1998; 258 (1): 132-8.
29. Bannister JV, Bannister WH, Rotilio G. Aspects of the structure, function, and applications of superoxide dismutase. CRC Crit Rev Biochem 1987; 22 (2): 111-80.
30. Zhang CM, Chi X, Wang B et al. Downregulation of STEAP4, a highly-expressed TNF-alpha-inducible gene in adipose tissue, is associated with obesity in humans. Acta Pharmacol Sin 2008; 29 (5):587-92.
31. Borkow G, Gabbay J, Dardik R et al. Molecular mechanisms of enhanced wound healing by copper oxide-impregnated dressings. Wound Repair Regen 2010; 18 (2): 266-7532. Cangul IT, Gul NY, Topal A, Yilmaz R. Evaluation of the effects of topical tripeptide-copper complex and zinc oxide on open-wound healing in rabbits. Vet Dermatol 2006; 17 (6): 417-23.
33. Sen CK, Khanna S, Venojarvi M et al. Copper-induced vascular endothelial growth factor expression and wound healing. Am J Physiol Heart Circ Physiol 2002; 282 (5): H1821-H1827.
34. Dickson KA, Kang DK, Kwon YS et al. Ribonuclease inhibitor regulates neovascularization by human angiogenin. Biochemistry 2009; 48 (18):3804-6.
35. La Mendola D, Magri A, Vagliasindi LI et al. Copper(II) complexformation with a linear peptide encompassing the putative cell binding site of angiogenin. Dalton Trans 2010; 39 (44): 10678-84.
36. SoncinF, GuittonJD, Cartwright T, Badet J.Interaction of human angio-genin with copper modulates angiogenin binding to endothelial cells. Bio-chem BiophysRes Commun 1997; 236 (3): 604-10.
37. Lowe NM, Lowe NM, Fraser WD, Jackson MJ. Is there a potential therapeutic value of copper and zinc for osteoporosis? Proc Nutr Soc 2002; 61 (2): 181-5.
38. Smoliar VI, Biniashevskii EV. [Effect of copper deficiency on growth and bone tissue formation]. Vopr Pitan 1988; (6): 28-32.
39. Jonas J, BurnsJ, Abel EW et al. Impaired mechanical strength of bone in experimental copper deficiency. Ann Nutr Metab 1993; 37 (5): 245-52.
40. Opsahl W, Zeronian H, Ellison M et al. Role of copper in collagen cross-linking and its influence on selected mechanical properties of chick bone and tendon.JNutr 1982; 112 (4): 708-16.
41. Borg TK, Klevay LM, Gay RE et al. Alteration of the connective tissue network of striated muscle in copper deficient rats. J Mol Cell Cardiol 1985; 17 (12): 1173-83.
42. Gallup WD, Norris LC. The essentialness of manganese for the normal development of bone. Science 1938; 87 (2245): 18-9.
43. Strause LG, Hegenauer J, Saltman P et al. Effects of long-term dietary manganese and copper deficiency on rat skeleton. J Nutr 1986; 116 (1): 135-41.
44. Marrotte EJ, Chen DD, Hakim JS, Chen AF. Manganese superoxide dis-mutase expression in endothelial progenitor cells accelerates wound healing in diabetic mice. J Clin Invest 2010; 120 (12): 4207-19 doi.
45. Bolze MS, Reeves RD, Lindbeck FE et al. Influence of manganese on growth, somatomedin and glycosaminoglycan metabolism. J Nutr 1985; 115 (3): 352-8.
46. Leach RM, Muenster AM. Studies on the role of manganese in bone formation. I. Effect upon the mucopolysaccharide content of chick bone. J Nutr 1962; 78:51-6.
47. TalE, Guggenheim K. Effect of manganese on calcification of bone. BiochemJ1965; 95:94-7.
48. Henry PR, Ammerman CB, Littell RC. Relative bioavailability of manganese from a manganese-methionine complex and inorganic sources for ruminants. J Dairy Sci 1992; 75 (12): 3473-8.
49. Izumikawa T, Kitagawa H. Mice deficient in glucuronyltransferase-I. Prog Mol Biol Transl Sci 2010;93:19-3450. Okajima T, Fukumoto S, Furukawa K Urano T. Molecular basis for the progeroid variant of Ehlers-Danlos syndrome. Identification and characterization of two mutations in galactosyltransferase I gene. J Biol Chem 1999; 274 (41): 28841-4.
51. Sato T, Kudo T, Ikehara Y. Chondroitin sulfate N-acetylgalactosaminyl-transferase 1 is necessary for normal endochondral ossification and ag-grecan metabolism. J Biol Chem 2011; 286 (7): 5803-12.
52. Watanabe Y, TakeuchiK, Higa Onaga S et al. Chondroitin sulfate N-ace-tylgalactosaminyltransferase-1 is required for normal cartilage development. Biochem J 2010; 432 (1): 47-55.
53. Родионова НА, Шабаева KB. Опыт применения препарата Тотема при предоперационной подготовке у женщин с железодефицитной анемией. Информационное письмо для врачей. Перинатальный центр г. Ульяновск (Симбирск), 2003.
54. Стуклов Н.И. Мета-анализ переносимости питьевой формы глюконата железа (Fe2+), меди и марганца (препарат Тотема) при лечении железодефицитной анемии у детей и взрослых. Земский врач. 2012; 4 (15): 11-20.
