Лучевая терапия рака предстательной железы
Статьи| »» Содержание | Б.П. Матвеев, Б.В. Бухаркин, В.Б. Матвеев |
Глава 8. Лучевая терапия рака предстательной железы
Лучевая терапия является в настоящее время одним из ведущих консервативных специальных методов лечения рака предстательной железы как при локализованном, так и при местнораспространенном процессе.
Дистанционное облучение с применением мегавольтных источников излучения (гамма-установка, линейные ускорители и др.) рекомендуется сейчас при всех стадиях рака предстательной железы (Алиев Б.М., 1983, Свиридова Т.В., 1994, Amin P.P. et al. 1983, Bagschow М.A., 1983 и др.). Оно является альтернативой радикальной простатэктомии в начальной стадии заболевания, в случае невозможности операции в связи с сопутствующими заболеваниями или отказом больного от оперативного лечения. Лучевая терапия с успехом применяется как в случаях локализованного, так и местнораспространенного рака предстательной железы.
При этом в подходах к лучевому лечению у различных авторов имеются существенные различия, касающиеся техники и технологии облучения, объема лучевого воздействия и суммарных очаговых доз.
Противопоказаниями к проведению лучевой терапии считаются: общее тяжелое состояние больного, раковая кахексия, выраженный цистит и пиелонефрит, наличие большого количества остаточной мочи, хроническая почечная недостаточность, азотемия (Голдобенко Г.В., 1997).
Последнее десятилетие ознаменовалось значительным прогрессом в изучении возможностей лучевой терапии рака предстательной железы. Арсенал средств и методов лечения обогатился новыми подходами к лучевому лечению, ряд которых оказался весьма плодотворным. Популярность ее объясняется рядом очевидных преимуществ перед другими известными терапевтическими методами. Лучевая терапия не оказывает пагубного влияния на сердечно-сосудистую и свертывающую системы крови, изменения которых под воздействием гормонотерапии нередко приводят к преждевременным летальным исходам. В последние годы некоторыми исследователями, даже при ранних стадиях заболевания, лучевой терапии отдается предпочтение перед хирургическим лечением (радикальной простатэктомией), так как отдаленные результаты обоих методов приблизительно одинаковы, но облучение не вызывает столь серьезных лечебных последствий, как хирургическое лечение: 0.5-5% - послеоперационной летальности, 95-100% - импотенции, 10-15% - недержание мочи и пр.
Некоторые литературные данные о выживаемости больных раком предстательной железы, леченных лучевым методом представлены в табл. 34.
Таблица 34. Результаты лучевой терапии рака предстательной железы. Выживаемость за 5 и 10 лет.
| Автор | Кол-во больных |
T1 | T2 | T3 | T4 | |||
| 5 лет | 10 лет | 5 лет | 10 лет | 5 лет | 10 лет | 5 лет | ||
| Kopper B., 1988 | 112 | 83% | 59% | 83% | 59% | |||
| Reed N., 1988 | 168 | 100% | 77% | 42% | ||||
| Howleu P., 1989 | 126 | 92% | 92% | 72% | ||||
| Maruoka M., 1989 | 129 | 100% | 100% | 75% | ||||
| Zagars G., 1989 | 114 | 84% | 68% | 84% | 68% | 72% | 47% | |
| Cuban D., 1990 | 96 | 61% | 61% | |||||
| Prestone J., 1990 | 191 | 79% | 75,5% | 52,5% | 0% | |||
| Abratt P.P., 1990 | 93 | 83% | 83% | 83% | ||||
| Jrumiyama K., 1990 | 33 | 100% | 100% | 65% | 50% | |||
| Lioyd-Da-Vies, 1990 | 209 | 67% | 32% | 67% | 32% | 67% | ||
| Fuse H., 1991 | 41 | 86% | 66% | 47% | ||||
| Kuten A., 1992 | 116 | 84% | 78% | 63% | ||||
| Kaprowsky C., 1992 | 176 | 95% | 80% | |||||
Эффективность радиотерапии больных раком предстательной железы во многом зависит от качества планирования облучения. Планированию лучевой терапии и ее клинико-дозиметрическому обоснованию обычно предшествует топометрическая подготовка больных. С этой целью широко применяются такие виды рентгенологического исследования как компьютерная томография, магнитно-ядерный резонанс и др.
В последние годы для оптимизации лучевой терапии широко применяются компьютерные программы и специальные устройства, так называемое конформальное (conformal) облучение, которые позволяют с учетом гетерогенности тканей и кривизны облучаемого участка в трех проекциях выбрать наиболее рациональные условия лучевого воздействия. В качестве критериев при этом выбрана лучевая нагрузка на наружные подвздошные и обтурационные лимфатические узлы, кожу передней и задней поверхности тела больного, тазобедренный сустав. Характер распределения доз определяют во фронтальной, сагиттальной и горизонтальной плоскостях облучаемого участка тела пациента. При оценке полученных данных исходят из того, что первичная опухоль и зоны регионарного метастазирования должны облучаться равномерно с допустимым градиентом дозы 90-100%, а лучевая нагрузка на тазобедренный сустав, заднюю стенку прямой кишки и на уровне кожных покровов не должна превышать их толерантность.
На основании полученной топометрической информации проводят тщательный анализ распределения доз при различных вариантах дистанционной гамма-терапии. Общим выводом из этих исследований явилось признание рациональности использования при локализованных формах рака предстательной железы подвижных методик дистанционной гамма-терапии, т.е. облучение только первичной опухоли; при распространенности опухоли на регионарные лимфатические узлы - сочетание вариантов подвижного и статического 4-х польного перекрестного облучения с соотношением доз с передних и задних полей 2:1. Показано, что при использовании этих вариантов облучения, лучевая нагрузка на заднюю стенку прямой кишки снижается почти на 20%, на кожные покровы ягодичной области - на 20-30% по сравнению с гамма-терапией с соотношением доз 1:1 и с однозонным подвижным облучением первичной опухоли с углом качания 240° или же двухзонным облучением с углом качания 180°. Лучевая нагрузка на уровне кожных покровов лобковой зоны с соотношением доз 2:1 находится на том же уровне, что и при старых вариантах гамма-терапии с соотношением доз 1:1, составляя 60% от величины очаговой дозы облучения.
На основе комплексного обследования, тщательной дозиметрической подготовки, а также в зависимости от распространенности опухолевого процecca, выделяют следующие варианты дистанционной лучевой терапии рака предстательной железы.
1. Облучение только первичной опухоли. В зависимости от размеров новообразования, распространения его на соседние органы и тканевые структуры, применяется одно- или двухзонная подвижная дистанционная гамма-терапия с требуемыми разведениями осей ротации, углами вращения 90°-120°. При инфильтрации одной или двух боковых стенок таза используется методика двухзонной ротации с углами качания 60°-90°. Размер поля на оси ротации, в зависимости от параметров опухоли, колеблется от 4 х 8 до 9 х 11 см. При этом в зону облучения включается первичная опухоль, шейка мочевого пузыря, передняя стенка прямой кишки с постепенным снижением поглощенных доз в направлении задней ее стенки, а также к тазобедренному суставу, до уровня ниже их толерантности. В зависимости от величины и конфигурации предстательной железы, изменяются размеры полей облучения, сектор качания и расстояние между осями качания в условиях двухзонного подвижного облучения. Если одна из долей железы увеличена, а другая имеет небольшие размеры, необходимо со стороны большего поражения железы увеличить только одно поле облучения. Разовая доза 1,8-2 Гр, суммарная - 65-70 Гр. Перерыв на дозе 30-40 Гр и продолжение облучения через 2-3 недели. Показания: ранние стадии заболевания - T1-2N0M0.
2. Облучение первичной опухоли и регионарных лимфатических узлов таза. Дистанционная гамма-терапия проводится с 4-х статических полей под углом 45° - два поля спереди, два сзади, с соотношением лучевой нагрузки с передних и задних полей 2:1. Для охвата опухоли и путей регионарного метастазирования 90-100% изодозой нижний край поля облучения располагается на уровне ануса, верхний - на уровне первого крестцового позвонка - места перехода внутренней и наружной цепочек лимфатических коллекторов в общую. Наружная граница поля проходит по линии, пересекающей внутренний край вертлужной впадины. После суммарной очаговой дозы 45 Гр поля уменьшаются в размерах и облучение проводится только на первичную опухоль одно- или двухзонной секторной ротацией до общей дозы 65-70 Гр. Углы качания варьируют при однозонной ротации от 90° до 120°, при двухзонной - от 60° до 90°. Облучение осуществляется в дозе 20-25 Гр (РОД 1,8-2 Гр) после перерыва в 2-3 недели. Показания: больные раком предстательной железы в стадии заболевания - T1-2N1-3M0, T3-4N0-x М0. При Т1-2NxM0 - суммарная доза на регионарные лимфатические узлы может быть ограничена дозой 45 Гр, на предстательную железу доза доводится до 65-70 Гр. При наличии метастатического поражения лимфатических узлов, общая суммарная доза на них доводится до 50-60 Гр.
3. Облучение первичной опухоли и лимфатических узлов таза с включением парааортальной и общей подвздошной групп лимфатических коллекторов. Лучевая терапия при этом проводится на фоне приема гормональных препаратов. Сначала облучению подвергается первичная опухоль и регионарные лимфатические узлы до общей очаговой дозы 40-45 Гр. На втором этапе расщепленного курса, после перерыва 2-3 недели, подключается облучение общих подвздошных и парааортальных лимфатических узлов с двух-фигурных полей, имеющих форму перевернутой буквы "U" с экранированием спинного мозга и почек до суммарной очаговой дозы 40 Гр. Затем продолжается облучение первичной опухоли суженными полями подвижным методом до общей очаговой дозы 65-70 Гр при значении разовой дозы 1.8-2 Гр. Показания: распространение опухоли на юкстарегионарные лимфатические узлы - Т1-4N2-3M0.
Больший объем тканей облучают на первом этапе лучевого лечения. Разовую очаговую дозу 1.8-2 Гр подводят ежедневно 5 раз в неделю. Суммарная очаговая доза достигает 45-50 Гр. Затем проводят облучение только предстательной железы и прилежащих тканей. Большинство авторов полагают, что рациональная суммарная очаговая доза, рассчитанная в центре железы должна составлять при Т0-1 - 60 Гр, при Т2 - 60-65 Гр, при Т3 - 65-70 Гр, при Т4 - более 70 Гр. При этом доза на расстоянии 4 см от центра железы должна достигать при Т0-2 -6 0 Гр, при Т3 - 65-70 Гр и при Т4 - более 70 Гр (Hanks G. et al., 1985).
При использовании высокоэнергетического излучения ускорителей (> 10 Мэв) облучение первичной опухоли и лимфатических узлов таза рекомендуется проводить с двух противолежащих полей (переднего и заднего), либо с четырех полей (переднего, заднего и двух боковых). Используя фотоны ниже 18 Мэв, передне-задними полями можно подвести дозу до 45 Гр и дополнительную дозу путем подключения боковых полей (Голдобенко Г.В., 1997).
Последние литературные данные свидетельствуют о серьезных достижениях лучевого метода лечения. Так группа RTOG привела отдаленные результаты лучевого лечения крупнейших лечебных учреждений, занимающихся этой проблемой. Они представлены в табл. 35.
Таблица 35. Отдаленные результаты лучевой терапии рака предстательной железы в % (RTOOG, Dearnaley D. ,1998).
| Стадия | Кол-во больных |
Локальный рецидив | Безрецидивная выживаемость | Общая выживаемость | ||||||
| 5 лет | 10 лет | 15 лет | 5 лет | 10 лет | 15 лет | 5 лет | 10 лет | 15 лет | ||
| Т1 | 583 | 3-6 | 4-8 | 17 | 84-85 | 52-68 | 39 | 83-95 | 52-76 | 41-46 |
| Т2 | 1117 | 12-14 | 17-29 | 32-35 | 66-90 | 27-85 | 15-42 | 74-78 | 43-70 | 22-36 |
| Т3 | 2292 | 12-26 | 19-31 | 25-56 | 32-60 | 14-16 | 17-40 | 56-72 | 32-42 | 23-27 |
Bagshaw M.A. et al.,1994, сообщили отдаленные результаты дистанционной лучевой терапии у 1245 пациентов со стадией Т1-2 при сроке наблюдения 31.5 года (медиана - 7.8 лет). Общая 15-летняя выживаемость больных не имевших метастазов в лимфатические узлы составила 53%.
Hanks et al.,1997, приводят результаты 3-летней (биохимической) безрецидивной выживаемости 233 пациентов с клинической стадией Т3 в зависимости от уровня ПСА перед началом лечения.(табл. 36)
Таблица 36. 3-летняя безрецидивная выживаемость больных раком предстательной железы в стадии Т3 в зависимости от уровня ПСА перед лечением и дозы радиации (Hanks et аl .,1997).
| Доза | ПСА 10-19,9 | ПСА > 20 |
| 70 Гр | 69% | 36% |
| 75 Гр | 80% | 46% |
| 80 Гр | 89% | 57% |
Мнения относительно дополнительных лечебных мероприятий на фоне облучения расходятся. Так И.А. Клименко и соавт.(1976), М.С. Старичков и соавт. (1980), С.И. Ткачев (1982) рекомендуют облучение на фоне гормонотерапии больным в стадии T3-4, Green et al. (1975) считают эстрогенотерапию благоприятной при прогрессирующих опухолях перед началом лучевого лечения с целью уменьшения объема мишени предстоящего облучения. Некоторые авторы (Klosterhalfen et al., 1982) в стадии Т3 дополняют лучевое лечение гормонами и кастрацией. При наличии симптомов инфравезикальной обструкции с хронической задержкой мочи на первом этапе проводят трансуретральную резекцию предстательной железы (ТУР) или операции отведения мочи с последующей (на 2 этапе) лучевой терапией.
В последние годы определенную новизну представляют попытки разработать дифференцированные показания к лучевой терапии в зависимости от степени злокачественности опухоли. С точки зрения Алиева Б.М. (1985) лучевое лечение всех недифференцированных вариантов рака предстательной железы должно вестись на фоне гормонотерапии независимо от стадии. Свиридова Т.В. с соавт. (1984, 1994) расширяют показания к комплексному гормонально-химиолучевому лечению, полагая, что оно должно применяться во всех стадиях низкодифференцированного и анапластического рака, а лучевая терапия в самостоятельном варианте должна использоваться при стадиях Т1-3 высоко- и умеренно-дифференцированного рака без поражения регионарных лимфоузлов.
Данные последних лет свидетельствуют о преимуществе комбинированного гормоно-лучевого лечения у больных раком предстательной железы с неблагоприятным прогнозом. Так в исследовании EORTC, включающем 401 пациента раком предстательной железы в стадии Т1-2 G 3 и стадиях Т3 и Т4 без отдаленных метастазов показано улучшение результатов лечения при применении адъювантной терапии аналогами LНRH, в частности, золадексом (Воllа M. et аl., 1998). Эти данные представлены в табл. 37.
Таблица 37. 5-летние результаты адъювантной гормонотерапии в комбинации с лучевой терапией больных раком предстательной железы в % (EORTC, 1998).
| Вид лечения | Отсутствие местных проявлений |
Отсутствие метастазов |
Безрецидивная выживаемость |
Общая выживаемость |
| Радиотерапия | 75 | 56 | 44 | 56 |
| Радиотерапия + золадекс |
95 | 89 | 85 | 78 |
| Р | < 0.001 | < 0.001 | < 0.001 | 0.001 |
Представляют несомненный интерес результаты другого крупного рандомизированного исследования американской онкологической радиологической группы (RTOG), показавшей преимущества адъювантной терапии гозерелином (золадексом) в сочетании с радиотерапией по сравнению с самостоятельной радиотерапией (Pilepich M.V. et аl., 1997). При рандомизированном исследовании, включавшем 945 пациентов, 477 вошли в группу получавших адъювантную терапию гозерелином, а 468 в чисто лучевую, 5-летний анализ показал, что 84% в первой группе и 71% во второй не имели локального рецидива (р < 0.0001). Отсутствовали отдаленные метастазы соответственно у 83% пациентов первой, и у 70% второй группы (р < 0.001); безрецидивная выживаемость соответственно составила 60% и 44% (р < 0.0001). В случаях если уровень сывороточного ПСА превышал 1.5 нг/мл после года лечения, безрецидивная выживаемость составляла в первой группе - 53%, во второй - 20% (р < 0.0001). У пациентов с градацией Глисона 8-10 пятилетняя выживаемость в первой группе составила 66%, а во второй - 55% (р=0,03). Исследователи пришли к заключению, что адъювантная гормонотерапия гозерелином в сочетании с лучевой терапией улучшает показатели безрецидивной выживаемости, отдаляет сроки отдаленного метастазирования. Однако достоверное повышение выживаемости наблюдается у пациентов с высокой градацией Глисона, то есть с плохим прогнозом.
Адъювантная лучевая терапия. Роль адъювантной лучевой терапии в комплексном лечении рака предстательной железы широко обсуждается в последнее время. Особенно обнадеживающие результаты получены после радикальной простатэктомии в стадии рТ3. Anscher М. & Prosnitz L, 1987, сообщили результаты исследования 159 пациентов в патологической стадии Т3, часть которых получала адъювантную лучевую терапию, другая часть составила контрольную группу, 15-летние результаты наблюдения показали клинически значимое преимущество в отношении локального контроля, безрецидивной и общей выживаемости в группе адъювантной лучевой терапии (рис. 17).
Рисунок 17. Эффективность адъювантной лучевой терапии в лечении рака предстательной железы стадии рТ3.
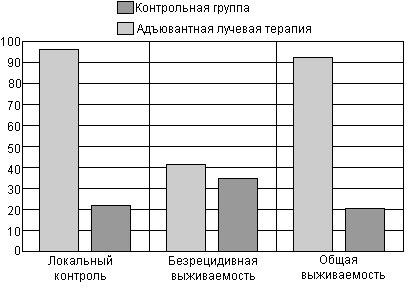
Хорошие результаты адъювантной лучевой терапии приводят Meier R. et аl., 1992. 10-летние результаты наблюдения показали статистически значимое преимущество в группе адъювантной лучевой терапии у больных с выходом опухоли за пределы капсулы. Так локальный рецидив через 10 лет в контрольной группе возник в 31% наблюдений, а в группе адъювантной терапии лишь в 6% (р-0.005). 10-летняя безрецидивная выживаемость составила 45% и 90% соответственно (р-0.08).
Учитывая частое выявление патологической стадии рТ3 после радикального хирургического лечения, Porter А.Т. et аl., 1997, предлагают следующую схему лечения этих пациентов в зависимости от клинической ситуации (табл. 38).
Таблица 38. Схема лечения больных раком предстательной железы в стадии рТ3.
| Клиническая ситуация | Предлагаемое лечение |
| "Позитивные" края, отсутствие экстракапсулярной инвазии, ПСА - 0 | Наблюдение |
| "Позитивные края", экстракапсулярная инвазия или наличие послеоперационного уровня ПСА | Дистанционная лучевая терапия на ложе удаленной предстательной железы в суммарной дозе 55 Гр. |
| "Позитивные" края, наличие макроскопически определяемого, не удаленного опухолевого субстрата или рецидива после радикальной простатэктомии | Дистанционная лучевая терапия на область ложа предстательной железы и на область таза в дозе 70 Гр. |
| Инвазия в семенные пузырьки, при отсутствии макроскопически видимого поражения окружающих тканей | Гормональная терапия |
| Инвазия в семенные пузырьки с большой площадью "позитивных" краев | Дистанционная лучевая терапия в сочетании с гормональной терапией |
Переносимость дистанционного облучения обычно удовлетворительная. Наш опыт указывает на возможность ее применения даже в амбулаторно-поликлинических условиях. Непосредственные местные лучевые реакции разной степени выраженности наблюдаются у большинства больных со стороны нижних мочевых путей и ректосигмоидного отдела толстой кишки. Они ликвидируются обычно в течение ближайших 3-х месяцев; некоторые симптомы могут сохраняться до 1 года, причем у 95% больных они купируются консервативными мероприятиями. Отдаленные лучевые последствия со стороны мочевых путей в виде циститов и уретритов, включая транзиторные макрогематурии - 0.8-32%, стриктуры уретры - 4-12% 3). Поздние проктиты и аноректальные стриктуры отмечаются соответственно от 4.5% до 42% и от 1.5% до 10% (Becker J.J., 1981, Rangala N. et.al., 1983). Однако хирургического лечения перечисленные осложнения требуют редко. Половая функция сохраняется у 60-70% из тех больных, у которых она была сохранена до облучения (Ray G.R., 1973, Bagschow M.A., 1983).
Возможные ближайшие и отдаленные осложнения лучевого лечения, представленные американской группой RTOG для пациентов со стадией Т1-Т2 отражены в табл. 39. (de Kernion J., Belldegrun A. & Naitooh J.,1998).
Таблица 39. Ближайшие и отдаленные осложнения лучевой терапии в %.
| Вид осложнения | Ближайшие | Отдаленные |
| Ректальное кровотечение | 3.8-14.9 | 0-2.7 |
| Диарея | 10-12 | 0.4-2 |
| Недержание мочи | 0-1.4 | 0-1.5 |
| Гематурия | 5.8-10.8 | 1-2.8 |
| Эректильная дисфункция | - | 55-66 |
| Стриктура уретры | 1.5-8.3 | 0-8.0 |
С целью профилактики лучевых реакций и осложнений Голдобенко Г.В., 1997, рекомендует комплекс мероприятий, включающий:
1) Исключение из рациона острой и соленой пищи, отказ от употребления алкоголя,
2) Поддержание гигиены половых органов и промежности.
3) При наличии цистита или пиелонефрита перед началом лучевого лечения провести антибактериальную терапию в соответствии с данными чувствительности микрофлоры мочи к антибиотикам.
4) При выраженном затруднении мочеиспускания начинать лечение с гормонотерапии или проводить лучевую терапию постепенно увеличивая разовую дозу с 0.5-1 Гр до 2 Гр к 3-4 сеансу. При этом у некоторых больных ликвидируются явления сопутствующего простатита и мочеиспускание после 2-3 сеанса облучения становится более свободным.
5) Не проводить непосредственно перед началом и в процессе облучения манипуляций на уретре (катетеризации, цистоскопии), и начинать облучение не ранее чем через 4-5 недель после ТУР,
6) Применять расщепленный курс облучения с перерывом между первым и вторым этапом на 2-3 недели при дозе 45-50 Гр у ослабленных больных,
7) При явлениях лучевого ректита применять свечи с белладонной, анестезином, метилурацилом, масляные микроклизмы.
Подобный комплекс мероприятий позволяет выполнить намеченную программу лучевого лечения у больных раком предстательной железы в более комфортных условиях с наименьшим числом лучевых реакций и осложнений.
В последние годы появились отдельные публикации о применении локальной электромагнитной гипертермии у больных раком предстательной железы. Это объясняется тем, что было установлено, что тепловое воздействие свыше 42°С повышает чувствительность опухолевых клеток к действию ионизирующего излучения. Последнее объясняется временной инактивацией ферментов репаративного комплекса или нарушением координации пострадиационных восстановительных процессов в опухоли. Кроме того установлено, что перегревание новообразования вызывает непосредственную гибель опухолевых клеток - особенно их гипоксических популяций.
Локальная гипертермия применялась как паллиативное средство у больных с генерализированным гормоно- и химиорезистентным раком для уменьшения первичной опухоли и восстановления нарушенного мочеиспускания (Голдобенко Г.В. и соавт, 1990, Mendecki J. et аl., 1980, Servadio С. et al., 1984), либо как адъювант при эндокринном или лучевом лечении. В основном рассматриваются вопросы переносимости и методики проведения гипертермии, распределения температуры в опухоли и нормальных тканях, либо технические характеристики аппарата и аппликаторов.
Большинство авторов рекомендуют проводить локальную гипертермию 1-3 раза в неделю с температурой в опухоли 42-43°С в течение 45-60 минут с помощью внутриполостных антенн, излучающих электромагнитные волны трансректально. Трансуретральная электромагнитная гипертермия, при которой частота осложнений достигает 20%, применяется ими в основном как самостоятельное лечение больных с аденомой предстательной железы.
Prionas et аl, представил благоприятные результаты сочетанной лучевой терапии 34 больных местно-распространенным раком предстательной железы в комбинации с внутритканевой электромагнитной гипертермией (45 мин, t=49°С). Последняя выполнялась после окончания этапа дистанционного конвенциального облучения первичной опухоли и зон регионарного метастазирования (СОД - 50 Гр) непосредственно перед внутритканевым введением Ir192. Доза при этом достигала 30 Гр.
Удовлетворительная переносимость, возможность создать в опухоли температуру 42-43°С, предварительные благоприятные результаты послужили основой для дальнейшего углубленного изучения локальной гипертермии в комбинации с лучевой терапией у больных с местнораспространенным раком предстательной железы.
За период с 1985 по 1993 год в урологическом отделении ОНЦ РАМН мы наблюдали 174 больных с местнораспространенным раком предстательной железы в стадии T1-4Nx-3M0. 63 больных получали только дистанционную мегавольтную лучевую терапию, у 110 - последняя сочеталась с локальной микроволновой гипертермией.
Анализируя полученные результаты лучевого и термолучевого лечения местно-распространенного рака предстательной железы, следует отметить, что сочетание дистанционной мегавольтной лучевой терапии с локальной микроволновой гипертермией позволяет увеличить число больных с полной регрессией первичной опухоли с 65% до 92.7%. Отмечается явная тенденция к ускорению регрессии опухоли в первые 6 месяцев от окончания лечения в группе термолучевой терапии. Эти показатели выросли с 51.2% до 84.3% (р < 0.0001).
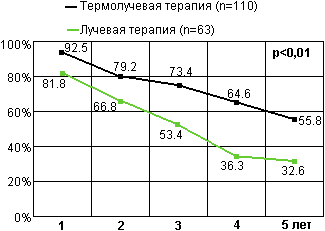
3 и 5-летняя выживаемость увеличилась с 68.8% до 86.8% и с 47.2% до 72.8% соответственно (р < 0.001). Отмечено явное улучшение показателей безрецидивной выживаемости: 3-летней с 58.4% до 73.3% и 5-летней с 32.6% до 55.7% (р < 0.01) (рис. 18-19).
Рис. 18. Выживаемость больных местно-распространенным раком предстательной железы (данные ОНЦ).
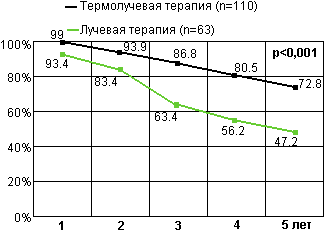
Рис. 19. Безрецидивная выживаемость больных местно-распространенным раком предстательной железы (данные ОНЦ).
Наилучшие результаты лечения получены при 3-5 сеансах гипертермии, дальнейшее увеличение количества сеансов не приводило к увеличению показателей выживаемости.
Естественно, что результаты лечения зависят от величины опухоли, и они значительно лучше при небольших объемах опухоли при отсутствии регионарных метастазов. При распространенных процессах с наличием регионарных метастазов существенной разницы в сроках выживаемости не получено.
Брахитерапия. Одним из методов улучшения результатов лечения является сочетание с дистанционной лучевой терапией, либо самостоятельное применение внутритканевой имплантацией радиоактивных препаратов, так называемая брахитерапия. Сущность ее заключается во введении под контролем УЗИ в предстательную железу гранул радиоактивного I125 . Одним из видов ее является разработанная американской компанией "Амершам" система I125 RAPID Standart, которая состоит из контейнера, содержащего 10 капсул, находящихся на расстоянии 1 см друг от друга. Это расстояние соответствует расположению капсул на специальной имплантационной игле. Процедура введения капсул занимает не более часа и проводится в амбулаторных условиях, что, естественно, выгодно отличает ее от других видов лучевого лечения.
Результаты брахитерапии рака предстательной железы начальных стадий вполне обнадеживающие. Так наблюдение за 451 пациентом в стадии Т1-2 в течение 6 лет в 91% случаев показали стойкий положительный эффект. (Northwest Cancer Foundation).
Интересны сравнительные данные различных методов лучевой терапии, приводимые Seung S.K. et аl., 1998, проанализировавших результаты 8 крупных исследований в этой области, включающих в общей сложности 2000 больных со стадией Т1-2b, сроки наблюдения за которыми составили от 3 до 7 лет. (табл. 40)
Таблица 40. Результаты лечения рака предстательной железы начальных стадий различными видами лучевого воздействия.
| Вид лечения | Выживаемость без повышения ПСА |
То же при ПСА < 4 нг/мл |
То же при ПСА > 4 < 10 нг/мл |
| Конвенциальное (стандартное) облучение 60-87 Гр |
70-75% | 82-91% | 43-69% |
| Конформальное (3-х прекционное) облучение 64.8-81 Гр. |
62% | - | - |
| Брахитерапия I125 | 43-69% | 94-100% | 70-90% |
Deger S. et аl., 1998, сообщили о результатах лечения 175 пациентов с локализованным раком предстательной железы, которым наряду с наружным облучением (45-50 Гр) в предстательную железу под контролем УЗИ имплантировали зерна иридиума 192. Через 3 месяца после лечения отмечалось снижение ПСА (средние показатели) с 13.3 нг/мл до 1.37 нг/мл; через год до 0.87 нг/мл, а через 2 года до 0.67 нг/мл. Через год после окончания лечения у 108 пациентов проведена биопсия, оказавшаяся негативной у 51%, через 2 года - эта цифра составила 69%.
К осложнениям брахитерапии относятся повреждения окружающих тканей. Уретро-везикальные и уретро-ректальные свищи, встречающиеся относительно редко.
Резюмируя, следует отметить, что дистанционная лучевая терапия является методом выбора и зачастую предпочтения, особенно для гериатрических контингентов, обладая такими преимуществами, как высокая клиническая эффективность, неинвазивный характер вмешательства, отсутствие риска летальности, органосохранный характер лечения, высокий шанс сохранения половой потенции, удовлетворительную переносимость. Перечисленные преимущества в сочетании с экономической доступностью обеспечивают большое клиническое значение метода в масштабах массового применения и огромные возможности дальнейшего совершенствования.
Паллиативное лучевое лечение. Необходимость паллиативного лучевого лечения метастазов у больных раком простаты общеизвестна, так как свыше половины первичных больных обращается уже в стадии генерализации. Наиболее часто приходится встречаться с метастатическим поражением скелета, особенно позвоночника, зачастую заканчивающимся неврологическими проявлениями компрессионного синдрома спинного мозга, полиневралгиями в связи с циркуляторными нарушениями. Реже встречаются патологические переломы трубчатых костей.
При лучевом лечении костных метастазов, в основном проводится облучение очагов поражения. Показана удовлетворительная эффективность дистанционной лучевой терапии в различных режимах облучения (при суммарных дозах 20-55 Гр) (Voss F.S. et аl., 1983, Madsen E., Undengaard F., 1983 и др.).
В частности отмечено уменьшение болевого синдрома у 71% больных, а полного его устранения - у 36% (Reddy E.K. et аl., 1983). Некоторые авторы сообщают, что удалось полностью снять боли у 42%, а у 35% уменьшить их в среднем на срок 5-7 месяцев (Benson R.S. et аl., 1982). При поражениях позвоночного столба рекомендуется применение ортопедических пособий.
Лучевая терапия при компрессионных синдромах спинного мозга является методом выбора перед нейрохирургическими вмешательствами (ламинэктомия). Следует иметь ввиду, однако, такие важные прогностические факторы, как сроки лучевого воздействия (оно особенно целесообразно в первые 2-е суток) и степень компрессии (тотальный или субтотальный блок, изолированное или множественные поражение).
При массированной генерализации прибегают к тотальному облучению или облучению половины тела (Rowland C.G. et аl., 1981). Последнее является более щадящим. Анальгезирующий эффект начинался уже в первые сутки и отмечался у многих больных.
В последнее время находит применение метод внутривенного введения радиоактивного стронция Sr89 обладающего выраженным обезболивающим эффектом при костных метастазах, о чем подробнее будет сказано в главе "Симптоматическая терапия".
Литература
Алиев Б.М. В кн.: Стандартизация методов лучевой терапии. - Л., 1983.- С. 57-59.
Голдобенко Г.В. Лучевая терапия больных раком простаты. Материалы Европейской школы онкологов. ОНЦ им. Н.Н. Блохинаю М.,1997.
Голдобенко Г.В., Матвеев Б.П., Ткачев С.И. и др. Лучевое воздействие и локальная гипертермия в лечении рака предстательной железы. Урол. и нефр., 1990, N4, с. 35-57.
Дунаевский Я.А., Арье В.М., Мышко И.В. Показания к кастрации при раке предстательной железы. В сб. "Диагностика и лечение онкоурологических заболеваний", 1991, с.134-138.
Клименко И.А., Сухенко В.М., Черниченко В.А., Мацуй В.И. Дистанционная лучевая терапия больных раком предстательной железы. Метод, рекоменд.- Киев, 1976.
Лопаткин Н.А., Хазанов В.Г. Протонное облучение гипофиза в комплексном лечении больных раком предстательной железы. Урол. и нефр., 1984, N2, с. 3-9.
Макарова Г.В., Матвеев Б.П., ГориловскииЛ.М. В кн.: Молдавская конф. респ. онкологов, 7-я. Тезисы докладов. -Кишинев, 1983. -с.21-22.
Макарова Г.В., Матвеев Б.П., Рябинский B.C., ГориловскииЛ.М. В кн.: Всесоюзный съезд урологов, 3-й. Материалы. Минск, 1984. -с.410-411.
Матвеев Б.П., Бухаркин Б.В. Консервативное лечение больных раком предстательной железы. В кн.: "Пленум Всеросс. общ. урологов", - Саратов, 1994. - с. 133-143.
Свиридова Т.В. Комплексное гормонально-лучевое лечение больных раком предстательной железы IV стадии. В кн.: Пленум Всеросс. общ. урологов.- Саратов, 1994. -С.170-171.
Свиридова Т.В., Дунчик В.Н., Мардынский Ю.С., Цодикова Л.Б. Урология и нефрология. -N 2. - с.9-13.
Свиридова Т.В., Дунчик В.Н., Мордынский Ю.С. и др. Комплексное лечение больных раком предстательной железы. Урол. и нефр. 1984, N2, с.9-13.
Ткачев С.И. Дистанционная гамма-терапия рака предстательной железы. Дисс. канд. мед. наук.- М., 1982.
Ткачев С.И. Повторная лучевая терапия больных раком предстательной железы. В сб. "Диагностика и лечение онкоурологических заболеваний", 1987, с.112-114.
Amin P.P., Salazar O.M. Int. J. Radiat. Oncol.- 1983. -V 9. -N 1. -P.90.
Anscher V., Prosnitz L. J. Urol. 1987, Vol. 138, p 1407-1412.
Arvis G. Sem. Hop.- Paris, 1977. -V 53. -P.255-257.
Bagsрaw V.A., Cox К.S., Hancoch S.L. Control of prostate cancer with radiotherapy: long-term results. J. Urol. 1994, Vol 152, P 1781-1785.
Bagshow M.A. In: Cancer of the Prostate and Kidney. New York, 1983. -P.283-294.
Bagshow M.A. Int. J. Radiat. Oncol.- 1983. -V 9. -N 1. -P.59-60.
Beiler D.D., Wright D.J., Reddy G.W. Int. J. Radiat.Oncol.- 1981. -V 7. -P.885-890.
Benson К.C., Hasan S.M.,Jones A.G. et al. Ibid. 1982. -V 127. -P.69-71.
Bolla M., Gonzalez D., Kurth J. et al. Adjuvant hormonal therapy with goserelin improves survival in patients with localy advansed prostate cancer treated with radiotherapy. Abstracts from the XIII congress of the EAU, Barselona. 1988, 537.
Deger S., Dinges S., Roigas J. et al. Combinet irradiation therapy of prostate cancerwith interstitial iridium 192 afterloading. Abstracts from the XIII congress of the EAU, Barselona. 1988, 217.
Green N., Melbye R.W., Lipsett J. et al. Urology. 1975. -V 6. -P.287-290.
Hanks G.E., Schultheiss Т.Е., Hanlon A.L. et al. Optimization of conformal radiation treatment of prostate cancer: report of a dose escalation study. IJROBP. 1977.
Heintz J., Le Fur R., Graic J et al. Sem. Hop.- Paris, 1983. -V59. -P.2557-2560.
Klein L.A. J. Christ. med. Ass. India- 1979. -V 54. -R216-231.
Klosterhalfen H., Altenahr E., Franke H.D. Das Prostatakarzinom.- Stuttgart, 1982.
Kutzner J., Dahnert W., Schreyer T. et al. Nukiearmedizin.- 1981. -Suppl.18. -S.1019-1022.
Madsen E., Undegaard F. Int. J. Radiat. Oncol.- 1983. -V 9. -P.1775-1779.
Meier R., Mark R., Royal L. et al. Postoperative radiation therapy after radikal prostatec-tomytor prostate carcinoma. Cancer. 1992, Vol.70, p 1960-1966.
Mendecki J., Friedenthal E., Botstein С et al. Int. J. Radial. Oncol.- 1980. -V 6. -P.1583-1588.
Pezer C.A. Int. J. Radial. Oncol.- 1983. -V 9. -P. 1427-1438.
Pilepich B.W. Int. J. Radiat. Oncol.- 1983. -V 9.- Suppl 1. -P.105.
Pilepich M.V., Caplan R., Byhardt R.W. et al. Phase III Trial of Andrjgen Supression Using Goserelin in Unfavorable- Prognostik Carcinoma of the Prostate Treated with Definitive Radiotherapy: Report of RTOG Protocol 85-31. J. Clin. Oncol , Vol 15, N3, 1977.p 1013-1021.
Porter A.T., Williams A., Forman J.D. Adjuvant radiation therapy for pathologic T3 prostate cancer. Canad. J. Urol., 1997, Vol.4, p 57-60.
Rangala N., Cox J.D., Byhardt P.W. et al. Int. J. Radiat. Oncol.- 1983. -V 8. -P.1909-1914.
Ray G.R., Cassady J.K., Bagshow M.A. Radiology.- 1973. -V 106. -P.402-418.
Reddy E.K., Mansfield С.M., Giri S. et al. Int. J. Radiat. Oncol.- 1983. -V 9.-Suppl.1, -P. 120.
Rodriges-Antuanez A., Cook S.A., Jelden G.L. et al. Amer. J. Roentgenol.- 1973. -V 118. -P.876-880.
Rowland C.G., Bullimore J.A., Smith J.B. et al. Brit. J. Urol.- 1981. -V53. -P.628-629.
Servadio C., Leib L. Prostate.- 1984. -V 5. -P.205-211.
Taylor W.J., Richardson R.G., Hafermann M.D. Cancer (Philad.).- 1979. -V 43. -P.1123-1127.
Voss A.C., Ziegler F. Klin.-radiol. Semin.- 1983. -Bd 13. -S.116-124.
Комментарии
ПРАКТИКА ПЕДИАТРА
