Опыт применения препаратов трехосновного железа (мальтофер и венофер) в лечении анемии у больных с хронической почечной недостаточностью на додиализном этапе
Статьи
Милованов Ю.С., д.м.н., ведущий научный сотрудник отдела нефрологии НИИ уронефрологии и репродуктивного здоровья человека ГОУ ВПО Первый МГМУ им. И.М. Сеченова Минздравсоцразвития России
Милованова Л.Ю. , к.м.н., научный сотрудник отдела нефрологии НИИ уронефрологии и репродуктивного здоровья человека ГОУ ВПО Первый МГМУ им. И.М. Сеченова Минздравсоцразвития России
Козловская Л.В. , д.м.н., профессор кафедры терапии и профболезней медико-профилактического факультета, ведущий научный сотрудник отдела нефрологии НИИ уронефрологии и репродуктивного здоровья человека ГОУ ВПО Первый МГМУ им. И.М. Сеченова Минздравсоцразвития России
Use of trihydric iron preparations in treatment of anemia in patients with pre-dialysis renal failure
Цель. Изучение частоты анемии и дефицита железа у больных хронической болезнью почек (ХБП) III - IV стадий с оценкой у них эффективности препаратов трехвалентного железа.
Материал и методы. В исследование включено 243 больных хроническим гломерулонефритом (ГН), разделенных на группы: 1 группу составили 211 больных хроническим ГН, среди них 123 с ХБП III стадии (СКФ 30-59 мл/мин/1,73 м2) (1а), и 88 с ХБП IV стадии (СКФ 15-29 мл/мин/1,73 м2) (16). В группу 2 включены 45 больных с системными заболеваниями: 30 больных с III стадией ХБП (2а) и 15 - с IV стадией ХБП (26). Группу 3 (контроль) составили 32 больных, среди которых 17 больных с III стадией ХБП (За) и 15 больных - с IV стадией ХБП (36). Больные из группы 3 за время наблюдения (24 - 48 мес) по личной мотивации не лечились (не соблюдали диету, не принимали фосфатсвязывающих и антигипертензивных препаратов), коррекция анемии у них не проводилась. У 141 больного с гипохромной анемией III (40 больных) и IV (101 больных) стадиями ХБП была оценена эффективность перорального (Мальтофер) и внутривенного (Венофер) препаратов трехвалентного железа.
Результаты. Анемия выявлена у 185 (84,2%) больных ХБП III - IV стадий; частота анемии увеличивалась по мере снижения скорости клубочковой фильтрации (СКФ). У больных системными заболеваниями анемия выявлялась уже при умеренном снижении СКФ, частота ее оказалась достоверно выше по сравнению с больными ХГН, имевшими аналогичные показатели. В группе пациентов с системными заболеваниями также достоверно чаще выявлялся дефицит железа. Мальтофер и венофер эффективно корректировали анемию у больных ХБП III - IV стадии;серьезных нежелательных явлений при применении этих препаратов отмечено не было.
Заключение. Анемия часто встречается при ХБП III - IV стадий, особенно у больных системными заболеваниями, при которых более выражен и дефицит железа; в лечении этих пациентов эффективны препараты трехвалентного железа.
Aim. Study of prevalence of anemia and iron deficiency in patients with chronic kidney disease (CKD) stage III - IV and assessment of trihydric iron preparations. Methods. 234 patients with chronic glomerulonephritis (primary and in systemic diseases) were included into the study; all of them had CKD III - IV stage. In 141 patients oral (Maltofer) and intravenous (Venofer) trihydric iron preparations were used.
Results. Anemia was revealed in 185 (84,2%) patients with CKD III - IV stages; prevalence of anemia increased according to glomerular filtration rate (GFR) decrease. In patients with systemic diseases anemia and iron deficiency were found more often even in mild decrease of GFR. Maltofer and Venofer were effective in anemia correction in CKD stage III - IV patients.
Conclusion. Anemia is frequent in CKD stage III - IV patients, especially in systemic diseases; in its correction trihydric iron preparations are effective.
Keywords: anemia, prevalence, chronic kidney disease, iron deficiency, trihydric iron.
Ключевые слова: анемия, распространенность, хроническая болезнь почек, дефицит железа, трехвалентное железо.
Анемия при хронической болезни почек (ХБП) развивается уже на ранней стадии почечной недостаточности и нарастает пропорционально снижению скорости клубочковой фильтрации (СКФ) [1,2]. В генезе анемии при ХБП основная роль принадлежит снижению способности почек синтезировать эритропоэтин в количествах, адекватных для поддержания гемопоэза [3, 4]. Нефрогенная анемия характеризуется наличием нормохромных нормоцитарных эритроцитов в крови и гипоплазией эритроидных клеток в костном мозге [5, 6]. Однако в дальнейшем, по мере нарастания уремии вследствие нарушения всасывания железа в ЖКТ, кровопотерь, или из-за повышенного расхода железана потребности эритропоэза при лечении препаратами эпоэтина развивается дефицит железа, и кроветворение становится железодефицитным [7, 8]. Железо в составе гема - структурной единицы гемоглобина осуществляет связывание, транспорт и перенос кислорода к тканям, в соединении с хромопротеидами тканей участвует в процессах биологического окисления [9].
Коррекция анемии у больных с ХБП III-V стадий основывается на сочетанном применении препаратов эпоэтина и железа [1, 9]. Для полной реализации пролиферативных возможностей эритроидного ростка необходимо, чтобы содержание железа в организме соответствовало уровню эритропоэтина. При недостаточном поступлении железа в костный мозг снижается продукция эритроцитов, а при глубоком дефиците железа нарушается синтез гемоглобина и развивается железодефицитное кроветворение [1,9].
Способы, дозы и кратность введения препаратов эпоэтина для лечения анемии у больных на разных стадиях ХБП определены американскими (NKF-K/DOQI, 2002) и европейскими (EBPG, 2004) рекомендациями [8, 9], в отношении препаратов железа на додиализных стадиях ХБП единые регламентирующие правила отсутствуют.
Целью настоящего исследования была оценка частоты анемии и дефицита железа у больных хроническим гломерулонефритом (ГН) и нефритом при системных заболеваниях с почечной недостаточностью -хронической болезнью почек III-IV стадий, а также определение стратегии лечения препаратами железа данной группы больных с позиций их эффективности и безопасности.
Материал и методы
Обследовано 288 больных ГН, из них 243 хроническим ГН и 45 ГН при системных заболеваниях - 33 системной красной волчанкой (СКВ) и 12 различными системными васкулитами. Системные заболеваниядиагностировали по критериям, принятым для каждой нозологической формы.
В зависимости от стадии ХБП и этиологии больные были рандомизированы на 3 группы (табл. 1). 1 группу составили 211 больных хроническим ГН, среди них 123 с ХБП III стадии (СКФ 30 - 59 мл/мин/1,73 м2) (1а), и 88 с ХБП IV стадии (СКФ 15 - 29 мл/мин/1,73 м2) (1б). В группу 2 включены 45 больных с системными заболеваниями: 30 больных с III стадией ХБП (2а) и 15 - с IV стадией ХБП (2б). Группу 3 (контроль) составили 32 больных, среди которых 17 больных с III стадией ХБП (3 а) и 15 больных - с IV стадией ХБП (3б). Больные из группы 3 за время наблюдения (24 - 48 мес) по личной мотивации не лечились (не соблюдали диету, не принимали фосфатсвязывающих и антигипертензивных препаратов), коррекция анемии у них не проводилась.
У больных, вошедших в группы 1 и 3, ГН был вне обострения. У 148 больных снижение СКФ и повышение уровня креатинина сочеталось с уменьшением размеров почек разной степени.
У больных, включенных в группу 2 и страдавших системными заболеваниями, наблюдалось рецидивирующее течение ГН, у части (10 -СКВ, 2 - микроскопическим полиартериитом, 2 - гранулематозом Вегенера) в анамнезе были обострения, клинически протекающие по типу быстропрогрессирующего нефрита. У 20 из 43 больных группы 2 с анемией и гипоферремией сохранялась активность нефрита (изменение отдельных иммунологических показателей) в связи с чем, у этих больных продолжали поддерживающую иммуносупрессивную терапию, больные груаа 1 и 3 иммунодепрессанты не получали.
У всех больных наряду с общепринятыми в нефрологическом отделении исследованиями изучали: уровень гемоглобина, гематокрита, количество тромбоцитов и ретикулоцитов, средний объем эритроцита (МС), средняя концентрация гемоглобина в эритроците (MCHC), уровень сывороточного железа, общая железо-связывающая способность сыворотки, уровень свободного трансферрина сыворотки, коэффициент насыщения трансферрина (TSAT), уровень сывороточного ферритина. Оценку показателей проводили в период скрининга и затем 1 раз в 1,5 - 3 мес.
Стадии ХБП определяли по критериям Национального почечного фонда США (National Kidney Foundation) 2002 г., при этом СКФ рассчитывали по формуле MDRD [98].
Статистическая обработка результатов выполнена с помощью пакета программ «SPSS 10 for Windows».
При анализе распределения переменной рассчитывали частоту отдельных значений, среднее арифметическое, среднее квадратичное отклонение и медиану с построением частотных гистограмм. При сравнении распределения параметров между группами использовали критерий %2 и дисперсионный анализ.
Для оценки связей между переменными использовали критерий %2, коэффициент корреляции Пирсона «г» и ранговый коэффициент корреляции Спирмена «р». Достоверными считали различия при р<0,05.
Результаты и обсуждение
Среди 288 больных с III - IV стадиями ХБП (СКФ < 60 - > 15 мл/мин/1,73 м ) анемия (НЬ < 11,5 г/дд у женщин и НЬ < 12 г/дл у мужчин, рекомендации K/DOQI) выявлена у 185 (64,2%), что практически не отличается от данных, приводимых в литературе (40-65%) [1, 9]. Частота анемии в группах обследованных больных увеличивалась по мере прогрессирования почечной недостаточности прямо пропорционально падению СКФ (табл. 1).
Таблица 1. Частота анемии в группах обследованных больных ХБП до лечения (п=288)
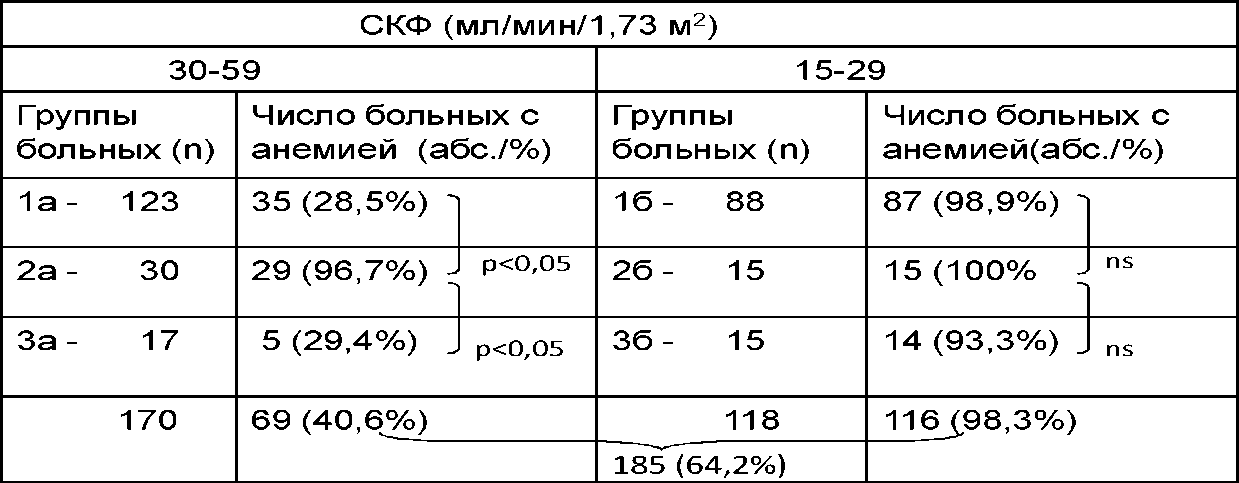
У подавляющего числа больных группы 2 с ХБП в рамках системных заболеваний анемия выявлялась уже при умеренном снижении СКФ (30-59 мл/мин/1,73 м ). При этом разница в частоте анемии среди больных группы 2 и представителей групп 1 и 3, страдавших с хроническим ГН, была статистически значимой, но по мере прогрессирования почечной недостаточности разница между группами нивелировалась: среди больных с IV стадией ХБП (СКФ 15-29 мл/мин/1,73 м ) независимо от нозологической принадлежности анемия выявлялась практически в 100% случаев.
Дефицит железа отмечался у 157 (84,9%) среди 185 больных с выявленной анемией, что согласуется с данными, приводимыми в литературе - 60-80% [98, 104]. Частота гипоферремии во всех группах увеличивалась по мере прогрессирования почечной недостаточности (табл. 2).
Таблица 2. Частота дефицита железа в группах больных ХБП с анемией до лечения
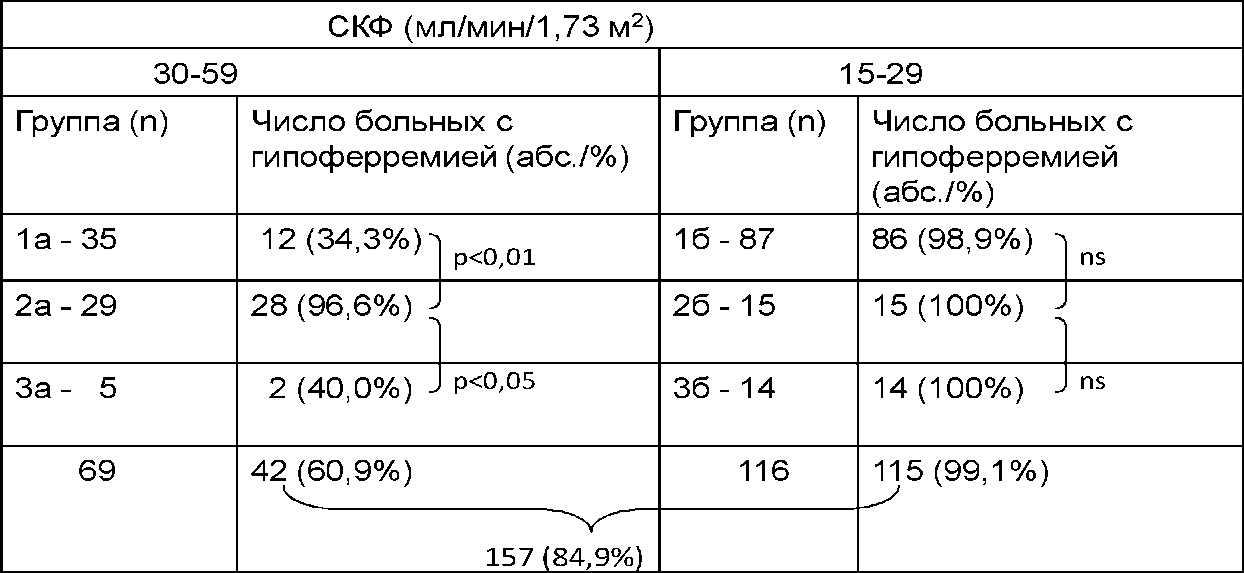
Среди больных гр. 2 а с умеренным снижением функции почек частота выявления дефицита железа была значительно выше (р < 0,05), чем среди больных групп 1 и 3, т. е. гипоферремия у них развивалась раньше, но затем, по мере нарастания тяжести поражения почек, различия между группами становились незначимыми (табл. 2).
Важно отметить, что, несмотря на снижение уровня сывороточного железа и насыщения железом трансферрина (TSAT), у большинства - 43 (95,6%) среди 45 больных группы 2 с анемией сохранялось нормальным содержание сывороточного ферритина, причем оно было статистически значимо выше, чем у больных 1 и 3 групп (табл. 3). Таким образом, у больных с системными заболеваниями анемия имела черты анемии хронических заболеваний (АХЗ) с относительным дефицитом железа из-за ретенции железа в макрофагах под влиянием воспалительных цитокинов. По мере нарастания почечной недостаточности у больных группы 26 развивался абсолютный дефицит железа, как и практически у всех больных с IV стадией ХБП.
Таблица 3. Показатели железа у больных ХБП с гипохромной анемией (п=157)
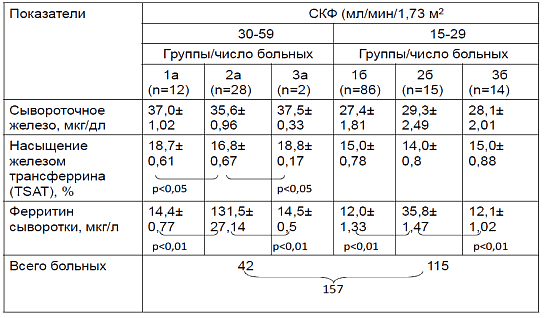
При множественном линейном регрессионном анализе доказано независимое влияние на выраженность гипоферремии (снижение показателя TSAT) уровня протеинурии (квадрат выборочного коэффициента корреляции Пирсона составил 0, 239; р< 0,001).
Мы провели анализ антианемического эффекта и безопасности применения эритропоэтина (рекормон, эпрекс) и гидроксид полимальтозного комплекса железа (мальтофер) внутрь и гидроксид сахарозного комплекса железа (венофер) внутривенно у 141 больного (м - 77, ж - 64) с гипохромной анемией III (40 больных) и IV (101 больных) стадиями ХБП [табл. 4]; среди них 98 больных хроническим ГН (гр. 1а - 12 и гр. 16 - 86) и 43 с системными заболеваниями соединительной ткани (гр. 2 а - 28 и гр. 26 -15), которым проводили лечение анемии и гипохромии, были разделены на 2 группы: 1 группа - 98 больных хроническим ГН, 2 группа - 43 больных с системными заболеваниями соединительной ткани (32 больных СКВ и 11 -разными формами системного васкулита).
Таблица 4. Распределение больных с гипохромной анемией, которым проводилось лечение (п=141)
|
СКФ (мл/мин/1,73 м2) |
|
|
30-59 |
15-29 |
|
Группы больных (п) |
Группа больных (п) |
|
1а - 12 |
16-86 |
|
2а - 28 |
26-15 |
|
Всего больных 40 |
101 |
|
|
141 |
Группу сравнения (3 группа) составили 16 больных с ХБП (сопоставимых с гр. 1 и 2 по возрасту и полу) у которых лечение гипохромной анемии анемии не проводилось.
В фазу коррекции анемии (рис. 1) у больных гр. 1а нами применялся мальтофер внутрь 200-300 мг/день, а у больных гр. 16, 2а и 26 - венофер внутривенно капельно 100-200 мг/неделю, поскольку при IV стадии ХБП и у больных системными заболеваниями независимо от стадии ХБП из-за наличия АХЗ всасывание в кишечнике железа нарушено. В фазу поддерживающей терапии анемии лечение железом продолжали в уменьшенных дозах: у больных гр. 1а мальтофером внутрь 200 мг/день, у больных гр. 16, 2а и 26 - венофером внутривенно 100 мг/1-2 недели.
Рис.1. Схема лечения больных III-IV стадиями ХБП с гипохромной анемией

В фазу коррекции анемии уровень Hb, Hct, свободного железа сыворотки, ферритина, трансферина, процент насыщения железомтрансферрина, содержание сывороточного альбумина и креатинина определяли каждый месяц.
В фазу поддерживающей терапии уровень НЬ и другие, выше отмеченные клинические и биохимические параметры крови контролировали 1 раз в 3 месяца. Больные самостоятельно ежедневно регистрировали АД, диурез, массу тела.
Антианемический эффект отмечен у всех больных в среднем через 12 недель лечения (табл. 5).
Таблица 5. Показатели НЬ и обмена железа у больных ХБП III-IV стадий, получавших лечение анемии (п=141)
|
Показатели |
Период исследования |
|||||
|
До лечения |
Фаза коррекции анемии (3 мес) |
Фаза поддерживающего лечения (24 мес) |
||||
|
Группа 1 |
Группа 2 |
Группа 1 |
Группа 2 |
Группа 1 |
Группа 2 |
|
|
НЬ (г/дл) |
10,3±0,48 |
9,6±0,49 |
11,8±0,22** |
12,0±0,75** |
11,5±0,21** |
11,9±0,27** |
|
Сывороточное железо (мкг/дл) |
49,9±18,7 |
43,0±9,02 |
71,1±19,1 |
79,8±16,3 |
90,9±16,02 |
92,7±13,56** |
|
TSAT (%) |
21,1±2,83 |
20,7±2,97 |
26,8±4,36 |
23,6±3,29 |
30,6±3,82* |
28,9±3,37* |
|
Ферритин (мкг/л) |
100,0±12,89 |
100,9±9,11 |
232,0±26,13** |
222,7±23,53* |
233,6±26,93** |
234,7±26,04** |
|
Доза эпоэтина ЕД/кг/нед., подкожно |
48,1 ±6,64 |
100,5+11,1 |
31,3±6,35 |
49,6±8,89** |
||
Различия с исходным уровнем статистически значимы: * - р< 0,05; ** - р < 0,01
При адекватном лечении основного заболевания и отсутствии дефицита железа анемию удалось устранить у всех больных.
Таким образом, анемия была диагностирована у 69 (40,6%) из 170 больных с ХБП (табл. 1) с умеренном снижении функции почек (СКФ 59-30 мл/мин/1,73 м ), у 42 (60,9%) из них выявлялась гипохромная анемия. Частота гипохромной анемии увеличивалась по мере прогрессирования почечной недостаточности прямо пропорционально степени снижения СКФ. В IV стадии ХБП (СКФ 15-29 мл/мин/1,73 м ) гипохромная анемия выявлена у 99,1% обследованных больных.
Как свидетельствуют данные литературы [6, 7] и результаты нашего исследования анемия оказывает нежелательное влияние на качество жизни больных, вызывает снижение работоспособности и ухудшение сексуальной и когнитивной функции, сопровождается различными симптомами (одышка, головокружение, нарушение нутритивного статуса и т. д.). Более того, анемия у больных с ХБП является независимым фактором риска сердечно -сосудистых заболеваний (независимо от тяжести нефропатии) и сама по себе способствует прогрессированию ГЛЖ и нарушению его диастолической функции.
Выраженность анемии, особенно на ранней стадии ХБП (СКФ 30-59 мл/мин/1,73 м ) зависит от первичного заболевания почек. В нашем исследовании анемия у больных при болезнях соединительной ткани с ХБП III-IV стадии характеризуется более тяжелым течением и более ранним развитием гипоферремии. Установлена зависимость между гипоферремией и величиной протеинурии: при высокой протеинурии с мочой может теряться значительное количество железа, трансферина [7, 9].
Ведущее значение «воспалительного» (цитокин-медиированного) механизма в развитии анемии у больных ГН при системных заболеваниях отчетливо прослеживается. Так, частота и тяжесть анемии у этих больных в нашем исследовании четко коррелирует с активностью предрасполагающего заболевания.
В последние годы получены данные о том, что у больных иммуновоспалительными заболеваниями (СКВ, РА, системные васкулиты) с поражением почек, особенно при быстропрогрессирующем развитии почечной недостаточности, сохраняется выработка провоспалительных цитокинов, в первую очередь ИЛ-1, ИФН-у, которые могут подавлять выработку эритропоэтина, высвобождение железа из макрофагов и пролиферацию предшественников эритроидных клеток, создавая дополнительные условия для поддержания анемии и железоограниченного кроветворения.
По нашим данным и данным литературы [9, 10] назначение железа внутрь при АХЗ малоэффективно, учитывая большое значение нарушенийвсасывания Fe в двенадцатиперстной кишке при АХЗ. Железо этим больным вводят парентерально, при этом показатели обмена железа (ферритин сыворотки крови, TSAT) необходимо определять не реже 1 раза в 3 мес [10].
По нашему опыту у пациентов с III стадией ХБП применение трехвалентного железа (мальтофер) для приема внутрь, обосновано. Суточная доза элементарного железа должна составлять 200 мг. Среди наблюдаемых нами 141 больных осложнений при приеме препарата мальтофер в дозе 200 мг/день мы не отмечали. Положительной стороной гидроксид полимальтозного комплекса железа является то, что на всасывание железа при использовании этого препарата не оказывает влияние прием пищи, сульфатное железо необходимо принимать за 2 часа до еды.
У пациентов с IV стадией ХБП и у пациентов с ХБП при системных заболеваниях вне зависимости от стадии нефрита коррекция железодефицита возможна только при парентеральном введении препаратов железа. Результатах нашего исследования подтверждают безопасность применения препарата - железа [III] для внутривенного введения - гидрохлорид сахарозного комплекса (венофера), который включен в Европейские и национальные рекомендации по лечению анемии у больных с ХБП [9]. Мы вводили препарат венофер внутривенно в течение 5 минут (в среднем 20 мг/мин) или путем инфузии, растворив 5мл венофера в 100 мл 0,9% раствора натрия хлорида, в течение 15 минут (6-7 мг/мин). Аллергических реакций, развития флебитов при таких способах введения препарата мы не отмечали.
В последнее время зарегистрирована новая лекарственная форма препарата венофер с содержанием 40 мг железа в 1 мл, что позволяет использовать его для поддерживающей терапии.
Литература
1. Добронравов В.А., Смирнов А.В. Анемия и хроническая болезнь почек. Анемия. 2005;2:2-8
2. Ермоленко В.М., Хасабов Н.Н., Михайлова Н.А. Рекомендации по применению препаратов железа у больных с хронической почечной недостаточностью. Анемия. 2005; 2: 9-25
3. Шеффер P.M., Гаше К., Хух Р., Краффт А. Железное письмо: рекомендации по лечению железодефицитной анемии. Анемия. 2005; 2: 37-45
4. ШосткаГ.Д. Дефицит железа. Анемия. 2004; 1: 11-18
5. Fishbane S., Ungureanu V., Maesaka et al. The safety of intravenous iron de[tran in hemodialysis patients. Am. J. Kidney Dis. 1996; 28: 529-534
6. Jacobs P., Wood I., Bird A.R. Better tolerance of iron polymaltose complex compared with ferrous sulfate in the treatment of amemia. Hematology. 2000; 5: 77-83
7. Langstaff F.J., Geisser P., Heil W.G., Browdler J.M. Treatment of iron-deficiency anemia: a lower incidence of adverse effects with Ferrum Hausmann that ferrous sulphate. Brit. Journal of Clin. Reserch. 1993; 4: 191-198
8. NKF-K/DOQI Clinical Practice Guidelines for Anemia of Chronic Kidney Disease: update. Am. J. Kidney Dis. 2001; 37 (suppl. 1): 182-238
9. Revised European Best Practice Guidelines for the Management of anemia in Patients with Chronic Renal Failure. Nephrol. Dial. Transplant. 2004; 19 (suppl. 2): ii2- ii45
10. Ю.Милованов Ю.С., Козловская Л.В., Милованова Л.Ю. Препараты железа в лечении анемии у больных хронической почечной недостаточность на додиализном этапе. Леч. врач. 2005; 10: 44-48.
Комментарии
ПРАКТИКА ПЕДИАТРА
