Резистентность к макролидам
СтатьиГлава из монографии "Макролиды"
Под редакцией Попковой А.М. Верткина А.Л. Колобова С.В.
При анализе резистентности к макролидам нельзя не учитывать наличие изначально резистентных (мутантных) штаммов некоторых грамположительных кокков, что в ряде случаев может ограничивать применение некоторых препаратов данной группы. Резистентность к макролидам может быть приобретена с помощью 3 различных механизмов: модификацией клетки-мишени (рибосомальной субъединицы 50 S), инактивацией и активным выведением препарата. Резистентность к макролидам в результате мутации очень редко наблюдается в клинических культурах. Наиболее часто встречающимся механизмом является посттранскрипционная модификация рибосомальной РНК 23S путем моно/диметилирования остатка аденина [24, 49, 103, 131]. В результате нарушается комплиментарность антибиотика-макролида к рибосоме, и препарат не может оказывать свое действие. Данная резистетность является перекрестной с 14- и 15-членными макролидами, стрептограминами, линкосамидами и хлорамфениколом и не является перекрестной с 16-членными макролидами. При этом гены метилаз (ферменты, индуцирующие метилирование) могут наследоваться бактериальными клетками или передаваться через плазмиды [24, 103]. Гены, кодирующие различные метилазы, определяют как эрм (эритромицин резистентная метилаза). Выялено по меньшей мере 8 классов эрм генов [63, 66, 117].
У стафилококков синтез метилаз РНК может быть конструктивным или индуцируемым 14 - членными макролидами или азалидами. 16-членные макролиды являются слабыми индукторами резистентности, и бактерии с индуцируемой резистентностью сохраняют чувствительность к 16-членным макролидам. Однако при индуцировании в присутствии эритромицина бактерии с индуцированной резистентностью нечувствительны и к 16 - членным макролидам. Бактерии, конструктивно резистентные к эритромицину, также резистентны к 16-членным макролидам [66, 152].
Большинство мутантных штаммов микроорганизмов, обладающих приобретенной резистентностью к эритромицину, обладают резистентностью и к кларитромицину [180]. Есть данные, что резистентность к кларитромицину может передаваться за счет плазмиды, кодирующей метилазу. Такие штаммы нечувствительны и к эритромицину [143].
Другие механизмы резистентности включают инактивацию эритромицин-эстеразами и макролидной фосфотрансферазой (E. coli) или неопределенными ферментами (Staphylococcus hominis, S. haemolyticus, S. saprophyticus). Штаммы S. epidermidis обнаружили резистентность к эритромицину из-за непроницаемости для препарата. Такой механизм резистентности, как активный выброс антибиотика, был отмечен для S. epidermidis, в штаммах которого связанный с АТФ белок выполнял функцию откачивающего насоса. В работе Peters и соавт. (1992) было показано, что микроорганизмы, продуцирующие b -лактамазу невосприимчивы к эритромицину и к азитромицину [179]. Возможно, что данная резистентность является приобретенной, а ген, кодирующий b -лактамазу может передаваться между различными штаммами микроорганизмов через плазмиды. Не исключено включение данного гена в микроорганизмы нормальной микрофлоры и сохранение его длительное время у микроорганизмов-сапрофитов. Поэтому, если в анамнезе было установлено наличие инфекционного заболевания, вызванного эритромицин-резистентными микроорганизмами, то применение данного препарата в дальнейшем может быть неэффективным. Возможно, что синтез b -лактамазы является одним из механизмов приобретенной резистентности к эритромицину. Однако данный вопрос требует дальнейшего изучения; в настоящее время имеющиеся литературные данные не достаточно полно охватывают эту проблему и во многом противоречивы.
Аминогликозид-резистентные штаммы S. aureus невосприимчивы и к азитромицину, и к метициллину и его производным [144]. Азитромицин неэффективен против некоторых штаммов S. pneumoniae, обладающих резистентностью к пенициллину [152], при этом есть данные, что чувствительность S. pneumoniaе к азитромицину, кларитромицину и пенициллину одинакова [141, 143].
Рис. 1.4.
Фармакокинетика азитромицина и кларитромии-цина после недельной терапии 10 мг/кг per os [123, 143]. МАК- минимальная активная концентрация. Если концентрация антибиотика больше МАК, но меньше МИК, то возможно развитие резистентности к препа-рату (закрашенная область). Видно, что закрашенная область для азитромицина существенно больше, чем для кларитромицина.
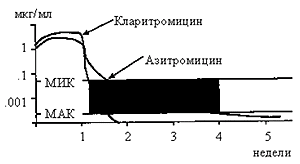
Интересно отметить тот факт, что из-за того, что время полувыведения кларитромицина составляет 5-6 часов, а азитромицина - 35-76 часов (см также гл. 2), частота развития резистености к кларитромицину существенно ниже, чем к азитромицину [127, 143]. Это обусловлено длительной персистенцией азитромицина в организме в низких концентрациях, которые не способны подавлять рост микроорганизмов, но тем не менее могут вызвать мутации, способствующие развитию резистентности (рис. 1.4).
Поэтому, так как спектр антибактериального действия препаратов во многом сходен, обычно кларитромицин предпочтительней азитромицина.
Резистентность к макролидам варьирует во всем мире в зависимости от клинического применения, видов бактерий и других факторов, таких как источник штаммов (больница/общество). Первые резистентные к эритромицину штаммы были обнаружены еще в 1956 г. у стафилококков (фенотип МЛСb) и с тех пор распространились на многие роды бактерий [7, 8].
Во Франции распространенность резистентности фенотипа МЛСb у стафилококков возросла с 1954 г. до 1962 г. и стабилизовалась на уровне около 40% (больница) и 10% (общество). Последующая эволюция резистентного фенотипа МЛСb в больнице развивалась параллельно с эволюцией резистентности к метициллину и отражает появление мультирезистентных форм в больнице. Отмечены большие межбольничные и межпалатные различия. В 1988 г. общая резистентность во Франции составила около 30% (больница) и 20% (общество). В многоцентровом международном эпидемиологическом исследовании более 1000 штаммов S. aureus в Англии 14% штаммов оказались резистентными к эритромицину, против 1,7% одновременно к спирамицину и эритромицину. Применение неиндукторных макролидов вызвало появление структурного фенотипа, который увеличил с 30 до 60% общее число штаммов S. aureus, резистентных к МЛСb. Что касается стрептококков, наблюдаемые различия зависят от штамма. У энтерококков резистентность очень высока (50 - 60%); с 1989 г. отмечалось увеличение процентного содержания эритромицин-резистентных культур у стрептококков группы А с 4% (1981 г.) до 24% (1990 г.) Возникает проблема среди пневмококков; первые резистентные штаммы были обнаружены в 1976 г., а в 1990 г. их частота возрастала до 29% во Франции, до 6,5% в Англии, 60% и 23 % в Испании у детей младшего возраста и у взрослых соответственно. У Bacteroides общая резистентность к МЛСb низкая [59, 74, 83, 92, 102, 125, 141, 144, 152, 164, 167, 194, 198, 208].
Согласно статистическому исследованию, проведенному в США, приблизительно 30% бактериальных инфекций, вызванных S. aureus в этой стране обладает одновременно резистентностью как к атибитикам-макролидам, так и к метициллину и аминогликозидам [144].
Однако появление препаратов нового поколения в значительной степени решило проблему резистентности: штаммы грамположительных кокков, обладающих резистентностью к макролидам первого поколения, чаще всего не обладают резистентностью к препаратам второй генерации [24, 49]. Резистентность к натамицину в клинической практике не отмечена [58, 73, 77, 129, 175].
Частота встречаемости резистентных штаммов при длительном назначении антибиотиков-макролидов in vivo представлена в таблице 1.4.
Таблица 1.4.
Частота встречаемости резистентных штаммов при длительном назначении антибиотиков-макролидов in vivo ( в %) [117].
|
Препарат |
Микроорганизм |
Недели |
|||||
|
0 |
1 |
2 |
3 |
4 |
6 |
||
|
Эритромицин |
Всего Sreptococcus Staphilococcus Другие |
0 0 0 0 |
42 40 40 0 |
42 40 60 0 |
8.3 100 0 0 |
0 0 0 0 |
1.7 100 0 0 |
|
Азитромицин |
Всего Sreptococcus Staphilococcus Другие |
0 0 0 0 |
70 36.2 12.8 6.4 |
88 36.2 12.8 6.4 |
82 34.6 11.5 3.8 |
90 20 12 6 |
86 26.9 13.5 5.8 |
|
Кларитромицин |
Всего Sreptococcus Staphilococcus Другие |
0 0 0 0 |
62 28.5 11.4 2.6 |
72 23.7 11.4 2.6 |
56 16 13.1 10 |
36 11.1 16.7 0 |
18 7.7 23 7.7 |
Примечание.
В таблице приведена частота встречаемости резистентных штаммов а при инфекциях верхних дыхательных путей детей в возрасте от 0.5 до 16 лет (171 человек). Эритромицин назначали 15 мг/кг в течение 7 дней, азитромицин - 10 мг/кг, 3 дня, кларитромицин -7.5 мг/кг, 7 дней per os.
Таким образом, резистентность к макролидам может быть осуществлена:
- модифицикацией клетки-мишени;
- инактивацией препарата;
- активным выведением антибиотика.
Комментарии
ПРАКТИКА ПЕДИАТРА
