Агомелатин, первый мелатонинергический антидепрессант: открытие, характеристики и развитие
Статьи Agomelatine, the first melatonergic antidepressant: discovery, characterization and development
Christian de Bodinat*, Beatrice Guardiola-Lemaitre‡, Elisabeth Mocaer*, Pierre Renard§, Carmen Muhoz**, Mark J. Millan¶
* Institut de Recherches Internationales Servier, 6 Place des Pleiades, 92415 Courbevoie, Cedex, France.
‡ Servier Monde, 22 rue Garnier, 92578 Neuillysur-Seine Cedex, France.
§ Prospective et Valorisation Scientifique, Institut de Recherches Servier, 11 rue des Moulineaux, 92150 Suresnes, France.
** Servier International, 35 rue de Verdun, 92284 Suresnes, France.
¶ Division of Neuropharmacology, Institut de Recherches Servier, 125 Chemin de Ronde, 78290 Croissy sur Seine, France.
Nature Reviews Drug Discovery AOP, published online 25 June 2010; doi:10.1038/nrd3140
Резюме
Современная терапия большой депрессии, распространенного и дезадаптирующего расстройства, связанного с большим социальным и персональным бременем, далека от идеальной. Все доступные сегодня антидепрессанты обладают моноаминергическими механизмами действия, в связи с чем особый интерес вызывают новейшие не моноаминергические подходы к оптимизации терапии депрессии. Одна из таких стратегий предусматривает воздействие на мелатонинергические рецепторы, так как мелатонин играет ключевую роль в синхронизации циркадианных ритмов, которые, как известно, нарушаются при депрессивных состояниях. В статье обсуждается открытие и развитие агомелатина, который является мелатонинергическим агонистом с дополнительными свойствами антагониста 5-гидрокситриптаминовых 2C (5-HT2C) рецепторов. После исчерпывающей фармакологической оценки и масштабных клинических исследований агомелатин (Вальдоксан/Тиманакс; Сервье) был зарегистрирован в 2009 году в Европе для терапии депрессии и соответственно стал первым зарегистрированным антидепрессантом с не моноаминергическим механизмом действия.
Депрессия является сложным, гетерогенным и дезадаптирующим расстройством, которое связано с тяжелым бременем как для пациентов и их близких, так и для общества в целом. Несмотря на несомненную терапевтическую ценность доступных сегодня антидепрессантов эти препараты имеют ряд существенных недостатков, включая задержку полного развертывания эффекта на несколько недель, недостаточную эффективность у многих пациентов, неадекватность контроля коморбидных симптомов и проблемы с неудовлетворительной переносимостью [1-3]. В связи с этим повышенное внимание уделяется когнитивным и поведенческим методам лечения. Кроме того, в случаях резистентности к антидепрессантам по прежнему используется электросудорожная терапия, возможно более широкое применение глубокой стимуляции головного мозга, не следует недооценивать и значение самопомощи у предрасположенных субъектов [1,2,4,5]. Тем не менее, фармакотерапии по всей видимости остается главным методом терапии эпизодов большой депрессии, поэтому сохраняется потребность в новых антидепрессантах с улучшенными характеристиками [1,2,6-8].
Первые антидепрессанты - трициклики (такие как амитриптилин), которые подавляют обратный захват моноаминов, и ингибиторы моноаминоксидазы (такие как фенелзин), которые блокирует катаболизм моноаминов - были внедрены в 1960х и 1970-х годах. Их появление сильно изменило терапию депрессии, однако вскоре стали очевидны их недостатки, связанные с проблемами переносимости и безопасности [1-3,7]. В последующем в 1980-х и 1990-х годах были разработаны более специфичные ингибиторы обратного захвата серотонина (также известного как 5-гидрокситриптамин; 5-HT) и/или норадреналина. Селективные ингибиторы обратного захвата серотонина (СИОЗС), ингибиторы обратного захвата норадреналин (ИОЗН) и ингибиторы обратного захвата серотонина/норадреналина (ИОЗСН) обладают значительно более благоприятными профилями безопасности и более эффективно купируют коморбидную тревогу, однако не превосходят своих предшественников первых поколений по эффективности [2,3,9,10]. Кроме того, все эти антидепрессанты, включая миртазапин, атипичный препарат, который не влияет на обратный захват серотонина и норадреналина, имеют моноаминергические механизмы действия [2,11].
С тех пор разработка новых антидепрессантов выглядела скорее как "вариации на тему" (хотя и нет идентичных препаратов, в связи с чем очень важно, что существует по несколько препаратов одного класса) [1,2,6,7], чем создание принципиально новых механизмов действия. Тем не менее было бы наивным думать, что невозможно улучшить моноаминергические антидепрессанты, поскольку еще примерно 30 рецепторов ожидают своей очереди для изучения и использования [2,11]. Кроме того, комбинация моноаминергических антидепрессантов с препаратами с иным механизмом действия, например, сочетанное применение СИОЗС и лития при резистентной депрессии, сохраняет свою клиническую привлекательность и практическую ценность [2,12,13].
| Вставка 1. Мелатонин, циркадианные ритмы и депрессия
Большая депрессия часто сопровождается нарушениями циркадианных ритмов поведения, сна, температуры тела, секреции кортизола и других гормонов [21-23]. Несмотря на гетерогенность подобных изменений у пациентов с депрессией часто выявляется уплощение амплитуды суточных ритмов и сниженная реакция на внешние (световые и не световые) стимулы времени. Преобладает смещение фазы вперед, однако сообщается и о задержке фазы, типичной для сезонного аффективного расстройства [46,119]. Циркадианные нарушение связаны и частично могут быть следствием изменений в поведении и профиле сна, сопровождающих депрессию; триггером десинхронизации также может быть нарушение функции супрахиазматического ядра [21,27]. С другой стороны циркадианные нарушения могут быть спровоцированы аномальными изменениями стимуляции со стороны мелатонина, ключевого синхронизатора биологических ритмов и сон, секреция которого тесно связана с циклами свет-темнота и времен года [34,101] (Рисунок 1). В этом контексте депрессия может рассматриваться как следствие нарушений суточного ритма выброса мелатонина, включая уплощение ночного пика [21-23,34,101,127]. Кроме того, несмотря на ограниченность данных, при депрессии возможно снижение выработки мелатонина, так как повышение концентраций циркулирующего мелатонина коррелирует с эффективность терапии некоторыми антидепрессантами [2,21,127]. Назначение собственно мелатонина не эффективно при большой депрессии [128]. Однако мелатонин может улучшать профиль сна и в этом контексте следует отметить пользу некоторых методов хронотерапии, таких как светотерапия и циркадианная поведенческая терапия [46,101]. В совокупности эти наблюдения подтверждают предположение о том, что реорганизация биологических ритмов путем манипуляций с мелатонинергическими механизмами может быть терапевтически ценной стратегией в лечении депрессивных состояний. |
Не моноаминергические механизмы также разрабатываются в поиске антидепрессантов с улучшенными характеристиками. Такие исследовательские программы направлены преимущественно на поиск высоко селективных лигандов предполагаемых мишеней, таких как нейрокинин 1 и кортикотропин-рилизинг фактор 1 рецепторы [14,15]. К сожалению результаты клинических исследований оказались неутешительными [16,17], возможно, как это ни парадоксально, именно по причине столь высокой селективности этих веществ [2]. В предварительных исследованиях показано быстрое развитие антидепрессивного эффекта антагонистов NMDA (N-метил-D-аспартат) рецепторов, однако даже селективные к подтипам этих рецепторов препараты вызывают серьезные психомиметические побочные эффекты [18]. Вещества, синтезированные для непосредственных манипуляций с внутриклеточными сигналами, контролирующими нейрогенез и "нейрональную устойчивость", также представляются интересными, но пока вызывают много вопросов относительно специфичности и безопасности [2,7,19,20].
Альтернативный, привлекательный и инновационный подход к оптимизации терапии депрессии связан с мелатонином - важным регулятором циркадианных ритмов, которые нарушаются при депрессии [21-23] (Вставка 1). В этой статье представлена хронология открытия, изучения и развития новейшего мелатонинергического антидепрессанта агомелатина, который несомненно занимает сразу две лидирующие позиции: это первый антидепрессант, разработанный для коррекции нарушений биологических ритмов, связанных с депрессивными состояниями, и первый доступный для клинического применения антидепрессант, обладающий не моноаминергическим механизмом действия.
От эпифиза к агомелатину
Эпифиз (шишковидная железа), который продуцирует мелатонин, является филогенетически древней структурой. Роль эпифиза обсуждается еще в древних научных трактатах [24,25], однако собственно мелатонин был открыт лишь немногим более 100 лет назад (в 1917 году), когда McCord и Allen обнаружили, что экстракты коровьего эпифиза влияют на пигментацию кожи головастиков. Затем прошло еще сорок лет до выделения и химической идентификации мелатонина (N-ацетил-5-метокситриптамин) Lerner в 1958 г. [24,26] Хотя участки высокого аффинитета к связыванию мелатонина были фармакологически выделены в коровьем головном мозге в 1979 г.[27] и затем идентифицированы в гипоталамусе крыс в 1980-х [28], прошло еще 40 лет до первого клонирования мелатонинергических рецепторов из меланофор Xenopus laevis в 1990-х [29].
Начало интенсивных исследований мелатонинергических агонистов в Исследовательской группе Сервье было положено в 1988 г., когда в коллектив прибыл один из авторов (B.G.-L.) после защиты докторской диссертации по мелатонину. До 1980-х главной функцией мелатонина считался контроль репродуктивной системы [30,31]. Однако затем выяснилось, что мелатонин действует как не световой "гонец", который взаимодействует со световыми сигналами в процессе регуляции циркадианных и суточных циклов (Рисунок 1). Это наблюдение было особенно важным с учетом того, что плазменные концентрации мелатонина обнаруживают отчетливую циркадианную ритмичность с пиковыми значениями в ночной фазе как у дневных, так и у ночных млекопитающих. В целом мелатонин играет фундаментальную роль в синхронизации циркадианных ритмов, [26,30] которые дезорганизуются при расстройствах центральной нервной системы, таких как [21-23,32] (Вставка 1).
Идея поиска мелатонинергических лигандов в качестве средств терапии [33,34] было воспринято с большим энтузиазмом и была создана серия нефталиновых производных мелатонина [35,36]. Эти вещества изначально синтезировались как пригодные для патентования и как минимум сопоставимые с мелатонином по эффективности. Кроме того, нафталиновое кольцо этих производных является более липофильным, чем индольное кольцо мелатонина, дополнительной задачей было улучшение способности преодолевать гематоэнцефалический барьер головного мозга. В то время не было доступных для исследований ни клонированных мелатонинергических рецепторов, ни экспериментальных процедур для изучения рецепторного связывания. Соответственно, было решено используя радиолиганд [125] иодмелатонин исследовать взаимодействие лигандов с участками связывания мелатонина, расположенными в задней области гипофиза овцы28. Как показано на Рисунке 2 мелатонинергические рецепторы связываются через Gαi/o протеин с аденил циклазой. Следовательно используя ферментный метод можно было исследовать функциональное действие лигандов in vitro, определяя его влияние на синтез форсколин-стимулированной циклической AMP в клетках овечьей pars tuberalis [36]. Кроме того, в электрофизиологических исследованиях агонистические свойства производных мелатонина были верифицированы в ключевой популяции мелатонинергических рецепторов, расположенных в супрахиазматическом ядре (СХЯ). Эта работа выполнялась на сирийских хомяках - классический вид для исследований циркадианных ритмов [37,38].
В совокупности результаты выполненных исследований свидетельствуют, что нафталиновые производные мелатонина действуют как агонисты с высоким аффинитетом. Вещество, обозначенное как S20098 - позднее получившее название агомелатин - было идентифицировано как наиболее перспективный препарат на основании его фармакологического профиля [36,38,39]. Агомелатин прочно связывается с мелатониновыми рецепторами, подавляет формирование cAMP и имитирует действие мелатонина с дозозависимым подавлением активности нейронов СХЯ38. Позднее эти наблюдения были подкреплены данными о том, что агомелатин также сильно активирует клонированные человеческие рецепторы мелатонина 1 (MT1) и MT2 [39] (Рисунок 2).
Рисунок 1. Связь между мелатонином, супрахиазматическим ядром и циркадианными ритмами: мелатонинергическое действие агомелатина in vivo.
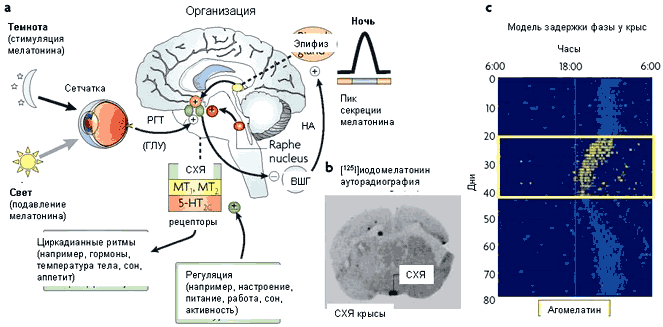
a Свет активирует глутамат (ГЛУ)-содержащий ретиногипоталамический тракт (РГТ), который передает информацию из глаза в супрахиазматическое ядро (СХЯ). Через полисинаптические связи СХЯ функционально подавляет активность верхних шейных ганглиев (ВШГ), из которых идет возбуждающий норадреналин (НА)-содержащий путь. Эта система позволяет свету подавлять синтез и выброс мелатонина из эпифиза и, соответственно, секреция мелатонина усиливается в темный период суток. Мелатонин реципрокно активирует нейроны СХЯ, воздействуя на мелатониновые 1 (MT1) и MT2 рецепторы. Серотонинергический путь из ядра шва регулирует СХЯ через действие на серотониновые (также известный как 5-гидрокситриптамин; 5-HT) рецепторы 5-HT2C и другие подтипы 5-HT рецепторов. Ежедневное поведение также влияет на сигналы, исходящие из СХЯ, нейрональных главных часов, координирующих циркадианные ритмы.
b Мелатонинергические рецепторы распознаются радиографически в СХЯ с помощью [125 I] иодомелатонина.
c Ритмы локомоторной активности крыс смещаются на более позднее время, если темный период суток задерживается на несколько часов. Ежедневное введение агомелатина (3.0 мг на кг, внутрибрюшинно) ресинхронизирует ритмы и восстанавливает нормальный циркадианный профиль (начало темного периода суток в 18:00 часов) [45].
Исследования [40-43], касающиеся другого интересного аспекта - как агомелатин влияет на реактивность MT1 и MT2 рецепторов - мы обсудим позднее.
Биодоступность агомелатина оценивается как умеренная. Тем не менее, агомелатин обнаруживает отчетливую активность in vivo у животных и человека, как будет показано в следующем разделе.
Рeсинхронизирующие свойства агомелатина
Главной целью исследования in vivo было подтверждение способности агомелатина корректировать нарушения циркадианных ритмов, особенно на моделях, связанных с депрессивными состояниями. У крыс, содержащихся в условиях постоянной темноты, время начала локомоторной активности смещалось на более позднее время, а при регулярном введении агомелатина возвращалось к нормальному значению - эффект, свойственный мелатонину [44]. Сходным образом было показано, что агомелатин оказывает ресинхронизирующее действие и в ряде других экспериментальных условий. Например, агомелатин восстанавливает циркадианные ритмы на модели смены часовых поясов, которая предусматривает смещение фазы вперед в цикле свет-темнота [45]. Агомелатин также ресинхронизирует циркадианные ритмы на модели задержки фазы, имитирующей условия клинического синдрома задержки сна и нарушение циркадианных ритмов при сезонной депрессии [46,47] (Вставка 1; Рисунок 1). Недавно были опубликованы данные о том, что тяжесть симптомов при большой депрессии коррелирует с искажением циркадианных ритмов: чем больше задерживается фаза водителя ритма в распорядке сна, тем тяжелее депрессивное состояние.
Старение также связано с ослаблением реактивности циркадианных часов на стимулы окружающей среды. Агомелатин восстанавливает циркадианные ритмы бега в колесе у старых хомяков [49], а также суточные ритмы моторной активности и температуры тела у старых (примерно 2 года) крыс [50]. Эти данные имеют значение для терапии депрессии, так как уплощение амплитуды суточных ритмов у старых крыс похоже на циркадианные расстройства у пациентов с депрессией [21-23] (Вставка 1). наконец, агомелатин восстанавливает нормальные циркадианные ритмы у инфицированных трипаносомой крыс, обнаруживающих нарушения цикла сон-бодрствование [51]. Во всех этих исследованиях использовались ночные животные (грызуны и хомяки), поэтому позднее ресинхронизирующие свойства агомелатина были воспроизведены на африканских крысах, Arvicanthis mordax, ведущих дневной образ жизни, как свойственно человеку [52].
В совокупности приведенные данные стимулировали исследования на здоровых добровольцах, в которых агомелатин смещал на более раннее время фазу ритма температуры тела, не оказывая влияния на плазменные концентрации мелатонина [53]. Эти наблюдения подтверждены результатами экспериментов, свидетельствующими, что удаление эпифиза не изменяет влияния на эффект агомелатина на циркадианные ритмы у грызунов [54,55]. Независимость от эпифиза предполагает, что действие агомелатина, как и предполагалось, реализуется в СХЯ. Однако, мелатонинергические рецепторы также представлены в других регионах головного мозга [30,56] (см. ниже), поэтому очень важны данные о том, что повреждение СХЯ сопряжено с ослаблением ресинхронизирующей способности агомелатина [54].
Рисунок 2. Агонизм агомелатина к мелатонинергическим рецепторам, связывающимся через Ga для подавления аденил циклазы.
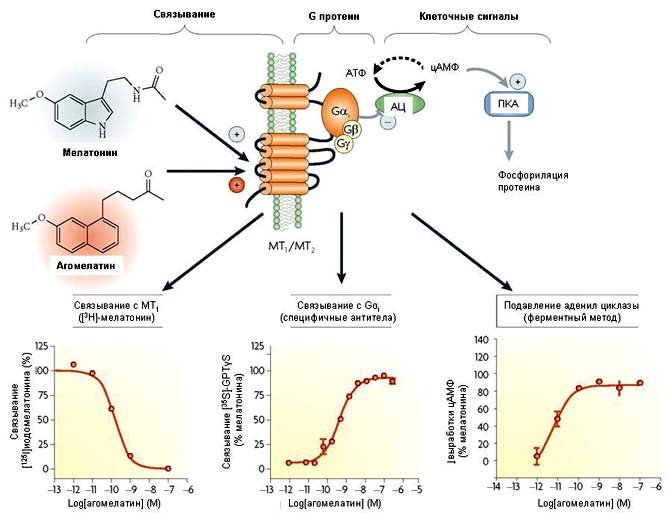
Мелатониновые рецепторы обоих типов (MT1 и MT2) связываются через Gai для подавления аденил циклазы (АЦ). Это приводит к снижению формирования циклического AMФ (цAMФ) из ATФ и, следовательно, падению активности протеин киназы A (ПKA), которая фосфорилирует множество клеточных субстратов. Мелатонин является эндогенным лигандом MT1 и MT2 рецепторов и его действие воспроизводится нафталиновым производным - агомелатином. Это подтверждено для MT1 рецепторов в низких панелях lower panels, в которых установлено замещение радиолиганда MT1 [125 I]иодомелатонина агомелатином, повышение связывания [35 S]-GTPyS с Gai и подавление продукции cAMP (сходные данные получены в участках MT2 [41]).
Главным циркадианным эффектом агомелатина является смещение фазы вперед, которое наиболее отчетливо проявляется в момент перехода от света к темноте. Т.е. максимальная эффективность агомелатина совпадает с началом ночной секреции мелатонина и временем максимальной чувствительности мелатониновых рецепторов [25,26,30,37]. Кроме того, кратковременного (1 час) введения агомелатин достаточно для проявления его ресинхронизирующего эффекта у человека, который сохраняется даже на следующий день [53,57,58]. Это очень важная информация, поскольку период полужизни агомелатина у человека составляет примерно 2 часа. В последующем исследовании было подтверждено, что кратковременной активации мелатонинергических рецепторов в критическое время суток достаточно для реализации эффекта препарата. Это может быть связано с индукцией киназа-регулируемых каскадов фосфоирялции протеинов, нарушениями выброса нейротрансмиттеров, которые медленно удаляются из синаптической щели, и с длительными изменениями синаптической пластичности в СХЯ и других регионах головного мозга [19,54,55].
Взаимодействие с 5-HT2C рецепторами
В конце 1990-х было решено исследовать потенциальные эффекты агомелатина на 5-HT2C рецепторы - взаимодействие, которое было обнаружено в результате стандартного скрининга рецепторного связывания. Интересно отметить, что незадолго до этого были открыты постранскрипционные изменения 5-HT2C рецепторов вследствие редактирования иРНК с формированием структурально разных изоформ [59-61]. Неизмененные 5-HT2C рецепторы обладают конститутивной активностью, т.е. инверсные агонисты снижают базисную сигнальную функцию и стимулируют миграцию 5-HT2C рецепторов из цитоплазмы в плазму и мембрану [61,62]. Напротив, нейтральные антагонисты не обладают собственной активностью, хотя блокуируют действие агонистов и инверсных агонистов. Еще одним интересным свойством 5-HT2C участков является их связывание с несколькими клеточными сигналами, которые могут дифференцированно поддаваться влиянию разных лигандов - феномен, который называется лиганд-смещенное сигналиизирование [60,63]. Тем не менее, канонический сигнальный путь 5-HT2C рецепторов - Gαq-регулируемая активация фосфолипазы C (Рисунок 3). Таким образом, после подтверждения того, что агомелатин замещает раидоактивный антагонист, [3 H]мезулергин, в рекомбинантных 5-HT2C рецепторах человека, было показано, что агомелатин является конкурентным антагонистом активации Gαq и фосфолипазы C под действием серотонина [64] (Рисунок 3). Эти наблюдения были дополнены другим G протеином, Gαi, в связи с чем предполагается, что агомелатин действует как широкопрофильный антагонист 5-HT2C рецепторов, связанных с разными сигнальными путями (Рисунок 3). Более того, агомелатин скорее нормализует сигнальные участки 5-HT2C, а не подавляет их до уровня, ниже базисного, что соответствует свойствам нейтрального антагониста [60,64].
Данные о том, что агомелатин блокирует 5-HT2C рецепторы, вызвали значительный интерес, поскольку эти рецепторы играют важную роль в регуляции настроения и реакций на стресс [65,66] (Вставка 2). Кроме того, синтез серотонин имеет отчетливый циркадианный профиль, СХЯ интенсивно иннервируется серотонинергическими путями, приходящими из raphe nucleus, а 5-HT2C рецепторы, локализованные в СХЯ, участвуют в интеграции световой и не световой регуляции циркадианных ритмов [67-70] (Рисунок 1). Вследствие различий между видами роль 5-HT2C рецепторов как регуляторов активности СХЯ человека пока установлена неполностью [70,71]. Тем не менее, действие агомелатина на мелатонинергические и 5-HT2C рецепторы, совместно расположенные в СХЯ, может участвовать в реализации его влияния на циркадианные ритмы и его ресинхронизирующие эффекты при депрессии.
Рисунок 3. Антагонизм агомелатина к 5-HT2c рецепторам, связанным через gaq с активацией фосфолипазы С.
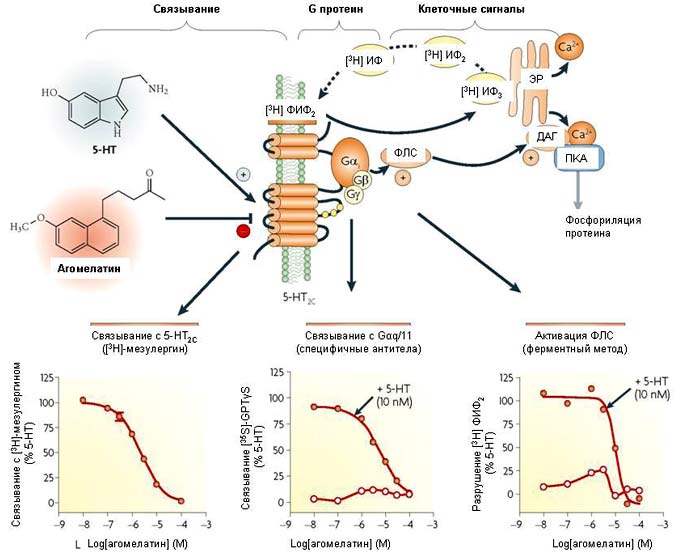
5-гидрокситриптамин 2C (5-HT2C) рецепторы связываются через Gaq/11 для активации фосфолипазы C (ФЛС), которая вырабатывает диаминоглицерин (ДАГ) и инозитол-1,4,5-трифосфат (ИнзФ3) из фосфоинозитидов, локализованных в мембране (фосфатидилинозитол 4,5-бифосфат; ФИФ2). ИнзФ3 стимулирует выброс кальция из эндоплазматического ретикулума (ЭР), который совместно с ДАГ активирует протеин киназу C (ПКC), что ведет к фосфориляции множества клеточных субстратов. Действие 5-HT на 5-HT2C рецепторы блокируется нейтральным антагонистом агомелатином (неактивным отдельно)[64]. В низких панелях показано замещение радиолиганда 5-HT2C рецепторов [3 H] мезулергина агомелатином, блокада 5-HT-стимулируемого связывания [35 S]-GTPyS с Gaq/11 и антагонизм в отношении 5-HT-индуцированного разрушения [3 H]PIP2. ИФ - инозитол фосфат; ИФ2 - инозитол 1,4-бифосфат.
Действие на мелатонинергические и 5-HT2C рецепторы
Открытие свойств 5-HT2C антагониста агомелатина было несомненно очень важным. Однако, возникла необходимость понять смысл диспропорциональности аффинитета: высокий аффинитет к человеческим MT1 и MT2 рецепторам и значительно менее выраженный (более чем в 100 раз) аффинитет к человеческим 5-HT2C рецепторам. Хотя сравнение агонизма к одному участку и антагонизма к другому участку является весьма трудной задачей, важно найти ответ на вопрос, является ли аффинитет агомелатина к 5-HT2C рецепторам биологически значимым. Наилучший подход к решению этого вопроса - эксперименты in vivo с использованием нескольких поведенческих и нейрохимических процедур. В таких исследованиях было показано, что агомелатин, но не мелатонин, блокирует популяции 5-HT2C рецепторов у грызунов [64]. Подобные эффекты агомелатина наблюдались в дозах (2.5-40.0 мг на кг, внутрибрюшинно), обеспечивающих низкие микромолярные уровни агомелатина в головном мозге, сопоставимые с его аффинитетом к 5-HT2C рецепторам. Более того, в сравнении с другими селективными антагонистами активность агомелатина in vivo коррелировала с его аффинитетом к 5-HT2C рецепторам in vitro [66].
В действительности в столь умеренной активности препарата нет ничего удивительного. Например, ИОЗСН венлафаксин обладает лишь микромолярным аффинитетом к переносчикам норадреналина, но при этом оказывает адренергическое действие у крыс и человека [2,11,72]. Обнадеживает и тот факт, что различие между дозами, которые обеспечивают существенное антагонистическое действие на 5-HT2C рецепторы и мелатонинергический агонизм агомелатина (наблюдался на дозах 1.0-3.0 мг на кг, внутрибрюшинно), было значительно меньшим in vivo, чем in vitro. Возможно для выраженной активации мелатонинергических рецепторов необходима высокая степень связывания с их участками [56]. Однако этот вопрос еще требует уточнения.
Независимо от предлагаемых объяснений интервал доз, в которых агомелатин проявляет свойства антидепрессанта у грызунов, для этого требуется активация и блокада и мелатонинергических и 5-HT2C рецепторов, соответственно, что, вероятно, справедливо и для механизма действия препарат у человека [73] (Рисунок 4). Результаты недавно выполненного исследования методом магнитного резонанса подтверждают, что агомелатин блокирует участки 5-HT2C рецепторов в головном мозге крыс [74] и сходные исследование планируются у человека.
Рисунок 4. Механизм антидепрессивного эффекта агомелатина.
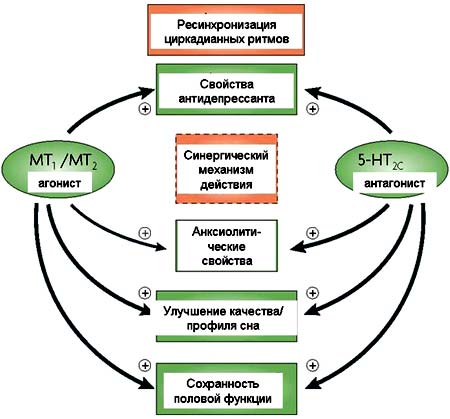
Агомелатин обладает свойствами агониста мелатонинергических рецепторов (MT1 и MT2) и антагониста 5-гидрокситриптаминовых рецепторов (5-HT2C). Эти свойства реализуются взаимодополнящим и вероятно синергическим образом, обеспечивая редукцию депрессивного состояния за счет ресинхронизации циркадианных ритмов, усиления дофаминергической и адренергической активности во фронтальной коре, индукции нейрогенеза, а также при участии других механизмов (Таблица 1). Кроме того, согласованное действие мелатонинергического агонизма и антагонизма к 5-HT2C также способствует редукции тревоги, нарушений сна и сохранности половой функции.
Антидепрессивный профиль агомелатина
Эффекты на разных экспериментальных моделях.
В экспериментальных исследованиях, направленных на оценку антидепрессивного потенциала агомелатина, использовались три дополнительные стратегии (Таблица 1). Во первых, действие препарата оценивали на нескольких хорошо известных моделях, отражающих ядерные клинические признаки депрессии. Во вторых, ресинхронизирующие свойства агомелатина изучали на моделях депрессии, связанных с нарушениями циркадианных ритмов. В третьих, исследовалось влияние агомелатина на нейробиологические параметры, сопряженные с соответствующими дисфункциями при депрессии: фронтокортикальная дофаминергическая и адренергическая трансмиссия (нарушается); нейрогенез в гиппокампе (подавляется) и активность гипоталамо-гипофизарно-надпочечниковой (ГГН) системы (гиперактивируется) [2,7,20].
Таблица 1. Эффекты агомелатина в экспериментальных моделях депрессии
| Характеристика | Модель | Вид | Основой результат | Источник |
| Ядерный симптом | Тест вынужденного плавания (отчаяние) | Крыса | Сокращение времени неподвижности | 76 |
| Обученная беспомощность (отказ) | Крыса | Высвобождение подавленных эффектов | 83 | |
| Хронический легкий стресс (ангедония) | Крыса | Восстановление потребления сахарозы | 75 | |
| Ольфакторная бульбэктомия (моторная ажитация) | Крыса | Снижение гиперактивности | 81 | |
| Циркадианные нарушения | Мутированные глюкокортикоидные рецепторы | Мышь | Коррекция нарушений ритмов секреции кортикостерона | 80 |
| Психосоциальный стресс | Тупайя | Коррекция нарушений ритмов секреции кортикостерона и температуры тела | 84,85 | |
| Биологический субстрат | Норадреналин/дофамин во фронтальной коре | Крыса | Повышение внеклеточных уровней | 64 |
| Нейрогенез в гиппокампе | Крыса | Повышение клеточной пролиферации и выживаемости | 78,79 | |
| Уровни мозгового нейротрофического фактора | Крыса | Повышение уровней иРНК | 79 |
Одним из наиболее важных вопросов с явным клиническим значением является время назначения агомелатина. Как минимум на основании мелатонинергических свойств препарата можно ожидать серьезные различия в зависимости от времени суток для приема агомелатина, к тому же учитывая и общий принцип: не только назначить правильный препарат, но еще и выбрать для его приема правильное время. В соответствии с нашей оригинальной гипотезой (см. выше) вечернее назначение выглядит более предпочтительным, так как совпадает с началом ночной секреции мелатонина как у дневных, так и у ночных видов [26,31,33] (Рисунок 1). Более того, эффекты ресинхронизации также наблюдались при назначении агомелатина в вечернее время. Поэтому было решено сохранить основной распорядок приема, за исключением некоторых исследований с кратковременным введением препарата.
Ранние результаты свидетельствуют об активности агомелатина в тесте вынужденного плавания и в условиях хронического легкого стресса , что было жизненно необходимо для запуска клинической программы исследований в терапии депрессии [75,76] (Таблица 1). Кроме того, повышение выброса дофамина и норадреналина во фронтальной коре обеспечивает убедительную основу для терапевтической эффективности [64] (Вставка 2; Рисунок 5). Интересно отметить, что в отличие от многих других антидепрессантов агомелатин селективно повышает фронтокортикальную дофаминергическую активность, не влияя на подкорковую дофаминергическую трансмиссию [2,77]. Следовательно, было установлено, что агомелатин обладает двумя другими взаимосвязанными свойствами антидепрессантов, которые вызывают большой интерес: он способствует нейрогенезу и повышает уровни мозгового нейротрофического фактора в гиппокампе [19,20,78,79].
| Вставка 2. 5-HT2C рецепторы, настроение и депрессия
5-гидрокситриптамин2C (5-HT2C) рецепторы представлены в супрахиазматическом ядре (СХЯ), где они модифицируют реакцию нейронов на световые стимулы [67,69,70]. Интересно, что полисинаптический путь, который пролегает из СХЯ в вентротегментальное ядро, происходит из мезокортикальных и мезолимбических дофаминергических путей [129]. Эта нейрональная связь обеспечивает анатомический субстрат для опосредованного влияния 5-HT2C рецепторов, расположенных в СХЯ, на восходящую дофаминергическую трансмиссию. Кроме того, 5-HT2C рецепторы широко представлены в самой вентротегментальной области и locus coeruleus - источнике адренергических путей в переднем мозге [2,77]. В этих ядрах, как и во фронтальной коре, возбуждающие 5-HT2C рецепторы расположены на ГАМК (γ-аминомасляная кислота)-ергических интернейронах. Следовательно, блокада этих рецепторов высвобождает фронтокортикальную дофаминергическую и адренергическую трансмиссию (Рисунок 5),активность которой может быть нарушена при депрессии [2,61]. 5-HT2C рецепторы также сконцентрированы в лимбических структурах, таких как лобная кора, амигдала, гиппокамп и перегородка, которые играют важную роль в контроле настроения и этиологии тревожно-депрессивных расстройств [65,66]. |
Рисунок 5. Усиление кортиколимбической адренергической и дофаминергической трансмиссии под действием агомелатина.
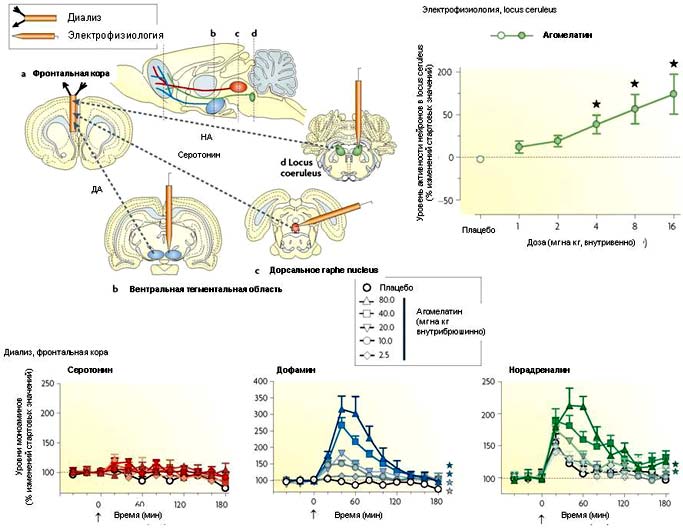
Фронтальная кора иннервируется восходящими адренергическими, дофаминергическими и серотонинергическими путями, который берут начало в locus coeruleus, вентротегментальной области и дорсальном raphe nucleus, соответственно. Влияние агомелатина на активность моноаминергических трактов измеряли у свободно движущихся крыс с помощью диализа в сочетании с высокоточной жидкостной хроматографией и электрохимической регистрацией для подсчета внеклеточных уровней моноаминов. Кроме того, проводилась оценка влияния агомелатина на электрическую активность тел моноаминергических клеток у крыс под анестезией, представленная на рисунке для locus coeruleus (вверху справа). Адренергические и дофаминергические пути опосредованно подавляются 5-гидрокситриптаминовыми 2C (5-HT2C) рецепторами, который действуют через возбуждение ГАМК (γ-аминомасляная кислота)-ергических интернейронов. Агомелатин дозозависимо повышает выброс дофамина (ДA) и норадреналина (НA), но не серотонина во фронтальной коре. Одновременно под влиянием агомелатина повышается активность адренергических нейронов в locus coeruleus [64]. Стрелками указаны инъекции агомелатина. Звездочками показано отличие P<0.01 от плацебо (тест Dunnett после ANOVA).
Синергизм мелатонинергического агонизма и 5-HT2C антагонизма.
Больше число подтверждений антидепрессивных свойств агомелатина (Таблица 1), а также его ресинхронизирующего действия, описанного выше, послужило основанием для запуска программы клинических исследований. Однако, вопрос о механизме антидепрессивного действия агомелатина оставался открытым: чем обусловлены его эффекты - мелатонинергическим агонизмом, антагонизмом к 5-HT2C рецепторам и/или комбинацией этих свойств? Маловероятно, что ответ на этот вопрос может быть унитарным, поэтому агомелатин сравнивали как с мелатонином, так и с 5-HT2C антагонистами. Кроме того, в определенных исследованиях проводилось механистическое сравнение с мелатонинергическими антагонистами.
Гипотеза о том, что мелатонинергический механизм участвует в реализации антидепрессивного эффекта агомелатина, подтверждается наличием MT1 и/или MT2 рецепторов в гиппокампе, nucleus accumbens и фронтальной коре человека, где они, как предполагается, играют важную роль в регуляции настроения [56]. Возможность участия мелатонинергических рецепторов в антидепрессивном действии агомелатина согласуется с тем фактом, что мелатонин корректирует циркадианные нарушение у трансгенной мыши с мутацией глюкокортикоидного гена, которая приводит к гиперактивности ГГН системы [80]. С другой стороны, антагонисты 5-HT2C рецепторов воспроизводят эффект агомелатина, связанный с повышением дофаминергической и адренергической трансмиссии, а также редукцию гиперактивности у крыс, подвергнутых ольфакторной бульбэктомии, т.е. на модели связанной с депрессией ажитации [64,66,81,82]. Однако, хотя антагонист мелатонина блокирует эффект агомелатина на модели обученной беспомощности, этот эффект агомелатина не воспроизводится при назначении мелатонина или антагонистов 5-HT2C рецепторов [83]. Поэтому можно предположить, что для реализации антидепрессивного эффекта агомелатина требуется комбинированное воздействие на мелатонинергические и 5-HT2C рецепторы. Эта гипотеза подкрепляется тем фактом, что 5-HT2C антагонисты повторяют свойственный агомелатину эффект индукции клеточной пролиферации в гиппокампе, но в отличие от агомелатина не обеспечивают повышения клеточной выживаемости или уровней мозгового нейротрофического фактора, которые лишь немного увеличиваются под действием мелатонина [79].
В другой модели с отчетливым циркадианным элементом - психосоциальный стресс у тупайи, Tupaia belangeri, агомелатин корректировал нарушения суточных ритмов секреции кортизола и температуры тела. Вновь мелатонин не обнаруживал активности, тогда как 5-HT2C антагонист отчетлива сглаживал гиперкортизолемию [84,85]. Элегантной иллюстрацией роли мелатониновых и 5-HT2C рецепторов служат данные, полученные на упомянутой выше модели с хроническим легким стрессом. Агомелатин был активен как при вечернем назначении (контроль - мелатонин), так и при утреннем (контроль - 5-HT2C антагонист)[75]. С другой стороны и в зависимости от экспериментальных условий и мелатонин, и 5-HT2C антагонисты были активны в тесте вынужденного плавания [66,82,86,87].
В совокупности приведенные данные подтверждают предположение о том, что ни мелатонинергический агонизм, ни антагонизм к 5-HT2C рецепторам в отдельности не могут полностью объяснить антидепрессивные свойства агомелатина. Именно двойное воздействие на мелатониновые и 5-HT2C рецепторы определяет широкий спектр антидепрессивной активности агомелатина на моделях у животных, в последующем подтвержденный в приведенных ниже клинических исследованиях [73,88].
Переход к клинике
В ранних исследованиях Фазы I была показана хорошая переносимость агомелатина в широком диапазоне доз (от 5 до 1200 мг), а доза 800 мг была определена как максимальная хорошо переносимая доза в связи с тем, что у одного субъекта отмечалось ортостатическое головокружение на дозе 1200 мг. Даже в более высоких дозах агомелатин не вызывал выраженных нежелательных эффектов; наиболее типичными нежелательными явлениями были легкая седация и головная боль [73,88]. Эти данные особенно обнадеживают, учитывая проблемы с переносимостью, возникающие при назначении других антидепрессантов [1-3].
Более того, хорошая переносимость агомелатина обеспечивает серьезный запас безопасности в случаях высоких концентраций препарата, зафиксированных у некоторых пациентов. Предположительно это связано с межиндивидуальной вариабельностью метаболизма агомелатина, протекающего преимущественно при участии цитохрома P450 1A2 - главного фермента деградации препарата [73,88]. Как и ожидалось на основании метаболических прогнозов in silico, исследований in vitro на человеческих микросомах и гепатоцитах, и исследований in vivo на животных, агомелатин быстро и полностью всасывается в кишечнике. Однако, биодоступность агомелатина после перорального приема ограничена вследствие значительного эффекта первого печеночного прохода. Кроме того, как отмечалось выше, агомелатин отличается быстрой элиминацией с периодом полужизни примерно 2 часа.
Тем не менее, целый ряд фактов убедительно свидетельствует о потенциально высокой терапевтической активности агомелатина у пациентов с депрессией. Во первых в преклинических исследованиях установлена отчетливая активность агомелатина у животных, включая модели для верификации ресинхронизации и антидепрессивных свойств. Во вторых, как указывалось выше, для реализации клинического эффекта агомелатина вовсе не требуется полного и 24-часового связывания с целевыми рецепторами, а 2=часового периода полужизни вполне достаточно для стимуляции пикового выброса мелатонина с началом темноты. В третьих, в исследованиях на добровольцах, получавших агомелатин в дозах от 5 мг до 100 мг, показано стойкое смещение фазы циркадианных ритмов на более раннее время, отчетливо проявляющееся даже на следующий день после приема препарата [7,58]. Наконец, в сходных дозах агомелатин несколько снижает температуру тела и вызывает легкую седацию [57,58], как можно ожидать в результате стимуляции мелатонинергических рецепторов [31].
Выбор доз для определения эффективности
Еще одной важной задачей был выбор дозы. Как ни парадоксально, хорошая переносимость агомелатина осложняла решение этого вопроса, так как максимальные поддающиеся тестированию дозы препарата часто вызывали нежелательные побочные эффекты. Поэтому при переходе от Фазы I к Фазе II/III в исследованиях эффективности нельзя было использовать хорошо известные методы, такие как фармакологический магнитный резонанс. Кроме того, попытки разработки лигандов для позитронной эмиссионной томографии с целью подсчета связанных мелатониновых и 5-HT2C рецепторов у человека пока не увенчались успехом. В действительности выбор доз 1 мг, 5 мг и 25 мг для инициального исследования с ранжированными дозами основывался преимущественно на данных упомянутых выше исследований смещения фазы у здоровых добровольцев [57,58]. Оглядываясь в прошлое с позиции современных знаний можно утверждать, что электроэнцефалография могла быть достаточно информативной в то время, поскольку сегодня мы знаем, что у крыс [89] и у пациентов90 агомелатин улучшает восстановительный медленноволновый сон - эффект, характерный для антагонистов 5-HT2C рецепторов [66,89]. Следует отметить, что в отличие от антидепрессантов, подавляющих обратный захват моноаминов [2,91], агомелатин не редуцирует парадоксальный сон ни у пациентов с депрессией [90], ни у здоровых добровольцев [92].
Таким образом, несмотря на современное пристрастие к методам компьютерной визуализации, эта история является хорошим примером того, насколько полезным мог быть и до сих является традиционный фармакодинамический подход для центральной оценки активных доз нового препарата.
Действительно, оказалось вполне возможным определить дозы агомелатина, эффективные в терапии большой депрессии. В следующем разделе обобщаются результаты исследований эффективности и безопасности с участием почти 5000 пациентов, преимущественно из Европы, а также из Южной Африки, Южной Америки, Северной Америки и Австралии.
Клиническая оценка при терапии большой депрессии
Клиническая оценка агомелатина при большой депрессии проводилась в соответствии с требованиями Европейского медицинского агентства (European Medicines Agency; EMA): во первых, подтверждение эффективности в сравнении с плацебо; во вторых, доказательство стойкости эффекта при длительной терапии (профилактика рецидивов); в третьих, сравнение с другими используемыми в клинической практике антидепрессантами; в четвертых, подтверждение благоприятного соотношения риска и пользы. Результаты всех 6 клинических исследований, 3 из которых были позитивными, были представлены в EMA и обнародованы в свободном доступе в Интернете (ссылка на отчет по оценке агомелатина представлена в дополнительной информации). Кроме того, в опубликованной недавно статье был представлен подробный анализ всей базы данных как позитивных, так и негативных исследований [93]. Последующее обсуждение будет посвящено основным клиническим данным, которые послужили основой для дальнейшей разработки и рекомендаций, которые были составлены EMA для выпуска агомелатина на рынок под торговыми марками Вальдоксан и Тиманакс.
Кратковременные исследования эффективности в сравнении с плацебо.
Проведено двойноеслепое, пароксетин (СИОЗС)-валидизированное с ранжированными дозами исследование длительностью 8 недель, в котором агомелатин назначался в дозах 1 мг, 5 мг и 25 мг. В результате показано, что доза 25 мг является наиболее эффективной в соответствии с главным критерием - суммарным баллом 17-пунктовой Шкалы депрессии Гамильтона (HAM-D) [94]. Этот вывод был подкреплен оценкой по дополнительному критерию эффективность: процент пациентов с >50% редукцией стартового суммарного балла HAM-D и баллов Шкалы общего клинического впечатления - Тяжесть (CGI-S). Интересно, что по результатам оценки динамики баллов Шкалы тревоги Гамильтона агомелатин также успешно редуцировал тревожную симптоматику. Кроме того, как и в исследованиях Фазы I, установлена хорошая переносимость препарата.
Успешное завершение этого исследования послужило стимулом для проведения нескольких дополнительных кратковременных исследований эффективности Фазы II в сравнении с плацебо. К сожалению, в этих исследованиях был получен чрезмерно высокий плацебо эффект, достигавший 47-58%. Хорошо известно, что эта сложная проблема часто возникает в исследованиях антидепрессантов и связана с множественными факторами; например, "недостаточно" тяжелое расстройство у пациентов при включении, и сопоставимость плацебо с формой психотерапии, которая не учитывается в "реальной практике" [5,95,96]. Для минимизации стойкого плацебо эффекта было разработано несколько инновационных методик. Так, в исследования включались только пациенты с умеренной и тяжелой депрессией со строгим соблюдением критериев отбора. Кроме того, использовалась шкала дезадаптации для оценки нарушений социального и профессионального функционирования. Эти меры оказались достаточно действенными, поскольку в двух ключевых исследованиях Фазы III с гибким режимом дозирования агомелатина (25-50 мг) были получены убедительные доказательства его превосходства по эффективности в сравнении с плацебо (уровень плацебо эффекта составил примерно 35%) [73,88,97].
Подтверждение эффективности в сравнении с другими антидепрессантами.
Выполнено несколько других очных сравнительных исследований Фазы III для сопоставления агомелатина (25-50 мг) с ИОЗСН венлафаксином (75-150 мг) и СИОЗС сертралином (50-100 мг). Агомелатин был как минимум сопоставим по эффективности с этими стандартными препаратами. В действительности агомелатин превосходил венлафаксин и сертралин по степени улучшения баллов HAM-D и CGI (улучшение), соответственно [98-100]. Следует отметить, что агомелатин был эффективен у всех пациентов выборки и у пациентов с более тяжелой депрессией (стартовые показатели: HAM-D >25; CGI-S >5). Кроме того, доля пациентов, полностью завершивших 6-месячный период терапии, была достоверно больше в группе агомелатина, чем в группах препаратов сравнения [99,100] (Рисунок 6b).
Учитывая задержку развития полного эффекта других антидепрессантов [1,2,7] особенно интересным представляются сроки реализации эффекта агомелатина, которые по данным первого плацебо-контролируемого исследования выглядят более короткими (неделя 2) [94]. Кроме того, сообщение о том, что доля респондеров на неделе 2 была больше среди пациентов, получавших агомелатин, в сравнении с пациентами, принимавшими сертралин, особенно интригует [99], тем более что в другом исследовании преимущество агомелатина выражалось в более выраженном улучшении состояния уже на первой неделе терапии в сравнении с венлафаксином [98]. В ходе сравнительной оценки агомелатин и венлафаксина по скорости развития инициального эффекта выявлено два вероятных фактора более быстрой редукции симптомов при назначении агомелатина: улучшение повседневного функционирования и улучшение сна, который часто нарушается под действием СИОЗС и ИОЗСН [2,3,91]. Так, в соответствии с измерениями по Вопроснику для оценки сна Leeds (Leeds sleep evaluation questionnaire) установлено отчетливое преимущество агомелатина над венлафаксином по показателям засыпания и качества сна, начиная с 1-й недели и далее на протяжении всех 6 недель терапии [98]. Эти результаты согласуются с данными о быстром субъективном улучшении сна и функционирования в дневное время при лечении агомелатином в сравнении с сертралином [99]. Способность агомелатина улучшать сон по видимому связана и с мелатонинергическим агонизмом, и с 5-HT2C антагонизмом [66,89,91,101]. Целесообразны дальнейшие исследования для оценки скорости развертывания антидепрессивного эффекта агомелатина. Подтверждение эффективности в профилактике рецидивов в сравнении с плацебо. Инициальное плацебо-контролируемое исследование профилактики рецидивов оказалось безуспешным, преимущественно в связи с низкой частотой рецидивов в группе плацебо. Тем не менее, это исследование было поучительным, поскольку агомелатин превосходил плацебо у пациентов с тяжелой депрессией при включении - наблюдение, которое полностью согласуется с данными кратковременных исследований, представленными выше [88,97]. В связи с этим методика следующего катамнестического исследования профилактики рецидивов была изменена для устранения проблем, возникших в первом исследовании. Например, был предусмотрен гибкий режим дозирования, позволяющие повышение (слепое) дозы с 25 мг до 50 мг через 2 недели лечения. Кроме того, через 8-10 недель открытой терапии для перехода к 6-месячной рандомизированной двойной-слепой поддерживающей терапии требовались баллы HAM-D и CGI-S, составляющие <10 и <2, соответственно, причем этот критерий не был известен ни пациентам, ни исследователям. По результатам оценки главного показателя (HAM-D) в этом исследовании установлено двукратное снижение вероятности рецидива в фазе поддерживающей терапии у пациентов, получавших агомелатин, в сравнении с пациентами, получавшими плацебо [102] (Рисунок 6a). Кроме того, в контролируемой дополнительной фазе исследования обнаружено, что такое преимущество агомелатина стойко сохраняется до 10 месяцев, как во всей выборке, так и в подгруппе пациентов с более тяжелой депрессией [103].
Рисунок 6. Эффекты агомелатина при большой депрессии: профилактика рецидива и низкая частота преждевременного выбывания пациентов из исследования относительно препаратов сравнения.
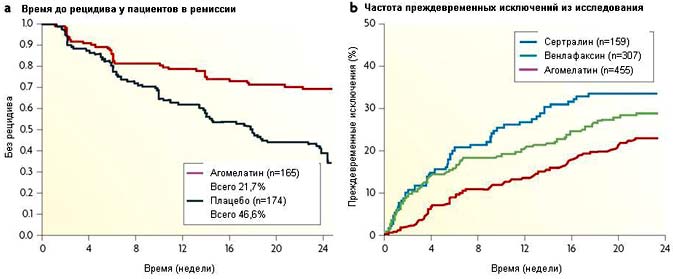
a Агомелатин обеспечивает достоверное снижение риска рецидивов на протяжении 6 месяцев терапии в сравнении с плацебо. Это превосходство агомелатина сохраняется и при увеличении сроков лечения до 10 месяцев [88,97,102].
b На диаграмме отражено достоверное снижение частоты преждевременного исключения пациентов и риска недостаточной комплаентности при терапии агомелатином (25-50 мг в сутки) в сравнении с селективным ингибитором обратного захвата серотонин сертралином (50-100 мг в сутки) и ингибитором обратного захвата серотонина/норадреналина венлафаксином (75-150 мг в сутки) [99,100].
Отсутствие синдрома отмены.
Зафиксированный в представленных выше исследованиях агомелатина минимальный уровень ранних рецидивов после перевода на плацебо можно объяснить тем фактом, что агомелатин не вызывает синдрома отмены. Это свойство подтверждено в плацебо-контролируемом исследовании с применением пароксетина (20 мг) в качестве активного препарата сравнения [104]. Отсутствие синдрома отмены после остановки приема агомелатина представляется серьезным преимуществом, поскольку синдром отмены является существенной проблемой при использовании определенных СИОЗС, что негативно сказывается на желании пациентов принимать эти препараты [105]. Очень сложно экстраполировать клинические данные обратно на клеточный уровень; тем не менее, длительное применение инверсных агонистов 5-HT2C рецепторов сопровождается повышением плотности и чувствительности 5-HT2C рецепторов на поверхности клетки, тогда как нейтральный антагонист агомелатин не вызывает подобного эффекта [61,62,64]. Следовательно, остановка терапии агомелатином не приводит к негативным эффектам, обусловленным вызванной серотонином активации гиперчувствительных 5-HT2C рецепторов. Однако, это предположение требует доказательств.
Хорошая переносимость в сравнении с другими антидепрессантами.
Стабильный результат, воспроизведенный во всех клинических исследованиях агомелатина - хорошая переносимость препарата, которая является ключевым фактором успешного начала лечения и приверженности пациентов длительной терапии [1,3]. Убедительные подтверждения благоприятного профиля побочных эффектов были получены уже в кратковременных исследованиях, в которых частота нежелательных явлений при терапии агомелатином была практически такой же, как при назначении плацебо [88,94,97]. Так, в соответствии с информацией в общей базе данных двойных-слепых 6-месячных исследований единственным нежелательным явлением, которое достоверно чаще наблюдалось в связи с приемом агомелатина (1120 пациентов) в сравнении с плацебо (998 пациентов) было головокружение: 5.9% против 3.5%, соответственно (P<0.01). Следует отметить, что в очных сравнительных исследованиях, в которых агомелатин непосредственно сопоставлялся с венлафаксином и сертралином, более благоприятный профиль безопасности агомелатина трансформировался в достоверное снижение частоты преждевременных исключений пациентов из исследований по причине побочных эффектов [98-100] (Рисунок 6b).
Гастроинтестинальные побочные эффекты и прибавка в весе иногда провоцируют преждевременную отмену терапии другими антидепрессантами [3,106]. Напротив агомелатин характеризуется хорошей гастроинтестинальной переносимостью и нейтральностью в отношении массы тела. Отсутствие прибавки в весе особенно важно, поскольку по данным исследований на мышах с генными мутациями (трансгенная мышь) ожирение может быть следствием терапевтического применения 5-HT2C антагонистов [65,66].
Даже в дозах, превышающих терапевтические, агомелатин не вызывает клинически значимых изменений в биохимических и сердечнососудистых показателях. У всех пациентов отмечалось некоторое изолированное и кратковременное повышение сывороточных концентраций аланин и/или аспартат трансаминаз на первом месяце терапии: 1.1% для всех доз агомелатина в сравнении с 0.7% для плацебо. Особенно типичным такое явление было при назначении агомелатина в дозе 50 мг в сутки, при этом в соответствии с результатами анализа объединенной базы данных сравнительных исследований частота повышения трансаминаз при терапии агомелатином (1.39%) была сопоставима с аналогичными показателями для венлафаксина в дозах 75-150 мг в сутки (1.53%) [44,47] (неопубликованные данные). В связи с этим EMA включила в рекомендации по применению агомелатина в качестве меры предосторожности тестирование функции печени в начале терапии, затем периодически через 6 недель, 12 недель и 6 месяцев, далее - по клиническим показаниям. Однако пациенты с депрессией в любом случае требуют регулярных осмотров лечащим врачом, поэтому подобное требование выглядит не столь проблематичным, как можно было бы представить. Кроме того, следует отметить, что агомелатин противопоказан пациентам с патологией печени, например, циррозом или активным заболеванием печени.
Половые дисфункции, которые относятся к наиболее нежелательным и частым побочным эффектам многих антидепрессантов, значительно влияют на качество жизни и являются фактором недостаточной комплаентности к терапии [2,3,107]. Мелатонинергические агонисты и 5-HT2C антагонисты, напротив, стимулируют сексуальное поведение у животных [2,108-110]. По данным сравнительных исследований риск половых дисфункций при терапии агомелатином значительно ниже, чем при лечении венлафаксином при назначении этих антидепрессантов в эквивалентных эффективных дозах [100]. Эти данные были подтверждены превосходством агомелатина над пароксетином по переносимости у сексуально активных здоровых добровольцев [111].
Взгляд в будущее: следующие главы
Дальнейшие экспериментальные исследования.
Как и другие препараты агомелатин пока находится в стадии изучения. Несмотря на детальное описание основных характеристик препарата предстоит еще большая работа по уточнению механизма его действия и возможностей практического применения. Можно выделить следующие направления, которые представляются наиболее перспективными в дальнейшей разработке агомелатина.
Во первых, уже проводятся исследования по оценке пропорции участия MT1 относительно MT2 рецепторов в механизме действия агомелатина, изучается значение взаимодействия (функционального или физического) между мелатонинергическими и 5-HT2C рецепторами, а также влияние агомелатина на многочисленные внутриклеточные сигналы, участвующие в патогенезе депрессивных состояний [19,56,60,112].
Во вторых, агомелатин обладает рядом дополнительных механизмов, которые потенциально способны улучшать когнитивные функции: усиление дофаминергической и адренергической активности во фронтальной коре; стимуляция нейрогенеза в гиппокампе; регуляция индуцированной стрессом гиперактивности ГГН системы; улучшение медленноволнового сна без подавления парадоксального сна; циркадианная синхронизация [2,113-115]. Учитывая выраженные когнитивные нарушения при депрессии [2,116] и способность агомелатина защищать когнитивные функции в условиях стресса [117] было бы интересно исследовать влияние агомелатина на функцию памяти.
В третьих, остается не решенным вопрос о том, как терапия агомелатином влияет на реактивность мелатонинергических рецепторов. Данные исследований, выполненных на клетках яичников китайского хомяка, позволяют предположить значительное снижение активности, разобщение и интернализацию мелатонином MT2 рецепторов человека. С другой стороны человеческие MT1 рецепторы более устойчивы: высокие ночные концентрации мелатонина приводят к десенситизации MT2 рецепторов, но не обязательно снижают чувствительность MT1 рецепторов в СХЯ крыс [40-42]. Менее выраженная подверженность MT1 рецепторов к десенситизации вызывает особый интерес, поскольку именно этот подтип рецепторов мелатонина преобладает в СХЯ человека [25,29,31]. Необходимы исследования рецепторной регуляции при длительной терапии агомелатином, так как агонисты могут по разному влиять на чувствительность G протеинсвязываемых рецепторов [2] и, соответственно, данные по сенситизации рецепторов под действием мелатонин нельзя напрямую экстраполировать на агомелатин. Против десенситизации свидетельствуют данные о том, что влияние агомелатина на активность нейронов СХЯ у хомяков сохраняется при повторном введении препарата [43]. Кроме того, относительно короткий период полужизни агомелатина соотносится с ночным всплеском секреции мелатонина и предположительно должен быть фактором, препятствующим снижению чувствительности мелатонинергических рецепторов [40,42]. Следовательно в условиях ежедневного вечернего приема агомелатина мелатонинергические (как минимум MT1) рецепторы в СХЯ вероятно должны сохранять свою чувствительность, однако это предположение требует подтверждений.
Дальнейшие клинические исследования.
Депрессия характеризуется высокой распространенностью и плохо поддается лечению у лиц пожилого возраста, которые к тому же особенно чувствительны к субъективно тягостным побочным эффектам антидепрессантов и часто обнаруживают выраженные нарушения циркадианных ритмов [2,118]. Соответственно с одобрения EMA было начато исследование агомелатина в терапии пациентов старше 65 лет.[93]
Одним из очевидных направлений дальнейшей разработки агомелатина является сезонное аффективные расстройство (САР), которое характеризуется депрессивными эпизодами, повторяющимися в одно и то же время года, преимущественно зимой [46,119]. Пациенты с САР обнаруживают нарушение, как правило - задержку фазы циркадианных ритмов и расстройства сна, а также нарушения секреции мелатонина. Как и в случае большой депрессии сам мелатонин не эффективен в лечении сезонного аффективного расстройства (Вставка 1), тогда как в открытом исследовании агомелатина (25 мг в сутки вечером) получены данные, свидетельствующие о хорошей эффективности препарата при 14-недельной терапии [120] и, соответственно, определяющие целесообразность дальнейших исследований в этом направлении.
Биполярное аффективное расстройство сопровождается тяжелыми нарушениями настроения и когнитивных функций, десинхронизацией суточных ритмов и нарушениями сна [19]. Получены данные об аномальных изменениях в механизмах регуляции нейрональной пластичности, включая процессы с участием гликоген синтазы киназы 3ß [19], в связи с чем представляется особенно интересным изучение эффектов агомелатина, который регулирует активность этих внутриклеточных сигналов [79,112]. Начаты экспериментальные и клинические исследования эффективности агомелатина в качестве дополнительного препарата в терапии биполярного расстройства. Кроме того, можно было бы предположить возможность присоединения агомелатина к другим антидепрессантам в терапии большой (монополярной) депрессии для повышения эффективности и улучшения переносимости (включая сон и половую функцию). Тем не менее, на сегодня основные данные по эффективности агомелатина получены в исследованиях монотерапии.
Высокая распространенность тревожных расстройств и коморбидности тревоги и депрессии [2,121] определяет актуальность исследований анксиолитических свойств агомелатина. На модели социального поражения у крыс агомелатин воспроизводил анксиолитические свойства мелатонина, причем его противотревожное действие блокировалось в случае повреждения СХЯ [122]. Кроме того, в соответствии с фармакологической или генетической инактивацией 5-HT2C рецепторов [66,82,123], агомелатин проявлял отчетливые анксиолитические свойства (вероятно реализующиеся на уровне амигдалы и гиппокампа) в нескольких экспериментальных исследованиях на крысах [66,124,125]. Эти данные формируют основу для дальнейшей оценки анксиолитического действия агомелатина у человека, причем недавно были опубликованы первые положительные результаты применения агомелатина в терапии генерализованного тревожного расстройства [126].
Общие соображения относительно R&D препарата
История создания и разработки агомелатина иллюстрирует целый ряд фундаментальных аспектов исследований и клинического развития препаратов, которые заслуживают отдельного рассмотрения в более широком контексте. Во первых, исключительно важно, что на протяжении всей истории нового препарата экспериментальные и клинические исследования проводятся в тандеме с программами его развития (Рисунок 7). Соответственно, свойства препарата требуют непрерывной переоценки по мере поступления новых разработок, от молекулярных до клинических. Например, в то время, когда началась программа развития агомелатина, рецепторы MT1, MT2 и 5-HT2C еще не были клонированы. Во вторых, открытие агомелатина иллюстрирует научно обоснованный и целенаправленный поиск вещества на основании гипотезы о том, что депрессия представляет собой не монолитное расстройство настроения, а сопровождается, наряду с другими факторами, нарушениями биологических ритмов; причем эта концепция по прежнему определяет направление дальнейших исследований свойств препарата. В третьих, невозможно все спрогнозировать с самого начала. Поскольку удача сопутствует подготовленному разуму (и лаборатории), гибкость и реактивность являются ключевыми элементами успеха в научных исследованиях и разработках. Соответственно, неожиданно обнаруженные у агомелатина свойства антагониста 5-HT2C рецепторов были подвергнуты систематическому изучению как дополнительные к его основному действию, связанному с мелатонинергическим агонизмом. Наконец, потребовались длительные и интенсивные усилия от создания до регистрации на рынке для реализации возможности практического применения агомелатина в терапии пациентов, страдающих большой депрессией (Рисунок 7).
Рисунок 7. История открытия, изучения, разработки и регистрации агомелатина.
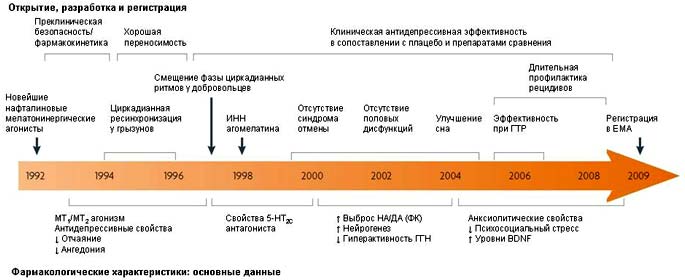
История агомелатина иллюстрируется стрелкой времени, которая начинается на этапе открытия и первой фармакологической спецификации и ведет к клиническому развитию препарата. На этой шкале времени отмечены ключевые фазы жизненного цикла агомелатина, кульминацией которого стала регистрация препарата в европейском медицинском агентстве (EMA) для терапии большой депрессии. Однако, время не остановилось и, помимо клинических исследований Фазы IV продолжается экспериментальное и клиническое изучение возможностей клинического применения агомелатина (см. основной текст). 5-HT, 5-гидрокситриптамин (также обозначается как серотонин); BDNF, мозговой нейротрофический фактор; ФК, фронтальная кора; ГТР, генерализованное тревожное расстройство; ГГН, гипоталамо-гипофизарно-надпочечниковая система; ИНН, интернациональное независимое название; MT, мелатонин; НА/ДA, норадреналин/дофамин.
Заключительные комментарии
Агомелатин представляет инновационный подход к терапия депрессии,[73] поскольку является первым зарегистрированным антидепрессантом с не моноаминергическим механизмом действия. В соответствии с данными экспериментальных исследований на животных и оценки терапевтического профиля у человека предполагается, что антидепрессивная активность агомелатина реализуется за счет взаимодействия мелатонинергических (агонист) и 5-HT2C (антагонист) свойства. В масштабных клинических исследованиях подтверждена эффективность агомелатина при кратковременной и длительной терапии большой депрессии, как легкой, так и тяжелой с улучшением качества сна, сохранностью половой функции, отсутствие прибавки в весе и хорошей переносимостью. Более того, резкая остановка терапии агомелатином не сопровождается развитием синдрома отмены. Такой профиль определяет превосходство агомелатина над всеми доступными сегодня антидепрессантами и может способствовать улучшению приверженности пациентов длительной терапии не менее 6 месяцев, рекомендуемой для стабильного излечения большого депрессивного эпизода. Дальнейшие исследования и опыт клинического применения позволят уточнить потенциал агомелатина как антидепрессанта. Также следует отметить потенциально широкие перспективы практического применения агомелатина, как отмечалось выше, в терапии других расстройств центральной нервной системы.
ГЛОССАРИЙ
Большая депрессия
Серьезное расстройство, характеризующееся депрессивным настроением (подавленность) и ангедонией (утрата способности испытывать удовольствие). Другие важные признаки депрессии включают чувство отчаяния, идеи малоценности, суицидальные мысли, сонливость или ажитацию, и инсомнию (либо гиперсомнию). Типичны коморбидные расстройства, такие как тревога, когнитивные нарушения, половые дисфункции и циркадианная десинхронизация. Для постановки диагноза требуется достаточная выраженность, дезадаптивность и более или менее стабильная представленность симптомов на протяжении минимум 2-х недель. Риск развития большой депрессии на протяжении жизни составляет примерно 10%.
Трициклики
Названные на основании химической структуры трициклические антидепрессанты подавляют обратный захват серотонина и/или норадреналина, активность которых, как считается, недостаточна у (как минимум некоторых) пациентов с депрессией. Трициклики могут быть высоко эффективными, однако их применение ограничивается побочными эффектами, обусловленными воздействием, например, на центральные мускариновые рецепторы и ионные каналы сердца.
Ингибиторы моноаминоксидазы
Действие этих антидепрессантов основано преимущественно на подавлении процесса разрушения серотонина и норадреналина моноаминоксидазой A. Эти препараты обладают высокой клинической эффективностью, однако, особенно необратимые ингибиторы, блокируют катаболизм пищевых аминов, таких как тирамин, что может приводить к потенциально опасной для жизни артериальной гипертензии.
Супрахиазматическое ядро
(СХЯ). Двустороннее СХЯ, расположенное непосредственно над перекрестом зрительных нервов у основания гипоталамуса, действует как главный водитель циркадианных ритмов организма. Нейроны СХЯ имеют автономную ритмическую активность, которая сохраняют даже в изолированном состоянии. In situ нейроны СХЯ синхронизируются с суточным циклом смены света и темноты с помощью информации об внешней освещенности, которую они получают через ретиногипоталамический тракт. СХЯ влияет на секрецию мелатонина, который в свою очередь регулирует активность СХЯ.
Агомелатин
В 1997 году на основании заявки во Всемирную организацию здравоохранения вещество S20098 получило интернациональное не проприетарное название агомелатин с подтверждением его инновационного мелатонинергического профиля в сравнении с другими антидепрессантами, действующими через моноаминергические механизмы.
Смещение фазы вперед и задержка фазы
Воздействие стимулов, таких как свет и мелатонин, может смещать циркадианные ритмы цикла сон-бодрствование и моторной активности на более раннее (смещение фазы вперед) или более позднее (задержка фазы) время. Например, кратковременное включение света после наступления темного периода суток приводит к задержке фазы. Смещение фазы вперед и задержка фазы у пациентов с депрессией являются симптомами циркадианной дезорганизации и вероятно отражают дисфункцию супрахиазматического ядра.
Не модифицированные 5-HT2C рецепторы
5-HT2C рецепторы человека и других видов представлены в 20 или более изоформ, отражающих полярные (три) цепочки аминокислот во второй внутриклеточной петле, участвующей в передаче клеточных сигналов. Нарушения в этих цепочках обусловлены посттрансляционными (аденозин в инозин) модификациями в иРНК. Не модифицированные (INI) участки обладают конститутивной активностью, не свойственной сильно модифицированным участкам (как VSV).
Конститутивная активность
Некоторые G протеин-связываемые рецепторы активны даже в отсутствие агонистов. Это связано со спонтанным взаимодействием рецепторов с G протеинами и другими преобразовательными механизмами и обычно проявляется базисным (в покое) уровнем преобразования независимых от агонистов сигналов и/или эндоцитоза рецепторов внутрь клетки.
Инверсный агонист
Инверсные агонисты подавляют базисную (в покое, конститутивную) активность G протеин-связываемых рецепторов в отсутствие агонистов.
Нейтральный антагонист
Сами по себе нейтральные антагонисты не влияют на базисную активность. Напротив, они нормализуют передачу сигналов за счет блокады действия агонистов и инверсных агонистов, тем самым возвращая активность рецепторов к базисному уровню.
Тест вынужденного плавания (Forced swim test)
Тест для оценки антидепрессивных свойств. Грызунов помещают на 15 минут в цилиндр с водой (комнатной температуры), из которого они не могут выбраться. На следующий день в рамках второй сессии измеряют время неподвижного состояния, которое определяет индекс отчаяния. При однократном (в день теста) или регулярном применении антидепрессанты сокращают длительность неподвижного состояния.
Хронический легкий стресс
Грызунов помещают на примерно 5 недель в условия воздействия слабых стрессоров, таких как увлажнение опилок, шум, перемещение клетки и пр. Это приводит к прогрессирующему состоянию ангедонии (утрата способности испытывать удовольствие), которое проявляется редукцией предпочтения раствора сахарозы обычной воде. такое состояние может купироваться регулярным введением антидепрессантов.
Обученная беспомощность (Learned helplessness)
Феномен, который наблюдается в условиях неконтролируемого стресса, который не позволяет научиться избегать последующих неприятных стимулов. В тесте обученной беспомощности крыс подвергают воздействию серии неизбежных ударов электрическим током через пол клетки, затем проводят тест избегания условного стимула (избегание однократного шока) в двухкамерном ящике. Число неудачных избеганий используется как индекс беспомощности. Назначение антидепрессантов до теста восстанавливает избегающее поведение.
Тупайя (Tree shrew)
(Также известны как скаденция) Тупайя относятся к приматам высшего порядка Euarchonta, вместе с грызунами и зайцеобразными классифицируются как Euarchontoglires. Это дневные имеющие индивидуальную территорию животные, которые образуют семейные социальные группы. Контакт побежденного подчиненного самца с доминантным самцом провоцирует выраженные связанные со стрессом изменения в поведении, эндокринной секреции (гиперактивность гипоталамо-гипофизарно-надпочечниковой системы) и физиологии, а также нарушения циркадианных ритмов.
Шкала депрессии Гамильтона
(HAM-D). Шкала используется для оценки депрессивных состояний. Учитывает различные параметры, такие как депрессивное настроение, чувство вины, инсомния и пр. Тяжесть симптомов оценивается в баллах от нуля (норма); чем выше балл, тем тяжелее депрессивное состояние.
Вопросник для оценки сна Leeds (Leeds sleep evaluation questionnaire)
Простой стандартизованный инструмент для псевдо количественного измерения влияния терапии на сон и ранее утреннее поведение. Содержит множество пунктов, включая качество сна, латентность сна и пр. Вопросник предназначен для самостоятельного заполнения пациентами.
Синдром отмены
Особенно в случаях применения антидепрессантов с короткими периодами полужизни после продолжительной (6 недель или больше) терапии резкая остановка приема препарата, а иногда даже снижение дозы может спровоцировать синдром отмены, состоящий из психологических (ажитация, тревога, раздражительность) и соматических (тошнота, головокружение, сенсорные расстройства и нарушения сна, гриппоподобный озноб, миалгия и слабость) симптомы. Хотя обычно легкие и кратковременные (в пределах недели) симптомы отмены вызывают дистресс и нарушают функционирование. Более того, в отдельных случаях они могут быть тяжелыми и ошибочно интерпретироваться как развитие рецидива.
Выражение благодарности
Мы выражаем благодарность J.-M. Rivet, C. Mannoury la Cour и A. Gobert for expert help with graphics; M. Soubeyran и A. Dekeyne за блестящую логистическую поддержку; L. Alliot, E. Canet, P. Delagrange и B. Renaud за полезные комментарии к рукописи; и, особую благодарность нашим многочисленным коллегам за их усилия, преданность и опыт в реализации этого проекта fruition.
Список использованной литературы
Идентификация агомелатина как высоко потенциального лиганда мелатонинергических рецепторов.
Подтверждение свойств агомелатина как агониста популяции мелатонинергических рецепторов в супрахиазматическом ядре.
In vivo исследование, подтверждающее, что агомелатин эффективно корректирует циркадианные ритмы.
Исследование, подтверждающее, что у здоровых добровольцев при вечернем назначении агомелатин достоверно и стойко влияет на циркадианные ритмы в течение 24 часов.
Подтверждение, что агомелатин действует как антагонист клонированных, человеческих и нативных 5-HT2C рецепторов головного мозга.
Модель ангедонии - первое доказательство, что агомелатин обладает отчетливыми антидепрессивными свойствами, которые реализуются за счет механизма взаимодействия мелатонинергических и 5-HT2C рецепторов.
Длительная терапия агомелатином усиливает клеточную пролиферацию и нейрогенез в гиппокампе - механизм, свойственный антидепрессантам других классов и участвующий в улучшении настроения.
Основные исследования, подтверждающие клиническую ценность агомелатина в терапии большой депрессии.
Антидепрессивный эффект агомелатина стойко сохраняется в течение 6 месяцев терапии и определяет его эффективность в профилактике рецидивов.
Подтверждение того, что резкоая остановка терапия агомелатином при большой депрессии не приводит к развитию симптомов отмены в отличие от СИОЗС пароксетина.
Первое подтверждение клинической эффективности агомелатина в терапии генерализованного тревожного расстройства.
