Розувастатин: доказательная база и значение для реальной клинической практики
СтатьиС.В. Недогода
Волгоградский государственный медицинский университет
Применение статинов, наряду с антигипертензивной терапией оказались двумя наиболее эффективными механизмами снижения сердечно-сосудистой смертности во многих странах мира.
Сегодня статины стали абсолютно необходимыми всем пациентам с ИБС, сахарным диабетом 2 типа и ишемическим инсультом. Причем они должны быть назначены вне зависимости от имеющегося липидного профиля у пациента, а врач должен осознавать, что их не назначение ведет к осознанному повышению риска смерти больного и сосудистых осложнений.
Розувастатин относится к «суперстатинам» ІV поколения и сегодня, благодаря появлению его генериков (в том числе Розистарка фирмы Белупо), многие достижения, связанные с его применением могут быть имплементированы в реальную клиническую практику российских врачей.
История. Розувастатин был разработан компанией Shionogi (Япония), появился на фармацевтическом рынке в 2003 году и к настоящему времени стал одним из самых изученных статинов [5,29], особенно при ИБС, в рамках долговременной и разноплановой исследовательской программы GALAXY (рисунок 1).
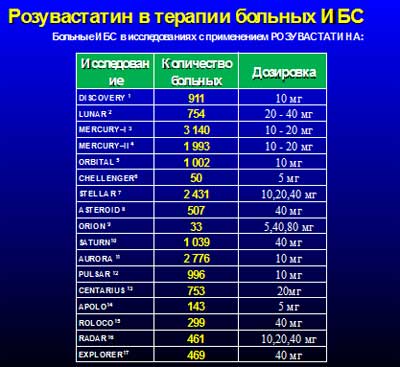
Рисунок 1.
Доказательная база применения.
Сравнительная эффективность розувастатина и других статинов
Существует огромное число исследований, доказавших большую гиполипидемическую эффективность розувастатина по сравнению с другими препаратами данной группы (Comets, Lunar, Mercury–I, Solar, Stellar, ARIANE, ARIES, DISCOVERY Alpha, POLARIS, ANDROMEDA, CORALL, PULSAR, URANUS). Особенно ярко это проявилось в исследовании STELLAR (Comparison of the Efficacy and Safety of Rosuvastatin Versus Atorvastatin, Simvastatin, and pravastatin Across Doses).
Для практического врача результаты этих исследований могут становятся более понятными, если их представить в графическом варианте (рисунок 2).
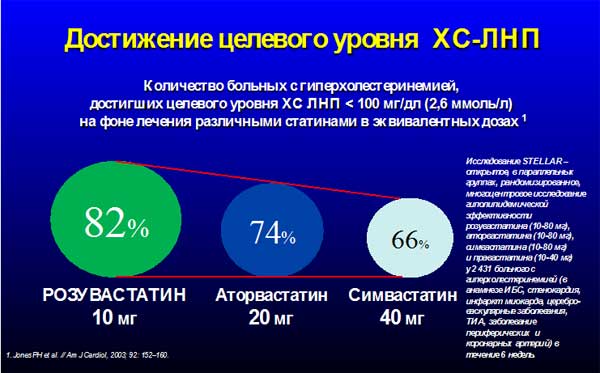
Рисунок 2.
Более того, только аторвастатин в максимальной дозировке и розувастатин в среднетерапевтической и максимальной дозировке могут обеспечить декларируемое многими рекомендациями снижение ЛПНП на 40-50% от исходного уровня.
Важной особенностью розувастатина является его дозозависимая способность в большей степени, чем у других статинов, снижать триглицериды и повышать ЛПВП [40]. Поэтому именно розувастатин считается идеальной основой для комбинации с фибратами [36].
Еще одним достоинством розувастатина является его способность оказывать гарантированный гиполипидемический эффект, не зависящий от индивидуальных особенностей аполипопротеинов А5 и Е у пациентов с семейной гиперхолестеринемией [16].
Розувастатин и ангиопротекция
Результаты исследования ORION (Outcome of rosuvastatin Treatment on Carotid Artery Atheroma: a Magnetic resonance Imaging Observation), показавшего способность розувастатина уменьшать более чем на 40% количество бляшек в сонных артериях нашли свое подтверждение в исследованиях ASTEROID (A Study to Evaluate the Effect of rosuvastatin on Intravascular Ultrasound-derived Coronary Atheroma Burden), METEOR (Measuring Effects on Intima Media Thickness: an Evaluation of rosuvastatin), COSMOS (Coronary Atherosclerosis Study Measuring Effects of rosuvastatin Using Intravascular Ultrasound in Japanese Subjects), SATURN (Study of coronary Atheroma by intTavascular Ultrasound: effect of RosuvastatiN versus atorvastatin) и ряде других [15,18,39,42], где было доказано положительное влияние препарата на регресс атеросклероза в коронарных, мозговых и других артериях. Сегодня розувастатин является единственным препаратом из группы статинов, доказавшим способность вызывать обратное развитие атеросклероза и стабилизовать атеросклеротическую бляшку по данным самых современных методов визуализации.
Небольшие дозы розувастатина оказываются эффективными при первичной профилактике атеросклероза у женщин в перименопаузе [19].
Интересно, что эта способность лишь отчасти обусловлена непосредственно гиполипидемическим действием розувастатина. В значительной мере она связана с его способностью подавлять неинфекционное воспаление и нормализовывать соотношение 1–го и 2–го типа рецепторов (соответственно проатерогенных и антиатерогенных) к ангиотензину II [8,26].
Розувастатин и воспаление
Благодаря исследованию JUPITER (Justification for the Use of Statins in Prevention: an Intervention Trial Evaluating Rosuvastatin), продемонстрировавшему эффективность розувастатина при первичной профилактике сердечно–сосудистых и цереброваскулярных событий у лиц с низким риском развития осложнений (практически здоровые люди без основных факторов риска, с нормальным уровнем ЛПНП – то есть формально не имевших показаний для терапии статинами), но повышенным уровнем высокочувствительного C–реактивного белка розувастатин в дозе 20 мг/сутки на 47% снижал возникновение случаев инфаркта миокарда, инсульта, внезапной кардиальной смерти и на 20% – общую смертность. Необходимо отметить, что, во-первых, это лишний раз указывает на важность плейотропных эффектов розувастатина в реализации его фармакодинамических эффектов и, во-вторых, на высокую эффективность применения препарата - для того, чтобы избежать указанных выше событий в жизни пациента, необходимо в течение 5 лет пролечить розувастатином всего 25 пациентов из группы низкого риска. По-видимому, именно это и обуславливает наиболее низкую смертность в популяции сердечно-сосудистых пациентов при применении розувастатина [11,13,28] (рисунок 3). Однако следует обратить внимание на то, что преимущества розувастатина становятся очевидными при его применении не менее чем в течение 9 месяцев [28].
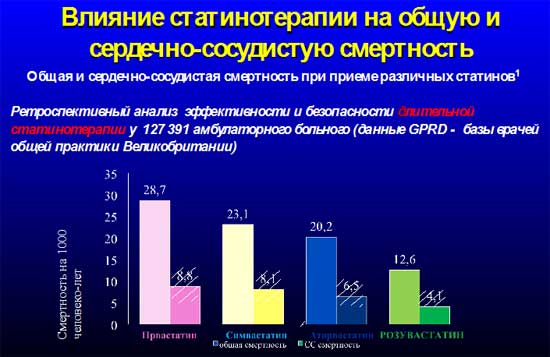
Рисунок 3.
Розувастатин в кардиологии
Острый коронарный синдром.
Целесообразность применения розувастатина не ставится под сомнение (CENTAURUS - Comparison of the Effects Noted in The ApoB:ApoA-I ratio Using rosuvastatin or Atorvastatin in patients with Acute Coronary Syndrome), равно как и использование его в высоких дозах перед чрескожными коронарными вмешательствами у больных с ОКС [1,10,14,17,22,24].
Согласно имеющейся доказательной базе, именно его применение при этой патологии изучено более полно, чем применение других статинов [27].
Розувастатин также изучался при остром инфаркте миокарда в исследовании GEOSTAT (Hepatic Metabolism and Transporter Gene variants Enhance response to rosuvastatin in patients with Acute Myocardial Infarction).
Хроническая сердечная недостаточность.
По данным исследования CORONA (Controlled rosuvastatin Multinational Trial in Heart Failure) снижения смертности у больных с ХСН на фоне терапии розувастатином выявлено не было. Однако, препарат снижает риски декомпенсации и госпитализации у пациентов с ХСН [12,21] и обладает положительным влиянием на ремоделирование и диастолическую функцию миокарда левого желудочка (в том числе при бессимптомном аортальном стенозе),а также повышает толерантность к физической нагрузке и качество жизни у больных с ХСН [30].
Фибрилляция предсердий.
В целом, имеются предпосылки для применения статинов при первичной профилактике фибрилляции предсердий и предупреждении ее рецидивов [23,37]. Розувастатин оказывается эффективным в снижении частоты первого эпизода фибрилляции предсердий, но не ее рецидивов [25].
Венозные тромбоэмболии.
Согласно данным исследования JUPITER применение розувастатина на 39% и 48% снижает риск развития неспровоцированных и спровоцированных венозных тромбэмболий соответственно без повышения риска развития кровотечений. При этом наблюдается так же снижение уровня тромбоза глубоких вен [35].
Некардиологические возможности розувастатина.
Прежде всего необходимо отметить, что розувастатин фактически является единственным из статинов, продемонстрировавшим свою безопасность в педиатрической практике – исследование PLUTO (Paediatric Lipid redUction Trial of rOsuvastatin). Благодаря своим плейотропным эффектам и антифибринолизному действию статины, в частности розувастатин, нашли широкое применение при лечении широкого спектра некардиологической патологии:
- неалкогольный жировой гепатоз - достоверно более выраженное снижение признаков стеатоза печени, подтверждённое гистологически, в сравнении с пациентами, не получавшими статины [31];
- ХОБЛ – достоверно снижают 90 дневную смертность при обострении ХОБЛ, а также снижают уровень системного воспаления и улучшают эндотелиальную функцию у пациентов со стабильной ХОБЛ, даже при отсутствии прямых показаний к назначению статинов [7,32];
- пневмонии [33];
- фиброзные изменения почек и ХПН – AURORA (A Study to Evaluate the Use of rosuvastatin in Subjects on regular Haemodialysis: An Assessment of Survival and Cardiovascular Events);
- артриты и васкулиты – уменьшение воспаления и уровня провоспалительных цитокинов [41];
- антифосфолипидный синдром [9];
- лечение атеросклероза у ВИЧ–инфицированных пациентов [4];
- гиперурикемия [34];
- сахарный диабет – исследования ANDROMEDA (A raNdomized, Double-blind, double-dummy, multicentre, phase IIIb, parallel-group study to compare the efficacy and safety of Rosuvastatin (10 mg and 20 mg) and atOrvastatin (10 mg and 20 mg) in patiEnts with type 2 DiAbetes mellitus), CORALL (Cholesterol Lowering Effects of rosuvastatin compared with Atorvastatin in patients with type 2 diabetes), URANUS (Use of rosuvastatin versus Atorvastatin in type 2 diabetes mellitus) [2,3,43];
Повышение риска развития сахарного диабета при терапии статинами стало активно обсуждаться в медицинской литературе фактически сразу после окончания исследования JUPITER и этот негативный стал приписываться исключительно розувастатину. В этой связи необходимо сделать несколько замечаний:
- во-первых, это свойство всех статинов, а не только розувастатина, в связи с тем, что они подавляют образование коэнзима Q10 и обусловленную им секрецию инсулина;
- во-вторых, речь идет исключительно о первичной профилактике с использованием статинов. Никто не ставит под сомнение их абсолютную необходимость назначения при сахарном диабете 2 типа;
- в-третьих, повышенный риск развития сахарного диабета 2 типа имеет место только у пациентов, изначально имеющих нарушение углеводного обмена и ожирение. В исследовании JUPITER 17,802 мужчин и женщин (средний возраст 66 лет) получали терапию розувастатином в дозе 20 мг в сутки или плацебо на протяжении 5 лет и из них 65 % имели один и более факторов риска СД 2 типа (в том числе ИМТ> 30 кг/м2);
- в-четвертых, снижение риска развития сердечно-сосудистых осложнений существенно перевешивает риск возникновения сахарного диабета 2 типа. Иными словами, больной скорее будет иметь серьезные сердечно-сосудистые осложнения и до развития сахарного диабета 2 типа ему еще надо дожить. У 11,000 пациентов с факторами риска сахарного диабета 2 типа (метаболический синдром, ожирение и повышение уровня глюкозы натощак) терапия статином при ПЕРВИЧНОЙ ПРОФИЛАКТИКЕ предотвратит 134 случая серьезных сердечно-сосудистых осложнений и смерти (снижение риска на 39%) против появления дополнительных 54 случаев СД 2 типа (повышение риска на 28%). У 6,000 пациентов без риска СД 2 типа терапия статином предотвратит 86 случаев серьезных сердечно-сосудистых осложнений и смерти без новых случаев СД 2 типа (снижение риска на 52%).
Еще одним несомненным достоинством розувастатина является его отличный профиль безопасности [6,13,20,28,38] и огромный опыт использования в крупных рандомизированных клинических исследованиях, где побочные эффекты отслеживаются особенно пристально.
На фармацевтическом рынке присутствует несколько генериков розувастатина с доказанной биоэквивалентностью оригинальному препарату. Одним из последних среди них по времени регистрации является РОЗИСТАРК (компания «БЕЛУПО»). Его очевидным преимуществом является низкая цена, что повышает доступность современной высокоэффективной гиполипидемической терапии.
Выбор статина и генерика в каждой конкретной клинической ситуации всегда остается за врачом, но всегда необходимо выбирать лучших среди них, поскольку заболевание может не дать пациенту и врачу второго шанса. СПИСОК ЛИТЕРАТУРЫ 1. Ballantyne C.M., Pitt B., Loscalzo J. et al. Alteration of Relation of Atherogenic Lipoprotein Cholesterol to Apolipoprotein B by Intensive Statin Therapy in Patients With Acute Coronary Syndrome (from the Limiting UNdertreatment of lipids in ACS With Rosuvastatin [LUNAR] Trial) // Am. J. Cardiol. 2012. Vol. 10. doi: 10.1016/j.amjcard.2012.10.037.
2. Berne C. et al. Comparison of rosuvastatin and atorvastatin for lipid lowering in patients with type 2 diabetes mellitus: results from the URANUS study //Cardiovascular Diabetology. – 2005. – Т. 4. – №. 1. – С. 7.
3. Betteridge D., Gibson M. M. 464 Effect of rosuvastatin and atorvastatin on LDL-C and CRP levels in patients with type-2 diabetes: Results of the andromeda study //Atherosclerosis Supplements. – 2004. – Т. 5. – №. 1. – С. 107-108.
4. Calza L., Manfredi R., Colangeli V. et al. Two–Year Treatment with Rosuvastatin Reduces Carotid Intima–Media Thickness in HIV Type 1–Infected Patients Receiving Highly Active Antiretroviral Therapy with Asymptomatic Atherosclerosis and Moderate Cardiovascular Risk // AIDS Res. Hum. Retroviruses. 2012.
5. Clinical trials for rosuvastatin. The U.S. National Institutes of Health. URL: http://clinicaltrials.gov/search/intervention=Rosuvastatin
6. Cziraky M.J., Willey V.J., McKenney J.M. et al. Statin safety: an assessment using an administrative claims database // Am. J. Cardiol. 2006. Vol. 97(8A). P. 61C–68C.
7. Dobler C. C., Wong K. K., Marks G. B. Associations between statins and COPD: a systematic review //BMC pulmonary medicine. – 2009. – Т. 9. – №. 1. – С. 32.
8. Du R., Ye P., Yan G. et al. Effect of intensive rosuvastatin therapy on adhesion molecules and the upstream mechanism in patients with peripheral atherosclerosis // Nan. Fang. Yi Ke Da Xue Xue Bao. 2012. Vol. 32(11). P. 1610–1614.
9. Erkan D., Lockshin M. D. New approaches for managing antiphospholipid syndrome //Nature Clinical Practice Rheumatology. – 2009. – Т. 5. – №. 3. – С. 160-170.
10. Gao Y., Jia Z.M., Sun Y.J. et al. Effect of high–dose rosuvastatin loading before percutaneous coronary intervention in female patients with non–ST–segment elevation acute coronary syndrome // Chin. Med. J. (Engl.) 2012. Vol. 125(13). P. 2250–2254
11. Garcia–Rodriguez L.A., Masso–Gonzalez E.L., Wallander M.A., Johansson S. The safety of rosuvastatin in comparison with other statins in over 100,000 statin users in UK primary care // Pharmacoepidemiol. Drug. Saf. 2008. Vol. 17(10). P. 943–952.
12. GISSI–HF Investigators. Effect of rosuvastatin in patients with chronic heart failure (the GISSI–HF trial): a randomised, double–blind, placebo–controlled trial // Lancet. 2008. Vol. 8. P. 240–244
13. Goettsch W.G., Heintjes E.M., Kastelein J.J. et al. Results from a rosuvastatin historical cohort study in more than 45,000 Dutch statin users, a PHARMO study // Pharmacoepidemiol. Drug. Saf. 2006. Vol. 15(7). P. 435–443.
14. Hall A.S., Jackson B.M., Farrin A.J. et al. SPACE ROCKET Trial Group. A randomized, controlled trial of simvastatin versus rosuvastatin in patients with acute myocardial infarction: the Secondary Prevention of Acute Coronary Events – Reduction of Cholesterol to Key European Targets Trial // Eur. J. Cardiovasc. Prev. Rehabil. 2009. Vol.
16. P. 712–721.
15. Hong Y.J., Jeong M.H., Hachinohe D. et al. Comparison of Effects of Rosuvastatin and Atorvastatin on Plaque Regression in Korean Patients With Untreated Intermediate Coronary Stenosis // Circ. J. 2011. Vol. 75. P. 398–406.
16. Hu M., Mak V.W., Tomlinson B. Polymorphisms in apolipoprotein E and apolipoprotein A–V do not influence the lipid response to rosuvastatin but are associated with baseline lipid levels in Chinese patients with hyperlipidemia // J. Clin. Lipidol. 2012. Vol. 6(6). P. 585
17.Hu X., Sun A., Xie X. et al. Rosuvastatin Changes Cytokine Expressions in Ischemic Territory and Preserves Heart Function After Acute Myocardial Infarction in Rats // J. Cardiovasc. Pharmacol. Ther. 2012. Vol. 8.
18. Huang Y., Li W., Dong L. et al. Effect of Statin Therapy on the Progression of Common Carotid Artery Intima–Media Thickness: An Updated Systematic Review and Meta–Analysis of Randomized Controlled Trials // J. Atheroscler. Thromb. 2012. Vol. 20(1). P. 108–121.
19. Igase M., Kohara K., Tabara Y. et al. Low–dose rosuvastatin improves the functional and morphological markers of atherosclerosis in asymptomatic postmenopausal women with dyslipidemia // Menopause. 2012. Vol. 19(12). P. 1294–1299
20. Kasliwal R., Wilton L.V., Cornelius V. et al. Safety profile of rosuvastatin: results of a prescription–event monitoring study of 11,680 patients // Drug. Saf. 2007. Vol. 30(2). P. 157–170.
21. Kjekshus J., Dunselman P., Blideskog M. et al. A statin in the treatment of heart failure? Controlled rosuvastatin multinational study in beart failure (CORONA): Study design and baseline characteristics // Eur. J. Heart Fail. 2005. Vol. 7(6). P. 1059–1069.
22. Lablanche J.M., Danchin N., Farnier M. et al. Effects of rosuvastatin and atorvastatin on the apolipoprotein B/apolipoprotein A–1 ratio in patients with an acute coronary syndrome: The CENTAURUS trial design // Arch. Cardiovasc. Dis. 2008. Vol. 101. P. 399–406.
23. Loffredo L., Angelico F., Perri L., Violi F. Upstream therapy with statin and recurrence of atrial fibrillation after electrical cardioversion. Review of the literature and meta–analysis // BMC Cardiovasc. Disord. 2012. Vol. 12. P. 107.
24. Luo J., Li J., Shen X. et al. The effects and mechanisms of high loading dose rosuvastatin therapy before percutaneous coronary intervention in patients with acute coronary syndrome // Int. J. Cardiol. 2012. Vol. 26. doi: 10.1016/j.ijcard.2012.11.032.
25. Maggioni A., Fabbri G., Lucci D. Effect of rosuvastatin on atrial fibrillation: Ancillary results of the gISSI–HF trial // Eur. Heart J. 2009. Vol. 30. P. 2327–2336.
26. Marino F., Maresca A.M., Cosentino M. et al. Angiotensin II type 1 and type 2 receptor expression in circulating monocytes of diabetic and hypercholesterolemic patients over 3–month rosuvastatin treatment // Cardiovasc. Diabetol. 2012. Vol. 11. P. 153.
27. Maroo B.P., Lavie C.J., Milani R.V. Secondary prevention of coronary heart disease in elderly patients following myocardial infarction: are all HMG–CoA reductase inhibitors alike? // Drugs Aging. 2008. Vol. 25(8). P. 649–664
28. McAfee A.T., Ming E.E., Seeger J.D. et al. The comparative safety of rosuvastatin: a retrospective matched cohort study in over 48,000 initiators of statin therapy // Pharmacoepidemiol. Drug. Saf. 2006. Vol. 15(7). P. 444–453
29. McTaggart F., Buckett L., Davidson R. et al. Preclinical and clinical pharmacology of Rosuvastatin, a new 3–hydroxy–3–methylglutaryl coenzyme A reductase inhibitor // Am. J. Cardiol. 2001. Vol. 87(5A). P. 28B–32B
30. Moura L.M., Ramos S.F., Kristensen S.D. et al. Rosuvastatin slows the development of diastolic dysfunction in calcific aortic stenosis // J. Heart Valve Dis. 2012. Vol. 21(4). P. 463–472.
31. Nakahara T., Hyogo H., Kimura Y. et al. Efficacy of rosuvastatin for the treatment of non–alcoholic steatohepatitis with dyslipidemia: An open–label, pilot study // Hepatol. Res. 2012. Vol. 42(11). P. 1065–1072
32. Neukamm A. et al. Rosuvastatin treatment in stable chronic obstructive pulmonary disease (RODEO): a randomized controlled trial //Journal of internal medicine. – 2015.
33. Novack V., MacFadyen J., Malhotra A. et al. The effect of rosuvastatin on incident pneumonia: results from the JUPITER trial // CMAJ. 2012. Vol. 184(7). P. E367–E372.
34. Ogata N. et al. Effects of three strong statins (atorvastatin, pitavastatin, and rosuvastatin) on serum uric acid levels in dyslipidemic patients //Nucleosides, nucleotides and nucleic acids. – 2010. – Т. 29. – №. 4-6. – С. 321-324.
35. Patterson K.A., Zhang X., Wrobleski S.K. et al. Rosuvastatin reduced deep vein thrombosis in ApoE gene deleted mice with hyperlipidemia through non–lipid lowering effects // Thromb. Res. 2012. Vol. 28. doi: 10.1016/j.thromres.2012.12.006.
36. Roth E.M., Rosenson R.S., Jones P.H. et al. Attainment of goal/desirable lipid levels in patients with mixed dyslipidemia after 12 weeks of treatment with fenofibric acid and rosuvastatin combination therapy: A pooled analysis of controlled studies // J. Clin. Lipidol. 2012. Vol. 6(6). P. 534–544
37. Savelieva I., Kakouros N., Kourliouros A., Camm A.J. Upstream therapies for management of atrial ibrillation: review of clinical evidence and implications for European society of cardiology guidelines. Part I: primary prevention // Europace. 2011. Vol. 13. P. 308–328.
38. Shepherd J., Vidt D.G., Miller E. et al. Safety of rosuvastatin: update on 16,876 rosuvastatin–treated patients in a multinational clinical trial program // Cardiol. 2007. Vol. 107(4). P. 433–443.
39. Soeda T., Uemura S., Okayama S. et al. Intensive Lipid–Lowering Therapy With Rosuvastatin Stabilizes Lipid–Rich Coronary Plaques (Evaluation Using Dual–Source Computed Tomography) // Circ. J. 2011. Vol. 75. P. 2621–2627.
40. Talavera J.O., Martinez G., Cervantes J.L. et al. A Double Blind, Double Dummy, Randomized, Placebo Control Trial to Evaluate the Effect of Statin Therapy on Triglycerides Levels in Mexican Hypertriglyceridemic Patients // Curr. Med. Res. Opin. 2013. Vol. 16. doi:10.1185/03007995.2013. 766590
41. Tam L. S. et al. Effects of rosuvastatin on subclinical atherosclerosis and arterial stiffness in rheumatoid arthritis: a randomized controlled pilot trial //Scandinavian journal of rheumatology. – 2011. – Т. 40. – №. 6. – С. 411-421.
42. Underhill H.R., Yuan C., Zhao X.Q. et al. Effect of rosuvastatin therapy on carotid plaque morphology and composition in moderately hypercholesterolemic patients: a high–resolution magnetic resonance imaging trial // Am. Heart J. 2008. Vol. 155(3). P. 584.e1–8.
43. Wolffenbuttel B. H. R., Franken A. A. M., Vincent H. H. Cholesterol?lowering effects of rosuvastatin compared with atorvastatin in patients with type 2 diabetes–CORALL study //Journal of internal medicine. – 2005. – Т. 257. – №. 6. – С. 531-539.
