Функциональные нарушения щитовидной железы: причины, последствия и возможности эффективной медикаментозной терапии
Статьи

ЖУРНАЛ "ПРАКТИКА ПЕДИАТРА"
Опубликовано в журнале:
«Практика педиатра», 2015, сентябрь-октябрь, с. 61-69 Е.В. Тозлиян, педиатр-эндокринолог, к. м. н., Обособленное структурное подразделение «Научно-исследовательский клинический институт педиатрии» ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава РФ, г. Москва
Ключевые слова: дети, щитовидная железа, диагностика, терапия, левотироксин.
Key words: children, glandula thyroidea, diagnostics, treatment, levothyroxine.
ИСТОРИЧЕСКАЯ СПРАВКА
Наиболее яркие проявления тиреоидной патологии, такие как зоб и кретинизм, обращали на себя внимание еще в глубокой древности. Первые описания так называемых опухолей в области шеи можно найти в древних манускриптах, написанных еще до нашей эры.
Гиппократ (460 г. до н. э.) в своей книге «Вода, воздух и земля» рассматривал плохую питьевую воду как причину зоба. Древние целители, не зная природы этого недуга - «опухоли шеи», - использовали для его лечения морские водоросли, видимо, интуитивно чувствуя взаимосвязь между появлением зоба и недостатком какого-либо компонента в питании. В 1846 году впервые была выдвинута гипотеза о появлении зоба вследствие недостатка йода. Однако в научных кругах ей в то время не придали должного значения. В 1896 году биохимик Е. Бауман установил присутствие микроэлемента йода в ткани щитовидной железы. Таким образом, была установлена неожиданная взаимосвязь между содержанием йода в щитовидной железе и уровнем умственных способностей человека. В 1970 году было окончательно доказано, что недостаточное потребление йода может вызвать ослабление интеллектуальных способностей человека.
КРАТКИЕ АНАТОМОФИЗИОЛОГИЧЕСКИЕ ДАННЫЕ
Щитовидная железа (ЩЖ) - непарный орган, расположенный обычно на передней поверхности шеи, в связи с чем почти всегда доступный пальпации. ЩЖ состоит из двух долей (правой и левой) и перешейка, а гистологически - из фолликулов и соединительнотканной стромы с проходящими в ней кровеносными, лимфатическими сосудами и нервами.
Зачаток ЩЖ возникает на 3-4-й неделе беременности как выпячивание вентральной стенки глотки между I и II парами жаберных карманов у основания языка. Из этого выпячивания формируется щитовидно-язычный проток, растущий вниз. К 8-й неделе дистальный конец тяжа раздваивается; из него впоследствии формируется правая и левая доли ЩЖ. Проксимальный конец эпителиального тяжа в норме атрофируется, и от него остается только перешеек, связывающий обе доли ЩЖ. Щитовидная железа у эмбриона начинает функционировать с 10-12-й недели гестационного возраста. До этого срока метаболизм зародыша контролируется только гормонами материнской щитовидной железы. С 10-12-й недели внутриутробного развития ЩЖ плода способна захватывать йод, синтезировать йодтиронины и накапливать коллоид. Необходимый для синтеза ГЩЖ йод поступает от матери и частично образуется в плаценте в результате дейодирования Т4. Постепенно функциональная активность ЩЖ нарастает, и к 36-й неделе концентрация тироксина и трийодтиронина в крови плода достигает уровня взрослых. Гипофиз в виде самостоятельного образования выявляют на 4-5-й неделе беременности, а с 9-й недели определяют наличие ТТГ в гипофизе плода. Рецепторы к Т3 в клетках головного мозга появляются с 8-й недели беременности, то есть до начала функционирования собственной гипоталамо-гипофизарно-тиреоидной системы. Таким образом, материнский тироксин (а в клетках головного мозга плода единственный путь получения Т3 - внутриклеточное дейодирование Т4) способствует развитию ЦНС плода и особенно миграции нейронов в кору головного мозга в первом триместре беременности.
Структурной единицей ЩЖ является фолликул, который представляет собой замкнутое образование округлой формы от 20 до 300 мкм. Стенка фолликула сформирована тиреоцитами (однослойный кубический эпителий), в полости фолликула - коллоид, продуцируемый тиреоцитами. Основные гормоны, синтезируемые в клетках ЩЖ и секретируемые в кровь, - тироксин (Т4) и трийод- тиронин (Т3). Необходимыми компонентами синтеза тиреоидных гормонов являются йод и аминокислота тирозин, поступающие в организм с пищевыми продуктами. Всосавшийся из кишечника йод в виде йодида достигает ЩЖ и активно проникает в фолликулярные клетки (тиреоциты), где окисляется до молекулярного йода. Параллельно в тиреоцитах осуществляется синтез тиреоглобулина (гликопротеида, молекула которого содержит 140 остатков тирозина). Связывание активированного йода с молекулами тирозина приводит к образованию монойодтирозина (МЙТ) и дийодтирозина (ДЙТ). В результате окислительной конденсации двух молекул ДЙТ образуется тироксин (тетрайодтиронин, Т4), а молекул МЙТ и ДЙТ - трийодтиронин (Т3). Все окислительные процессы в щитовидной железе происходят при помощи фермента тиреопероксидазы. По мере того как на молекуле тиреоглобулина все остатки тирозина йодируются с последующим образованием тирозинов и тиронинов, она перемещается в просвет фолликула, где происходит ее накопление «про запас» в форме коллоида. Секреция гормонов ЩЖ начинается с резорбции коллоида под влиянием протеолитических ферментов. В результате протеолиза освобождаются МЙТ, ДЙТ, Т4 и Т3. В кровоток поступают в основном Т3 и Т4, а МЙТ и ДЙТ подвергаются дейодированию, и йод вновь используется в синтезе гормонов ЩЖ. Главным стимулятором биосинтеза и секреции основных тиреоидных гормонов Т3 и Т4 является тиреотропный гормон (ТТГ - гликопротеид, образующийся в тиреотрофах аденогипофиза). Секреция ТТГ контролируется двумя механизмами: стимулирующее влияние оказывает пептидный гормон тиролиберин, образующийся в серобугорных ядрах гипоталамуса, ингибирующее - гормоны щитовидной железы (ГЩЖ) [1].
ГЩЖ находятся в сыворотке крови как в свободной, так и в связанной форме, причем гормональной активностью обладают только свободные Т4 и Т3.
Биологическое действие ГЩЖ очень разнообразно. Важнейшим считают так называемые ядерные или геномные эффекты. ГЩЖ индуцируют генную экспрессию (стимулируют образование мРНК, в том числе мРНК соматотропного гормона) и тем самым повышают эффективность синтеза белка. Т3 и Т4 воздействуют на процессы, протекающие в митохондриях и других органеллах, в клеточной мембране и цитоплазме. У млекопитающих и человека тиреоидные гормоны особенно важны для развития ЦНС. Рецепторы гормонов ЩЖ присутствуют в нейронах и глиальных клетках головного мозга. Гормоны ЩЖ стимулируют пролиферацию и миграцию нейробластов, рост аксонов и дендритов, дифференцировку и миелинизацию олигодендроцитов, формирование синапсов, активируют экспрессию гена, кодирующего белок миелина, а также способствуют накоплению липидов и гликопротеидов в нервной ткани. Кроме того, ГЩЖ контролируют образование тепла, скорость потребления кислорода и протекания окислительных процессов, активность ферментативных систем, процессы роста, дифференцировку всех тканей и систем организма.
Гормоны щитовидной железы имеют определяющее значение в развитии и поддержании многих функциональных систем и органов человеческого организма, в нормальном поддержании практически всех видов обмена веществ и энергии. Влияя на углеводный обмен, они усиливают кишечную резорбцию углеводов, стимулируют глюконеогенез и метаболизм углеводов, стимулируют синтез гликогена и процессы гликогенолиза, потенцируют эффект инсулина. На белковый обмен в физиологических концентрациях тиреоидные гормоны оказывают анаболическое воздействие. Стимулируют метаболизм жиров. Гормоны щитовидной железы влияют на сократимость миокарда, частоту сердечных сокращений, систолическое и пульсовое давление, а также потребность миокарда в кислороде. Нормальный уровень тиреоидных гормонов необходим для формирования костной ткани. Недостаток гормонов щитовидной железы вызывает замедление созревания скелета и может сопровождаться диспропорциональным его развитием. Гормоны щитовидной железы необходимы для нормального созревания и развития нервной системы. Дефицит тиреоидных гормонов в фетальном периоде может привести к необратимым изменениям ЦНС. Первостепенная физиологическая роль тиреоидных гормонов во внутриутробном и раннем постнатальном формировании нервной системы не исчерпывается только влиянием на интеллектуальное развитие ребенка. От того, насколько полно удовлетворены его потребности в гормонах щитовидной железы, во многом зависит физическое и психомоторное развитие, рост, становление иммунной системы и множество других функций детского организма. Активно функционирующая тиреоидная система определяет уровень общего здоровья ребенка.
Заболевания ЩЖ занимают лидирующее положение среди всей эндокринной патологии у детей, а первое место в их структуре принадлежит диффузному нетоксическому зобу (ДНЗ). В большинстве регионов России ДНЗ регистрируется более чем у 5% детей препубертатного возраста, что обусловлено наличием на этих территориях зобной эндемии, связанной как с дефицитом йода в окружающей среде, так и с экологическим неблагополучием [2-4]. Экологическая обстановка крупных городов России характеризуется многофакторностью экопатогенных воздействий на человека. В этой связи распространение патологии ЩЖ можно рассматривать как маркер экологического благополучия региона. На сегодняшний день известен целый ряд причин развития тиреоидной патологии: неадекватное потребление йода (дефицит или избыток), нарушение обмена других эссенциальных или токсических микроэлементов, пищевые струмогены, дефицит белкового питания, медикаментозные струмогенные эффекты, курение, генетические факторы, беременность [5].
Медико-социальная значимость проблемы йодной недостаточности определяется широкой распространенностью зобной эндемии в большинстве регионов России, с одной стороны, и неблагоприятным влиянием гипотироксинемии на состояние физического здоровья и интеллектуального уровня населения, с другой [6]. Недостаточность функции щитовидной железы (гипофункция) может вызывать следующие последствия:
- формирование структурных изменений щитовидной железы;
- нарушения умственного, нервно-психического физического развития;
- отклонения в интеллектуально-мнестической сфере;
- нарушения познавательных процессов (снижение показателей механической памяти, объема и концентрации внимания, логичности мышления);
- снижение скорости принятия решений, уменьшение объема оперативной памяти;
- нарушения физического и полового развития;
- увеличение частоты острой инфекционной и хронической соматической заболеваемости.
По данным исследований, проведенных в России за последние 5 лет, показатели IQ (коэффициент интеллекта) у школьников из йод- дефицитных регионов оказались в среднем на 11-18% ниже значений, характерных для нормального интеллектуального развития [7]. Потребность в йоде и тиреоидных гормонах у младенцев чрезвычайно велика. Дефицит тиреоидных гормонов для этой возрастной группы не может пройти бесследно. Есть немногочисленные данные о том, что у 70% этой категории детей в условиях йодного дефицита на первом году сохраняются симптомы перинатального поражения ЦНС [8]. У половины отмечается задержка психомоторного развития на 1,5-2 эпикризных срока и трудности приобретения навыков, у трети выявляется задержка речевого развития, у 80% - эмоциональная неустойчивость. В раннем возрасте у 90% детей в йоддефицитном регионе диагностируется замедление речевого развития, у 50% - трудности звукопроизношения, у 20% - трудности общения со сверстниками и взрослыми, у 80% - эмоциональная неустойчивость и агрессивность, у 30% - снижение внимания.
У подростков, проживающих в йоддефицитных регионах, гораздо чаще выявляются такие репродуктивные расстройства, как задержка полового созревания у мальчиков и девочек, более поздние сроки менархе и нарушения овариально-менструального цикла у девочек пубертатного возраста [9]. Обнаруживается взаимосвязь тиреоидной недостаточности с высокой заболеваемостью детей разных возрастных групп, а также младенческой смертностью. При существенном недостатке йода в питании детей (а как следствие - недостаточности функции щитовидной железы) выявлено формирование хронической соматической патологии с первых лет жизни и наличие двух и более заболеваний к началу пубертатного периода у детей [10].
Йод является обязательным структурным компонентом гормонов щитовидной железы - тироксина (Т4) и трийодтиронина (Т3). Следовательно, его адекватное поступление в организм является необходимым для физиологического синтеза и секреции тиреоидных гормонов. Йод необходим для роста и дифференциации клеток всех тканей организма человека, поглощения кислорода и митохондриального дыхания, метаболизма и индукции генов, регуляции трансмембранного транспорта натрия и гормонов. В условиях йодного дефицита щитовидная железа не способна синтезировать достаточное количество тиреоидных гормонов. В таком случае нормальная секреция ГЩЖ может быть достигнута только в результате перестройки функции щитовидной железы. На первом этапе увеличивается поглощение йода щитовидной железой. Далее происходит изменение внутритиреоидного метаболизма - организм более экономно расходует йод, образовавшийся в процессе разрушения тиреоидных гормонов, используя его повторно. Свободные атомы йода направляются для синтеза трийодтиронина, биологическая активность которого в 3-5 раз выше, чем тироксина. Чтобы захватить больше йода, щитовидная железа увеличивается в размерах - за счет гиперплазии (количества) и гипертрофии (объема) тиреоидных клеток, таким образом, формируется эндемический зоб. Эндемический зоб является предрасполагающим фактором для развития многих заболеваний щитовидной железы.
Если дефицит йода не восполнять, то со временем функциональная активность щитовидной железы снижается, уровень тиреоидных гормонов в крови падает, скорость обмена веществ замедляется, то есть развивается гипотиреоз (гипофункция щитовидной железы).
Первичным источником йода служат океаны, его содержание в 1 литре океанической воды составляет около 50 микрограммов. Ежегодно за счет испарения в атмосферу Земли поступает до 400 тыс. тонн йода, который разносится дождями по земной поверхности и поступает в питьевую воду и продукты питания. Территории, удаленные от океанических побережий, оказываются обедненными по содержанию йода и эндемичными в силу этого по гипотиреозу (снижению функции щитовидной железы) и зобу.
Морские продукты питания особенно богаты йодом. Так, в рыбьем жире его содержание составляет от 2,5 до 8,4 мкг/кг, в рыбе - от 0,3 (лосось, сардины) до 1,5-3 мкг/кг (треска, пикша). В коровьем молоке содержание йода невелико (в среднем 35-40 мкг/л), но в женском оно достигает 77-95 мкг/л. От 20 до 90 мкг йода содержится в 1 кг мяса, ржаной муки, куриных яиц, кабачков, картофеля, моркови, риса. Данные о содержании йода в пищевых продуктах подвержены сезонным колебаниям, а также существенно зависят от геохимических особенностей региона и технологии изготовления [11].
Формирование зоба является компенсаторной реакцией, направленной на поддержание постоянной концентрации тиреоидных гормонов в организме. Эндемический зоб в детском возрасте - это чаще всего диффузное (равномерное и однородное) увеличение щитовидной железы, но без нарушения ее функции - эутиреоидное состояние.
Клиническая картина эндемического зоба у детей зависит главным образом от степени увеличения щитовидной железы. В большинстве случаев в условиях легкого и умеренного йодного дефицита небольшое увеличение щитовидной железы обнаруживается только при целенаправленном обследовании. И лишь при тяжелой йодной недостаточности эндемический зоб может достигать гигантских размеров либо сопровождаться узлообразованием даже при небольшой своей общей величине. Сам по себе факт умеренного увеличения щитовидной железы (при нормальной функции последней) практически не отражается на работе органов и систем. Поэтому ребенок чаще всего не предъявляет никаких специфических жалоб и внешне никогда не производит впечатления тяжело больного человека. Поэтому неудивительно, что за образом йоддефицитного зоба в литературе закрепилась крылатая фраза как о признаке «скрытого голода». Ни о каком явно выраженном и клинически манифестном нарушении ее функции речи пока не идет. На самом деле зоб для того и формируется, чтобы предотвратить развитие гипотиреоза.
Однако дети с зобом нередко имеют низкие показатели физического развития, состояние их здоровья по многим показателям хуже: они чаще и тяжелее болеют, чаще имеют хронические заболевания, изменения со стороны желудочно-кишечного тракта (запоры), сердечно-сосудистой системы, показателей гемопоэза и ряда параметров крови (признаки анемии, дефицита железа, дис- или реже гиперлипидемия) и др.
В обычной клинической практике самым простым методом выявления зоба является осмотр шеи и пальпация щитовидной железы. Этот метод позволяет выявить само наличие зоба и оценить его величину (степень выраженности). А также по нарушению консистенции (плотности) тиреоидной ткани заподозрить наличие и определить ориентировочный размер узловых образований в щитовидной железе. 0-я степень зоба - зоба нет (объем каждой из долей не превышает объема дистальной фаланги большого пальца обследуемого); 1-я степень - зоб пальпируется, но не виден при нормальном положении шеи (отсутствует видимое увеличение щитовидной железы), а узловые образования не приводят к увеличению самой щитовидной железы; 2-я степень - зоб четко виден при обычном положении шеи.
Помимо пальпаторного определения размеров щитовидной железы и распознавания узловых образований, оценка щитовидной железы проводится при помощи ультразвукового исследования (УЗИ). При помощи УЗИ возможно: точно определить размеры щитовидной железы; визуализировать узловые образования и определить их размеры; подсчитать объем щитовидной железы и т. д. Оценивать результаты УЗИ щитовидной железы ребенка и определять тактику лечения способен только детский эндокринолог, так как помимо эндемического увеличения щитовидной железы существуют другие патологические состояния, дифференцировать которые и определять терапевтическую тактику может только специалист-эндокринолог.
ПРОФИЛАКТИКА ЭНДЕМИЧЕСКОГО ЗОБА
Фактическое среднее потребление йода жителем России составляет 50-80 мкг в день, то есть является недостаточным. Для удовлетворения потребности организма в йоде рекомендуются следующие нормы ежедневного потребления (ВОЗ, 2001): 90 мкг - для детей 0-6 лет; 120 мкг - для детей 7-12 лет; 150 мкг - для подростков старше 12 лет и взрослых; 200 мкг - для беременных и кормящих женщин. Учитывая эпидемиологические данные, большинство регионов России испытывают легкий или умеренный дефицит йода. В связи с этим дети, проживающие в йоддефицитных регионах, должны получать ежедневно дополнительное количество йода: дети препубертатного возраста - 100 мкг, подростки - 200 мкг. Для преодоления дефицита йода используются следующие методы профилактики. Массовая йодная профилактика - профилактика в масштабе популяции, осуществляемая путем внесения йода в наиболее распространенные продукты питания (соль, хлеб). Групповая йодная профилактика - профилактика в масштабе определенных групп повышенного риска по развитию йод- дефицитных заболеваний: дети, беременные и кормящие женщины. Осуществляется путем регулярного длительного приема препаратов, содержащих физиологические дозы йода. Индивидуальная йодная профилактика - профилактика у отдельных лиц путем длительного приема препаратов, содержащих физиологические дозы йода.
ЛЕЧЕНИЕ ЭНДЕМИЧЕСКОГО ЗОБА
При наличии увеличения щитовидной железы по данным пальпации и/или увеличения ее объема по отношению к площади поверхности тела (после исключения аутоиммунного тиреоидита) диагностируется эндемический зоб 1-й или 2-й степени. Назначается прием препаратов йодида калия в суточной дозе 200 мкг курсом не менее 6 месяцев. Если через 6 месяцев отмечается значительное уменьшение или нормализация размеров щитовидной железы, рекомендуется продолжить прием препаратов йода в профилактической дозе (например, йодомарин 200 по 1/2-1 таб. в день) с целью предотвращения рецидива зоба. Если на фоне приема препаратов йода в течение 6 месяцев не произошло нормализации размеров щитовидной железы, то показано применение левотироксина (L-тироксина) в дозе 2,6-3 мкг / кг массы тела в сутки или его комбинации с 100-150 мкг йода в день. Адекватная доза тироксина подбирается в соответствии с уровнем ТТГ. При нормализации размеров щитовидной железы, по данным УЗИ, проводимого каждые 6 месяцев, рекомендуется переход на длительный прием профилактических доз йода.
Безусловно, что тактика ведения и назначение терапии при заболеваниях щитовидной железы (в том числе и при йоддефицитных состояниях) должны контролироваться специалистом эндокринологом.
При гипофункции щитовидной железы используются препараты левотироксина. Гипотиреоз (гипофункция щитовидной железы) представляет собой клинический синдром, развитие которого характеризуется снижением тиреоидных гормонов. Гипотиреоз является одним из наиболее часто встречающихся заболеваний эндокринной системы, распространенность его среди населения постепенно увеличивается. По статистике, гипотиреоз встречается примерно у 2-3% населения России, а в скрытой форме гипофункция щитовидной железы выявляется у 10% взрослого населения и 3% детей. Гипотиреоз намного реже встречается у лиц мужского пола, чем женского (в 3-9 раз) [12]. Для лечения гипотиреоза необходима заместительная терапия препаратами тиреоидных гормонов, которые относятся к группе жизненно необходимых и важнейших лекарственных средств. Назначение заместительной терапии при гипотиреозе требует тщательного подбора дозы препарата, а после достижения компенсации - динамического наблюдения с контролем уровня тиреотропного гормона (ТТГ). Целью лечения гипотиреоза является стабильное поддержание концентрации тиреоидных гормонов на нормальном физиологическом уровне. На сегодняшний день левотироксин - наиболее часто принимаемый гормональный препарат в мире, причем большинство пациентов получают монотерапию левотироскином. Ежедневный однократный прием (стандартная доза - 1,6 мкг/ кг, но она может варьировать в зависимости от возраста и других факторов - патология сердечно-сосудистой системы, неврологические заболевания и др.) позволяет поддерживать эутиреоидное (нормальное) состояние. Одна из самых значимых проблем применения левотироксина связана с взаимозаменяемостью препаратов этого гормона. Препараты-синонимы содержат одно и то же активное лекарственное вещество, но могут отличаться по составу вспомогательных веществ; кроме того, различия могут быть и в технологическом процессе производства препаратов разными предприятиями-производителями [13].
Проблема взаимозаменяемости лекарственных препаратов, содержащих одинаковое действующее вещество, является актуальной для разных препаратов во всех странах мира. Для многих специалистов очевидно, что регистрация препаратов-дженериков только на основании исследования биоэквивалентности является явно недостаточной, необходимо испытание на терапевтическую эквивалентность. Терапевтическая эквивалентность - это комплексное понятие, объединяющее фармацевтическую эквивалентность, биоэквивалентность, доказанную эффективность и безопасность (одинаковый клинический эффект и профиль безопасности), соответствие места производства требованиям качественной производственной практики (GMP, GOOD Manufacturing Practice). Терапевтически эквивалентные препараты оказывают одинаковый клинический эффект и обладают сходным профилем безопасности. В связи с этим в настоящее время большое число исследований посвящено вопросам взаимозаменяемости препаратов различных фармакотерапевтических групп, для того чтобы гарантировать пациенту равный эффект лекарственных препаратов независимо от производителя [14].
На основании проведенных исследований было установлено: на российском фармацевтическом рынке представлен широкий ассортимент препаратов левотироксина как отечественного, так и зарубежного производства. Препараты левотироксина разных производителей не всегда являются взаимозаменяемыми, так как отличаются по составу вспомогательных средств. Применение двухосновного фосфата кальция в качестве вспомогательного вещества обеспечивает большую стабильность препаратов левотироксина по сравнению с использованием лактозы [15].
ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ ПРЕПАРАТА ЛЕВОТИРОКСИНА В ДЕТСКОЙ ПРАКТИКЕ. КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Девочка К., 1 год (фото 1)
Фото 1. Внешний вид (фенотип) девочки К., 1 год, врожденный гипотиреоз (при первичном обращении); без лечения
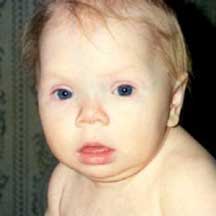
Родители обратились за консультацией в Московский областной клинико-диагностический центр для детей с жалобами на выраженную задержку в психомоторном развитии, мышечную гипотонию, сонливость, запоры, плохой аппетит.
Анамнез семейный:
Ребенок от молодых родителей, маме на момент рождения девочки 24 года, отцу - 26 лет. Со слов - русских по национальности, не состоящих в кровном родстве и не имеющих профессиональных вредностей. В родословной случаев психических заболеваний, ДЦП, эпилепсии, задержки в развитии не отмечалось. Сибс, девочка, 5 лет, - здорова. Семья приехала из Молдавии (город Каменка).
Анамнез жизни и заболевания:
Девочка от второй желанной беременности. Беременность протекала с угрозой прерывания в первой половине. Роды в срок, самостоятельные, в домашних условиях (по желанию родителей). Измерение массы и длины тела новорожденного не проводились. Педиатр малыша не осматривал, в поликлинику по месту жительства не обращались. Ребенок находился на грудном вскармливании.
На первом году жизни у девочки отмечались чрезмерная вялость и диффузная мышечная гипотония. В 3 мес. обратились в детскую поликлинику по месту жительства, где были проведены общеклинические исследования, выявлено снижение уровня гемоглобина, назначены препараты железа, витамины. Данная терапия не улучшала состояние ребенка. Отмечалась выраженная задержка в развитии: не удерживала голову, не переворачивалась, на игрушки не реагировала. Семья решила проконсультироваться в Москве.
Данные объективного исследования:
При осмотре (девочке 1 год) обращали внимание микроаномалии развития: телекант, широкое уплощенное переносье, открытые вперед ноздри, удлиненный фильтрум, тонкие, плохо растущие волосы, гипопигментация волос, радужки. У ребенка всегда открыт рот и высунут язык. Телосложение ребенка несколько диспропорционально, укороченные конечности. Девочка имела низкие показатели физического развития ребенка: длина тела - 66 см (Диагноз клинически не вызывал сомнений: врожденный гипотиреоз, поздно диагностированный. По CITO взят анализ крови на ТТГ, свободный Т4.
Так как роды проходили в другой стране (Молдавии), в домашних условиях, скрининг на врожденные и наследственные заболевания (неонатальный скрининг) не проводился.
Данные лабораторных и функциональных исследований:
Клинический анализ крови: низкий уровень гемоглобина Hb 80 г/л (норма 110-135), эритроциты - 3,5 (норма 3,6-4,9x1012), цветовой показатель 0,75 (норма 0,85-1,15), остальные показатели в норме. Общий анализ мочи в норме. Биохимический анализ крови - норма.
Тиреоидный профиль: тиреотропный гормон (ТТГ) - 466,0 мкМЕ/мл (норма 0,4-4,0), свободный Т4 - 3,2 (норма 10-25 пмоль/л).
При ультразвуковом сканировании анатомических аномалий внутренних органов не обнаружено. Планируется сцинтиграфия щитовидной железы.
УЗИ щитовидной железы - щитовидная железа в типичном месте не обнаружена.
Электрокардиограмма - брадиаритмия.
Эхокардиограмма - без патологии.
Консультация невролога - выраженная задержка психомоторного и речевого развития.
Консультация сурдолога - слух в норме.
Таким образом, ребенку диагностирован врожденный гипотиреоз, подтвержденный результатами лабораторного анализа на ТТГ и Т4 свободный.
Ребенку назначен L-тироксин (Левотироксин - L-тироксин-50 Берлин-Хеми (Berlin-Chemie AG - торговое название)) в дозе 50 мкг/сутки. Через 3 недели проводился контроль тиреоидных показателей: ТТГ - 19,5 (при норме 0,3-3,5 мкМЕ/мл) и Т4 свободный - 6,8 пмоль/л (при норме 10-25 пмоль/л). При повторном анализе через 1 месяц на фоне лечения L-тироксином 50 мкг/сут. было достигнуто эутиреоидное состояние: ТТГ - 5,1 мкМЕ/ мл, Т4 свободный - 10 пмоль/л.
Назначен комплекс реабилитационных мероприятий, направленных на стимуляцию психомоторного развития: массаж, физиолечение, ЛФК. Девочка постоянно получает курсы физиолечения, массажа, работает инструктор по плаванию, что эффективно сказывается на ее моторном развитии (фото 2).
Фото 2. Девочка К., 1 год 6 мес., врожденный гипотиреоз (через 6 мес., на терапии)
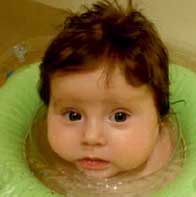
Неврологом назначена ноотропная терапия по схеме.
На фоне терапии L-тироксином состояние и самочувствие ребенка стремительно улучшалось: девочка стала активней, появился аппетит, увеличились масса тела - на 1 кг за 1 мес. и рост - на 3 см за 1 мес. (на 1-м году жизни темпы роста остановились); стала следить за игрушками, проявлять к ним интерес, улыбаться, узнавать близких. В 1 год 3 мес. девочка стала сидеть, в 1 год 6 мес. - вставать у опоры, в 1 год 9 мес. появились отдельные слоги. В общеклиническом анализе крови купировалась анемия, уровень гемоглобина приблизился к норме. Стул стал регулярным.
В настоящее время ребенок наблюдается в поликлинике по месту жительства (Московская область, семья переехала в г. Дмитров на постоянное место жительства). К концу первого года наблюдения (девочке 2 года) сохранялась умеренная задержка моторного (ребенок пока неуверенно ходит), сенсорного и речевого развития (развитие соответствует 1 году 3 мес.), физическое развитие в 2 года - ниже среднего, гармоничное (в 2 года масса тела составила 10 кг, рост - 78 см) (фото 3). В 2 года начаты профилактические прививки. Несмотря на положительную динамику, прогноз состояния здоровья ребенка остается относительно благоприятным, учитывая позднюю диагностику заболевания (врожденный гипотиреоз) у ребенка.
Фото 3. Девочка К., 2 года, врожденный гипотиреоз (через 1 год, на терапии)

Динамика развития ребенка позволяет прийти к заключению, что даже настолько поздно начатая терапия L-тироксином, назначение комплексных реабилитационных мероприятий могут способствовать эффективному физическому и психомоторному развитию. Только совместные усилия врачей различных специальностей помогают детям с врожденной и наследственной патологией социализироваться в обществе, мало отличаться от окружающих сверстников и быть счастливыми вместе с их родителями и близкими.
Список литературы находится в редакции.
Комментарии
ПРАКТИКА ПЕДИАТРА
