Клиническая фармакология рофлумиласта
СтатьиВ.В.Архипов
ГОУ ВПО "Первый МГМУ им. И.М.Сеченова", кафедра клинической фармакологии и пропедевтики внутренних болезней: 109249, Москва, ул. Яузская, 11, корп. 5
Ключевые слова: хроническая обструктивная болезнь легких, фосфодиэстераза, обострения, рофлумиласт.
Clinical Pharmacology Of Roflumilast
V.V.Arkhipov
Key words: chronic obstructive pulmonary disease, phosphodiesterase, exacerbation, roflumilast
Фосфодиэстеразы (ФДЭ) — семейство ферментов, участвующих в регуляции сигнальных путей, связанных с рецепторами на поверхности клеточной мембраны (β-адренорецепторы, М-холинорецепторы и т. д.). Целый ряд процессов, например стимуляция β-адренорецепторов, блокада М-холинорецепторов или взаимодействие глюкогона с рецепторами на поверхности клеток, приводит к синтезу и накоплению в клетках циклического аденозинмонофосфата (цАМФ) или циклического гуанозинмонофосфата (цГМФ). В свою очередь цАМФ и цГМФ служат вторичными посредниками, активируя или замедляя некоторые биологические процессы в клетках. Так, цАМФ участвует в регуляции тонуса гладких мышц, уменьшает синтез медиаторов воспаления, регулирует процессы дифференциации и апоптоза клеток, активирует глюкогенез и влияет на активность ионных каналов.
После стимуляции соответствующего рецептора количество цАМФ и цГМФ внутри клетки превышает количество действующего на клетку медиатора примерно в 100 раз. Это обеспечивает "эффект домино": даже небольшое количество гормона или лекарственного вещества, взаимодействуя с единичными рецепторами на поверхности клетки вызывают мощный биологический ответ. Благодаря цАМФ ингаляция незначительного количества формотерола (6 X 10-6 г) способна купировать выраженный бронхоспазм, а адреналин значимо повышает число сердечных сокращений в дозе < 10-7 г / кг веса больного.
Однако, эффекты цАМФ могут принести вред отдельным клеткам и организму в целом, если они не будут ограничены по времени и интенсивности. ФДЭ катализируют расщепление цАМФ и цГМФ, предохраняя клетки от избыточного воздействия гормонов и медиаторов [1]. С другой стороны, при целом ряде заболеваний усиление внешних стимулов может иметь важное терапевтическое значение. Например, ингибирование ФДЭ в мышечном слое бронхов увеличивает продукцию цАМФ в ответ на воздействие катехоламинов или бронхолитиков. Таким образом, снижение активности ФДЭ обеспечивает бронходилатацию для пациентов с бронхиальной астмой (БА) или хронической обструктивной болезнью легких (ХОБЛ).
С точки зрения химического строения и функциональных особенностей принято выделять 11 типов ФДЭ [1]. ФДЭ 4, 7 и 8-го типов катализируют расщепление цАМФ до АМФ. ФДЭ 5, 6 и 9-го типов отвечают за расщепление цГМФ. ФДЭ 1—3-го и 10—11-го типов взаимодействуют как с цАМФ, так и с цГМФ. Распределение отдельных типов ФДЭ в органах и тканях существенно отличаются. При этом в одних и тех же клетках всегда присутствуют ФДЭ различных типов.
Препараты, способные ингибировать активность ФДЭ, могут отличаться селективностью к определенному типу фермента (выделяют селективные ингибиторы ФДЭЗ, ФДЭ4 и ФДЭ5) или ингибировать любой тип ФДЭ (теофиллин). Фармакологические свойства селективных ингибиторов ФДЭ существенно различаются в зависимости от типа ФДЭ, с которым способен взаимодействовать препарат [2].
Например, селективный ингибитор ФДЭЗ милринон обладает выраженным инотропным действием и применяется для лечения острой сердечной недостаточности. Ингибиторы ФДЭ4 оказывают положительное влияние на процессы воспаления в дыхательных путях, но не обладают прямым бронхолитическим эффектом. Теофиллин по-разному взаимодействует практически с любыми типами ФДЭ, оказывая влияние на тонус бронхов, сердечный ритм, скорость почечного кровотока и на моторику желудочно-кишечного тракта (ЖКТ). Силденафил (селективный ингибитор ФДЭ5) используется для лечения эректильной дисфункции и легочной гипертензии.
Блокада ФДЭ как таковая обычно мало влияет на функцию клетки, но если на клетку воздействуют специфические стимулы (гормоны или лекарственные средства), блокаторы ФДЭ способны существенно усилить их эффект. Например, селективный ингибитор ФДЭ 5-го типа силденафил (Виагра) сам по себе не вызывает эрекцию, но усиливает стимулирующее действие на клетки оксида азота, который выделяется при половом возбуждении [3].
Для больных ХОБЛ наибольшее значение имеет блокада ФДЭ4 [4]. Имеется несколько подтипов ФДЭ4. Например, ФДЭ4В локализован в нейтрофилах и моноцитах и имеет важное значение для регуляции процессов воспаления [5]. ФДЭ4D контролирует сокращение гладкой мускулатуры бронхов, но, кроме того, ФДЭ4D встречается в клетках центральной нервной системы, в Т-лимфоцитах [6]. Подавление активности ФДЭ4D может вызывать рвоту [7]. В регуляции тонуса бронхов также принимает участие ФДЭЗ и некоторые другие типы ФДЭ.
Ингибиторы ФДЭ4
К селективным ингибиторам ФДЭ4 относятся рофлумиласт и циломиласт. Но, несмотря на принадлежность к одной фармакологической группе, эти препараты существенно различаются по своим свойствам. Рофлумиласт демонстрирует примерно одинаковую селективность в отношении ФДЭ4В и ФДЭ4D, в то время как у циломиласта селективность в отношении блокады ФДЭ4D в 10 раз выше, чем по отношению в ФДЭ4А и ФДЭ4В [8]. Поскольку за регуляцию функции нейтрофилов отвечает главным образом ФДЭ4В [9], а ингибирование ФДЭ4D может вызывать нежелательные явления (НЯ) со стороны ЖКТ [10]. Рофлумиласт значительно лучше переносится, чем циломиласт.
Кроме того, рофлумиласт и циломиласт существенно различаются по своей активности: чтобы снизить наполовину активность ФДЭ4В, потребуется 240 нмоль циломиласта или всего 0,4 нмоль рофлумиласта (табл. 1).
Таблица 1
Сравнительная активность рофлумиласта и циломиласта в отношении подтипов ФДЭ 4 [11]
|
Препарат |
IC50*, нмоль | ||
| ФДЭ4В |
ФДЭ4D | ||
| Рофлумиласт | 0,41 |
0,81 | |
| Циломиласт | 240 |
61 | |
Таким образом, рофлумиласт обладает более высоким фармакологическим потенциалом для воздействия на процессы воспаления и является более безопасным, по сравнению с циломиластом. Следует подчеркнуть, что селективные ингибиторы ФДЭ4 не оказывают прямого бронхолитического действия.
Рофлумиласт в сравнении с теофиллином
Теофиллин является неселективным ингибитором ФДЭ всех типов. Но при этом активность теофиллина в отношении ФДЭ4 существенно ниже, чем у рофлумиласта. Теофиллин блокирует активность ФДЭ4 на 50 % в концентрации > 10 000 нмоль, в то время как рофлумиласт достигает аналогичного эффекта при концентрации < 1 нмоль [12]. Таким образом, теофиллин обладает существенно более скромной противовоспалительной активностью, по сравнению с рофлумиластом. Например, чтобы снизить продукцию фактора некроза опухоли-α (TNF-a) в дыхательных путях на одинаковую величину, потребуется в 500 раз больше теофиллина, чем рофлумиласта [12]. (TNF-a — многофункциональный провоспалительный цитокин, который синтезируется моноцитами и макрофагами и отвечает за ряд системных проявлений ХОБЛ.)
Рофлумиласт отличается от теофиллина высокой селективностью: этот препарат в ~ 10 000 раз более активно связывается с ФДЭ4, чем с ФДЭ других типов [13], как показано в табл. 2. В силу этого обстоятельства рофлумиласт существенно более безопасен, по сравнению с теофиллином. Следует добавить, что теофиллин не только ингибирует ФДЭ, но и выступает в качестве антагониста аденозина, что дополнительно увеличивает спектр потенциальных нежелательных эффектов.
Таблица 2
Сравнительная характеристика теофиллина и рофлумиласта
| Характеристика | Теофиллин | Рофлумиласт |
| Механизм действия | Неселективный ингибитор ФДЭ, антогонист А,- и А2-рецепторов аденозина, стимулятор HDAC-2 | Селективный ингибитор ФДЭ4 (подтипы A-D) |
| Взаимодействие с пищей | Белковая пища увеличивает клиренс теофиллина на 30 % | Нет |
| Нежелательные лекарственные взаимодействия | Со множеством препаратов, включая циметидин, фенитоин, эритромицин, ципрофлоксацин, рифампицин, флуконазол, блокаторы кальциевых каналов и т. д. | Нет |
| Влияние курения на фармакокинетику препарата | Курение увеличивает клиренс теофиллина на 40-60 % и снижает эффективность лечения | Курение не влияет на эффективность |
| Терапевтический мониторинг концентрации препарата в крови | Необходим при подборе дозы | Не требуется |
| Нежелательные эффекты | Кардиоваскулярные (нарушение ритма, тахикардия, снижение давления), неврологические (тремор, судороги), нежелательные явления со стороны ЖКТ (тошнота, рвота, гастроэзофагеальный рефлюкс, изжога, обострение язвенной болезни, диарея) | Снижение массы тела, побочные эффекты со стороны ЖКТ (тошнота, боли в животе, диарея) |
| Синдром отмены | Через 32 ч после отмены [22] | Нет |
Рофлумиласт быстро и полностью всасывается (биодоступность при назначении внутрь — 80 %) и достигает пиковой концентрации в крови здоровых добровольцев уже через 1 ч после приема [ 14]. В печени рофлумиласт под воздействием системы цитохромов Р450 (изоферменты CYP3A4 и CYP1A2) быстро метаболизируется до рофлумиласта N-оксида (рис. 1), который по своей активности и селективности практически не отличается от рофлумиласта [14].

Рис. 1. Метаболизм рофлумиласта
Рофлумиласт N-оксид в высокой концентрации сохраняется в плазме на протяжении 1 сут. (рис. 2). Поэтому на его долю приходится ~ 90 % от общей ингибирующей активности препарата. За метаболизм рофлумиласт N-оксида отвечает CYP3A4.
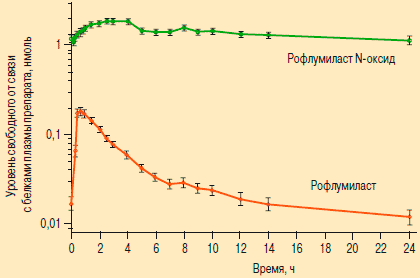
Рис. 2. Уровень рофлумиласта и его активного метаболита в плазме после однократного приема
Теоретически на скорость метаболизма рофлумиласта в печени может влиять целый ряд факторов: возраст больного, курение, прием препаратов, которые являются индукторами или ингибиторами CYP3A4 и CYP1A2. Однако, поскольку по своей активности рофлумиласт и его активный метаболит почти не различаются, изменения скорости метаболизма не имеют существенного клинического значения [15]. В исследованиях лекарственных взаимодействий не было выявлено необходимости коррекции дозы рофлумиласта при одновременном назначении анатцидов [16], эритромицина [17], кетоконазола [18] и дигоксина [15]. Тем не менее на кинетику рофлумиласта могут существенно влиять 2 препарата:
В отличие от рофлумиласта, теофиллин обладает узким терапевтическим индексом (от 10 до 15 (20) мкг / мл) и не имеет активных метаболитов. Поэтому некоторые факторы (возраст, сердечная недостаточность, прием ингибиторов микросомальных ферментов печени) способны повышать концентрацию теофиллина в крови до токсического уровня (табл. 2). Подбор поддерживающей дозы теофиллина представляет сложную задачу и требует мониторинга концентрации препарата в крови [21].
Значение селективной блокады ФДЭ4 для контроля над воспалением дыхательных путей у больных хронической обструктивной болезнью легких
Исследования селективных ингибиторов ФДЭ4 in vitro (табл. 3) показывают, что эти препараты способны положительно влиять на важные звенья в патогенезе ХОБЛ [23, 13]:
Таблица 3
Эффекты ингибиторов ФДЭ4 in vitro [28—31]
| Клетки | Эффект ингибиторов ФДЭ4 |
|
Нейтрофилы | Угнетение продукции IL-8 (служит хемокином для нейтрофилов, макрофагов, лимфоцитов и эозинофилов); |
| Макрофаги / моноциты | Уменьшение синтеза TNF-α, лейкотриенов С4 и В4; увеличение продукции IL-10 (противовоспалительный цитокин) |
| Т-лимфоциты | Подавление синтеза IL-2, IL-4, IL-5 и подавление пролиферации |
| Клетки эпителия | Угнетение продукции IL-6 and TNF-a; увеличение продукции простагландина Е2 |
| Дендритные клетки | Угнетение продукции TNF-a |
| Эндотелиальные клетки | Уменьшение экспрессии молекул адгезии |
У части больных ХОБЛ, наряду с нейтрофилами, в дыхательных путях обнаруживается большое количество эозинофилов [24, 25]. Было показано, что эозинофильная инфильтрация у пациентов с ХОБЛ сочетается с более тяжелым течением или обострением заболевания. Рофлумиласт эффективно снижает число эозинофилов и подавляет способность эозинофилов синтезировать активные формы кислорода и лейкотриен С4 [26].
Данные, полученные in vitro, подтверждаются результатами клинических исследований у больных ХОБЛ. Например, было показано, что назначение рофлумиласта в течение 4 нед. привело к снижению абсолютного числа нейтрофилов в мокроте на 35,5 % (р = 0,002), а число эозинофилов при этом уменьшилось на 50 % (р < 0,001). Также у больных, принимавших рофлумиласт, достоверно снизился уровень эозинофильного катионного протеина, интерлейкина-8 (IL-8) и нейтрофильной эластазы в мокроте, а о влиянии препарата на системное воспаление свидетельствовало достоверное (по сравнению с плацебо) снижение уровня TNF-a в крови больных [27].
Было бы интересно сопоставить влияние на нейтрофильное воспаление у рофлумиласта и глюкокортикостероидов (ГКС). На экспериментальных моделях воспаления дыхательных путей, которое было вызвано табачным дымом, превентивное назначение метилпреднизолона не снижало числа нейтрофилов, а назначение рофлумиласта уменьшало количество этих клеток в слизистой оболочке трахеи на 35—84 % в зависимости от назначенной дозы [33].
Сравнительные клинические исследования рофлумиласта и ГКС не проводились. Но, опираясь на косвенные данные, можно заключить, что рофлумиласт за 4 нед. более заметно снижает число нейтрофилов в мокроте, чем комбинированная терапией сальметеролом / флутиказоном в течение 13 нед. [34]. Другой пример — исследование у больных ХОБЛ, получавших высокие дозы бекламетазона дипропионата (1 500 мкг / сут.). За 2 мес. такого лечения число нейтрофилов в мокроте у больных снизилось на 27 % [35]. Между тем при назначении рофлумиласта за 4 нед. удалось добиться снижения количества нейтрофилов на 35,5 % [27].
У большинства больных ХОБЛ ингаляционные ГКС (иГКС) существенно менее эффективны, чем у больных БА [36]. Эффективность ГКС при ХОБЛ зарегистрирована главным образом у пациентов с высокой эозинофилией мокроты [25, 37]. Причинами недостаточной эффективности ГКС при ХОБЛ считают преобладание нейтрофильного воспаления и снижение активности гистон деацетилазы-2 (HDAC) под воздействием курения [38]. Однако эти особенности заболевания не снижают эффективности рофлумиласта, которая при ХОБЛ существенно выше, чем при БА [39].
Бронхолитическое действие рофлумиласта
В отличие от теофиллина, рофлумиласт не является бронхолитиком, т. е. после его назначения не увеличиваются показатели спирометрии. В исследованиях рофлумиласта [40] и циломиласта [41] объем форсированного выдоха за 1-ю с (ОФВ1) у больных не изменялся в первые 6 ч после назначения препаратов.
Но при регулярном назначении ингибиторов ФДЭ4 ОФВ1 у больных постепенно увеличивается, достигая максимума спустя 2—4 нед. лечения. Это обстоятельство свидетельствует о том, что ингибиторы ФДЭ4 влияют на бронхиальную проходимость опосредовано, благодаря своему противовоспалительному действию.
В исследовании, длившемся 6 мес., 1411 больных с умеренным и тяжелым течением ХОБЛ были поделены на группы, которым назначались рофлумиласт в суточных дозах 250 мкг и 500 мкг или плацебо [43]. К концу исследования у пациентов, получавших рофлумиласт в дозе 250 мг, ОФВ1 был на 74 мл больше, чем в группе плацебо. А при приеме рофлумиласта по 500 мкг средняя разница с группой плацебо по величине ОФВ1 составила 97 мл (р < 0,0001). Таким образом, влияние рофлумиласта на показатели спирометрии представляется достаточно выраженным и имеет дозозависимый характер.
В более продолжительных исследованиях у больных, получавших рофлумиласт по 500 мкг в течение года, ОВФ1 к концу наблюдения оказывался на 36—58 мл выше, чем в группе плацебо (табл. 4). В целом влияние этого препарата на ОФВ1 в исследованиях продолжительностью 1 год вполне сопоставимо с аналогичным эффектом иГКС или β2-агонистов длительного действия [42].
Таблица 4
Дополнительный (по сравнению с плацебо) прирост ОФВ1 у больных ХОБЛ, пронимавших рофлумиласт
| Исследование | n | ОФВ1, % долж | Продолжительность | Суточная доза рофлумиласта, мкг | ΔОФВ1 после ингаляции бронхолитика, мл, рофлумиласт vs плацебо |
|
М2-107 [43] |
1 411 |
30-80 |
24 нед. | 250 | 74 (р< 0,0001) |
| 500 | 97 (р< 0,0001) | ||||
| М2-111 [44] | 1 176 | ≤50 | 52 нед. | 500 | 36 (р< 0,0001) |
| М2-112 [45] | 1 513 | ≤50 | 1 год | 500 | 39 (р = 0,001) |
| М2-124 [46] | 1 523 | ≤50 | 1 год | 500 | 54 (р = 0,0003) |
| М2-125 [46] | 1 568 | ≤50 | 1 год | 500 | 58 (р <0,0001) |
Бронхолитический эффект длительно действующих β2-адреностимуляторов и антагонистов М-холинорецепторов реализуется за счет накопления в клетках цАМФ. Таким образом, теоретически ингибиторы ФДЭ4 способны усиливать действие этих препаратов, выступая в качестве синергистов. Клинические исследования полностью подтвердили это положение. В исследовании М2-127 больным, получавшим салметерол, дополнительно назначался рофлумиласт или плацебо [47]. Добавление рофлумиласта к терапии сальметеролом обеспечивало больным дополнительный прирост ОФВ1 на 49 мл, по сравнению с плацебо (р < 0,0001). В аналогичном по дизайну исследовании М2-128 [47] рофлумиласт добавлялся к терапии тиотропиумом, благодаря чему спустя 24 нед. показатель ОФВ1 в группе комбинированной терапии был на 80 мл выше, чем при монотерапии М-холинолитиком (р < 0,0001).
Обобщенный анализ исследований М2-124 и М2-125 (оба исследования продолжительностью в 12 мес.) показал, что преимущества комбинации рофлумиласта с β2-агонистами длительного действия сохраняются и в течение более продолжительного срока. В этих работах у больных, получавших рофлумиласт в комбинации с сальметеролом или формотеролом, спустя год лечения ОФВ1 оказался на 46 мл выше, чем у пациентов, которые принимали только β2-агонисты длительного действия. Аналогичные преимущества (прирост ОФВ1 на 52 мл к концу года) отмечались у больных, получавших рофлумиласт в сочетании с М-холинолитиками короткого действия [46].
Важно отметить, что дополнительный прирост ОФВ1 у больных, которым к терапии бронхолитиками был добавлен рофлумиласт, сопоставим или даже превышает степень прироста ОФВ1 при добавлении иГКС к терапии сальметеролом [42] или тиотропиумом [48].
Таким образом, назначение рофлумиласта сопровождается стойким увеличением ОФВ1 у больных ХОБЛ. Повышение ОФВ1 сохраняется по крайней мере на протяжении 1 года, более длительных исследований пока не проводилось. При этом степень улучшения бронхиальной проходимости сопоставима с иГКС. Комбинация рофлумиласта с ингаляционными бронхолитиками разных групп позволяет добиться дополнительной (по сравнению с действием бронхолитика) бронходилатации.
Снижение риска обострений ХОБЛ
Ни один из предложенных для терапии ХОБЛ препаратов, назначенный по отдельности или в комбинации, не способен полностью защитить больных ХОБЛ от обострений заболевания. В клинических исследованиях последних лет влияние более эффективной терапии (в т. ч. комбинированной) на риск обострений проявляется уменьшением числа тяжелых обострений лишь на 20—25 % [42, 49, 50].
Снижение риска обострений в исследованиях рофлумиласта оценивалось по сравнению с плацебо. Но при этом большинство больных как в группе рофлумиласта, так и в группе плацебо одновременно получали современные препараты, способные эффективно снижать количество обострений. Например, в исследовании М2-112 [45] > 60 % больных получали иГКС, примерно 1/2 пациентов в исследованиях М2-124 и М2-125 применяли β2-адреностимуляторы длительного действия [46]. Все участники исследований М2-127 и М2-128 принимали длительно действующие бронхолитики [47]. Таким образом, комментируя эти исследования, можно говорить лишь об относительном снижении числа обострений.
Одновременный прием препаратов для терапии ХОБЛ существенно влияет на оценку рофлумиласта как препарата для профилактики обострений ХОБЛ. Например, в исследования М2-127 и М2-128 были включены больные с одинаковым средним уровнем ОФВ1 которые не отличались по возрасту, продолжительности заболевания и другим клиническим характеристикам [47]. В исследовании М2-127 назначение рофлумиласта в сочетании с сальметеролом позволяло достоверно снизить частоту умеренных и тяжелых обострений ХОБЛ на 36,8 % (рис. 3). Но в другом исследовании (М2-128), в котором рофлумиласт назначался больным, принимавшим тиотропиум, снижение риска обострений оказалось существенно более скромным (на 23,2 %), т. к. тиотропиум исходно уменьшает риск обострений ХОБЛ, причем существенно более эффективно, чем сальметерол [51].
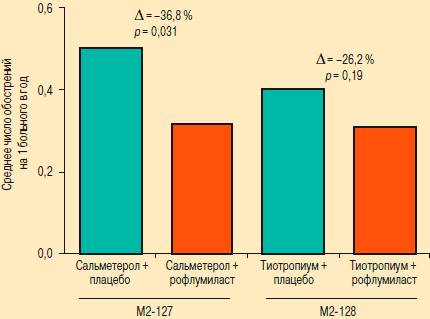
Рис. 3. Частота умеренных и тяжелых обострений ХОБЛ в исследованиях М2-127 и М2-128 (ретроспективный анализ [52])
Способность рофлумиласта снижать риск обострений ХОБЛ лучше всего проявляется у больных с более тяжелым течением ХОБЛ. Например, в исследовании М2-112 [45] у больных с IV стадией ХОБЛ разница в числе обострений между группами рофлумиласта и плацебо составила 36 % (р = 0,02). Также рофлумиласт особенно эффективен при фенотипе ХОБЛ с частыми обострениями. Ретроспективный анализ исследований М2-124 и М2-125 [54] показал, что у больных с ≥ 2 обострениями в течение года, предшествовавшего включению в исследование, лечение рофлумиластом снижало частоту обострений на 23,3 %, а у пациентов с редкими обострениями — только на 16,6 % (рис. 4). В исследованиях М2-124 и М2-125 больные, получавшие рофлумиласт в сочетании с β2-агонистами длительного действия, имели на 20,7 % меньше умеренных и тяжелых обострений (р = 0,011), чем пациенты, получавшие только β2-агонисты. Примерно в той же степени проявлялась способность рофлумиласта предотвращать обострения ХОБЛ у больных, которые до включения в исследование получали иГКС. У таких пациентов умеренные и тяжелые обострения встречались на 19,3 % реже по сравнению с группой плацебо (р = 0,0038). Приведенные данные свидетельствуют об очень высоком терапевтическом потенциале препарата.
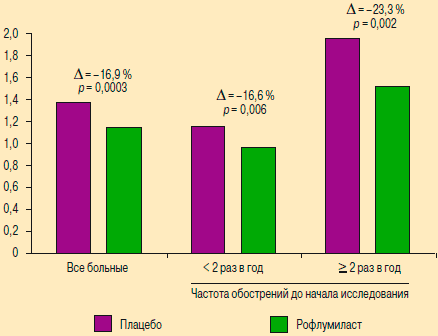
Рис. 4. Снижение риска обострений у больных с частыми и редкими обострениями ХОБЛ [54]
Помимо больных с тяжелым течением ХОБЛ и частыми обострениями заболевания, рофлумиласт продемонстрировал высокую эффективность у пациентов с эмфиземой, выраженным кашлем и повышенной продукцией мокроты [53].
Место рофлумиласта в современной терапии ХОБЛ
Новая редакция Глобальной стратегии по хронической обструктивной болезни легких 2011 г. (GOLD) при выборе терапии предписывает опираться на комбинированную оценку заболевания по выраженности симптомов и риску обострений [55]. При подобном подходе все больные ХОБЛ разделяются на 4 группы (рис. 5):
Рис. 5. Комбинированная оценка заболевания по GOLD 2011 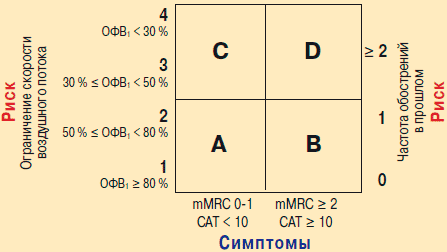
Согласно рекомендациям GOLD 2011 г. рофлумиласт показан больным, относящимся к группе D, которые характеризуются высоким риском обострения и выраженными симптомами. У таких пациентов рофлумиласт назначается в качестве препарата 2-го ряда, т. е. с учетом доступности препарата или при недостаточной эффективности других лекарственных средств. (Препаратами выбора для данной категории больных являются иГКС в сочетании с β2-агонистами длительного действия или М-холинолитики длительного действия.) При этом рекомендуется применять рофлумиласт в сочетании с комбинированными препаратами (иГКС / /β2-агонист длительного действия) или с М-холинолитиком длительного действия.
Кроме того, поскольку рофлумиласт назначается внутрь, он может применяться в терапии больных группы С в тех случаях, когда пациенты испытывают затруднения в использовании ингаляторов.
Нежелательные лекарственные реакции рофлумиласта
В целом рофлумиласт хорошо переносится больными. Наиболее распространенными НЯ в ходе клинических исследований были расстройства со стороны желудочно-кишечного тракта (ЖКТ) и снижение массы тела. С другой стороны, по сравнению с плацебо, больные, получавшие рофлумиласт, реже отмечали обострения ХОБЛ, инфекции нижних дыхательных путей и одышку. Число случаев пневмонии при назначении рофлумиласта оказалось существенно ниже, чем в группе плацебо. В отличие от теофиллина и бронхолитиков, рофлумиласт не оказывает нежелательного действия на сердечнососудистую систему. Среди пациентов, которые получали рофлумиласт, эпизоды повышения артериального давления отмечались значительно реже, чем в группе плацебо.
В табл. 5 представлены наиболее частые НЯ, возникавшие у 5 766 пациентов, получавших рофлумиласт в ходе различных плацебоконтролируемых исследований. Как видно из представленных данных, по общему количеству нежелательных явлений (НЯ), серьезных нежелательных явлений (СНЯ) и летальных исходов рофлумиласт практически не отличается от плацебо.
Таблица 5
Наиболее частые НЯ при терапии рофлумиластом [58]
|
Рофлумиласт |
Плацебо (n = 5 491) | |
|
Любые нежелательные явления, n (%) | ||
| Больные с НЯ | 3873 (67,2) | 3 447 (62,8) |
| Больные с СНЯ | 781 (13,5) | 782 (14,2) |
| Умершие | 84 (1,5) | 86 (1,6) |
| Выбывшие из исследования из-за НЯ | 824 (14,3) | 503 (9,2) |
|
Нежелательные явления со стороны органов и систем, % | ||
| Инфекции | 25,9 | 27,5 |
| Риниты и фарингиты | 6,3 | 6,3 |
| Инфекции нижних дыхательных путей | 3,8 | 4,3 |
| Бронхиты | 3,1 | 3,5 |
| Грипп | 2,5 | 2,4 |
| Пневмония | 1,8 | 2,0 |
|
НЯ, связанные с органами дыхания |
25,6 |
29,3 |
| Обострение ХОБЛ | 19,8 | 23,1 |
| Одышка | 1,5 | 2,2 |
| НЯ со стороны ЖКТ | 22 | 10,7 |
| Диарея | 10,1 | 2,6 |
| Тошнота | 5,2 | 1,4 |
|
НЯ, связанные с нервной системой |
10,7 |
5,5 |
| Головная боль | 4,6 | 2,0 |
| Головокружения | 2,4 | 1,2 |
|
НЯ, связанные с опорнодвигательным аппаратом |
10,2 |
8,1 |
| Боли в спине | 3,1 | 2,1 |
| Общие нарушения | 6,4 | 5,8 |
| Иносомния | 2,6 | 0,9 |
| Заболевания сердца | 5,7 | 5,9 |
| Болезни сосудов | 3,4 | 4,2 |
| Гипертензия | 1,6 | 2,5 |
| НЯ, связанные с метаболизмом и питанием | 5,4 | 3,4 |
| Снижение аппетита | 2,2 | 0,4 |
| Снижение массы тела | 6,8 | 1,8 |
| НЯ, связанные с кожей и подкожной клетчаткой | 3,6 | 2,8 |
| Новообразования | 2,0 | 1,7 |
Тем не менее больные, которым назначался рофлумиласт, несколько чаще прерывали лечение из-за НЯ, чем пациенты, получавшие плацебо. Среди причин отказа от лечения следует назвать диарею (у 10,1 % больных) и снижение массы тела (у 6,8 %). НЯ со стороны ЖКТ специфичны для всех ингибиторов ФДЭ4 и связаны с блокадой ФДЭ4D в нейронах, контролирующих моторику ЖКТ и рвотный рефлекс [10]. При назначении циломиласта, который в 10 раз более селективен по отношению к D-подтипу ФДЭ4, нежелательные эффекты со стороны ЖКТ возникают значительно чаще, чем при лечении рофлумиластом [39].
Снижение массы тела также не является уникальным эффектом рофлумиласта и может встречаться у больных, получающих теофиллин [59]. Механизм этого явления изучен недостаточно. Снижение веса связывают с активацией липолиза под воздействием АМФ-зависимых протеинкиназ или с увеличением синтеза глюкагоноподобного пептида-1 клетками кишечника [60].
Потеря веса у больных, получавших рофлумиласт, в целом невелика — ≤ 3 % от исходной массы тела — и проиходит главным образом в первые 4 нед. приема препарата [61]. При этом пациенты с пониженным питанием не испытывают дополнительного снижения массы тела, а наиболее выраженные изменения наблюдается у пациентов с ожирением [58]. Таким образом, в большинстве случаев снижение массы тела не является опасным для больного.
Заключение
Рофлумиласт (Даксас) представляется перспективным препаратом для терапии больных с тяжелым течением ХОБЛ и высоким риском обострений. Он лишен недостатков, присущих ингаляционным формам доставки, хорошо сочетается со всеми традиционными препаратами для терапии ХОБЛ и выступает в качестве их синергиста. По механизму действия рофлумиласт относится к средствам, подавляющим воспаление в дыхательных путях. При этом действие препарата сфокусировано на подавлении активности нейтрофилов, что выгодно отличает рофлумиласт от иГКС и длительно действующих бронхолитиков.
Доказательная база, основанная на крупных международных исследованиях, позволила включить рофлумиласт в международные стандарты терапии ХОБЛ, в качестве средства, снижающего риск обострений ХОБЛ и улучшающего функциональные показатели больных. Рофлумиласт особенно эффективен у наиболее тяжелых больных и при фенотипе ХОБЛ с частыми обострениями. По своей эффективности рофлумиласт сопоставим с иГКС, имеются данные о положительном влиянии препарата на системные проявления ХОБЛ (снижение уровня TNF-a в крови больных).
Препарат в целом хорошо переносится, а НЯ со стороны ЖКТ компенсируются положительным влиянием на систему дыхания и отсутствием кардиоваскулярных рисков.
ЛИТЕРАТУРА
1. Jeon Y., Нео Y., Kim С. et al. Phosphodiesterase: overview of protein structures, potential therapeutic applications and recent progress in drug development. Cell. Mol. Life Sci. 2005; 62 (11): 1198-1220.
2. Boswell-Smith V., Spina D., Page C.P. Phosphodiesterase inhibitors. Br. J. Pharmacol. 2006; 147: S252—S257.
3. Uckert S., Kuthe A., Stief C.G., Jonas U. Phosphodiesterase isoenzymes as pharmacological targets in the treatment of male erectile dysfunction. Wld J. Urol. 2001; 19: 14—22.
4. Mclvor R.A. Future options for disease intervention: important advances in phosphodiesterase 4 inhibitors. Eur. Respir. Rev. 2007; 16 (105): 105-112.
5. Wang P., Wu P., Ohleth KM. et al Phosphodiesterase 4B2 is the predominant phosphodiesterase species and undergoes differential regulation of gene expression in human monocytes and neutrophils. Mol. Pharmacol. 1999; 56: 170—174.
6. Erdogan S., Houslay M.D. Challenge of human Jurkat T-cells with the adenylate cyclase activator forskolin elicits major changes in cAMP phosphodiesterase (PDE) expression by up-regulating PDE3 and inducing PDE4D1 and PDE4D2 splice variants as well as down-regulating a novel PDE4A splice variant. Biochem. J. 2003; 321 (Pt 1): 165-175.
7. Mehats C., Jin S.L., Wahlstrom J. et al. PDE4D plays a critical role in the control of airway smooth muscle contraction. FASEB J. 2003; 17: 1831-1841.
8. Giembycz M.A. Cilomilast: a second generation phosphodiesterase 4 inhibitor for asthma and chronic obstructive pulmonary disease. Exp. Opin. Invest. Drugs 2001; 10: 1361-1379.
9. Jin S.L., Conti M. Induction of the cyclic nucleotide phosphodiesterase PDE4B is essential for LPS-activated TNF-alpha responses. Proc. Natl Acad. Sci. USA 2002; 99: 7628-7633.
10. Robichaud A., Stamatiou P.B., Jin S.L. et al. Deletion of phosphodiesterase 4D in mice shortens alpha(2)-adrenoceptor- mediated anaesthesia, a behavioural correlate of emesis. J. Clin. Invest. 2002; 110: 1045—1052.
11. Wang D., Cui X. Evaluation of PDE4 inhibition for COPD. Int. J. Chron. Obstruct. Pulm. Dis. 2006; 1 (4): 373—379.
12. LeadDiscovery. 2006. Phosphodiesterase 4 (PDE4) & phosphodiesterase 5 (PDE5) inhibitors [online]. Accessed 16 lune 2006.
13. Hatzelmann A., Morcillo E.J., Lungarella G. et. al The preclinical pharmacology of roflumilast — a selective, oral phosphodiesterase 4 inhibitor in development for chronic obstructive pulmonary disease. Pulm. Pharmacol. Ther. 2010; 23: 235-256.
14. Bethke T.D., Bohmer G.M., Hermann R. et al Dose-proportional intraindividual single- and repeated-dose pharmacokinetics of roflumilast, an oral, once-daily phosphodiesterase 4 inhibitor. J. Clin. Pharmacol. 2007; 47: 26—36.
15. Lahu G., Hunnemeyer A., Diletti E. et al Population pharmacokinetic modelling of roflumilast and roflumilast N-Oxide by total phosphodiesterase 4 inhibitory activity and development of a population pharmacodynamicadverse event model. Clin. Pharmacokinet. 2010; 49: 589—606.
16. Nassr N., Lahu G, Hunnemeyer A. et al Magnesium hydroxide / aluminium hydroxide-containing antacid does not affect the pharmacokinetics of the targeted phosphodiesterase 4 inhibitor roflumilast. J. Clin. Pharmacol. 2007; 47: 660—666.
17. Lahu G., Hunnemeyer A., Herzog R. et al Effect of repeated dose of erythromycin on the pharmacokinetics of roflumilast and roflumilast N-oxide. Int. J. Clin. Pharmacol. Ther. 2009; 47: 236-245.
18. Lahu G., Hunnemeyer A., von Richter O. et al. Effect of single and repeated doses of ketoconazole on the pharmacokinetics of roflumilast and roflumilast N-oxide. J. Clin. Pharmacol. 2008; 48: 1339—1349.
19. Nassr N., Huennemeyer A., Herzog R. et al Effects of rifampicin on the pharmacokinetics of roflumilast and roflumilast N-oxide in healthy subjects. Br. J. Clin. Pharmacol. 2009; 68: 580-587.
20. von Richter O., Lahu G., Hunnemeyer A. et al Effect of fluvoxamine on the pharmacokinetics of roflumilast and roflumilast N-oxide. Clin. Pharmacokinet. 2007; 46: 613—622.
21. Ram F.S. Use of theophylline in chronic obstructive pulmonary disease: examining the evidence. Curr. Opin. Pulm. Med. 2006; 12 (2): 132-139.
22. Bennett J.A., Thompson Coon I., Pavord P. et al The airway effects of stopping regular oral theophylline in patients with asthma. Br. J. Clin. Pharmacol. 1998; 45: 402—404.
23. Boswell-Smith V., Cazzola М., Page C.P Are phosphodiesterase 4 inhibitors just more theophylline? J. Allergy Clin. Immunol. 2006; 117 (6):1237—1243.
24. Profita М., Sala A., Bonanno A. et al Chronic obstructive pulmonary disease and neutrophil infiltration: role of cigarette smoke and cyclooxygenase products. Am. J. Physiol. Lung Cell. Mol. Physiol. 2010; 298 (2): L261-L269.
25. Brightling C.E., Monteiro W, Ward R. et al Sputum eosinophilia and short-term response to prednisolone in chronic obstructive pulmonary disease: a randomized controlled trial. Lancet 2000; 356: 1480—1485.
26. Tenor H., Hatzehnann A., Church M.K. et al Effects of theophylline and rolipram on leukotriene C4 (LTC4) synthesis and chemotaxis of human eosinophils from normal and atopic subjects. Br. J. Pharmacol. 1996; 118: 1727—1235.
27. Grootendorst D.С., Gauw S.A., Verhoosel R.M. et al Reduction in sputum neutrophil and eosinophil numbers by the PDE4 inhibitor roflumilast in patients with COPD. Thorax 2007; 62 (12): 1081-1087.
28. Jones N.A., Boswell-Smith V, Lever R., Page C.P. The eff ect of selective phosphodiesterase isoenzyme inhibition on neutrophil function in vitro. Pulm. Pharmacol. Ther. 2005; 18: 93-101.
29. Hidi R., Timmermans S., Liu E. et al Phosphodiesterase and cyclic adenosine monophosphate-dependent inhibition of T-lymphocyte chemotaxis. Eur. Respir. J. 2000; 15: 342—349.
30. Au B.T., Teixeira M.M., Collins P.D., Williams T.J. Effect of PDE4 inhibitors on zymosan-induced IL-8 release from human neutrophils: synergism with prostanoids and salbutamol. Br. J. Pharmacol. 1998; 123: 1260—1266.
31. Cortijo J., Villagrasa V., Navarrete C. et ah Effects of SCA40 on human isolated bronchus and human polymorphonuclear leukocytes: comparison with rolipram, SKF94120 and levcromakalim. Br. J. Pharmacol. 1996; 119: 99—106.
32. Nadel J.A. Role of neutrophil elastase in hypersecretion during COPD exacerbations, and proposed therapies. Chest 2000; 117 (5, Suppl. 2): S386-S389.
33. Fitzgerald M.F., Spicer D., McAulay A.E. et al. Roflumilast butnot methylprednisolone inhibited cigarette smoke-induced pulmonary inflammation in guinea pigs. Eur. Respir. J. Suppl. 2006; 663s: P3850.
34. Barnes N.C., Qiu Y.S., Pavord L.D. et al. Antiinflammatory effects of salmeterol / fluticasone propionate in chronic obstructive lung disease. Am. J. Respir. Crit. Care Med. 2006; 173 (7): 736-743.
35. Confalonieri М., Mainardi E., Della Porta R. et al. Inhaled corticosteroids reduce neutrophilic bronchial inflammation in patients with chronic obstructive pulmonary disease. Thorax 1998; 53: 583-585.
36. Keatings V, Jatakanon A., Worsdell Y. et al. Effects of inhaled and oral glucocorticoids on inflammatory indices in asthma and COPD. Am. J. Respir. Crit. Care Med. 1997; 155: 548.
37. Leigh R., Pizzjchini M.M., Morris M.M. et al. Stable COPD: predicting benefit from high-dose inhaled corticosteroid treatment. Eur. Respir. J. 2006; 27 (5): 964—971.
38. Barnes P.J., Adcock L.M. Glucocorticoid resistance in inflammatory diseases. Lancet 2009; 373: 1905—1917.
39. Lipworth B.J. Phosphodiesterase-4 inhibitors for asthma and chronic obstructive pulmonary disease. Lancet 2005; 365: 167-175.
40. Boszormenyi-Nagy G., Pieters W.R., Steffen H. et al. The effect of roflumilast treatment and subsequent withdrawal in patients with COPD [abstract]. Proc. Am. Thor. Soc. 2005; 2: A544.
41. Grootendorst D.C., Gauw S.A., Baan R. et al. Does a single dose of the phosphodieasterase 4 inhibitor, cilomilast (15 mg), induce bronchodilatation in patients with chronic obstructive pulmonary disease? Pulm. Pharmacol. Ther. 2003; 16: 115-120.
42. Calverley P., Pauwels R., Vestbo J. et al. Combined salmeterol and fluticasone in the treatment of chronic obstructive pulmonary disease: a randomised controlled trial. Lancet 2003; 361 (9356): 449-456.
43. Rabe K.F., Bateman E.D., O'Donnell D. et al. Roflumilast — an oral anti-inflammatory treatment for chronic obstructive pulmonary disease: a randomized controlled trial. Lancet 2005; 366: 563-571.
44. Nycomed data on file.
45. Calverley P.M., Sanchez-Toril F., McIvor A. et al. Effect of 1-year treatment with roflumilast in severe chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2007; 176: 154-161.
46. Calverley P.M., Rabe K.F., Goehring U.M. et al. Roflumilast in symptomatic chronic obstructive pulmonary disease: two randomised clinical trials. Lancet 2009; 374: 685—694.
47. Fabbri L.M., Calverley P.M.A., Izquierdo-Alonso J.L. et al. Roflumilast in moderate-to-severe chronic obstructive pulmonary disease treated with longacting bronchodilators: two randomised clinical trials. Lancet 2009; 374 (9691): 695-703.
48. Aaron S.D., Vandemheen K.L., Fergusson D. et al. Tiotropium in combination with placebo, salmeterol, or fluticas-one-salmeterol for treatment of chronic obstructive pulmonary disease. Ann. Intern. Med. 2007; 146 (8): 545—555.
49. Casaburi R., Mahler D.A., Jones P. W. et al. A long-term evaluation of once-daily inhaled tiotropium in chronic obstructive pulmonary disease. Eur. Respir. J. 2002; 19: 217—224.
50. Burge P.S., Calverley P.M., Jones P.W. et al. Randomised, double blind, placebo controlled study of fluticasone propionate in patients with moderate to severe chronic obstructive pulmonary disease: the ISOLDE trial. Br. Med. J. (Clin. Res. Ed.) 2000; 320 (7245): 1297-1303.
51. Vogelmeier С., Hederer В., Glaab F. et al. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N. Engl. J. Med. 2011; 364 (12): 1093-1103.
52. Chapman K.R., Rabe K.F. Efficacy and safety of roflumilast in patients with chronic obstructive pulmonary disease (COPD) concomitantly treated with tiotropium or salmeterol. Prim. Care Respir. J. 2010; 19: A12.
53. Rennard S.I., Calverley P.M., Goehring U.M. et al. Reduction of exacerbations by the PDE4 inhibitor roflumilast— the importance of defining different subsets of patients with COPD. Respir. Res. 2011; 12: 18.
54. Bateman E.D., Rabe K.F., Calverley P.M. et al. Roflumilast with long-acting/β2-agonists for COPD: influence of exacerbation history. Eur. Respir. J. 2011; 38 (3): 553—560.
55. Global Initiative for Chronic Obstructive Lung Disease. Global Strategy for the Diagnosis, Management and Prevention of Chronic Obstructive Pulmonary Disease (updated 2011).
56. Mahler D., Wells C. Evaluation of clinical methods for rating dyspnea. Chest 1988; 93: 580—586.
57. Jones P. W., Harding G., Berry P. et al. Development and first validation of the COPD Assessment Test. Eur. Respir. J. 2009; 34 (3): 648-654.
58. Calverley P.M.A., Fabbri L.M., Rabe K.F., Mosberg H. Roflumilast in the treatment of COPD: a pooled safety analysis. In: Presented at the European Respiratory Society annual congress, Barcelona, Spain 18—22 Sept., 2010: Barcelona; 2010. Poster 4732.
59. Boswell-Smith V, Spina D. PDE4 inhibitors as potential therapeutic agents in the treatment of COPD-focus on roflumilast. Int. J. Chron. Obstruct. Pulm. Dis. 2007; 2: 121-129.
60. Rabe K.F. Update on roflumilast, a phosphodiesterase 4 inhibitor for the treatment of chronic obstructive pulmonary disease. Br. J. Pharmacol. 2011; 163 (1): 53—67.
61. Wouters E.F.M., Feichmann P., Brose M. et al. Effects of roflumilast, a phosphodiesterase 4 inhibitor, on body composition in chronic obstructive pulmonary disease. Am. J. Respir. Crit. Care Med. 2010; 181: A4473.
