Применение Изопринозина (инозин пранобекса) для профилактики и лечения респираторных инфекций у детей
СтатьиВведение
Несмотря на определенные успехи в понимании патогенеза атопической бронхиальной астмы и разработке различных терапевтических программ, распространенность заболевания среди детей остается высокой.
Одной из причин отсутствия контроля над симптомами бронхиальной астмы является рецидивирующая инфекция. По данным многих исследователей, среди факторов, обусловливающих возникновение и прогрессирование заболевания, важную патогенетическую роль играет острая респираторная инфекция (ОРИ).
Установлено, что влияние вирусов на воздухоносные пути очень многогранно. Одним из важных патогенных механизмов является повреждение эпителия слизистой оболочки бронхов, приводящее к повышению ее проницаемости для аллергенов и поллютантов, а также «обнажающее» сенсорные нервные волокна подслизистого слоя. В результате этого происходит значительное повышение бронхиальной гиперреактивности, что имеет патогенетическое значение не только у больных бронхиальной астмой, но и у здоровых лиц. Известно, что в дебюте бронхиальной астмы у многих детей наблюдались повторные респираторные вирусные инфекции, сопровождающиеся бронхообструктивным синдромом.
Острые респираторные инфекции нередко вызывают обострение многих хронических болезней и могут провоцировать обострение не только бронхиальной астмы, но и атопического дерматита, аллергического ринита. В свою очередь, среди детей с респираторными и кожными проявлениями аллергии значительную группу составляют пациенты, склонные к возникновению частых респираторных инфекционных заболеваний. При иммунологическом обследовании таких детей выявляются признаки функциональной недостаточности различных звеньев иммунной системы, участвующих в защите организма от вирусных и бактериальных инфекций. Они проявляются угнетением интерферонопродуцирующей активности лейкоцитов, нарушениями дифференцировки иммунокомпетентных клеток, тенденцией к снижению уровней иммуноглобулинов классов A и G в сыворотке крови, секреторных иммуноглобулинов.
По данным отечественной и зарубежной литературы в большинстве (90%) случаев, при которых удалось обнаружить возбудителей культуральными, серологическими или молекулярно-генетическими методами, причиной развития острого респираторного заболевания (ОРЗ) служат респираторные вирусы (табл. 1). Если возбудителя не удается обнаружить, ОРЗ, вероятнее всего, вызвано вирусами, которые не удалось выявить при проведении исследования.
Таблица 1
Возбудители острых респираторных инфекций (Wenzel R.P., Fowler A.A. , 2006; Куценко М.А., 2010)
| Частота | Патоген | Комментарии |
| 90% | Вирус гриппа | Быстрый подъем температуры. Озноб. Головная боль. Часто отмечаются миалгии и артралгии. Может развиваться миозит с появлением в моче миоглобина и повышением уровня «мышечных» ферментов (КФК). Возможно развитие гипер-токсических форм. Информация об эпидемии гриппа. |
| Вирус парагриппа | Чаще возникает в период с января по май, с максимумом в феврале-апреле. У детей часто отмечается картина ложного крупа. Кашель грубый, приступообразный, изнуряющий. Шумное дыхание. Осипший голос за счет поражения гортани. | |
| Респираторно-синцитиальный вирус | Семейный анамнез. В 20% случаев отмечается боль в ушах. Вспышки в зимне-весенний период. Часто развивается бронхообструктивный синдром | |
| Коронавирусы | Течение схоже с инфекцией, вызванной вирусом гриппа, но отсутствует внезапное начало с быстрым подъемом температуры и ознобами. Выраженные катаральные явления. Конъюнктивит. Лимфаденопатия. | |
| Риновирусы | Течение легкое. Симптомы поражения носоглотки. Обильная слизь на задней стенке ротоглотки. Сохраняется нормальная температура или отмечается незначительное ее повышение. | |
| 10% | B. pertussis, B. parapertussis | Инкубационный период 1 -3 недели. Чаще отмечается в подростковом и юношеском возрасте. Манифестирует «лающим» пароксизмальным кашлем. Лихорадка не характерна. Выраженный лейкоцитоз со сдвигом вправо. |
| M. pneumoniae | Часто - миалгии, головная боль. Фарингит. В отличие от гриппа - постепенное начало с 2-3-дневным ростом температуры. Вспышки характерны в детских и молодежных коллективах (детские сады, школы, ВУЗы). Часто отмечается выраженная немотивированная слабость. | |
| C. pneumoniae | Кашель нарастает постепенно. В предкашлевой период характерна охриплость голоса за счет ларингита и першение в горле вследствие фарингита. |
Более 200 вирусов могут вызывать ОРЗ, частота регистрации которых в России ежегодно достигает от 27 до 41 млн. В Москве ежегодно гриппом болеют около 2 млн. человек. Суммарные экономические потери по больничным листам и лечению оцениваются в 40 млрд. руб., составляя 80 % от всех затрат по инфекционным болезням (Маркова Т.П., 2009).
Биологические свойства вирусов, так же как и особенности других микроорганизмов, определяют поражение того или иного отдела респираторного тракта и, следовательно, клинические проявления заболевания. Результаты исследований свидетельствуют, что наиболее частыми возбудителями ОРИ с поражением нижних отделов респираторного тракта являются вирусы гриппа, парагриппа и респираторносинцитиальный вирус. Верхние отделы чаще поражаются коронавирусами, аденовирусами и энтеро- и риновирусами, вирусами простого герпеса 1 типа (ВПГ-1), вирусом Эпштейн-Барр, хотя нельзя полностью исключить их роль в поражении нижних отделов дыхательных путей. Например, в исследовании, проведенном Creer D.D. и соавт. (2006) у пациентов с инфекцией нижних дыхательных путей частота обнаружения риновирусов составила 33%, а вируса гриппа - только 24%.
При проведении исследований в отсутствие эпидемических вспышек менее чем в 10% случаев у пациентов с неосложненным течением ОРЗ находят бактериальную инфекцию. Доказано участие только следующих микроорганизмов: Bordetella pertussis, Bordetella parapertussis, Mycoplasma pneumoniae и Chlamydophila pneumoniae. В настоящее время не доказано, что этиологическими факторами ОРЗ могут являться Streptococcus pneumoniae, Haemophilus influenzae и Moraxella catarrhalis, однако они могут стать причиной развития суперинфекции.
Возраст пациента во многом обуславливает восприимчивость к различным группам вирусов, т.е. и этиология острых респираторных инфекций у детей с бронхиальной астмой различна в разные возрастные периоды (табл. 2).
Таблица 2
Респираторные вирусы как триггеры обострения бронхиальной астмы в различные возрастные периоды (Tuffaha A., Gern J.E., Lemanske R.F., 2000)
| Возраст | Респираторный вирус |
| До 5 лет | РС-вирус, вирусы парагриппа 1-3 типов, аденовирусы, коронавирус |
| С 5 до 16 лет | Риновирус, вирусы гриппа, парагриппа, РС-вирус |
| Старше 16 лет | Вирусы гриппа, риновирус, РС-вирус |
Наиболее значимыми в отношении патологии дыхательных путей у пациентов с бронхиальной астмой являются вирусы парагриппа 1-3 типов, гриппа, риновирусы, аденовирусы, РС-вирусы и др. Особая роль в развитии бронхиальной астмы отводится респираторно-синцитиальной (РС) вирусной инфекции. Это обусловлено тем, что РС-вирусная инфекция часто поражает детей первых лет жизни и из-за тропизма этого вируса к эпителию мелких бронхов и бронхиол является наиболее частой причиной бронхиолита. РС-вирусная инфекция способствует сенсибилизации организма к экзогенным аллергенам и часто предшествует развитию приступов бронхиальной астмы. По данным различных авторов, у 25-75% детей, перенесших вирусный бронхиолит в младшем возрасте, впоследствии развивается бронхиальная астма.
Если у детей первых лет жизни наибольшее значение в развитии обструкции бронхов уделяется респираторно-синцитиальным вирусам, то у детей дошкольного возраста - аденовирусам, у детей старшего возраста и подростков - риновирусам и вирусам гриппа, а у детей всех возрастных групп - вирусам парагриппа.
Многолетние наблюдения в нашей клинике подтверждают высокую заболеваемость респираторными инфекциями детей с атопической бронхиальной астмой. Нами было показано, что часто причиной интеркуррентных респираторных заболеваний у детей с бронхиальной астмой является инфекция, обусловленная двумя и более возбудителями (Балаболкин И.И., Булгакова В.А., 2002, 2008). При проведении комплексного обследования обнаружена высокая инфицированность детей с аллергическими болезнями дыхательных путей (бронхиальной астмой, аллергическим ринитом) вирусными и бактериальными респираторными возбудителями, имеющая в основном ассоциативный характер. Впервые было установлено, что в период обострения бронхиальной астмы и при тяжелом течении болезни отмечается наиболее высокое выявление вирусных и бактериальных инфекционных агентов на слизистой верхних дыхательных путей. Обнаружение цитомегаловируса, вируса Эпштейна-Барр в период обострения на фоне незначительного их выделения в целом у детей с астмой, а также более высокое обнаружение антигенов хламидийной и микоплазменной инфекции в период обострения болезни позволило нам предположить о персистенции этих возбудителей на фоне неадекватного иммунного ответа у детей с аллергией. Нами показано высокое инфицирование в целом детской популяции Mycoplasma pneumoniae и внутриклеточными патогенами семейства Chlamydiaceae, но при этом было установлено, что характер инфицирования у пациентов при атопической бронхиальной астме в отличие от детей без аллергической отягощенности имеет хроническую персистирующую форму и склонность к реинфицированию (Булгакова В.А., Зубкова И.В., 2008).
В последние годы группа препаратов, используемых специалистами для профилактики и лечения острых респираторных инфекций (ОРИ) постоянно растет, однако существенного прогресса в результатах лечения пока не отмечено. Возможности этиотропной противовирусной терапии острой респираторной инфекции в педиатрической практике, особенно для лечения пациентов с хроническими заболеваниями, в том числе с бронхиальной астмой, ограничены из-за токсичности большинства противовирусных препаратов. В связи с этим актуальным является разработка новых технологий и методов, сочетающих безопасность и эффективность проводимой терапии и профилактики.
Оптимальным методом иммунопрофилактики и иммунотерапии респираторных инфекций считается специфическая вакцинация против гриппа и пневмококковой инфекции, применение иммуномодуляторов микробного происхождения или бактериальных вакцин (Баранов А.А., Намазова-Баранова Л.С., Таточенко В.К., 2010). Однако возможности вакцинопрофилактики респираторных инфекций ограничены. Это обусловлено широким этиологическим спектром острых респираторных инфекций, в то время как эффективные и безопасные вакцины разработаны лишь против нескольких респираторных патогенов, таких как вирус гриппа, пневмококк и H. influenzae (тип b). Максимальное снижение заболеваемости респираторной инфекцией может быть достигнуто при сочетании вакцинации и иммунофармакотерапии, применения препаратов с комбинированным иммуномодулирующим и противовирусным действием (Костинов М.П. и соавт., 2007).
В настоящее время использование иммуномодуляторов рассматривают как один из перспективных способов профилактики респираторных инфекций. Известно, что острые респираторные вирусные инфекции часто вызывают депрессию иммунного ответа, что способствует возникновению реинфекции в период выздоровления ослабленного организма. Реинфекция создает дополнительную нагрузку на иммунную систему организма.
Риск реинфекции становится актуальным во время эпидемиологического подъема респираторной инфекции и особенно характерен для детей с хроническими заболеваниями, в том числе с аллергическими болезнями. Разнообразие и изобилие лекарственных средств, применяемых у детей, часто демонстрирует их временную, а иногда и сомнительную эффективность.
Основными требованиями при применении иммунофармакопрепаратов являются наличие у них иммуномодулирующего или иммуностимулирующего свойства, клинически доказанная высокая противовирусная эффективность, предпочтительное природное происхождение, безопасность, отсутствие привыкания, побочных и канцерогенных эффектов. Иммуномодуляторы не должны вызывать чрезмерную сенсибилизацию и индукцию иммунопатологических реакций, а также потенцировать их у других медикаментов. Необходимыми качествами приемлемости препарата также являются предсказуемость схемы метаболизма и путей выведения из организма, хорошая совместимость с другими лекарственными средствами, применяемыми при инфекционных и воспалительных заболеваниях. Предпочтительными качествами, кроме того, считается возможность легкой доставки препарата в область назначения и возможность его использования непарентеральным путём.
Иммуномодуляторы стимулируют защитные механизмы организма против возбудителей инфекционных заболеваний. В идеале, оптимальными иммуномодуляторами считаются вещества, принимающие участие в регуляции иммунных процессов в организме (цитокины) или их синтетические, либо рекомбинантные аналоги. Однако применение цитокинов лимитировано в связи с присущей цитокинам токсичностью, недостаточностью их фармакологического поведения и наличием плейотропных эффектов. Известно, что эффективность экзогенных цитокинов ограничена у лиц со сниженным иммунитетом, в связи с отсутствием соответствующих эффекторных клеток или наличием патогномоничных факторов заболевания, препятствующих активации лимфоцитов. Короткий период полужизни экзогенных цитокинов и необходимость их применения в высоких дозах для достижения терапевтического эффекта стимулирует исследователей к поиску наиболее приемлемых и адекватных иммуномодуляторов, принимающих участие в регуляции иммунных процессов в организме, обладающих хорошей переносимостью. К таким иммуномодуляторам можно отнести синтетические аналоги инозина, предшественниками которых являются природные пурины.
В последние годы большое значение в патогенезе болезней, в т.ч. аллергических, придается персистенции вирусов и других патогенных микроорганизмов (герпесвирусов, хламидии, микоплазмы и др.), способствующей изменению реактивности организма. Установлено, что и вирусы парагриппа, аденовирусы, РС-вирус могут длительное время персистировать в дыхательных путях человека. Полагают, что персистенция респираторных вирусов может вызывать и поддерживать длительное время гиперреактивность бронхов (Busse W.W., Gern J.E., 1997).
Таким образом, представленные данные отражают сложность проблемы профилактики и лечения респираторных инфекций у детей, в том числе с аллергической патологией, в связи с чем, перспективным представляется применение препаратов с комбинированным иммуномодулирующим и противовирусным действием.
Материально-техническое описание метода
К препаратам с комбинированным иммуномодулирующим и противовирусным действием относится Изопринозин (МНН: инозин пранобекс, Teva Pharmaceutical Industries Ltd).
Изопринозин (инозин пранобекс) зарегистрирован в Российской Федерации как иммуностимулирующее средство с противовирусным действием и разрешен для применения в педиатрической практике (регистрационный номер в РФ -П №015167/01 с датой оформления регистрационного удостоверения от 11.02.10). В ассоциированной ВОЗ международной анатомо-терапевтическо-химической классификации лекарственных средств (АТС) инозин пранобекс зарегистрирован в группе иммуномодуляторов (L) и противомикробных антивирусных препаратов (J) для системного использования.
Изопринозин выпускается в виде таблеток по 0,5 г активного вещества для приема внутрь. Максимальная концентрация изопринозина достигается через 1 ч после приема 1,5 г препарата, 1-й период полувыведения (50 мин) связан с выведением инозина и проходит с образованием мочевой кислоты, 2-й период полувыведения диметиламино-2-пропанол β-ацетамидо-бензоата равен 3-5 ч, при этом метаболиты выводятся почками.
Инозин пранобекс - синтетический аналог инозина, состоит из соли пара-ацетамидобензоевой кислоты и N,N-диметил-амино-2-пропанола и β-изомера инозина в соотношении 3:1, получен путем соединения инозина с вспомогательной молекулой, которая повышает доступность инозина для лимфоцитов, и таким образом, усиливает его иммуностимулирующие свойства. Инозин является природным пуриновым соединением, присутствующим в пище и входящим в состав некоторых важных веществ: пуриновых коэнзимов, высокоэнергетических фосфатных соединений (АТФ, ГТФ) и циклических пуриновых нуклеотидов. Инозин, обладая противовоспалительным, анаболическим, метаболическим, антигипоксическим и антиаритмическим свойствами, принимает участие в регуляции многих физиологических процессов в организме. Инозин пранобекс (изопринозин) восстанавливает и усиливает деятельность клеток иммунной системы, повышает способность организма эффективно противостоять инфекциям, обладает не только иммуномодулирующим, но и противовирусным (подтверждено in vivo и in vitro) действием.
Клинические исследования показали, что он хорошо переносится (практически неиммуногенный), что, по-видимому, обусловлено близостью (родственностью) составляющих препарата веществам, обнаруженным в организме.
Согласно инструкции среди побочных эффектов препарата: тошнота, рвота, диарея, гастралгия, обострение подагры, гиперурикемия, головокружение, слабость, головные боли, аллергические реакции. Однако за почти 40 летний период применения лекарственных аналогов инозин пранобекса во всем мире не зарегистрированы случаи серьезных побочных эффектов. При этом из менее 1,5 тыс. зарегистрированных случаев побочных эффектов среди 20 млн. пациентов, принимавших за эти годы препарат, основными были - транзиторное повышение концентрации мочевой кислоты в сыворотке крови и в моче.
Инозин пранобекс обладает прямым противовирусным действием, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной РНК. Противовирусное действие инозин пранобекса активно обсуждалось в ранних его исследованиях, и считалось главным свойством препарата. Однако в последующем на основании результатов многочисленных исследований действия препарата было показано, что наряду с антивирусным эффектом инозин пранобекс обладает свойствами иммуномодулятора. Таким образом, этиотропная противовирусная эффективность инозин пранобекса могла быть связана также с иммуномодулирующим действием препарата. По данным зарубежных авторов, после лечения инозин пранобексом клиническое улучшение наблюдалось в 89,6% изученных случаев (1573 из 1754 пациентов), иммунологическое улучшение было достоверно установлено в 93,1% изученных случаев (1273 из 1376 пациентов).
Инозин пранобекс, стимулируя дифференцировку Т-лимфоцитов в цитотоксические Т-клетки и Т-хелперы, а также повышая продукцию лимфокинов, стимулирует выработку интерлейкина IL1, IL2 и IFN-γ и функциональную активность NK-клеток. Инозин пранобекс также потенцирует морфофункциональную состоятельность нейтрофилов и моноцитов, усиливая хемотаксис макрофагов и фагоцитоз, тем самым нормализует клеточный иммунитет. В то же время, стимулируя дифференцировку В-лимфоцитов в плазматические клетки и повышая продукцию антител, нормализует гуморальный иммунитет. При этом происходит повышение концентрации иммуноглобулинов IgG, IgA и IgM, а также поверхностных маркеров комплемента и вирус-нейтрализирующих антител. Активизируя функцию иммунокомпетентных клеток, инозин пранобекс опосредованно подавляет синтез вирусной РНК, что сопровождается ингибированием вирусной репродукции.
Комплексное действие инозина пранобекса объясняет его успешное применение при различных, в том числе трудно поддающихся терапии, инфекционных заболеваниях. В течение многих лет препарат успешно используют для лечения герпесвирусных инфекций, кори, эпидемического паротита, вирусных гепатитов, папилломавирусной инфекции, подострого склерозирующего панэнцефалита и др.
Противовирусная активность Изопринозина (инозин пранобекса) доказана в отношении герпесвирусов: вируса простого герпеса, цитомегаловируса, вируса Эпштейна-Барр (Симованьян Э.Н. и соавт, 2007). В опытах in vitro и in vivo доказано наличие у препарата умеренной противовирусной активности в отношении вирусов гриппа, РС-вируса, парагриппозных вирусов (Осидак Л.В. и соавт., 2008). Показано, что инозин пранобекс обладает противовирусным действием в отношении вирусов гриппа А и В. Ингибирующее влияние препарата на репродукцию вирусов гриппа выявлено как при предварительной обработке культуры клеток (профилактический режим), так и при внесении препарата непосредственно после инфицирования клеток (терапевтический режим).
Лечебно-профилактическая эффективность Изопринозина (инозин пранобекса), в том числе при наличии осложненного преморбидного фона (у часто болеющих детей, пациентов с аллергией, с хроническими инфекциями ЛОР-органов и респираторного тракта) была продемонстрирована в многоцентровом постмаркетинговом исследовании в рамках программы «Здоровый ребенок», проведенном в 13 городах РФ (2007) с участием 2503 детей в возрасте 1 года и старше с ОРИ. Назначение препарата в терапии ОРИ способствовало сокращению симптомов и общей продолжительности заболевания. Применение Изопринозина способствовало достоверному снижению заболеваемости ОРИ еще до 4 месяцев после одного курса терапии, но увеличение курсов до 3-х статистически значимо уменьшало частоту возникновения повторных случаев респираторных инфекций.
Мета-анализ оценки клинической и иммунологической эффективности инозин пранобекса при респираторных инфекциях у иммунокомпрометированных пациентов по данным 10 опубликованных исследований, в которых 2500 пациентам (детям и взрослым) инозин пранобекс использовался с лечебно-профилактической целью, свидетельствует об эффективности иммунотерапии инозин пранобексом (Мынбаев О.А. и др.). Показано снижение частоты новых эпизодов ОРИ при профилактическом режиме назначения инозин пранобекса, уменьшение тяжести и укорочение длительности проявления вирусных респираторных инфекции при назначении его в лечебном режиме на фоне восстановления морфофункциональной потенции иммунной системы.
Учитывая иммуномодулирующий и противовирусный эффекты Изопринозина (инозин пранобекса), в частности, при острых респираторных вирусных инфекциях у детей, нами проведена оценка его клинико-иммунологической эффективности при назначении детям с атопической бронхиальной астмой и частыми острыми респираторными инфекциями.
Описание и эффективность использования метода
Применение Изопринозина (инозин пранобекса) у детей с атопической бронхиальной астмой для лечения острых респираторных инфекций.
Под нашим наблюдением находилось 60 детей со среднетяжелым персистирующим течением атопической БА в возрасте от 5 до 14 лет. Методом простой рандомизации были сформированы две группы по 30 пациентов: основная группа, получавшие при ОРИ Изопринозин (ИП), и группа сравнения, получившие при ОРИ только симптоматическую терапию. ИП назначали внутрь в лечебных дозах из расчета 50 мг/кг массы тела на 3 или 4 приема (в зависимости от суточной дозы) в течение 5-7 дней. При этом исключалось использование противовирусных препаратов (ремантадин и др.), применяемых для лечения гриппа или других острых респираторных вирусных инфекций. Эффективность препарата оценивалась по срокам уменьшения симптомов интоксикации, катаральных явлений, клинических проявлений болезни, данных лабораторного исследования, свидетельствующих об активности патологического процесса, элиминации вирусов со слизистой полости носа, данных иммунного статуса. ИП использовался в период лечения острых респираторных заболеваний у пациентов, находящихся на стационарном и амбулаторном лечении в НЦЗД РАМН. До лечения и сразу после окончания приема ИП проводили определение вирусных антигенов в мазках носоглоточных смывов у всех наблюдавшихся пациентов иммунофлюоресцентным методом. Активность накопления вирусного антигена в организме больного ребенка оценивалась путем морфометрического анализа результатов иммунофлюоресцентного исследования. В динамике до лечения и через 2 недели после окончания терапии острой респираторной инфекции проводили оценку показателей цитокинового статуса в сыворотке крови иммуноферментным методом (ELISA) - определение содержания IL4, IL5, IL8, IL12, определение уровней TNFα и IFNγ, растворимых мембранных рецепторов иммунокомпетентных клеток sCD4, sCD25, sCD30; исследовали антительный иммунный ответ определением в сыворотке крови уровней IgG, A, M методом лазерной нефелометрии и общего IgE методом ELISA, с использованием коммерческих наборов реактивов. Нормативные значения исследуемых показателей были получены в лабораториях НИИ педиатрии НЦЗД РАМН.
Результаты
Этиология ОРВИ установлена у 93,3% из всех наблюдавшихся пациентов, в том числе у половины обследованных детей выявлена смешанная вирусная инфекция. Преимущественно диагностированы грипп (в т.ч. грипп типа А1, А2, В), парагрипп, аденовирусная инфекция (преимущественно серотипы 1, 2, 5, 3, 6, 7). Повторное вирусологическое обследование детей после окончания лечения в обеих группах выявило сохранение различных респираторных вирусов, хотя в группе пролеченных изопринозином отмечена тенденция к снижению числа тестируемых у них вирусов и частоты выявления смешанной респираторно-вирусной инфекции с 46,7% до 26,7% (табл. 3). Морфометрический показатель активности вирусной инфекции снизился в 1,2 раза.
Таблица 3
Динамика результатов вирусологического исследования смывов из носа и зева
| Изучаемые группы | Вирусы | До лечения | После лечения | ||
| Абс. | % | Абс. | % | ||
| 1. Основная группа n=30 | Грипп А1 | 14 | 46,7 | 11 | 36,7 |
| Грипп А2 | 3 | 10 | 2 | 6,7 | |
| Грипп В | 1 | 3,3 | 1 | 3,3 | |
| Парагрипп 1-3 | 10 | 33,3 | 10 | 33,3 | |
| РС | 6 | 20 | 5 | 16,6 | |
| Аденовирусы | 9 | 30 | 8 | 26,7 | |
| Всего с подтвержденной респираторно- вирусной инфекцией | 29 | 96,7 | 29 | 96,7 * | |
| В том числе со смешанной | 14 | 46,7 | 8 | 26,7 # | |
| 2. Группа сравнения n=30 | Грипп А1 | 11 | 36,7 | 10 | 33,3 |
| Грипп А2 | 3 | 10 | 2 | 6,7 | |
| Грипп В | 1 | 3,3 | 1 | 3,3 | |
| Парагрипп 1-3 | 15 | 50 | 12 | 40 | |
| РС | 5 | 16,6 | 5 | 16,6 | |
| Аденовирусы | 10 | 33,3 | 10 | 33,3 | |
| Всего с подтвержденной респираторно- вирусной инфекцией | 27 | 90 | 27 | 90,0 * | |
| В том числе со смешанной | 16 | 53,3 | 13 | 43,3 * | |
| Всего, n=60 | Всего с подтвержденной респираторно- вирусной инфекцией | 56 | 93,3 | ||
| В том числе со смешанной | 30 | 50,0 |
обозначение звездочкой * - p>0,05 и решеткой # - p<0,01 - достоверность различий между частотой выявления инфекционных антигенов у обследованных пациентов по сравнению с их исходными данными.
Результаты клинического мониторинга свидетельствуют о более легком течении гриппа и ОРВИ у детей, получавших ИП. Так, длительность лихорадки в группе сравнения была дольше, чем в основной группе, причем у всех - свыше 2 дней, а у почти трети - до 4 дней и более. В основной группе у 27 (90%) больных детей продолжительность лихорадки была не более 2-х дней (табл. 4).
Таблица 4
Клиническая характеристика течения ОРВИ
| Вирусы | Основная группа, n=30 | Группа сравнения, n=30 | |||
| Абс. | % | Абс. | % | ||
| Температурная реакция | >38,5 | 1 | 3,3 | 1 | 3,3 |
| 38,4-37,5 | 14 | 46,7 | 10 | 33,3 | |
| <37,5 | 15 | 50 | 19 | 63,3 | |
| Продолжительность лихорадки (дни) | 1 | 6 | 100/2* | 30 | 0 |
| до 2 | 21 | 100/2* | 30 | 73,3 | |
| до 4 и более | 3 | 70/2* | 26 | 26,7 | |
| Симптомы интоксикации (Абс.%/дни) | Головная боль | 30 | 96,7 | 29 | 100/5 |
| Слабость | 30 | 46,7 | 8 | 100/5 | |
| Боли в мышцах | 1121 | 36,7 | 10 | 87/4 | |
| Катаральные симптомы (Абс.%/дни) | Слезотечение | 5 | 16,7/4 | 6 | 20/6 |
| Насморк | 24 | 80/4 | 27 | 90/6 | |
| Кашель | 26 | 86,7/5 | 24 | 80/7 | |
| Одышка | 12 | 40/2 | 14 | 46,7/3 | |
обозначение звездочкой * - p <0,05 - достоверность различий между показателями сравниваемых групп.
Выраженность температурной реакции, катаральных симптомов и признаков интоксикации в обеих группах была практически одинаковой, однако длительность в группе сравнения в 1,5-2 раза дольше (p<0,05).
При клиническом исследовании периферической крови и мочи, исследовании биохимических показателей крови, в том числе билирубина, трансаминаз, щелочной фосфатазы, концентрации мочевой кислоты, каких-либо отклонений от нормы изучаемых показателей не возникало.
Выявленный характер исходных изменений в содержании сывороточных маркеров активации иммунокомпетентных клеток sCD4, sCD25 и sCD30 у обследованных детей отражает активацию Тh2-лимфоцитов, характерную для атопии, и свидетельствовует о супрессии Тh1-ответа, наиболее выраженные при длительном и тяжелом течении астмы. Обнаруженное в нашем исследовании снижение уровня sCD25 при достаточном или даже повышенном содержании хелперов (sCD4), характеризующем тяжесть аллергического процесса, отражается, прежде всего, на тех иммунных механизмах, которые в первую очередь необходимы для элиминации как аллергенов, так и инфекционных агентов: формировании специфического иммунного ответа, стимуляции нейтрофилов, макрофагов, NK-клеток. У всех детей, получавших ИП, отмечалось достоверное повышение sCD4+, sCD25, IL12 и IL8 (р<0,05) и уменьшение sCD30, TNFα (р<0,05) после приема препарата. Отмечалась тенденция к незначительному понижению IL4, IL5 (р>0,05). Выявлялось достоверно значимое увеличение концентрации IFNγ (р<0,001), сохранявшееся и в период реконвалесценции ОРИ (табл. 5). Вероятно, достигаемый применением ИП терапевтический эффект при бронхиальной астме связан с активацией Тh1-иммунного ответа, проявляемой повышением продукции IFNγ и IL12, которые вызывают пролиферацию NК-клеток, оказывающих противовирусное действие.
Таблица 5
Динамика концентрации IFN γ у детей до и после лечения (M±m, пг/мл)
| До лечения | Через 7 дней | Через 15 дней | |
| Основная группа, n=30 | 0,18±0,07 | 5,1±0,6*# | 5,4±0,5*# |
| Группа сравнения, n=30 | 0,13±0,04 | 0,9±0,1 | 1,3±0,1 |
| Здоровые дети | 9,6±0,9 |
* - р<0,05 по сравнению с группой сравнения;
#- р<0,001 по сравнению с исходными данными.
Оценка безопасности проводилась на основании учета нежелательных побочных явлений и отклонений лабораторных показателей, принимая во внимание степень их выраженности, серьезность, длительность и возможную связь с ИП. Выбывших из исследования по указанным выше критериям, в том числе в связи с нежелательными побочными явлениями не было. По результатам опроса у 1 больного отмечено возникновение жалоб на боли в животе и расстройства стула, но препарат не был отменен и более детальный расспрос выявил наличие других факторов, которые могли явиться причиной этих явлений. При применении ИП побочных действий препарата отмечено не было, переносимость была хорошей.
Выводы
1. Применение Изопринозина (инозин пранобекса) способствует уменьшению проявлений ОРВИ и длительности симптомов при атопической бронхиальной астме у детей и предупреждает развитие вызываемых ими обострений бронхиальной астмы.
2. Лечение Изопринозином способствует снижению выявления в носоглотке детей с атопической бронхиальной астмой антигенов респираторных вирусов.
3. Достигаемый применением Изопринозина (инозин пранобекса) терапевтический эффект при бронхиальной астме может быть связан с активацией Тh1-иммунного ответа, проявляемой повышением продукции IFNγ и IL12, которые вызывают пролиферацию NК-клеток, оказывающих противовирусное действие.
Таким образом, в результате проведенного нами исследования по данным клинических наблюдений и результатов лабораторных исследований доказана эффективность и безопасность препарата Изопринозин (инозин пранобекс). Применение иммуномодулятора с противовирусной активностью Изопринозина в период острой респираторной инфекции у детей с атопической бронхиальной астмой способствует уменьшению длительности интоксикации и катаральных явлений, элиминации вирусных агентов. Прием Изопринозина предотвращает развитие осложнений и обострение аллергической патологии на фоне острой респираторной инфекции.
Применение Изопринозина (инозин пранобекса) у детей с атопической бронхиальной астмой для профилактики респираторных инфекций
Для исследования эффективности исследуемого препарата нами были отобраны пациенты с атопической бронхиальной астмой (БА), получающие базисную терапию: с частыми острыми респираторными инфекциями (более 5 раз в год) и связанными с ними обострениями бронхиальной астмы (вне острого респираторного заболевания); с рецидивирующими инфекциями ЛОР-органов - отитом, гайморитом, тонзиллитом, аденоидитом; с отсутствием показаний для проведения аллергенспецифической иммунотерапии.
Под нашим наблюдением находились 37 детей со среднетяжелым персистирующим течением атопической БА в возрасте от 4 до 15 лет, 26 из которых получали препарат внутрь в профилактической дозе из расчета по 50 мг/кг в сутки на 2-3 приема в день в течение 14 дней. Группу сравнения составили 11 детей, не получавшие иммунофармакопрофилактики. При этом в обеих группах исключалось использование других иммунных препаратов, в т.ч. вакцинации, противовирусных и антибактериальных препаратов за 12 недель до начала исследования и в период исследования. У всех детей отмечались частые инфекционные заболевания органов дыхания: средняя заболеваемость острыми респираторными инфекциями составила 8,4±0,6 раз в год в основной группе, 8,2±0,6 - в группе сравнения. Обострения бронхиальной астмы были связаны с присоединением респираторной инфекции. У всех обследованных детей была выявлена слабая поливалентная сенсибилизация.
Родители каждого ребенка были проинформированы об особенностях исследования и были согласны на его проведение, велось наблюдения за самочувствием ребенка, отмечались частота и причина обострений бронхиальной астмы, частота и тяжесть ОРИ, наличие или отсутствие сопутствующего бронхообструктивного синдрома.
У всех наблюдавшихся пациентов в динамике (до и через одну неделю после окончания терапии) проводили определение вирусных антигенов в мазках носоглоточных смывов иммунофлюоресцентным методом и бактериологическое исследование микрофлоры слизистой носоротоглоточной области классическим полуколичественным методом.
Анализ показателей иммунного статуса включал оценку показателей цитокинового статуса в сыворотке крови иммуноферментным методом (ELISA) - определение содержания IL4, IL5, IL8, IL12, определение уровней TNFα и IFNγ, эотаксина, растворимых мембранных рецепторов иммунокомпетентных клеток sCD4, sCD25, sCD30, sCD95, sCD54, sCD62E; исследование антительного иммунного ответа определением в сыворотке крови уровней IgG, IgA, IgM методом лазерной нефелометрии и общего IgE методом ELISA, с использованием коммерческих наборов реактивов. Нормативные значения исследуемых показателей были получены в лабораториях НИИ педиатрии НЦЗД РАМН.
В течение 12 месяцев после лечения в обеих группах регистрировались частота интеркуррентных острых респираторных инфекций, число обострений заболеваний ЛОР-органов, а также средняя продолжительность острого периода инфекционных заболеваний и обострений бронхиальной астмы.
Результаты
В результате комплексного исследования обнаружена высокая инфицированность детей с бронхиальной астмой вирусными и бактериальными респираторными возбудителями, имеющая в основном ассоциативный характер. Вирусологическое исследование выявило антигены респираторных вирусов и возбудителей оппортунистических инфекций (герпесвирусной инфекции, микоплазмоза, хламидиоза), микробиологическое обследование обнаружило интенсивную микробную колонизацию слизистых оболочек носоглотки Staphilococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Haemophуlus influenzae, Moraxella catarrhalis у большинства обследованных детей. Поскольку исследования выполнялось полуколичественным методом, это позволило наблюдать в динамике (до и через неделю после окончания иммунотерапии) процесс эрадикации возбудителей со слизистой верхних дыхательных путей (табл. 6), который имел явную позитивную динамику у пациентов, получавших изопринозин, нежели у группы сравнения.
Таблица 6
Динамика результатов вирусологического исследования смывов из носа и зева
| Возбудители | Вирусы | |||
| Основная группа, n=26 | Группа сравнения, n=11 | |||
| до | после | до | после | |
| Вирусы гриппа (А1, А2, В) | 7 (27%) | 3 (12%)* | 3 (27%) | 3 (27%) |
| Вирусы парагриппа 1-3 типы | 11 (42%) | 7 (27%)* | 5 (45%) | 4 (36%) |
| РС-вирус | 6 (23%) | 4 (15%) | 3 (27%) | 3 (27%) |
| Аденовирусы (I-III пулы) | 8 (31%) | 5 (19%)* | 4 (36%) | 3 (27%) |
| Вирус простого герпеса 1 типа (HHV-1) | 26 (100%) | 22 (85%)* | 9 (91%) | 11 (91%) |
| Цитомегаловирус (HHV-5) | 4 (15%) | 1 (4%)* | 0 | 0 * |
| Вирус Эпштейна-Барр (HHV-4) | 4 (15%) | 2 (8%)* | 1 (9%) | 1 (9%) |
| Вирус герпеса 6 типа (HHV-6) | 0 | 0 | 0 | 0 |
| Chlamydia pneumoniae | 8 (31%) | 5 (19%)* | 3 (27%) | 3 (27%) |
| Mycoplasma pneumoniae | 11 (42%) | 7 (27%)* | 4 (36%) | 4 (36%) |
| Staphilococcus aureus | 12 (46%) | 8 (31%) | 5 (45%) | 5 (45%) |
| Streptococcus pneumoniae | 6 (23%) | 4 (15%) | 4 (36%) | 3 (27%) |
| Streptococcus pyogenes | 5 (19%) | 1 (4%) * | 1 (9%) | 1 (9%) |
| Haemophilus influenzae | 3 (12%) | 1 (4%) * | 1 (9%) | 1 (9%) |
| Moraxella catarrhalis | 4 (15%) | 2 (8%)* | 1 (9%) | 1 (9%) |
*p<0,05 - по сравнению с исходными значениями.
Клинический эффект от применения ИП отмечался у 23 детей (88,5%) и заключался в снижении частоты и длительности интеркуррентных острых респираторных вирусных инфекций у детей в основной группе в 1,5 раза (p<0,05) и обострений бронхиальной астмы в 1,7 раза (табл. 7).
Таблица 7
Оценка клинической эффективности иммунопрофилактики изопринозином у обследованных детей
| Показатель | Группы пациентов | |||
| Основная группа, n=26 | Группа сравнения, n=11 | |||
| до | после | до | после | |
| Среднее число острых респираторных инфекций (ОРИ) | 8,4±0,6 | 5,6±0,4*# | 8,2±0,6 | 7,6±0,5 |
| Число ОРИ с осложнениями (отиты, трахеобронхиты) | 4,4±0,6 | 2,0±0,4*# | 4,2±0,6 | 3,9±0,6 |
| Число дней ОРИ в году на одного больного | 28,6±4,3 | 13,3± 1,9*# | 25,6±4,5 | 23,5±1,9 |
| Средняя продолжительность ОРИ в днях | 8,8±0,9 | 5,9±0,5* | 9,3±1,4 | 9,1±0,9 |
| Число детей, лечившихся антибиотиками | 64,7% | 41,2%* | 40% | 40% |
| Среднее число обострений бронхиальной астмы в связи с ОРИ | 7,8±0,8 | 4,5±0,6*# | 7,3±0,5 | 6,9±0,4 |
| Среднее число обострений бронхиальной астмы без связи с ОРИ | 11,8±1,6 | 8,6±0,8* | 10,0±1,3 | 9,6±1,8 |
p<0,05 - по сравнению с исходными значениям; # p<0,05 - по сравнению с группой сравнения.
Этих изменений не отмечалось у больных в группе сравнения. Несколько сократилось число обострений бронхиальной астмы, не связанных с интеркуррентными респираторными инфекциями, что можно объяснить действием препарата на иммунный ответ пациентов. Кроме того, применение ИП способствовало снижению заболеваемости инфекциями ЛОР-органов у детей основной группы в 2,2 раза — с 4,4±0,6 до 2,0±0,4 раз в год (p<0,05), в то время как в группе сравнения заболеваемость изменилась с 4,2±0,6 до 3,9±0,6 раз за год, что не являлось статистически достоверным.
В группе пациентов, пролеченных ИП, достоверно сократилась средняя продолжительность течения острых респираторных заболеваний, уменьшилось число детей, получавших антибиотики при интеркуррентных респираторных инфекциях.
Наряду с клиническим улучшением терапия исследуемым препаратом сопровождалась положительными изменениями в иммунном статусе, которые выражались в повышении содержания sCD4, sCD25, значительном повышении уровня IFNγ, снижении концентрации sCD30, sCD95, TNFα (табл. 8-10).
Таблица 8
Динамика концентрации цитокинов в сыворотке крови у обследованных детей (М±m)
| Показатель | IL12 M±m, Е/мл | INF γ | IL4 M±m, пг/мл | IL5 M±m, пг/мл | ||||
| до | после | до | после | до | после | до | после | |
| Основная группа, n=26 | 15,9 ±1,6 | 18,8 ±1,9* | 0,8± 0,06 | 5,4 ±0,4** | 32,1±3,1 | 22,4 ±2,3* | 24,5 ±2,3 | 20,4 ±0,18 |
| Группа сравнения, n=11 | 16,3 ±1,7 | 16,9 ±1,6 | 0,9± 0,08 | 1,1±0,1 | 28,9±3,1 | 25,4 ± 2,8 | 23,9±2,2 | 22,3 ±2,0 |
| Здоровые дети | 25,6±0,3 | 9,6±0,9 | 20,8±0,21 | 2,77±0,2 | ||||
* - р<0,05, ** - р<0,001 по сравнению с исходными данными.
Таблица 9
Динамика концентрации сывороточных маркеров активации и апоптоза иммунокомпетентных клеток в сыворотке крови у обследованных детей (М±m)
| Показатель | sCD4+ M±m, пг/мл | sCD25 M±m, Е/мл | sCD30 M±m, Е/мл | sCD95 M±m, пг/мл | ||||
| до | после | до | после | до | после | до | после | |
| Основная группа, n=26 | 17,2 ±0,17 | 19,3 ±0,19* | 730,0 ±64,2 | 800,4 ±88,2* | 61,2 ±5,9 | 50,1 ±5,6* | 534,4 ±43,6 | 520,19 ±44,8* |
| Группа сравнения, n=11 | 18,1 ±0,19 | 18,7 ±0,2 | 729,7 ±60,2 | 731,5 ±63,1 | 60,3 ±6,2 | 59,6 ±6,4 | 539,6 ±51,1 | 531,19 ±54,1 |
| Здоровые дети | 0,38±0,01 | 823,0±107,03 | 34,4±0,3 | 400,5±4,9 | ||||
* - р<0,05 по сравнению с исходными данными.
Таблица 10
Динамика концентрации TNFα , хемокинов и молекул межклеточной адгезии в сыворотке крови у обследованных детей (М±m)
| Показатель | TNF-α | IL8 М±m, пг/мл | Эотаксин М±m, пг/мл | sCD54 М±m, пг/мл | sCD62E М±m, пг/мл | |||||
| до | после | до | после | до | после | до | после | до | после | |
| Основная группа, n=26 | 27,9±2,5 | 16,6±1,9** | 30,5±3,2 | 27,9±2,5 | 16,6±1,9** | 5,7±0,56 | 4,51±0,46* | 4,51±0,46* | 106,4±11,81 | 91,78±9,73* |
| Группа сравнения, n=11 | 25,5±2,4 | 21,27±1,9 | 29,9±3,0 | 25,5±2,4 | 27,3±1,9 | 4,83±0,48 | 4,12±0,42 | 4,12±0,42 | 105,2±12,0 | 100,0±11,6 |
| Здоровые дети | 3,03±1,13 | 3,61±0,42 | 18,4± 1,1 | 2,28±0,84 | 63,7±0,58 | |||||
* - р<0,05, ** - р<0,001 по сравнению с исходными данными.
Выявленные в ходе исследования изменения связаны, очевидно, с нормализующим влиянием ИП на функциональное состояние макрофагов и синтез ими цитокинов - IL12 и IFNγ. Повышение уровня IL12 и IFNγ может быть обусловлено способностью препарата активизировать функцию Th1 -клеток, усиливая тем самым неспецифическую резистентность организма к инфекциям. Эти свойства препарата, очевидно, способствовали активации противовирусного и противомикробного иммунитета, что проявилось в уменьшении частоты интеркуррентных ОРИ и сопутствующей инфекционной патологии респираторного тракта. На фоне лечения ИП отмечалась тенденция к нормализации уровня IL4, что наряду тенденцией к уменьшению sCD30 способствует уменьшению атопических проявлений у детей с бронхиальной астмой, вероятно, воздействуя на иммунный ответ в направлении нормализации соотношения Тh1/Тh2-клеток.
После терапии ИП отмечалось снижение концентрации sCD62E (p<0,05) и тенденция к уменьшению содержания sCD54 в сыворотке крови (табл. 10). Эти изменения могут быть также связаны с нормализующим влиянием препарата на функциональную активность макрофагов и продукцию ими TNFα . Под влиянием уменьшения синтеза TNFα происходит ингибирование продукции факторов миграции лейкоцитов, что, соответственно, способствует уменьшению воспалительных изменений на слизистых оболочках респираторного тракта. Незначительные изменения уровней IL5 и эотаксина свидетельствует о выраженном аллергическом воспалительном процессе у обследуемых детей с астмой.
При оценке показателей антительного ответа на фоне иммунотерапии отмечалось повышение концентрации IgG в сыворотке крови (p<0,05), тенденция к повышению уровня IgA, сниженного до лечения, а также тенденция к нормализации содержания IgE (табл. 11). Данные изменения наблюдались только у детей, получавших исследуемый препарат, но не были выявлены у больных из группы сравнения. Повышение уровня IgG у часто болеющих ОРИ детей с бронхиальной астмой может свидетельствовать о повышении противоинфекционной гуморальной защиты. IgG-антитела, являясь важным фактором борьбы с внутриклеточными возбудителями, опсонизируют пораженные клетки, делают их доступными для антителозависимого клеточного цитолиза и фагоцитоза, активируют макрофаги для разрушения инфицированных клеток.
Таблица 11
Динамика концентрации иммуноглобулинов А, М, G и общего иммуноглобулина Е в сыворотке крови у обследованных детей (M±m)
| Показатель | Ig A M±m, г/л | Ig M M±m, г/л | Ig G M±m, г/л | Ig E M±m, МЕ/мл | ||||
| до | после | до | после | до | после | до | после | |
| Основная группа, n=26 | 1,19±0,11 | 1,32±0,13* | 1,79±0,16 | 1,85±0,2 | 11,98±2,3 | 13,86±2,41* | 330,2±29,4 | 300,4± 28,5 |
| Группа сравнения, n=11 | 1,20±0,12 | 1,21±0,14 | 1,81±0,2 | 1,83±0,22 | 11,48±2,4 | 12,0±2,5 | 350,6±34,2 | 320,0± 30,4 |
| Здоровые дети | 1,42±0,30 | 1,07±0,30 | 10,99±1,60 | До 150 | ||||
* - р<0,05 по сравнению с исходными данными.
Переносимость Изопринозина у детей с бронхиальной астмой была хорошей. Каких-либо побочных действий препарата, отклонений от нормы клинических и биохимических показателей крови и мочи нами не отмечено.
В патогенезе аллергических болезней, в том числе атопической бронхиальной астмы, вторичная иммуносупрессия занимает важное место, в развитии которой предполагается нарушение апоптотических процессов, в частности связанная с эффектом негативной активации (Караулов А.В., 1998; Ковальчук Л.В. и соавт., 1998; Порядин Г.В. 1999; Смирнов И.Е., 2005). Это показано и в наших собственных исследованиях (Булгакова В.А., Балаболкин И.И., 2008).
Иммунологические изменения у обследованных детей с атопической бронхиальной астмой отражают стойкую активацию Th2-лимфоцитов и свидетельствуют о супрессии Th1-ответа и являются предрасполагающим фактором, способствующим инфицированию, а также персистированию возбудителей респираторных инфекций, что в свою очередь, создавая порочный круг способствует формированию иммуносупрессии у пациентов с атопической бронхиальной астмой и склонности их к частым респираторным инфекциям.
Таким образом, клинические результаты профилактической эффективности инозин пранобекса, по-видимому, являются как следствием ингибирующего влияния препарата на репродукцию возбудителей, вызывающих респираторные инфекции, так и способностью активизировать функцию Th1-клеток, усиливая тем самым неспецифическую резистентность организма к инфекциям. Эти свойства, очевидно, способствовали активации противовирусного и противомикробного иммунитета, что проявилось в уменьшении частоты интеркуррентных острых респираторных заболеваний и сопутствующей инфекционной патологии респираторного тракта у пролеченных детей.
После курса Изопринозина у всех детей, посещающих образовательное учреждение, отмечалось снижение в 1,5 раза пропусков занятий по причине ОРИ (рис. 1).
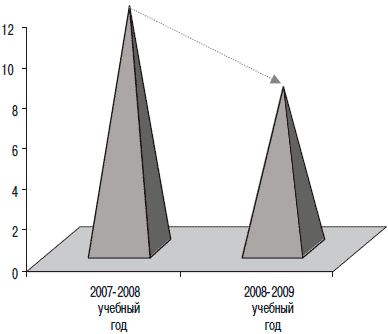
Рис 1. Дни пропусков по причине ОРИ.
Выводы:
1. Применение Изопринозина (инозин пранобекса) позволяет снизить частоту и длительность интеркуррентных острых респираторных инфекций и связанных с ними обострений бронхиальной астмы.
2. Изопринозин (инозин пранобекс) оказывает позитивное влияние на иммунный ответ, в частности на функциональное состояние макрофагов и синтез ими цитокинов - IL12 и IFNγ, активацию Th1-клеток, усиливая тем самым неспецифическую резистентность организма к инфекциям, активацию противовирусного и противомикробного иммунитета.
3. Отмечаемое под влиянием Изопринозина (инозин пранобекса) усиление продукции IFNγ способствует снижению активности Th2-клеток и вторично - уменьшению продукции sCD30, IL4, IL5, TNFα, IgE снижению выраженности хемотаксиса эозинофилов, аллергического воспаления в бронхах и уменьшению клинических проявлений бронхиальной астмы.
Заключение
Изопринозин (инозин пранобекс) является эффективным иммуномодулирующим препаратом, удобным для использования в детском возрасте, хорошо переносимым, не дающим побочных эффектов, что позволяет широко применять его в педиатрической практике, в том числе у детей с бронхиальной астмой и другими аллергическими заболеваниями, часто болеющими острыми респираторными инфекциями.
Рекомендуемые дозы:
При острой респираторной вирусной инфекции Изопринозин (инозин пранобекс) рекомендуется в противовирусной дозе из расчета 50-100 мг/кг в сутки, разделенных на 3-4 приема в течение всего острого периода болезни (от 5 до 10 дней в зависимости от длительности вирусемии и выраженности синдрома интоксикации).
Для профилактики респираторных инфекций и восстановления иммунологических показателей, уменьшения астении после перенесенных острых инфекционных респираторных заболеваний Изопринозин (инозин пранобекс) назначается по иммуномодулирующей схеме 50 мг/кг в сутки, разделенных на 2-3 приема в течение 2 недель. При необходимости курс повторяют или продлевают при обязательном соблюдении перерыва в приеме препарата в течение 8-10 дней.
