Helicobacter pylori - все-таки нехороший микроб
СтатьиОпубликовано в журнале:
Международный Медицинский Журнал »» № 6/2002
Джеймс Фокс, Тимоти Вонг
Массачусетский Технологический институт, г. Кембридж, штат Массачусетс;Медицинский центр Массачусетского университета, г. Ворчестер, штат Массачусетс, США
В общемировой статистике, охватывающей случаи всех злокачественных болезней, рак желудка занимает второе место по частоте и второе место по числу смертельных исходов. С 1982 года, то есть со времени, когда Marshall и Warren открыли Helicobacter pylori, подозревается связь между этой бактерией и раком желудка. Прошло 10 лет, и несколько исследований с группами контроля выявили связь между Н. pylori и раком путем анализа сохраняемых образцов сыворотки с применением иммуносорбентной реакции с энзимами (ELISA), но итоговые относительные величины были довольно небольшими. В этих начальных сообщениях только 60% случаев рака желудка могли быть отнесены на счет инфекции Н. pylori [1]. Хотя Всемирная организация здравоохранения и Международное агентство по исследованиям рака в 1994 году отнесло Н. pylori к первому классу канцерогенных факторов, но в то время еще не было исследований на животных, подтверждающих гипотезу, что инфицирова-ние желудка Н. pylori может вызвать злокачественную трансформацию.
Коме того, не было известно, сокращает ли долговременный риск рака желудка терапия против Н. pylori. Некоторые исследователи сомневались в важной роли инфекции Н. pylori в генезе рака желудка, и появились голоса, возражавшие против искоренения Н. pylori у всех больных или у всех подряд. Было достигнуто согласие о том, что терапия против Н. pylori должна рассматриваться как лечение первой линии при пептической язве. Но вот диспепсия неязвенного происхождения не ослабевала у значительного числа больных после искоренения Н. pylori. В нескольких работах даже было предположено, что у некоторых больных устранение инфекции Н. pylori могло усилить гастроэзофагеальный рефлюкс, что чревато дополнительным риском развития рака пищевода.
Многие из этих сомнений насчет связи Н. pylori и рака желудка теперь можно не принимать во внимание. Исследование Uemura с соавт. [2] является одним из первых долговременных проспективных исследований инфицированных и неинфицированных пациентов с диспепсией, которым проводилась эндоскопия, и у которых развитие рака желудка принималось в качестве конечного показателя. Важно отметить, что инфекция Н. pylori оценивалась при этом тремя различными способами. В этом исследовании, охватывавшем 1526 больных в Японии, рак желудка развился примерно у 3% инфицированных больных и ни у кого из неинфицированных. Повышение риска отмечено во всех подгруппах больных (с язвами желудка, с гиперпластическими полипами и с неязвенной диспепсией), за исключением больных с язвами двенадцатиперстной кишки. Хотя гистологическое исследование ограничивалось только двумя биоптатами желудка при каждом обследовании больных, но и на таком материале было показано, что риск рака желудка четко связан и с конкретными типами гистологической картины, полученной при начальной эндоскопии. К этим типам относились: тяжелая желудочная атрофия, преимущественно-корпусный гастрит и инте-стинальная метаплазия [2].
Данное исследование предоставляет веские аргументы в пользу связи Н. pylori и рака желудка. Накапливается все больше данных о том, что поиск Н. pylori одним методом, например, с помощью серологических реакций, приводит в значительной недооценке распространенности инфекции. В недавнем исследовании в Швеции [3] применялся не только традиционный анализ ELISA, но также и тест на наличие антител против протеина CagA Я. pylori, присутствие которого говорит о начальной или об активной инфекции. У больных раком желудка при этом выявлен значительный процент инфицированных, и относительная частота рака была гораздо выше при наличии Н. pylori, чем выявлялось ранее. Взятые вместе, эти исследования указывают на то, что связь Н. pylori и рака желудка настолько же значительна, как связь между курением и раком легких.
Как H. pylori приводит к возникновению рака желудка? Имеется два основных типа этого злокачественного заболевания: интестинальный и диффузный рак, наиболее часто встречается интестинальный тип. Важно отметить, что в исследовании Uemura с соавт. обнаружена высокая степень связи как интестинального, так и диффузного рака желудка с инфекцией H. pylori [2]. Гистопатологические данные исследования Correa при хорошо дифференцированном раке желудка интестинального типа указывают, что хроническая инфекция H. pylori прогрессирует в течение десятков лет, проходя стадии хронического гастрита, атрофии, интестинальной метаплазии и рака (рис. 1) [4]. Развитие рака относили на счет таких факторов, как нарушения в ДНК, вызванные хроническим воспалением, дисбаланс между пролиферацией эпителиальных клеток и апоптозом, колонизация желудка кишечными бактериями с активной нитрат-редуктазой, которая ускоряет образование канцерогенных нит-розаминов на фоне условий, свойственных атрофии и ахлоргидрии. Преимущественно-корпусная атрофия, то есть потеря специализированных железистых клеток, в частности, париетальных и главных клеток, является, очевидно, важной начальной стадией на пути к развитию рака.
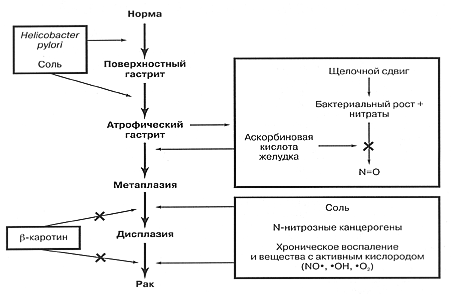
Рис. 1. Предполагаемый каскад патологических изменений при развитии адеиокарцииомы желудка.
Зачеркнутая стрелка обозначает ингибирование процесса. Адаптировано из Correa [4].
Недавно многие из этих стадий были воспроизведены у мышей и монгольских тушканчиков. Прямые эффекты H. pylori имеют отношение к индукции атрофии и рака, при этом определенную роль могут играть разные факторы вирулентности H. pylori [5]. На прогрессию в направлении атрофии и/или рака в организме, инфицированном Я. pylori, может повлиять соль в пище [6] и амидированный гастрин [7]. К тому же, в настоящее время имеются веские данные о важной роли хронического воспаления как фактора прогрессии на ранних этапах заболевания. Эту роль связывают с изменением экспрессии различных цитокинов и хемокинов,. У мышей наблюдается четкая и сильная зависимость между реакцией Т-клеток, цитокинами (интерфероп-у, интерлейкин 1 и фактор некроза опухолей а) Т-хелперов типа 1 и развитием атрофии, а также пренеопластического заболевания. Переход от иммунной реакции, опосредованной Т-хелперами типа 1, к иммунной реакции, опосредованной Т-хелперами типа 2, у мышей, инфицированных Я. pylori, уменьшает воспаление и замедляет изменения в направлении желудочной атрофии [8]. Эти данные, полученные при экспериментах па животных, нашли подтверждение и в исследовании людей, в которых показана сильная связь риска возникновения атрофии и рака желудка со случаями полиморфизма по единичному нуклеотиду в гене, кодирующем интерлейкин-1В [9]. Вероятно, в дальнейшем будет обнаружено, что на риск атрофии и рака желудка влияет полиморфизм по единичным нуклеотидам и в других генах, кодирующих цитокины или рецепторы к цитокинам.
В отличие от элегантной модели патогенеза рака толстой кишки, представленной группой Vogelstein, линейную модель развития рака желудка разработать не удалось. В рамках текущего исследования по химиопрофилактике и санации в На-рино, Колумбия, ведется поиск генетических нарушений при атрофическом гастрите, но до сих пор не обнаружена мутация, являющаяся фактором гистологической прогрессии [10]. Несомненно, требуются дальнейшие исследования для того, чтобы найти молекулярные маркеры, которые бы указывали на возможность неопластической трансформации.
В исследовании Uemura с соавт. есть интересное подтверждение сообщения от 1996 года о выраженной защищенности пациентов с язвенной болезнью двенадцатиперстной кишки от развития атрофии и рака желудка [II]. В исследовании Uemura с соавт. не отмечено случаев рака желудка при язвенной болезни двенадцатиперстной кишки. Причина этого неясна. Возможно, что развитие дуоденальных язв связано, в основном, со своими, особыми штаммами H. pylori [5]. У больных с такими язвами часто отмечается преимущественно антральный гастрит. Современные представления связывают увеличенное число париетальных клеток, а также высокий уровень секреции кислоты (что типично у больных с дуоденальными язвами) с защитой против проксимальной миграции колонизирующих бактерий и против возникновения преимущественно корпусного гастрита. До сих пор такие особые реакции в ответ на инфекцию H. pylori не удалось связать с увеличением образования конкретных цитокинов.
Язвенная болезнь двенадцатиперстной кишки, требует, как представляется, и повышения секреции кислоты в желудке, и активности про-воспалительных цитокинов.
Одна из самых манящих и провоцирующих находок исследования Uemura с соавт. - это предотвращение или отсрочка развития рака желудка за счет искоренения Н. pylori. Это, возможно, факт огромной важности. В предшествующей работе той же группы было показано, что искоренение Н. pylori у больных с ранним раком желудка, которых лечили эндоскопической резекцией слизистой, уменьшало частоту рецидива рака желудка [12]. Три другие, недавние исследования демонстрируют, что искоренение Н. pylori может предотвратить прогрессию патологических изменений в желудке [13] или повысить частоту регрессии образований-предшественников рака [14, 15].
Остается неразрешенным вопрос, кому следует проводить искоренение Н. pylori. До сих пор ведутся жаркие споры, каково должно быть идеальное лечение неязвенной диспепсии, при этом одной из главных тем дебатов является вопрос: насколько эффективна терапия против H. pylori в облегчении верхнеабдоминальных симптомов [16, 17]. Uemura с соавт. указывают, что пациенты с неязвенной диспепсией имеют самый высокий риск рака (4,7%), и одним лишь этим теперь можно обосновать применение у них терапии против Н. pylori. Однако, у большинства людей хроническая инфекция H. pylori протекает бессимптомно, что заставляет думать об организации популяционного скрининга на наличие инфекции или желудочных нарушений, имеющих прогностическое значение.
Ранее проведенные оценки показывают, что затраты на скрининг в отношении H. pylori и лечение этой инфекции с целью профилактики рака желудка будут эффективными, если мы сможем предотвратить, по меньшей мере, 30% случаев рака, возникающих на фоне инфекции Н. pylori [18]. Все больше данных за то, что терапия против H. pylori имеет, по меньшей мере, именно такую высокую эффективность, и в будущем рак желудка может быть отнесен к числу заболеваний, в значительной степени поддающихся профилактике, подобно раку толстой кишки. Но может быть H. pylori в чем-то "хороший микроб", который способен защитить против рака кардиального отдела желудка и рака пищевода? Это еще нужно доказать. Хроническая инфекция H. pylori может, вызывая преимущественно-корпусный гастрит, ингибировать секрецию кислоты, и, вероятно, замедлять развитие кислотного рефлюкса; однако, если мы позволим персистировать Я. pylori, - потенциальной причине рака желудка, это будет, очевидно далеко не идеальная стратегия предотвращения или лечения болезни гастроэзофагального рефлюкса. Для подтверждения данных Uemura с соавт. требуются дополнительные исследования. Необходимо прояснить динамику и исходы искоренения H. pylori в популяциях с меньшим риском рака желудка. Врачи будущего будут видеть в H. pylori, скорее всего, не полезного микроба-комменсала, а нечто, по вредоносности близкое табаку.
Литература
1. Correct P. Is gastric carcinoma an infectious disease? N Engl J Med 1991;325:1170-1.
2. Uernura N, Okamoto S, Yamamoto S, et al. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med 2001:345:784-9.
3. Ekstrom AM, Held M, Hansson LE, Engstrand L, Nyren 0. The role of Helicobacter pylori in gastric cancer revised: CagA immunoblot as a marker of past infection. Gastroentcrology (in press).
4. Correa P. Human gastric carcinogenesis: a multistep and multifactorial process — First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention. Cancer Res 1992;52:6735-40.
5. Israel DA, Salama N, Arnold CN, et al. Helicobacter pylori strain-specific differences in genetic content, identified by microarray, influence host inflammatory responses. J Clin Invest 2001;107:611-20.
6. FoxJG, Dangler CA, Taylor NS, King A, Koh 77, Wang TC. High-salt diet induces gastric epithelial hyperpla-sia and parietal cell loss, and enhances Helicobacter pylori colonization in C57BL/6 mice. Cancer Res 1999;59:4823-8.
7. Wang TC, Dangler CA, Chen D, et al. Synergistk interaction between hypergastrinemia and Helicobacter infection in a mouse model of gastric cancer. Gastroenterology 2000; 118:36-47.
8. Fox JG, Beck P, Dangler CA, el: al. Concurrent enteric helminth infection modulates inflammation and gastric immune responses and reduces helicobacter-induced gastric atrophy. Nat Med 2000:6:536-42.
9. El-Omar ЕМ, Carrington M, Chow WH, et al. Interleukin-1 polymorphisms associated with increased risk of gastric cancer. Nature 2000;404: 398-402.
10. Hunt JD, Mem R, Strimas A, et al. KRAS mutations are not predictive for progression of preneoplastk gastric lesions. Cancer Epidemiol Biomarkers Prev 2001;10:79-80.
11. Hansson L-E, Nyren 0, Hsing AW, et al. The risk of stomach cancer in patients with gastric or duodenal ulcer disease. N Engl J Med 1996;335: 242-9.
12. Uernura N, Mukai T, Okamoto S, et al. Effect of Helicobacter pylori eradication on subsequent development of cancer after endoscopic resection of early gastric cancer. Cancer Epidemicl Biomarkers Prev 1997;6:639-42.
13. SungJJ, Lin SR, ChingJY, et al. Atrophy and intestinal metaplasia one year after cure of H. pylori infection: a prospective, randomized study. Gastroenterology 2000;119:7-14.
14. Ohkusa T, Fujiki К, Takashimizu I, et al. Improvement in atrophic gastritis and intestinal metaplasia in patients in whom Helicobacter pylori was eradicated. Ann Intern Med 2001;I34:380-6.
15. Correa P, Fontham ET, Bravo JC, et al. Chernoprevention of gastric dysplasia: randomized trial of antioxidant supplements and anti-Helicobacter pylori therapy. J Natl Cancer Inst 2000;92:1881-8.
16. McColl К, Murray L, El-Omar E, et al. Symptomatic benefit from eradicating Helicobacter pylori infection in patients with normlcer dyspepsia. N Engl J Med 1998:339:1869-74.
17. Talley NJ, Vakil N, Ballard ED II, Fennerty MB. Absence of benefit of eradicating Helicobacter pylori in patients with nonulcer dyspepsia. N Engl J Med 1999; 341:1106-11.
18. Parsonnet J, Harris RA, Hack HM, Owens DK. Modeling cost-effectiveness of Helicobacter pylori screening to prevent gastric cancer: a mandate for clinical trials. Lancet 1996;348:150-4.
