Эффект лечения Кетокислотами (Кетостерил ) на течение хронической почечной недостаточности и нутритивные параметры у больных в предиализном периоде и на программном гемодиализе: Венгерское когортное исследование Кетостерила
СтатьиГабор Закар* от имени группы исследователей
Клиника Св. Пантелеймона, 2-е Медицинское отделение, и Центр Диализа Еврокэре №13, Дунайварош, Венгрия
(Gabor Zakar for the study group, St. Pantaleon Hospital, 13th Dialysis Center, Dunaujvaros, Hungary)
Wiener Klinische Wochenschrift, The Middle European Journal of Medicine
2001; 113 (17-18): 688-694
Резюме. Сообщаются результаты Венгерского когортного динамического исследования Кетостерила. Целью этого исследования была оценка выполнения лечения и эффекта применения кетокислот/аминокислот (КК) при малобелковой диете на прогрессирование хронической почечной недостаточности (ХПН) в большой группе предиализных пациентов (PRE), а также оценка влияния на нутритивные параметры больных, как в предиализном периоде, так и находящихся на диализе (DIA).
Пациенты и методы: В течение 18 месяцев наблюдали предиализных (n=181) и диализных (n=42) пациентов, находившихся на лечении в 47 венгерских нефрологических и диализных центрах. Больным предписывался стандартный протокол лечения – диета и назначение кето/аминокислот (предиализная группа: КК в дозе 0,1 г/кг/сут, количество белка в рационе 0,5-0,6 г/кг/сут, калорийность диеты 30 ккал/кг/сут; диализная группа: количество белка в диете 1,2 г/кг/сут, калорийность диеты и доза КК такие же, как и в предиализной группе).
Прогрессирование ХПН оценивали методом линейного регрессионного анализа обратной величины концентрации cывороточного креатинина (sCr) в зависимости от времени, результаты субъективной глобальной оценки (СГО) при помощи χ-квадрат теста. Другие метаболические показатели (уровень сывороточного альбумина, паратгормона (iПТГ), отношения Са/Р) анализировали методами описательной статистики.
Результаты: у предиализных больных наклон кривой величины 1/sCr находился в пределах 0,0022-0,0015 [100 мл/мг х месяц] и значимо не отличался в трех подгруппах больных: (группа А: исходный уровень креатинина сыворотки (sCr) 201-400, группа В: sCr 401-600, группа С sCr > 600 мкмоль/л). При применении КK наблюдалось значительное повышение исходных уровней сывороточного альбумина, которые были ниже 35 г/л, а показатели iПТГ имели тенденцию к улучшению.
У больных, находящихся на диализе, отмечено улучшение показателей СГО. Додиализные показатели сывороточного креатинина и мочевины крови в середине недели значимо не менялись.
Выводы: На большой группе предиализных пациентов показано, что назначение КК при малобелковой диете приводит к уменьшению наклона кривой величины 1/sCr, независимо от исходной степени нарушения функций почек, предполагая замедление скорости прогрессирования ХПН. Также отмечено улучшение нутритивных параметров, как у предиализных больных, так и у пациентов на диализе, причем у больных, находящихся на диализе, характерно улучшались показатели СГО.
Ключевые слова: Кетокислоты, аминокислоты, хроническая почечная недостаточность, малобелковая диета, прогрессирование, гемодиализ, питание, СГО, паратгормон, iПТГ.
* Адрес для переписки: Dr. Gabor Zakar, e-mail gzakar.mis@mail.matav.hu
Введение
В 1995 г. в Венгрии при поддержке Национальной системы медицинского страхования и Венгерского нефрологического общества (MNT) было начата комплексная программа диетотерапии больных с хронической болезнью почек. В данной программе было назначение кето/аминокислот (КК) при обычной малобелковой диете предиализным больным и компенсация потерь аминокислот во время диализа больным на программном гемодиализе. Для MNT требовалось собрать данные обследований больных в динамике, чтобы сделать анализ прогрессирования хронической почечной недостаточности (ХПН) и изменений нутритивных показателей в течение первых 12-18 месяцев применения кето/аминокислот.
В соответствии с протоколом MNT, основной целью применения КК у больных с хронической почечной недостаточностью (ХПН) до их перевода на диализ (предиализные пациенты – PRE) было достижение стандартного оптимального уровня потребления аминокислот/кетокислот при одновременном ограничении общего потребления белка для замедления прогрессирования почечной недостаточности. При применении малобелковой диеты были приняты меры для обеспечения достаточного поступления энергии (30-35 ккал/кг/сут). Ранее, разные исследования ясно продемонстрировали, что применение КК при малобелковой диете (МБД) оказывает благоприятные эффекты на больных ХПН (3,6,29,34).
Основной целью применения КК у больных, находящихся на диализе (DIA), была компенсация потерь аминокислот в процессе диализа, особенно при высокопроницаемых, высокоэффективных процедурах, и, во-вторых, коррекция спонтанного уменьшения потребления белка с пищей, которое часто недостаточно как в количественном, так и в качественном отношении (4,8,27,28). Различные методы коррекции белково-энергетической недостаточности у диализных больных приносили мало успеха (9,35). Несколько авторов отмечали повышенную смертность диализных больных с белково-энергетической недостаточностью (1,4,9,10,22,28).
Важным терапевтическим преимуществом кетоаналогов аминокислот является реутилизация азота мочевины (5). Кроме улучшения белкового метаболизма, кетокислоты как «бесфосфорные» предшественники аминокислот могут благоприятно влиять на течение вторичного гиперпаратиреоза (25). Для обеспечения нейтрального или положительного баланса азота большинству больных, находящихся на поддерживающем диализе, требуется суточное потребление белка в количестве около 1,2 г/кг веса тела, и, по крайней мере, 50% потребляемого белка должно иметь высокую биологическую ценность. Однако, животные белки имеют высокое содержание фосфора (21). При коррекции недостаточного спонтанного потребления белка у истощенных диализных больных, кетокислоты дают преимущество в обеспечении аминокислотами без дополнительной нагрузки фосфором.
Мы представляем результаты Венгерского когортного динамического исследования Кетостерила, крупномасштабного исследования по выполнению лечения, в котором изучались эффекты применения кетокислот/аминокислот при малобелковой диете на прогрессирование почечной недостаточности у больных в предиализном периоде, а также на нутриционные показатели у предиализных и диализных больных, получавших лечение и наблюдавшихся в 47 венгерских нефрологических и диализных центрах в течение 18 месяцев.
Материалы и методы
Крупномасштабное исследование применения КК у больных с хронической почечной недостаточностью в Венгрии началось в 1995 г. Это общенациональное исследование основывалось на принятых Венгерским нефрологическим обществом (MNT) стандартном протоколе диеты и лечения больных, который включал показания к диетотерапии и к применению КК, биохимические и антропометрические методы контроля состояния больных и методы сбора данных. Участники Венгерского исследования Кетостерила (нефрологи, диетологи) провели несколько подготовительных конференций, с целью стандартизации методов (среди них применение СГО для оценки питания) и протоколов лечения. После этих предварительных шагов исследование КК стартовало в ноябре 1995 г.
Больным с разной степенью ХПН (sCr от 212 до 800 мкмоль/л) на предиализной стадии было предписано потребление белка 0,5-0,4 г/кг веса тела в сутки, и, кроме того, назначен прием кетокислот (КК) в дозе 1 таблетка на 5 кг веса тела, н-р, больному весом 70 кг 14 таблеток (Кетостерил®, Фрезениус Каби, Германия).
Диализным пациентам с умеренной и тяжелой степенью белково-энергетической недостаточности было предписано продолжать придерживаться своей диеты (рекомендуемое потребление белка 1,0-1,2 г/кг/сут) и дополнительно назначалось принимать КК в той же дозе, что и предиализным больным. Обе группы больных обеспечивались рационом с потреблением калорийностью, по крайней мере, 30 ккал/кг/сут (по нашему опыту, большинство больных с заболеваниями почек не потребляют рекомендуемые 35 ккал/кг/сут).
К марту 1996 г. в исследование выполнения лечения были включены 47 медицинских центров, и к концу июня 1997 г. Кетостерил начали принимать более 800 предиализных и диализных пациентов. Центры-участники исследования предоставляли данные каждые 3 месяца. Автор объединял эти данные в нефрологическом центре Мишколц (Miscolc).
Прогрессирование ХПН оценивали методом линейного регрессионного анализа обратной величины концентрации сывороточного креатинина (sCr) в зависимости от времени (30), и результаты модифицированной субъективной глобальной оценки (СГО) (11) при помощи χ-квадрат теста. Другие метаболические показатели (уровень сывороточного альбумина, парат-гормона iПТГ, сывороточного соотношения Са/Р) анализировали методами описательной статистики.
Скорость клубочковой фильтрации у предиализных больных контролировали по серийным измерениям уровня сывороточного креатинина (sCr). Регулярно получали и анализировали следующие нутритивные и биохимические показатели: уровень сывороточного альбумина, азота мочевины крови, СГО, отношение концентраций Са/Р в сыворотке крови. Из-за сложностей сбора мочи и технических ограничений, данные о клиренсе эндогенного креатинина и уровне сывороточного паратгормона были получены только у ограниченного числа больных.
Из-за зависимости уровня альбумина в крови от предиализного баланса жидкости и других влияющих показателей, мы попытались охарактеризовать состояние питания больных с помощью модифицированной шкалы субъективной общей оценки (СГО), в которой оптимальное состояние соответствует 4 баллам, а увеличение баллов соответствует усилению истощения, с максимальной оценкой до 24 баллов (11). При анализе учитывали только результаты больных с полным комплектом оценок СГО в динамике.
К моменту завершения сбора данных (30 июня 1997 г.) в 47 медицинских центрах 521 больной получал КК. Из них 316 – предиализные больные, а 205 из диализной группы. Однако из-за проблем с наблюдением и позднего начала лечения, данные только части из них (181 предиализного пациента и 42 диализных пациентов) были пригодны для оценки, по крайней мере, 12 месяцев лечения. В данной статье представлены результаты, полученные только у этих больных.
Результаты
Демографические характеристики больных суммированы в таблице 1. Распределение больных по полу и возрасту в обеих PRE и DIA группах было сопоставимо с общими данными. Что касается основного заболевания, то в обеих группах было необычно большое число больных с пиелонефритом, что может отражать систематическую ошибку классификации.
Таблица 1. Демографические характеристики - пол, возраст и причина почечной недостаточности у предиализных и диализных больных, получавших Кетостерил
| Предиализные больные (PRE) | Диализные больные (DIA) | |
|---|---|---|
| Количество Возраст (лет) Пол (М/Ж) | n=181 55,3 (18-85) 100/81 | n=42 47,1 (22-85) 27/15 |
| Причины хронической почечной недостаточности Гломерулонефрит Хронический пиелонефрит Поликистоз почек Неустановленная Диабетическая нефропатия Гипертензивное поражение почек Анальгетическая нефропатия Другое | 47 53 24 16 10 2 13 16 | 12 8 5 2 1 0 1 3 |
Для оценки скорости прогрессирования по отдельности предиализные больные (n=181) были разделены на 4 подгруппы в соответствии с исходной функцией почек. Подгруппа А – sCr <200 мкмоль/л; В – sCr =201-400 мкмоль/л; С – sCr = 401-600 мкмоль/л, и D – sCr >600 мкмоль/л.
Таблица 2. Изменение среднего уровня сывороточного кретинина (мкмоль/л) у предиализных больных, получавших Кетостерил
| Уровень сывороточного креатинина (мкмоль/л) | ||||||
|---|---|---|---|---|---|---|
| Месяцы | n | Среднее | SD | SEM | Мин | Макс |
| 0 3 6 9 12 15 18 | 182 183 183 156 181 81 43 | 410,2 426,0 445,0 474,4 485,2 498,8 495,0 | 134,18 150,23 179,50 178,99 202,14 204,24 203,95 | 9,94 11,10 13,27 14,33 15,02 22,69 31,10 | 115 120 130 181 166 188 113 | 873 883 1351 1261 1311 1336 1305 |
Таблица 2 содержит данные sCr у всей предиализной группы больных в динамике. Видно, что через 12-18 месяцев лечения увеличение среднего уровня sCr было довольно небольшим и составляло около 75 мкмоль/л. Для корректного определения скорости прогрессирования заболевания у больных в подгруппах B, C и D был применен анализ линейной регрессии величины 1/sCr по методу, предложенному Mitch и Walser (30). Количество данных показателя sCr в подгруппе A оказалось недостаточным для статистического анализа из-за малого количества больных в этой подгруппе.
Результаты регрессионного анализа реципрокной величины sCr в подгруппах B, С, D, показаны на рис.1. Линии регрессии в подгруппах больных B (белые кружки, n=64), C (треугольники, n=63) и D (пятиугольники, n=13) располагаются на разной высоте в соответствии со средней начальной величиной sCr в этих группах. Даже при визуальной оценке, очевидно, что наклоны линий регрессии (соответствующие значениям «b» в уравнениях кривых) существенно не отличаются друг от друга.
Поскольку в нашем исследовании не было контрольной группы, мы сравнивали полученные данные регрессии величины 1/sCr с результатами, полученными Schmicker и др. (34). Значения «b» в наших регрессионных уравнениях близки к соответствующему значению в исследовании Schmicker (линия R1 на рис.1. приведена для сравнения). Вместе с тем, это значение достоверно отличалось от значений коэффициента «b» у больных, не придерживавшихся никакой диеты (линия R3 на рис.1, приведена из работы 18) и у больных, получавших незаменимые аминокислоты при малобелковой диете (линия R2 на рис.1, приведена из работы 34).
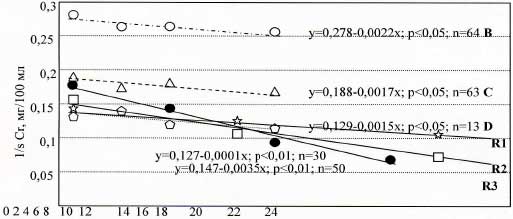
Рис.1. Средние значения реципрокной величины sCr, у предиализных больных, получавших КК
Белые кружки: группа В (sCr 201-400 мкмоль/л);
треугольники: группа С (sCr 401-600 мкмоль/л);
пятиугольники: группа D (sCr >600 мкмоль/л);
R1 (звездочки): КК (кетокислоты) при малобелковой диете (из работы 34);
R2 (прямоугольники): НАК (незаменимые аминокислоты) при малобелковой диете (из работы 34);
R3 (точки): неограниченное потребление белка (из работы 18).
Суточную порцию мочи для измерения клиренса эндогенного креатинина удалось собрать только у ограниченной группы больных (n=107, независимо от исходной величины sCr).
За 12 месяцев лечения клиренс креатинина снизился в среднем на 1,9 мл/мин (с исходной 16,7 мл/мин/1,73 м² до 14,8 мл/мин/1,73 м² через 12 месяцев применения Кетостерила и малобелковой диеты). Эта скорость снижения составляла примерно 1/5 от той, что наблюдалась у больных с ХПН при неограниченном потреблении белка (18), и это соответствовало результатам анализа реципрокной величины sCr (рис.2).
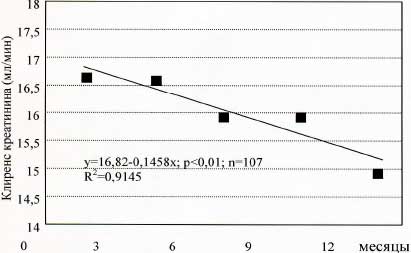
Рис.2. Регрессионный анализ зависимости клиренса креатинина от времени у предиализных больных, получавших Кетостерил (n=107). Среднее снижение клиренса эндогенного креатинина составило 1,9 мл/мин/год.
Влияние кето/аминокислот на нутритивный статус оценивалось при помощи измерений антропометрических параметров и уровня сывороточного альбумина. Для лучшего понимания, что происходит при назначении кетокислот при малобелковой диете, предиализные больные были разделены на подгруппы в соответствии с исходным уровнем сывороточного альбумина. В таблице 3 суммированы результаты анализа.
Таблица 3. Концентрации сывороточного альбумина у предиализных больных. Отмечается уменьшение количества больных с низкими показателями через 12 мес. лечения Кетостерилом
| n | 181 | 181 | 178 | 77 | 42 |
|---|---|---|---|---|---|
| sCr (г/л) | 0 мес | 6 мес | 12 мес | 15 мес | 18 мес |
| 20-25 25,1-30 30,1-35 35,1-40 40,1-43 >43 | 2 6 19 44 37 73 | 0 1 17 47 43 73 | 0 1 11 47 48 71 | 0 2 5 19 15 36 | 0 2 0 10 17 14 |
У больных с исходно низким уровнем альбумина (<35 г/л) при применении Кетостерила и малобелковой диеты (27 из 181 больных) наблюдалось значительное увеличение этого показателя, и, следовательно, количество истощенных больных за год уменьшилось с 27 до 11 (p<0,05). Уровень сывороточного альбумина у больных с его приемлемым или хорошим показателем в начале исследования, в дальнейшем не увеличивался.
В группе предиализных больных результаты СГО удалось измерить только у 79 пациентов, и не было найдено значимых различий (табл.4). Напротив, в группе диализных больных (n=36), через 12 мес. при анализе методом χ-квадрат стало очевидным небольшое, но статистически значимое улучшение. Лучший результат СГО у больных, находящихся на диализе, объясняется улучшением аппетита и мышечной силы у всех этих больных, а также увеличением у некоторых больных толщины кожно-жировых складок (над бицепсом и трицепсом) и исчезновением, в некоторых случаях, пальпируемых отеков на ногах.
Таблица 4. Изменение среднего результата СГО при применении Кетостерила у предиализных и диализных больных
| Группа | n | 0 мес | 12 мес | |
|---|---|---|---|---|
| Предиализные больные (PRE) | B C D | 39 35 5 | 7,0 8,3 9,6 | 6,9 7,6 8,8 статистически незначимо |
| Диализные больные (DIA) | 36 | 9,1 | 8,4 | |
| <медианы | χ-квадрат тест 36 | 7 | 17 | |
| ≥медианы χ²=5,062; DF=1 | 36 | 29 | 19 p<0,05 |
Уровень сывороточного фосфора у больных, находящихся на диализе, существенно не менялся и оставался умеренно повышенным, в среднем около 2 ммоль/л с широким диапазоном разброса (от 0,8 до 4,0 ммоль/л). Из-за технических и частично финансовых затруднений уровень iПТГ крови был измерен только у ограниченного количества диализных больных (n=11; рис.3). В динамике через 12 месяцев лечения этот показатель был ниже исходного. Но из-за небольшого количества измерений и широкого разброса индивидуальных значений данные оказались непригодны для статистического анализа. 0 12 месяцы
Рис.3. Изменение уровня сывороточного паратгормона у диализных больных, получавших Кетостерил (iПТГ – иммунореактивный интактный паратгормон)
Обсуждение
Влияние малобелковой диеты на прогрессирование ХПН изучалось очень широко. Относительно значимости этого типа диетотерапии имелись данные как за (6,7,10,19,21), так и против (26,32,33,45). Однако следует подчеркнуть, что в указанных работах основные условия (однородность исследуемой группы больных, уровень потребления больными белков и энергии, контроль биохимических показателей и соблюдения лечения, методы оценки прогрессирования заболевания и статистического анализа) довольно сильно различались, а эти условия могут оказывать значительное влияние на результаты, делая спорными выводы и предположения.
Тем не менее, недавно проведенный перекрестный анализ исследований из базы данных Cochrane, в которых участвовали в общей сложности 1494 больных, четко подтвердил, что снижение потребления белка до 0,6 г/кг/сут увеличивает продолжительность жизни больных с ХПН примерно на 40% по сравнению с более высоким или неограниченным потреблением белка (13).
Меньше данных опубликовано о роли кетокислот, назначаемых при малобелковой диете. Хотя первые результаты (3,5,6,29,33) были довольно оптимистичными, по нескольким причинам КК сразу не нашли широкого применения (30). Одной из этих причин является увеличение доступности диализа, что сделало почечные диеты и их вклад «средством второго сорта», или средством лечения ХПН, применяемым «вместо» чего-то.
С другой стороны, было также тщательно изучено нарушение спонтанного потребления питательных веществ, как у больных на диализе, так и в предиализном периоде, и неблагоприятные последствия этого хорошо описаны в патогенезе белково-энергетической недостаточности у больных с хроническими заболеваниями почек (1,4,7,8,22,27,29). Больные с ХПН имеют аномальный спектр аминокислот в плазме крови со снижением уровня большинства незаменимых аминокислот, включая разветвленные аминокислоты (валин, изолейцин и лейцин) при повышении уровня некоторых заменимых аминокислот. Во многих отношениях этот спектр аминокислот сходен с тем, который наблюдается у больных с белковой недостаточностью (2,14,20).
Малобелковая диета уже давно является признанным методом лечения ХПН в Венгрии. Однако до 1995 г. организационных и людских ресурсов (диетологи, нефрологи) для применения ее в полной мере было недостаточно. В конце 1980-х г.г. в Венгрии бурно развивались возможности проведения диализа (главным образом за счет приватизации центров диализа), и создавалось впечатление непропорциональной значимости технических средств лечения.
С появлением кетокислот стало возможным большее понимание роли диетотерапии в лечении больных с почечной недостаточностью, и особенно использования малобелковых диет и применения кето/аминокислот. Наличие грамотного в назначении диеты нефролога и диетолога было обязательным условием участия медицинских центров в данном исследовании Кетостерила, поэтому не следует упускать из виду и образовательный аспект этого исследования.
Результаты наблюдения (линия регрессии показателя 1/sCr) в нашем исследовании позволяют предположить замедление прогрессирования ХПН во всех трех подгруппах предиализных больных (группы B, C, D). Значение коэффициента регрессии «b» (в виде наклона кривой) в уравнениях кривых регрессии для всех трех подгрупп оказалось ниже, чем для больных с ХПН, не получавших малобелковой диеты (рис.1, линия R3) и ниже, чем для больных с ХПН, получавших малобелковую диету и незаменимые аминокислоты (рис.1, линия R2) (18,34).
В работе Walser и др. строгая малобелковая диета (сМБД) и применение кето/аминокислот очевидно приостанавливало, по крайней мере на год, прогрессирование хронической почечной недостаточности средней тяжести в небольшой группе больных, у которых однако ограничение потребления белка и фосфора без применения кето/аминокислот прогрессирования заболевания не замедляло (43). Перекрестное исследование диетотерапии, проведенное теми же авторами 6 лет спустя, дало аналогичные результаты: у 13 из 16 больных строгая МБД и применение кето/аминокислот замедляло прогрессирование болезни по сравнению с назначением просто аминокислот, независимо от количества потребления белка и фосфора (44).
Данные о возможности замедления прогрессирования ХПН с помощью малобелковой диеты и применения кето/аминокислот в равной степени у больных с ранней (группа В) и поздней стадией (группа D) ХПН имеют важные практические выводы. Согласно полученным нами результатам, нет причин откладывать начало диетотерапии и фармакотерапии до поздних стадий развития ХПН (клиренс креатинина 15-16 мл/мин), рекомендуется лучше вводить ограничение потребления белка и назначение кетокислот уже на ранних стадиях ХПН, когда еще нет существенного повышения уровня креатинина в крови. По этому поводу часто лицемерно упоминается «тяжесть» диеты, чтобы скрыть субъективные и/или финансовые причины нежелания рекомендовать малобелковую диету (нежелание нефролога, отсутствие диетолога). Наш опыт показал, что эта проблема успешно преодолевается грамотными в вопросах диеты врачами и диетологами. Аналогичные наблюдения были опубликованы Haeberle в 1989 г. (17).
Анализ показателей нутритивного статуса свидетельствует о благоприятном влиянии кето/аминокислот на состояние питания больных как в предиализном периоде, так и на диализе. В связи с этим, мы подчеркиваем важность долгосрочного лечения (по крайней мере, в течение 12 месяцев) и важность адекватных статистических методов анализа для выявления терапевтического эффекта. Наши данные подтверждаются результатами недавно выполненного двойного слепого контролируемого исследования, в котором показано повышение уровня сывороточного альбумина у больных на гемодиализе с тяжелой степенью белково-энергетической недостаточности (12).
У наших больных, находящихся на диализе, не удалось подтвердить «фосфоропонижающего» эффекта КК, возможно из-за недостаточного соблюдения лечения этими больными. Было довольно поучительно обнаружить, что протокол питания соблюдает гораздо больше больных в предиализной стадии, чем больных, находящихся на диализе (как по абсолютному количеству, так и по доле среди всех больных данной группы). Мы считаем, что это может служить показателем мотивации больных и персонала в данном медицинском центре.
Тем не менее, влияние кето/аминокислот на белковый обмен и на снижение уровня сывороточного фосфора диализных больных может быть значительным. Можно довольно просто рассчитать, что потребление фосфора диализными больными, получающими рекомендуемую суточную дозу белка (1,2-1,4 г/кг веса тела) с обычной пищей, непременно превысит предельную суточную норму (800 мг). Диализ и препараты, связывающие фосфор, не всегда могут компенсировать этот избыток, о чем ясно свидетельствует обычно плохо контролируемый уровень фосфора у многих больных, находящихся на диализе. Еще одним из решений данной проблемы может быть снижение содержания белка в пище, примерно до 1,0-1,1 г/кг/сут, и назначение кето/аминокислот для обеспечения необходимого уровня потребления белка.
В нашем исследовании мы не смогли достичь этой цели, вероятно из-за того, что не обеспечили большое количество диализных больных в исследовании диетическими консультациями и обучением.
В заключение, можно утверждать, что применение малобелковой диеты и назначение кето/аминокислот является выполнимым способом лечения в большой группе предиализных больных ХПН, который приводит к уменьшению наклона кривой зависимости величины 1/sCr от времени, что предполагает замедление скорости прогрессирования почечной недостаточности. Этот эффект был сопоставимым в подгруппах больных с разной степенью почечной недостаточности, то есть имеется выгода от малобелковой диеты и назначения кето/аминокислот даже при ранних стадиях ХПН. Как у предиализных больных, так и у больных на диализе, также наблюдалось улучшение показателей питания, причем для диализных больных наиболее характерно улучшение субъективной глобальной оценки.
Приложение
Автор выражает благодарность всем участникам данного исследования из 48 венгерских нефрологических и диализных центров, перечисленных ниже: Литература
Budapest: Dr. K.Albert, Dr. P.Andreka, Dr. I.Barna, Dr. K.Berta, Dr. J.Doman, Dr. M.Faludi, Dr. E.Gombos, Dr. A.Haris, Dr. A.Hering, Dr. M.Homoki, Prof. Dr. L.Kammemer, Dr. I.Kiss, Dr. A.Lakatos, Dr. J.Mako, Dr. K.Meidchelbeck, Dr. E.Molnar, Dr. E.Nagy, Dr. K.Polner, Dr. P.Sallay, Dr. P.Sallay, Dr. L.Szalay, Dr. Gy.Szollossy, Prof. Dr.T.Tulaasay, Dr. M.Visy, Dr. P.Voros, Dr. Gy.Zsigmond, Bekescsaba: Dr. M.Juhasz, Dr.E.Toth, Cegled: Dr. M.Haraszti, Csorna: Dr.J.Nemeth, Debrecen: Dr.L.Asztalos, Dr.Gy.Kakukk, Dr.I.Karpati, Dr. Zs.Kincses, Dr. Locsey, Dr. J.Matyus, Dr. L.Ujhelyi, Eger: Dr. I.Mezei, Dr. M.Misz, Esztergom: Dr. M.Gali, Dr. L.Major, Cyor: Dr.S.Ferenczi, Dr. Sz. Vinkovits, Hodmezovasarhely: Dr. M.Kassai, Dr. J.Szabo, Kalocsa: Dr. I.Toth, Dr. M.Torok, Kecskemet: Dr. L. Kozepessy, Dr. J.Sovergjarto, Dr. I.Worum, Kiskunfelegyhaza: Dr.B.Tichy, Miscolic: Dr.O.Arkossy, Dr. E.Ladanyi, Dr. L.Szabo, Nagykanizsa: Dr. T. Toth, Nyiregyhaza: Dr. B.Borbas, Pecs: Prof. Dr. A.Karatson, Dr. E.Kollmann, Dr. M.Molnar, Prof. Dr. J.Nagy, Salgotarjan: Dr. F. Petho, Sopron: Dr.N.Palvolgyi, Dr. L.Vaslaki, Szeged: Dr. E. Buzas, Dr. I.Haszon, Dr. E.Kiss, Dr. M.Mihalcso, Prof. Dr. S.Sonkodi, Dr. S.Turi, Dr. M. Zsom, Szekszard: Dr.Gy.Warner, Szentes: Dr.Zs.Szigethy, Szolnok: Dr. J.Redl, Szombathely: Dr. M.Hollosy, Dr.I.Kulcsar, Szekesfehervar: Dr. H.Brasch, Dr. Cs.Rikker, Dr. I.Solt, Satoraljaujhely: Dr. A. Nagy, Tatabanya: Dr. M.Grosz, Dr. M.Harnos, Dr. L.Nagy, Veszprem: Dr.K.Akocsi, Dr.I.Harhegyi, Zalaegerszeg: Dr.E.Garai, Dr.D.Kosa, Ozd: Dr. A. Koos.
Комментарии
ПРАКТИКА ПЕДИАТРА
