Железодефицитная анемия. Современная тактика диагностики и лечения, критерии эффективности терапии
Статьи Опубликовано в журнале:«КЛИНИЧЕСКАЯ МЕДИЦИНА»; № 12; 2013; стр. 61-67.
Н.И. Стуклов, Е.Н. Семенова
ФГБОУ ВПО Российский университет дружбы народов, Москва
Рассмотрен современный взгляд на проблему железодефицитной анемии (ЖДА) с точки зрения эпидемиологии, этиологии, патогенеза. Описаны известные в настоящее время механизмы регуляции обмена железа, приведены наиболее важные данные литературы и результаты собственных исследований. Основываясь на рекомендациях по лечению больных ЖДА, авторы представляют описанный в литературе и собственный клинический опыт использования железосодержащих препаратов и рассматривают полученные результаты. В рамках статьи авторы объясняют механизмы низкой эффективности лечения при ЖДА и предлагают способы решения проблемы с учетом опубликованных в литературе последних научных исследований.
Ключевые слова: анемия; обмен железа; сидеропенический синдром; лечение железодефицитной анемии.
Iron Deficiency Anemia. Modern Diagnostic And Treatment Strategy. Criteria For Therapeutic Efficacy
N.I. Stuklov, E.N. Semenova
Russian University of People’s Friendship, Moscow, Russia
Modern views of epidemiology, etiology and pathogenesis of iron deficiency anemia are considered. Mechanisms of iron metabolism regulation are described based on the most important literature data and the results of the authors ’ research. The authors present their own and literature clinical experience of using iron-containing drugs with reference to the existing recommendations on the treatment of iron deficiency anemia. Causes of low treatment efficiency are discussed and the ways to address this problem are proposed based on the published results of clinical research.
Key words: anemia; iron metabolism; sideropenic syndrome; treatment of iron deficiency anemia.
Анемии (греч. αναιμια — бескровие) определяются как ряд клинических состояний, связанных со снижением уровня гемоглобина менее 120 г/л у женщин и менее 130 г/л у мужчин; (ВОЗ, 2001) и (или) гематокрита ( менее 36,4% соответственно), что обусловлено уменьшением количества эритроцитов или содержания гемоглобина в них [1]. В настоящее время железодефицитная анемия (ЖДА) является самым распространенным состоянием, связанным со снижением уровня гемоглобина, поэтому ее признают государственной проблемой более чем в 100 странах мира, где разрабатываются программы, направленные на профилактику и снижение заболеваемости. ЖДА чаще выявляется у представителей наиболее социально значимых и незащищенных слоев населения — у женщин детородного возраста и детей. Количество больных анемией в указанных группах, по данным ВОЗ (2001), превышает 1 млрд [2]. В итоге ЖДА является причиной роста материнской и детской смертности [3].
Регуляция обмена железа.
Ежедневно организму для нормальной жизнедеятельности требуется 20—25 мг железа, причем экзогенного железа необходимо только 1— 2 мг: женщинам — 2 мг (из-за физиологической кровопотери), а мужчинам — 1—1,5 мг. Около 20 мг железа поступает из «старых» разрушенных эритроцитов, столько же расходуется на синтез нового гемоглобина.
Железо накапливается в органах ретикулоэндотелиальной системы (до 500 мг), остальные запасы железа на 70% сосредоточены в гемоглобине, что и обусловливает развитие ЖДА при хронической кровопотере (рис. 1).
Рис. 1. Схема обмена железа. 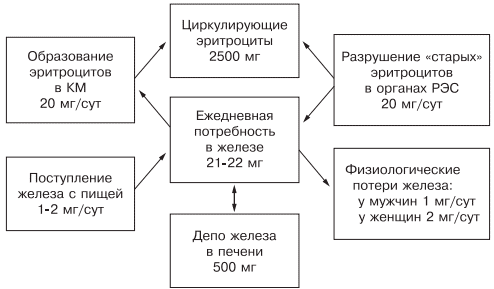
Всасывание железа происходит в верхних отделах тонкой кишки, причем этот процесс требует участия множества белков. В основном до 70—80% железа усваивается в двухвалентном состоянии (гемовое железо, содержащееся в основном в мясе, меньше — в печени и рыбе). При поступлении в кишечник растительного трехвалентного железа с помощью медьзависимой ферроредуктазы на апикальной мембране энтероцитов или под действием витамина С оно восстанавливается до двухвалентного. Двухвалентное железо через марганецзависимые белки — транспортеры двухвалентных металлов (ДМТ — двухвалентный металлотранспортер) поступает в энтероцит, а затем через белок ферропортин на базальной мембране — в кровь, где с помощью медьзависимых феррооксидаз (гефестина, расположенного на базальной мембране и связанного с ферропортином, и церулоплазмина, находящегося в плазме) окисляется до трехвалентного состояния, чтобы связаться с транспортным белком — трансферрином (рис. 2). Только очень незначительная часть железа, образуя комплекс с муцином, может поступить в энтероциты путем пиноцитоза [4, 5].
Рис. 2. Схема регуляции обмена железа.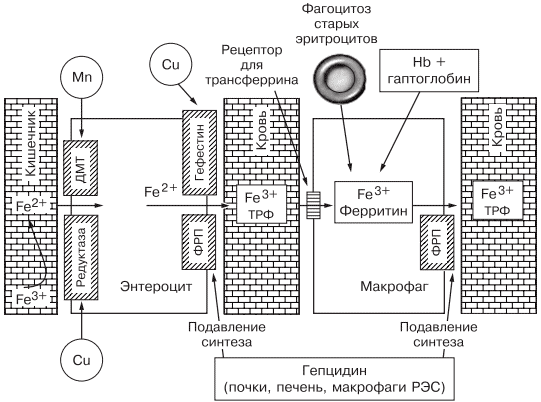
Универсальным регулятором метаболизма железа является гепцидин [6—9], который блокирует транспорт железа, причем этот механизм реализуется с помощью регуляции активности белка ферропортина, т.е. путем воздействия на высвобождение железа из клеток кишечника и макрофагов ретикулоэндотелиальной системы [10—13]. Увеличение количества железа в организме ведет к стимуляции синтеза гепцидина, что уменьшает абсорбцию железа в кишечнике и его транспорт в циркуляцию. В свою очередь уменьшение абсорбции железа в кишечнике ведет к угнетению синтеза гепцидина в печени и по обратной связи — к восстановлению захвата железа из пищи и кишечника (см. рис. 2) [14—18]. Помимо железорегуляторной функции, гепцидин оказывает выраженное бактерицидное действие, является белком воспаления, его уровень повышается при инфекционных, воспалительных, опухолевых заболеваниях, блокируя выход железа в кровь [6]. Такой эффект гепцидина отрицательно влияет на рост бактерий, опухолей, блокирует избыточный воспалительный процесс. В работе, проведенной в 2011 г. [19], доказана роль гепцидина как основного фактора развития ЖДА у женщин с гинекологическими заболеваниями без патологической кровопотери. Показатели гепцидина в указанной группе составили 108,75 ± 40,08 нг/л (референсные значения 60— 85 нг/л), что обусловило резкое уменьшение содержания ферропортина — 0,43 ± 0,21 нг/л (референсные значения 3,1 ± 0,2 нг/л) и привело к нарушению поступления железа из кишечника в кровь [19].
Железо, которое остается внутри клеток, депонируется в виде ферритина, количество которого в крови прямо пропорционально содержанию железа в депо [20].
Клиническая картина и диагностические критерии.
Дефицит железа приводит к нарушению синтеза гемоглобина в эритрокариоцитах костного мозга, уменьшению содержания миоглобина в мышцах, активности цитохромов и каталаз в митохондриях клеток, миелопероксидазы в нейтрофилах [21—23].
В настоящее время выделяют несколько этапов развития дефицита железа [5, 24].
1. Предрасположенность к развитию дефицита железа (вегетарианство, подростковый возраст в сочетании с нарушением менструального цикла у девочек, частые роды, наличие хронических болезней желудочно-кишечного тракта — ЖКТ, заболеваний женской репродуктивной системы, связанных с кровопотерей).
2. Предлатентный дефицит железа. На этой стадии нет никаких лабораторных критериев дефицита железа, однако можно определить повышение абсорбции трехвалентного железа в ЖКТ, которое может превышать 50% (в норме 10—15%).
3. Латентный дефицит железа характеризуется развитием сидеропенического синдрома и уменьшением запасов железа в организме (по данным лабораторных исследований).
4. ЖДА. Диагноз устанавливается при уровне гомоглобина менее 120 г/л у женщин и 130 г/л у мужчин. Выделяют следующие стадии ЖДА:
В основе патологии эритропоэза при дефиците железа лежит нарушение синтеза гема, в результате которого уменьшается количество гемоглобина в эритрокариоцитах костного мозга, что проявляется на первом этапе гипохромией эритроцитов, а в дальнейшем — развитием гипохромной микроцитарной анемии.
Клинические проявления ЖДА связаны с развитием как сидеропенического синдрома, для которого характерны выраженная мышечная слабость, нарушение целостности слизистых оболочек, кожи, ее придатков (ломкость и расслаивание ногтей, выпадение волос), снижение иммунитета, так и непосредственно симптомов анемии (головокружение, мелькание «мушек» перед глазами, сонливость, снижение работоспособности).
Наиболее характерным лабораторным признаком ЖДА являются гипохромия, микроцитоз эритроцитов, анизоцитоз. О гипохромии эритроцитов свидетельствуют цветовой показатель менее 0,8, среднее содержание гемоглобина в эритроците менее 28 пг, средняя концентрация гемоглобина в эритроците менее 290 г/л. О микроцитозе говорят, когда средний диаметр эритроцита менее 7 мкм, а средний объем эритроцита — менее 80 фл [21, 22, 24].
Параметры обмена железа широко используются в клинической практике, но в связи с отсутствием четко определенных значений, доказывающих наличие ЖДА, высокой стоимостью исследования и большим количеством больных их применение не всегда оправдано. Так, показатель ферритина сыворотки (ФС) как единственный маркер, отражающий запасы железа в организме и используемый для верификации и дифференциальной диагностики ЖДА, по мнению разных исследователей [5, 20], варьирует от 15 до 100 мкг/л. Известно, что показатель ФС является положительным маркером воспаления, а количество его определяется белково-синтетической функцией печени. В настоящее время для установления диагноза ЖДА принято считать достоверным показатель ФС менее 30 мкг/л [25]. Уровень такого транспортного белка, как трансферрин, как правило, повышен при недостатке железа, однако при наличии инфекции его содержание уменьшается и не может использоваться в диагностике ЖДА [26]. Тем более изменчивы такие параметры обмена железа, как железосвязывающая способность (общая и латентная) и коэффициент насыщения трансферрина железом, так как они рассчитываются исходя из содержания трансферрина и сывороточного железа, а последний показатель вообще не имеет связи с содержанием железа в организме и зависит от времени, в которое проведено исследование, и приема пищи [21]. Значения коэффициента насыщения трансферрина железом у больных ЖДА, по опубликованным данным, могут составлять от 15 до 20%. Наиболее точным методом диагностики ЖДА в настоящее время считается подсчет растворимых рецепторов для трансферрина, однако этот метод не используется в качестве рутинного из-за отсутствия единого способа детекции, высокой стоимости исследования, невозможности интерпретировать результат при наличии любых пролиферативных процессов [26].
Наиболее частыми причинами ЖДА являются как физиологические, так и патологические состояния. В группу риска развития ЖДА входят недоношенные дети, так как у них не успевает сформироваться депо железа, и подростки, которым требуется больше железа в связи с быстрым ростом организма [27]. Наиболее часто ЖДА развивается при беременности. В период беременности, родов и лактации в среднем расходуется до 1000 мг железа, что в 2 раза больше его запасов в депо [28]. Репродуктивный возраст у женщин связан с повышенной потерей железа при менструациях; этот недостаток компенсируется увеличением всасывания железа в ЖКТ, что в настоящее время объясняется изменением влияния гепцидина. При наличии гиперполименореи, однако, такой баланс нарушается в связи с увеличением кровопотери [29, 30], при сопутствующих заболеваниях ЖКТ нарушается всасывание железа и развивается ЖДА [6, 19]. Часто у женщин меноррагии имеют органические причины: полипы, эндометрит, миома матки, аденомиоз, открывающийся в полость матки; мало того, такие заболевания, как миома матки и дисплазия шейки матки, оказывают влияние на развитие анемии и без патологической кровопотери [5, 19, 30]. Указанный механизм связан с увеличением содержания гепцидина в крови и снижением активности эритропоэза, доказанным синдромом неадекватной выработки эритропоэтина. В настоящее время продукцию эритропоэтина принято считать неадекватной при отношении определяемого эритропоэтина к предполагаемому (О/П log эритропоэтина менее 0,9) [28, 31]. Так, В.А. Бурлевым и Е.Н. Коноводовой [32] при обследовании женщин с миомой матки выявлено отношение О/П log эритропоэтина менее 0,8, а при обследовании гинекологических больных с анемией без нарушения менструальной функции в 2011 г. отношение О/П log эритропоэтина составило 0,89 (рис. 3). Для всех женщин с диагностированной ЖДА необходимо обязательное обследование у гинеколога. В случае обнаружении ЖДА у мужчин, наоборот, показано исключение заболеваний ЖКТ.
Рис. 3. Зависимость между уровнем гемоглобина и сывороточного эритропоэтина (логарифмическая шкала и экспоненциальные кривые) у больных с постгеморрагической ЖДА при заболеваниях ЖКТ (предполагаемый эритропоэтин) и анемии при гинекологических заболеваниях (определяемый эритропоэтин) [5].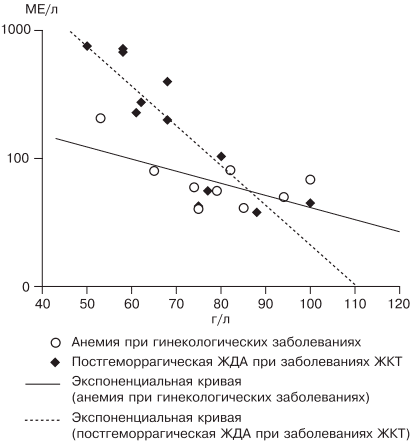
Помимо повышенной потребности в железе и хронической кровопотери, патологическими состояниями, способными вызывать развитие ЖДА, являются различные нарушения всасывания железа и поступления его с пищей (в том числе и обусловленные вегетарианством), нарушения транспорта железа (гипотрансферринемии при заболеваниях печени и наследственные атрансферринемии) [21].
Таким образом, гипохромная микроцитарная анемия, особенно при наличии характерной для сидеропенического синдрома клинической картины, даже без исследования обмена железа может определяться как ЖДА при условии полноценного клинического и инструментального обследования больного и установления причины ее развития [5].
Лечение.
Современная тактика лечения при ЖДА в настоящее время направлена на устранение этиологического фактора и восполнение запасов железа в организме [4, 5]. Наиболее оправдано более физиологическое пероральное применение препаратов железа; парентерально препараты можно использовать только при доказанном дефиците железа. Перорально следует назначать препараты железа в высоких дозах (от 200 до 300 мг/сут), что, однако, может приводить к возникновению диспепсических явлений, поэтому (особенно в детской и акушерской практике) рекомендуется постепенное повышение дозы до терапевтической, а при достижении нормальных значений уровня гемоглобина — ее снижение [20].
Степень абсорбции двухвалентных солей железа в несколько раз выше, чем трехвалентных, так как они пассивно диффундируют через каналы ДМТ-белков [33], поэтому препараты, содержащие двухвалентное железо, дают быстрый эффект и нормализуют уровень гемоглобина в среднем через 1—2 мес, а нормализация депо железа происходит уже через 3—4 мес от начала лечения в зависимости от степени тяжести анемии и дозы препарата. Препараты, содержащие железо в трехвалентном состоянии, требуют более длительного применения, а в случае дефицита меди в организме будут неэффективны. Нормализация уровня гемоглобина при лечении препаратом трехвалентного железа наступит только через 2—4 мес, а нормализация показателей депо железа — через 5—7 мес от начала терапии [5, 19, 33]. Степень абсорбции отражается и на частоте развития побочных эффектов. Уменьшить нежелательное влияние таблетированных препаратов железа на ЖКТ можно, принимая их во время еды, но при этом уменьшается всасывание железа. Лучше (но также с потерей эффективности) использовать формы с замедленным высвобождением, так как часть препарата будет высвобождаться в нижних отделах ЖКТ, где железо практически не всасывается [34]. Несмотря на рекомендации ВОЗ по применению для лечения ЖДА препаратов двухвалентного железа как более эффективных, препараты с низкой биодоступностью на основе трехвалентного железа активно применяются благодаря их лучшей переносимости.
В современной клинической практике используются различные варианты сочетаний двухвалентного железа с витаминами С, В9, В12, что позволяет минимизировать побочные эффекты и одновременно повысить эффективность терапии, однако переносимость такого лечения до настоящего времени была основным лимитирующим фактором [20, 33]. Анализ переносимости различных препаратов железа более чем у тысячи пациентов показал, что современная жидкая форма двухвалентного железа (препарат тотема, лаборатория Иннотек Интернасиональ, Франция) по количеству побочных эффектов не превышает таковые у трехвалентного (рис. 4) [4]. Такой эффект достигается равномерным распределением препарата по слизистой оболочке желудка и его высокой биодоступностью. Двухвалентное железо равномерно и максимально эффективно проникает в энтероциты и, не накапливаясь в них, поступает в кровь. Это обусловлено наличием в составе препарата меди и марганца, которые входят в состав ДМТ-белков и гефестина, окисляющего железо, что способствует наилучшему его метаболизму (см. рис. 2) [33]. Помимо этого, указанные металлы участвуют в работе системы антиоксидантов, наиболее важными составляющими которой являются Cu, Zn-супероксиддисмутаза, Mn-супероксиддисмутаза (в митохондриях), каталаза, глутатионпероксидаза и глутатион. При уменьшении антиоксидантной защиты происходит сдвиг в сторону избыточного накопления свободных радикалов, что обусловливает их повреждающее действие на клетки. Следует понимать, что процесс активации перекисного окисления липидов запускается ионами двухвалентного железа, что проявляется частым развитием побочных эффектов при лечении препаратами железа. Наличие меди и марганца в составе тотемы уменьшает образование свободных радикалов, что улучшает переносимость препаратов железа [37].
Пациентам с заболеваниями ЖКТ назначать препараты железа перорально следует с осторожностью, причем острые заболевания, такие как язва желудка и двенадцатиперстной кишки, эрозивный гастрит, являются противопоказаниями; также не следует использовать указанный метод лечения у больных с заболеваниями тонкой кишки (болезнь Крона, целиакия, мальабсорбция) или отсутствием ее части.
Рис. 4. Сравнение результатов исследований безопасности применения различных железосодержащих препаратов.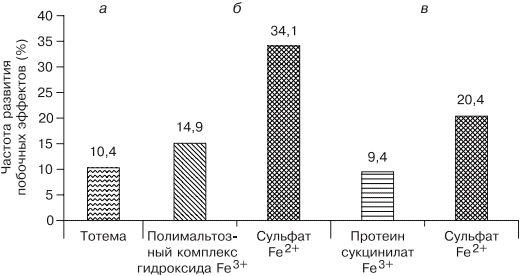
Fe2+— двухвалентное железо; Fe3+ — трехвалентное железо.
При лечении больных ЖДА остро стоит вопрос оценки эффективности терапии, так как часто ЖДА диагностируется у соматически тяжелых больных с крайне низким уровнем гемоглобина. Попытки ранней диагностики, как правило, связаны с исследованием количества ретикулоцитов [38], однако в настоящее время такой подход не является доказательным, так как часто ретикулоцитоз возникает компенсаторно при наличии кровотечения. В работе [5, 9] показано, что наиболее достоверными показателями, указывающими на хороший эффект препаратов железа, служат появление молодых форм ретикулоцитов и увеличение дельты гемоглобина (разницы между средним содержанием гемоглобина в ретикулоците и эритроците) уже через 1 нед после начала лечения (рис. 5).
Рис. 5. Динамика гемоглобина эритроцитов (RBC), количества ретикулоцитов (Ret), фракции незрелых ретикулоцитов (IRF-) среднего содержания гемоглобина в эритроците (RBC-Hb), среднего содержания гемоглобина в ретикулоците (Ret-Hb), дельты гемоглобина (D-Hb) при лечении ЖДА в течение 1 мес. 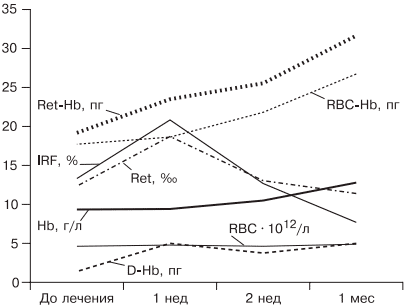
Основным критерием положительного ответа на терапию ЖДА является прирост уровня гемоглобина через 1 мес после начала применения препаратов железа, однако рекомендации разных организаций по этому вопросу не согласуются друг с другом. Минимальным приростом уровня гемоглобина в периферической крови для признания терапии эффективной является его увеличение более чем на 10 г/л за 1 мес (Центр по контролю и профилактике заболеваний в США) [39]. В нашем исследовании, проведенном при лечении 61 пациентки с гинекологической патологией и заболеваниями ЖКТ, у которых лечение привело к полному восстановлению показателей гемоглобина и обмена железа, прирост уровня гемоглобина в течение первого месяца составил от 10 до 50 г/л с медианой прироста 30 г/л [19]. Поэтому с учетом большого количества сопутствующих заболеваний у больных ЖДА и доказанной роли гепцидина в нарушении метаболизма железа за оптимальный критерий оценки эффективности терапии лучше принять прирост уровня гемоглобина более 10 г/л за 1 мес [5].
При отсутствии прироста уровня гемоглобина, согласно указанным критериям, необходимо обязательно исследовать обмен железа, провести диагностический поиск, исключить другой механизм развития анемии. При подтверждении абсолютного дефицита железа и отсутствии злокачественной опухоли следует перейти на парентеральное применение препаратов железа со строго рассчитанной терапевтической дозой. При назначении препаратов парентерально предпочтение следует отдавать внутривенному пути введения. Наиболее часто в настоящее время используются венофер (100 мг в 5 мл), космофер, феринъект (50 мг в 1 мл). За один раз, как правило, вводят 100—200 мг, но, используя феринъект, это количество можно увеличить до 1000 мг. Эти препараты должны применяться только при наличии показаний, доказанном абсолютном дефиците железа и невозможности перорального применения. Существенным недостатком парентерального применения является то, что необходимо использовать строго рассчитанное количество препарата, врач может назначать препараты только в условиях стационара, применение препаратов ограничено из-за наличия большого количества тяжелых побочных реакций (анафилактический шок, аллергические реакции, передозировка железа, системный гемосидероз, локальный гемосидероз тканей). Кроме того, как правило, есть ограничения парентерального применения препаратов при беременности, особенно в ранние сроки.
В случае отсутствия гипоферритинемии есть основания проводить лечение анемии с использованием препаратов рекомбинантного человеческого эритропоэтина, эффективность которого доказана при терапии ЖДА в поздние сроки беременности [28] и у больных с миомой матки [40, 41]. Такую тактику необходимо выбирать у больных с доказанными хроническими воспалительными или инфекционными заболеваниями, доброкачественными опухолями при наличии синдрома неадекватной степени тяжести анемии выработки эритропоэтина [5, 19, 28].
Таким образом, оптимальным у больных с наличием гипохромной микроцитарной анемии является выявление причины развития дефицита железа, после чего следует начинать лечение. Если есть сомнения в железодефицитном характере анемии, лучше проверить обмен железа, подтвердив диагноз ЖДА низкими показателями ФС и насыщения трансферрина железом. Далее следует устранить хроническое заболевание, остановить кровотечение, убрать погрешности в диете и начать пероральный прием препаратов железа (с обязательным учетом противопоказаний). Лечение следует начинать с двухвалентных препаратов железа. При наличии хронических воспалительных, пролиферативных, инфекционных заболеваний лучше использовать жидкую лекарственную форму (препарат тотема), содержащую в своем составе глюконат двухвалентного железа, медь и марганец. Через 1 мес следует определить прирост уровня гемоглобина и если он выше 10 г/л в месяц — продолжить лечение, если нет — пересмотреть диагноз (рис. 6).
Рис. 6. Схема лечения ЖДА.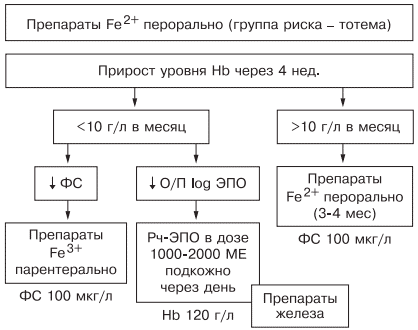
При использовании препаратов железа необходимо ориентироваться на показатель ФС, целевое значение которого должно составлять около 100 мкг/л, после чего можно остановить лечение (поздние критерии эффективности терапии [39]). При пероральном приеме препаратов достаточно подтвердить нормализацию содержания ФС через 3 мес терапии, при назначении препаратов железа внутривенно этот показатель необходимо проверять каждую неделю. Лечение препаратами рекомбинантного человеческого эритропоэтина опасно из-за возможности развития эритроцитоза и тромботических осложнений, поэтому ориентироваться прежде всего необходимо на уровень гемоглобина, целевая концентрация которого не должна превышать 120 г/л [42].
Таким образом, ЖДА представляет собой важную социально значимую проблему, а ее диагностика и лечение до сих пор являются трудной задачей. Только выполнение современных рекомендаций позволит существенно повысить качество и эффективность оказания медицинской помощи больным ЖДА.
Сведения об авторах:
Российский университет дружбы народов, Москва
Кафедра госпитальной терапии с курсом клинической лабораторной диагностики Стуклов Николай Игоревич — д-р мед. наук, проф. кафедры; руководитель курса гематологии;
Семенова Елена Николаевна — учебный мастер кафедры.
ЛИТЕРАТУРА
1. Козинец Г.И., Сарычева Т.Г., Луговская С.А. и др. Гематологичекий атлас: настольное руководство врача-лаборанта. М.: Практическая медицина; 2008.
2. The prevalence of anaemia in women: a tabulation of availablein-formation. Geneva, World Health Organization, 1992(WHO/MCH/ MSM/92.2).
3. Шеффер Р.М., Гаше К., Хух Р., Краффт А. Железное письмо: рекомендации по лечению железодефицитной анемии. Гематол. и трансфузиол. 2004; 49 (4): 40—8.
4. Стуклов Н.И., Семенова Е.Н. Безопасная терапия железодефицитной анемии. Сравнение данных метаанализа 30 исследований (1077 пациентов) тотема с данными переносимости других препаратов. В кн.: Материалы VI научно-практической конференции «Современная гематология. Проблемы и решения». М.; 2012: 30—1.
5. Стуклов Н.И., Козинец Г.И., Леваков С.А., Огурцов П.П. Анемии при гинекологических и онкогинекологических заболеваниях. М.: МИА; 2013.
6. Демихов В.Г., Морщакова Е.Ф., Павлов А.Д. Роль гепцидина в патогенезе анемии хронических болезней. Гематол. и трансфузиол. 2006; 5: 31—4.
7. Левина А.А., Казюкова Т.В., Цветаева Н.В., Сергеева А.И., Мамукова Ю.И., Романова Е.А. и др. Гепсидин как регулятор гомеостаза железа. Педиатрия. 2008; 87 (1): 67—74.
8. Цветаева Н.В., Левина А.А., Казюкова Т.В., Романова Е.А., Цыбульская М.М., Сергеева A.M. и др. Гепсидин как регулятор гомеостаза железа. Педиатрия. 2008; 1: 67—74.
9. Kemna E., Pickkers P., Nemeth E. et al. Time course analisis of hepcidin, serum iron and plasma cytokine levels in humans injected with LPS. Blood. 2005; 106 (5): 1864—6.
10. Deicher R., Horl W.H. New insights into the regulation of iron homeostasis. Eur. J. Clin. Inv.2006; 36: 301—8.
11. Detivaud L., Nemeth E., Boudjema K. et al. Hepcidin levels in humans are correlated with hepatic iron stores, hemoglobin levels and hepatic function. Blood. 2005; 106 (2): 746—8.
12. Papanikolaou G., Tzilianos M., Christakis J.I. Hepcidin in iron overload disorders. Blood. 2005; 10: 4103—5.
13. Park C.H., Valore E.V., Waring A.J. et al. Hepcidin: a urinary antibacterial peptide synthesized in the liver. J. Biol. Chem. 2001; 276: 7806—10.
14. Левина А. А., Цибульская М. М., Щербинина С. П., Романова Е. А., Мамукова Ю. И. Диагностическое значение комплексного исследования показателей метаболизма железа в клинической практике. Гематол. и трансфузиол. 2005; 5: 23—8.
15. Hunt J.R., Roughead Z.K. Adaptation of iron absorption in men consuming diets with high or low iron biovavailability. Amer. J. Clin. Nutr. 2000; 71: 94—102.
16. Nemeth E., Valore E.V., Territo M. et al. Hepcidin a putative mediator of anemia of inflammation is a type II acutephase protein. Blood. 2003;101: 2461—3.
17. Nemeth E., Rivera S., Gabajan V. et al. IL6 mediates hypoferremia inducing the synthesis of the iron regulatory hormone hepcidin. J. Clin. Inv. 2004; 113 (9): 1271—6.
18. Nicolas G., Bennoun M., Porteu A. et al. Severe iron deficiency anemia in transgenic mice expressing liver hepcidin. Proc. Nat. Acad. Sci. USA. 2002; 99: 4596—601.
19. Стуклов Н.И. Показатели эритрона в дифференциальной диагностике, выборе терапии и оценке эффективности лечения анемий при гинекологических и онкогинекологических заболеваниях: Автореф. дис. ... д-ра. мед. наук. М.; 2011.
20. Тарасова И.С., Чернов В.М. Принципы выбора препарата для лечения железодефицитной анемии у детей. Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2006; 10(34): 3—26.
21. Луговская С.А., Почтарь М.Е. Современная оценка состояния эритрона и метаболизма железа. Клин. лаб. диагностика. 2002; 9: 16.
22. Козинец Г.И., Погорелов В.М. и др. Кровь: Клинический анализ. Диагностика анемий и лейкозов. Интерпретация результатов. Практ. Руководство. М.: Медицина XXI. 2006.
23. Higashi O. et al. Mean cellular peroxidase (MCP) of leukocytes in iron deficiency anaemia. Tohoku J. of Experim. Clin. Med. 1967, 93:105—13.
24. Долгов В.В., Луговская С.А., Морозова В.Т., Почтарь М.Е. Лабораторная диагностика анемий: Пособие для врачей. Тверь: «Губернская медицина». 2001.
25. Румянцев А.Г., Тарасова И.С., Чернов В.М. Железодефицитные состояния: причины развития, диагностика и лечение. Медицинский научный и учебно-методический журнал. 2006; 34: 3—26.
26. Луговская С.А., Козинец Г.И. Гематология пожилого возраста. Тверь: Триада. 2010.
27. Pollitt E. Effects of a diet deficient in iron on the growth and development of preschool and school-age children. Food and Nutrition Bulletin. 1991; 13: 110—8.
28. Демихов В.Г. Анемии беременных: дифференциальная диагностика и патогенетическое обоснование терапии: Автореф. дис. ... д-ра. мед. наук. М.; 2003.
29. Balin A. et al. Iron state in female adolescents. Am. J. Dis. Child. 1992; 146: 803—5.
30. Тихомиров А.Л., Сарсания С.И., Ночевкин Е.В. Железодефицитные состояния в гинекологической и акушерской практике. Рус. мед. журн.2003; 11 (16): 941—5.
31. Румянцев А.Г., Морщакова Е.Ф., Павлов А.Д. Эритропоэтин в диагностике, профилактике и лечении анемий. М.: Медпрактика. 2003.
32. Бурлев В.А., Коноводова Е.Н. Синдром неадекватной продукции эритропоэтина у больных миомой матки. Проблемы репродукции. 2004; 3: 27—33.
33. Стуклов Н.И., Семенова Е.Н. Лечение железодефицитной анемии. Что важнее, эффективность или переносимость? Существует ли оптимальное решение? Журнал международной медицины. 2013; 1 (2): 47—55.
34. Стуклов Н.И. Метаанализ данных переносимости питьевой формы глюконата железа (II), меди и марганца (препарат Тотема) при лечении железодефицитной анемии у детей и взрослых. Земскийврач. 2012; 4: 11—20.
35. Toblli J.E., Brignoli R. Полимальтозный комплекс гидроксида железа (III) при железодефицитной анемии. Обзор и мета-анализ. Анемия. Журнал рабочей группы по анемии. 2008; Прил. к № 1: 95—104.
36. Kopcke W., Sauerland M.C. Мета-анализ данных эффективности и переносимости железа протеинсукцинилата при лечении пациентов с железодефицитной анемией разной степени тяжести. Arzneimittel-Forchung/Drug Research. 1995; 45(II): 11: 1211—6.
37. Громова О.А., Торшин И.Ю., Хаджидис А.К. Анализ молекулярных механизмов воздействия железа (II), меди, марганца в патогенезе железодефицитной анемии. Клиническая фармакология и фармаэкономика. 2010; 1: 1—9.
38. Ковригина Е.С., Казанец Е.Г., Карамян Н.А., Айвазова Д.Х., Лукьянова Е.Г., Панфилова Е.Л. Современные методы диагностики железодефицитной анемии у беременных и критерии оценки эффективности ферротерапии. Гинекология. 2005; 7 (2): 90—3.
39. Тарасова И.С., Чернов В.М. Факторы, определяющие правильность и эффективность лечения детей с железодефицитной анемией. Вопросы практической педиатрии. 2011; 6 (3): 49—53.
40. Бурлев В.А., Коноводова Е.Н., Гаспаров А.С., Барабанова О.Э., Коробицын Л.П. Рекомбинантный эритропоэтин в предоперационном лечении анемии у больных миомой матки. Проблемы репродукции. 2003; 5: 23—7.
41. Бурлев В.А., Гаспаров А.С, Коноводова Е.Н., Барабанова О.Э., Коробицын Л.П. Эпокрин в лечении железодефицитной анемии у больных миомой матки после гистерэктомии. Проблемы репродукции. 2003; 6: 59—64.
42. Рукавицын О.А. Актуальные вопросы диагностики и лечения анемии при хронических заболеваниях. Клиническая онкогематология. 2012; 5 (4): 296—304.
REFERENCES
1. Kozinets G.I., Sarycheva T.G., Lugovskaya S.A. et al. Atlas hematology: table-book of physician assistant. Moscow: Prakticheskaya meditsina; 2008 (in Russian).
2. The prevalence of anaemia in women: a tabulation of availablein-formation. Geneva, World Health Organization, 1992(WHO/MCH/ MSM/92.2).
3. Sheffer R.M., Gashe K., Khukh R., Krafft A. Iron letter: recomandations on iron deficiency anemia treatment. Gematol. i transfuziol. 2004; 49 (4): 40—8 (in Russian).
4. Stuklov N.I., Semenova E.N. Safe treatment of iron deficiency anemia. Meta-analisis of 30 researches (1077 patients) totema comparison with the data on other drug sto lerability. In.: Materials of the VI Scientific Conference»Modern hematology. Problems and decisions». Moscow; 2012: 30—1 (inRussian).
5. Stuklov N.I., Kozinets G.I., Levakov S.A., Ogurtsov P.P. Anemias in gynecological and oncogynecological diseases. Moscow: MIA; 2013 (in Russian).
6. Demikhov V.G., Morshchakova E.F., Pavlov A.D. Hepcidin role in the anemias of chronic diseases pathogenesi. Gematol. i transfuziol. 2006; 5: 31—4 (in Russian).
7. Levina A.A., Kazyukova T.V., Tsvetaeva N.V., Sergeeva A.I., Mamukova Yu.I., Romanova E.A. et al. Hepcidin as an iron hemostasis regulator. Pediatriya. 2008; 87 (1): 67—74 (in Russian).
8. Tsvetaeva N.V., Levina A.A., Kazyukova T.V., Romanova E.A., Tsybul’skaya M.M., Sergeeva A.M. et al. Hepcidin as an iron hemostasis regulator. Pediatriya. 2008; 1: 67—74 (in Russian).
9. Kemna E., Pickkers P., Nemeth E. et al. Time course analisis of hepcidin, serum iron and plasma cytokine levels in humans injected with LPS. Blood. 2005; 106 (5): 1864—6.
10. Deicher R., Horl W.H. New insights into the regulation of iron homeostasis. Eur. J. Clin. Inv.2006; 36: 301—8.
11. Detivaud L., Nemeth E., Boudjema K. et al. Hepcidin levels in humans are correlated with hepatic iron stores, hemoglobin levels and hepatic function. Blood. 2005; 106 (2): 746—8.
12. Papanikolaou G., Tzilianos M., Christakis J.I. Hepcidin in iron overload disorders. Blood. 2005; 10: 4103—5.
13. Park C.H., Valore E.V., Waring A.J. et al. Hepcidin: a urinary antibacterial peptide synthesized in the liver. J. Biol. Chem. 2001; 276: 7806—10.
14. Levina A.A., Cybulskaya M.M., Shcherbinina S.P., Romanova E.A., Mamukova Y.I. Diagnostic value of a comprehensive study of metabolism of iron in clinical practice. Gematologiya i transfuziologiya. 2005; 5: 23—8.
15. Hunt J.R., Roughead Z.K. Adaptation of iron absorption in men consuming diets with high or low iron biovavailability. Amer. J. Clin. Nutr. 2000; 71: 94—102.
16. Nemeth E., Valore E.V., Territo M. et al. Hepcidin a putative mediator of anemia of inflammation is a type II acutephase protein. Blood. 2003;101: 2461—3.
17. Nemeth E., Rivera S., Gabajan V. et al. IL6 mediates hypoferremia inducing the synthesis of the iron regulatory hormone hepcidin. J. Clin. Inv. 2004; 113 (9): 1271—6.
18. Nicolas G., Bennoun M., Porteu A. et al. Severe iron deficiency anemia in transgenic mice expressing liver hepcidin. Proc. Nat. Acad. Sci. USA. 2002; 99: 4596—601.
19. Stuklov N.I. Erythron indexes in differential diagnosis, therapy choose and threatment efficiency evaluation in anemias of gynecological and oncogynecological diseases. Diss. Moscow; 2011. (in Russian).
20. Tarasova I.S., Chernov V.M. Principles of choosing a drug for iron deficiency anemia treatment in children. Voprosy gematologii/onkologii i immunopatologii v pediatrii. 2006; 10 (34): 3—26 (in Russian).
21. Lugovskaya S.A., Pochtar’ M.E. Modern evaluation of the erythron and iron metabilism. Klinicheskaya laboratornaya diagnostika. 2002; 9: 16 (in Russian).
22. Kozinets G.I., Pogorelov V.M. et al. Blood film. Anemias and leukemias diagnosis. Results interpretation. Pract. manual. Moscow: Meditsina XXI. 2006 (in Russian).
23. Higashi O. et al. Mean cellular peroxidase (MCP) of leukocytes in iron deficiency anaemia. Tohoku J. Experim. Clin. Med. 1967, 93:105—13.
24. Dolgov V.V., Lugovskaya S.A., Morozova V.T., Pochtar’ M.E. Laboratory diagnosis of anemias: Tutorial for doctors. Tver: «Gubernskaya meditsina». 2001 (in Russian).
25. Rumyantsev A.G., Tarasova I.S., Chernov V.M. Irondeficiency: causes, diagnosisand treatment. Meditsinskiy nauchnyy i uchebno-metodicheskiy zhurnal. 2006; 34: 3—26 (in Russian).
26. Lugovskaya S.A., Kozinets G.I. Geriatric hematology. Tver: Triada. 2010 (in Russian).
27. Pollitt E. Effects of a diet deficient in iron on the growth and development of preschool and school-age children. Food and Nutrition Bulletin. 1991; 13: 110—8.
28. Demikhov V.G. Anemiasinpregnancy: differential diagnosis and pathogenetic justification of the treatment. Diss. Moscow. 2003 (in Russian).
29. Balin A. et al. Iron state in female adolescents. Am. J. Dis. Child. 1992; 146: 803—5.
30. Tikhomirov A.L., Sarsaniya S.I., Nochevkin E.V. Irondeficiency in gynecological and obstetricpractice.Tusskiy meditsinskiy zhurnal. 2003; 11 (16): 941—5.
31. Rumyantsev A.G., Morshchakova E.F., Pavlov A.D. Erythropoietinin diagnosis, prophylaxis and treatment of anemias. M.: Medpraktika. 2003 (in Russian).
32. Burlev V.A., Konovodova E.N. Non-adequate erythropoietin production syndrome in patients with hysteromyoma. Problemy reproduktsii. 2004; 3: 27—33 (in Russian).
33. Stuklov N.I., Semenova E.N. Iron deficiency anemia treatment. What is more important, efficiency or tolerability? Is there an optimal decision? Zhurnal mezhdunarodnoy meditsiny. 2013; 1 (2): 47—55 (in Russian).
34. Stuklov N.I. A meta-analysis of data portability drinking form ferric gluconate (II), copper and manganese (Totem drug) in the treatment of iron deficiency anemia in children and adults. Country Doctor 2012; 4: 11—20.
35. Toblli J. E., Brignoli R. Polymaltose complex iron hydroxide (III) with iron deficiency anemia. Review and meta-analysis. Anemia. Journal of the working group on anemia. 2008; Suppl.1: 95—104.
36. Kopcke W., Sauerland M.C. A meta-analysis of efficacy and tolerability of iron proteinsuktsinilata in patients with iron deficiency anemia of varying severity. Arzneimittel- Forchung/ Drug Research. 1995; 45(II), 11: 1211—6.
37. Gromova O.A., Torshin I.Yu., Khadzhidis A.K. Analysis of molecular impact of iron (II), copper, manganesein the iron deficiency anemia pathogenesis. Klinicheskaya farmakologiya i farmaekonomika. 2010; 1: 1—9 (in Russian).
38. Kovrigina E.S., Kazanets E.G., Karamyan N.A., Ayvazova D.Kh., Luk’yanova E.G., Panfilova E.L. Modern methods of iron deficiency anemia diagnosis and treatment efficiency evaluation criteria in pregnancy. Ginekologiya. 2005; 7 ((2): 90—3 (in Russian).
39. Tarasova I.S., Chernov V.M. Defining factors in right and effective treatment of children with iron deficiency anemia.Voprosy prakticheskoy pediatrii. 2011; 6 (3): 49—53 (in Russian).
40. Burlev V.A., Konovodova E.N., Gasparov A.S., Barabanova O.E., Korobitsyn L.P. Recombinant erythropoietin in pre-operative treatment of patients eith hysteromyoma. Problemy reproduktsii. 2003; 5: 23—7 (in Russian).
41. Burlev V.A., Gasparov A.S., Donovodova E.N., Barabanova O.E., Korobitsyn L.P. Epocrinin iron deficiency treatment in patients eith hysteromyoma after hysterectomy. Problemy reproduktsii. 2003; 6: 59—64 (in Russian).
42. Rukavitsyn O.A. Topical problems of anemia in chronic diseases diagnosis and treatment. Klinicheskaya onkogematologiya. 2012; 5 (4): 296—304 (in Russian).
Комментарии
ПРАКТИКА ПЕДИАТРА
