Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
 pikfarma.ru
pikfarma.ru

Аксамон® ( ипидакрин ) – ингибитор холинэстеразы:
при невритах, полиневритах и полинейропатиях;
при бульбарных параличах и парезах;
при миастении и различных миастенических синдромах;
при болезни Альцгеймера и сенильной деменции
Патогенетические механизмы травматической болезни головного мозга и основные направления их коррекции
СтатьиОпубликовано в журнале:
«Журнал неврологии и психиатрии», 2009, №10, с. 42-46
С.А. Живолупов, И.Н. Самарцев, С.В. Коломенцев
Кафедра нервных болезней Военно-медицинской академии, Санкт-Петербург
Pathogenetic mechanisms of traumatic brain disease and main lines of their treatment
S.A. Zhyvolupov, I.N. Samartsev, S.V. Kolomentsev
Кафедра нервных болезней Военно-медицинской академии, Санкт-Петербург
Для оценки эффективности и переносимости аксамона (ипидакрина) в комплексной терапии больных с черепно-мозговыми травмами обследованы 40 пациентов. В основной группе (20 больных) вместе с традиционной терапией назначался аксамон по 0,02 г 3 раза в день в течение 2 мес, 20 больных контрольной группы получали только традиционную терапию. Перед началом лечения, через 1 и 2 мес больным проводили общеклиническое обследование, электрофизиологические исследования (магнитная диагностика, электронейромиография с исследованием соматосенсорных вызванных потенциалов), КТ (МРТ) головного мозга, осуществляли балльную оценку по шкале неврологических расстройств NIS, вопроснику вегетативных изменений, шкале Гамильтона для оценки тревоги. Аксамон в 1-й месяц лечения продемонтрировал наибольшую эффективность в купировании тревожных нарушений, достоверно большую у пациентов основной группы (pКлючевые слова: черепно-мозговая травма, антихолинэстеразные средства, ипидакрин, аксамон.
To assess efficacy and tolerability of axamon (ipidacrine) in the complex therapy of patients with cranial-brain injuries, 40 patients have been studied. Patients of the main group (20 persons) received, along with traditional therapy, axamon in dose 0,02 g 3 times daily during 2 months and patients of the control group (20 persons) received only traditional therapy. Clinical examination and assessment with NIS, Autonomic Symptoms Questionnaire, Hamilton anxiety scale, electrophysiological study (magnetic diagnostics, electroneuromyography with investigation of somatosensory evoked potentials, brain CT (MRI) have been conducted at the beginning of treatment and 1 and 2 months after. Axamon demonstrated the highest efficacy (pKey words: cranial-brain injury, anticholinesterase drugs, axamon, ipidacrine.
Лечение травм головного мозга является одной из важнейших проблем современной медицины. Это объясняется устойчивой тенденцией к росту черепно-мозговых травм (ЧМТ) как по частоте, так и по тяжести, достигая 30—50% от всех видов травм в мирное время [3, 5, 13, 17]. Ежегодно во всем мире на каждый миллион населения регистрируется от 5000 до 7000 ЧМТ, подавляющее большинство из них (85—90%) — легкие [4, 9]. В нашей стране ежегодно происходит свыше 1,2 млн случаев травм головного мозга [6].
Для военной неврологии травмы головного мозга являются особенно актуальной проблемой, поскольку, например, в ходе локального вооруженного конфликта на Северном Кавказе частота повреждений головного мозга составила 17,9% от общего числа раненых (83% от числа пострадавших неврологического профиля). ЧМТ приводит к возникновению травматической болезни головного мозга (ТБГМ), которая отличается определенной стадийностью в своем развитии — обычно выделяют острый, промежуточный и отдаленный периоды ее развития. Периодизация ТБГМ обусловлена сложной многоуровневой взаимосвязью церебрально-органических, функционально-динамических, личностных и психосоциальных факторов [18]. Особое внимание в последние годы обращено на взрывную травму в связи со значительным увеличением ее частоты, в течение последних 3 лет — до 30—35% [8, 9].
В 50—90% случаев после перенесенной травмы мозга сохраняется неврологическая патология или формируются новые неврологические синдромы, что приводит к потере трудоспособности в 45% случаев, причем большинство пострадавших составляют лица молодого трудоспособного возраста [4, 14]. Экспериментальные и клинические исследования показали, что при ЧМТ возникают патологические изменения в различных участках головного мозга, которые сохраняются в течение многих месяцев после травмы, что является причиной длительных посттравматических расстройств. Так, в 2000 г. около 70 000 взрослых (или 4,7 на 10 000 населения) и 17 600 детей (6,2 на 10 000) были признаны инвалидами вследствие травм всех локализаций, при этом в общей структуре травматизма на долю нарушения функций ЦНС приходилось до 30—40%, а в структуре причин инвалидности — 25— 30% [1, 10]. Указанные обстоятельства определяют проблему последствий ЧМТ не только как медицинскую, но и как социально-экономическую.
Считается, что в основе клинического проявления сотрясения мозга лежит асинапсия, преимущественно функциональная. Экспериментально подтверждено, что морфологическим субстратом сотрясения мозга является нарушение коллоидного равновесия в нервных клетках, что приводит к набуханию синапсов и блокаде афферентных и эфферентных нервных импульсов (охранительное торможение функций). В более тяжелых случаях к ним присоединяются нарушения ультраструктуры осевых цилиндров нейронов вследствие линейного или вращательного ускорения, которое вызывает смещение больших полушарий относительно жестко фиксированного ствола и преходящее повышение внутричерепного давления. В результате происходит натяжение и скручивание длинных аксонов в глубине белого вещества полушарий, мозолистом теле и стволе (диффузное аксональное повреждение). Впервые этот феномен был описан в 1956 г. S. Strich.
В результате последовательно происходят следующие изменения: ретракция и разрыв аксонов с выходом аксоплазмы из нейрона (в первые часы и сутки после травмы), далее формируется реакция микроглиацитов и астроцитов (в течение нескольких дней и недель), и демиелинизация проводящих путей в белом веществе (в течение нескольких недель и месяцев). Соответственно при диффузном аксональном повреждении возможен широкий спектр расстройств — от кратковременной потери сознания (при сотрясении головного мозга) до длительной комы с тяжелыми остаточными явлениями [6].
Вторичное повреждение головного мозга возникает в результате внечерепных осложнений, вызывающих нарушение доставки к мозгу кислорода и питательных веществ (при пневмонии, тромбоэмболии легочной артерии, артериальной гипотензии), или внутричерепных осложнений (внутричерепная гематома, отек мозга, гидроцефалия или инфекция).
К ведущим клиническим синдромам посттравматической энцефалопатии относят симптомы неврологического дефицита, психических изменений (психорганические), вегетативной дизрегуляции (вегетативно-дистонический синдром), астеноневротический синдром, ликвородинамические нарушения. Хроническая посттравматическая энцефалопатия характеризуется, главным образом, астенизацией, диффузной головной болью («тяжелая голова»), головокружением, снижением памяти, расстройством сна, очаговой неврологической микросимптоматикой. При этом характерны трудности в сосредоточении внимания и выполнении интеллектуальных задач, эмоциональная лабильность, полиморфные проявления вегетативной дистонии, ипохондрия. После ЧМТ возможны посттравматическая деменция, развитие которой зависит от характера ЧМТ и возраста пациентов (чаще встречается у пожилых), а также тревожность и депрессия.
При выборе адекватной восстановительной (в частности, лекарственной) терапии при ЧМТ эффективным представляется индивидуальный, патогенетически и физиологически обоснованный подбор фармакологических средств. В настоящее время традиционная терапия ЧМТ включает ноотропные, нейропротекторные, вазоактивные, реопозитивные препараты, антиоксиданты, анксиолитики и витамины. При этом среди основных направлений консервативной терапии наименее изученным является коррекция диашиза (процессов, лежащих в основе функциональных нарушений, происходящих непосредственно после повреждения головного мозга).
В связи с этим представляется перспективным поиск новых препаратов, обладающих многоуровневым воздействием на основные патологические процессы, возникающие при ЧМТ, а также способных оказывать нейромодулирующий и нейропротекторных эффект. Среди всех современных медикаментозных средств наиболее подходит для этих целей антихолинэстеразный препарат аксамон (международное непатентованное название — ипидакрин), обладающий двойным механизмом действия: способностью блокировать калиевую проницаемость мембраны и вызывать обратимое ингибирование антихолинэстеразы (АХЭ).
Ипидакрин (аксамон, NIK247, 9-амино-2,3,5,6,7,8-гексагидро-1Н-циклопента [b] хинолина гидрохлорид моногидрат и др.) был синтезирован в СССР в Институте азотной промышленности и продуктов органического синтеза. В 1988 г. он был разрешен к применению как стимулятор нервно-мышечной передачи для лечения заболеваний периферической нервной системы. Действие ипидакрина основано на способности обратимо ингибировать АХЭ, увеличивая таким образом содержание ацетилхолина в нервно-мышечных синапсах и в головном мозге (за счет хорошей проницаемости через гематоэнцефалический барьер). Помимо этого эффекта ипидакрин способен ингибировать и другой фермент, разрушающий ацетилхолин, бутирилхолинэстеразу [16]. В настоящее время модуляторы метаболизма ацетилхолина в головном мозге рассматриваются как препараты с наиболее доказательной базой в плане коррекции когнитивных и мнестических функций. Также выявлено влияние ипидакрина на ГАМКергическую и катехоламиновую системы, что вкупе с торможением амилоидогенеза в головном мозге предполагает нейропротективное действие ипидакрина [7, 12].
В последнее время ипидакрин рассматривается как препарат, способный модулировать нейропластические изменения в головном мозге, что связано с его М2-агонистической активностью, отражением которой является изменение длиннолатентных потенциалов нейронов СА1 в области гиппокампа [6, 15].
Кроме того, ипидакрин влияет на работу К- и Na-каналов, а также опосредовано увеличивает скорость вхождения ионов кальция в терминаль аксона. Блокада К-каналов вызывает удлинение периода возбуждения в пресинаптическом волокне во время прохождения импульса, что в свою очередь обеспечивает выход больших количеств ацетилхолина в синаптическую щель. С влиянием на Na-каналы связывают седативные и аналгезирующие свойства ипидакрина [2, 11].
Целью настоящей работы явилась оценка эффективности и переносимости препарата аксамон в комплексной терапии больных с ЧМТ. Для этого было выполнено открытое клиническое исследование.
Материал и методы
В исследовании приняли участие 40 пациентов с ЧМТ с давностью травмы от 1 до 132 сут (среднее время от момента получения травмы до начала лечения 65,7 сут).
Критериями исключения из исследования были: возраст старше 70 лет, хронические заболевания печени, повышенные к моменту лечения трансферазы печени (АЛТ, АСТ), судорожный синдром и период после ЧМТ более 140 сут.
Наблюдение большинства пострадавших проходило в амбулаторных условиях, некоторые пациенты в период исследования часть времени находились в условиях стационара. Разрешение на проведение исследований было получено этическим комитетом Военно-медицинской академии им. С.М. Кирова. Все испытуемые предупреждались о проведении исследования и включались в группу только после получения письменного информированного согласия.
Среди всех обследованных 33 (82%) пациента были с сотрясением головного мозга, 1 (3%) — с ушибом головного мозга легкой степени тяжести, 6 (15%) — с ушибом головного мозга средней и тяжелой степени. По обстоятельствам травмы пострадавшие распределились следующим образом: в результате автоаварии — 11 (27%) пациентов, избиение — 18 (44%) , кататравма (падение с высоты больше 3 м) — 3 (8%), взрывная травма — 1 (3%), падение в быту — 7 (18%).
Все пациенты были разделены на 2 однотипные группы, не имеющие достоверно значимых различий по полу, возрасту, индексу массы тела, времени, прошедшему с момента получения ЧМТ до начала лечения: 20 пациентов (14 мужчин, 6 женщин) основной группы наряду с традиционной терапией получали аксамон; 20 больных (12 мужчин, 8 женщин) контрольной группы получали традиционное лечение (ноотропные, вазоактивные, реопозитивные препараты, витаминотерапию, физиотерапию). Аксамон назначался пациентам при отсутствии критериев для исключения (наличие эписиндрома или индивидуальной непереносимости) по 0,02 г 3 раза в день в течение 2 мес.
Перед началом лечения, через 1 мес и по окончании курса больным выполнялись общеклинический и биохимический анализ крови, ЭКГ, УЗИ органов брюшной полости, МРТ (КТ) головного мозга, электрофизиологические исследования — магнитная диагностика, электронейромиография (ЭНМГ) с исследованием соматосенсорных вызванных потенциалов, больным с подозрением на судорожный синдром — электроэнцефалография. Эффективность лечения определялась нами по балльным шкалам: невропатических расстройств NIS, вопроснику вегетативных изменений, шкале Гамильтона для оценки тревоги.
Результаты
В неврологическом статусе на этапе начала лечения у пострадавших в зависимости от степени повреждения головного мозга наблюдались рассеянная очаговая симптоматика или пирамидные и мозжечковые знаки, астеновегетативные расстройства. По данным магнитной диагностики и ЭНМГ, выявлялись признаки застойного торможения в проводящих системах головного и спинного мозга.
Через 1 мес от начала лечения у пациентов основной группы наблюдались положительная динамика в неврологическом статусе, улучшение вегетативного статуса, снижение уровня тревоги. В контрольной группе также наблюдалась положительная динамика по всем шкалам (рис. 1—3).
Рис. 1. Динамика изменения средних значений по шкале неврологических расстройств NIS (в баллах) в контрольной и основной группах.
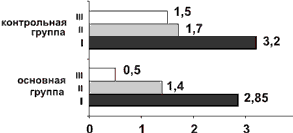
Здесь и на рис. 2, 3: I — до лечения; II — после 1 мес лечения; III — после 2 мес лечения.
Рис. 2. Динамика изменения средних значений индекса вегетативных изменений (в баллах) в контрольной и основной группах.
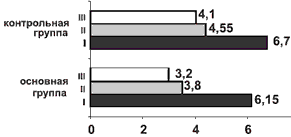
Рис. 3. Динамика изменения средних значений индекса тревожности по шкале тревожности Гамильтона (в баллах) в контрольной и основной группах.
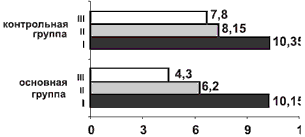
Через 2 мес от начала лечения у пациентов основной группы наблюдались достоверное улучшение в неврологическом и вегетативного статусе (см. рис. 1 и 2) и дальнейшее снижение уровня тревоги (см. рис. 3). В контрольной группе также наблюдалась положительная динамика по результатам оценки неврологического, вегетативного статуса и уровня тревоги.
Сравнительный анализ результатов исследования показал, что аксамон в 1-й месяц приема продемонстрировал наибольшую эффективность в купировании тревожных нарушений, достоверно большую у пациентов основной группы (рЧерез 2 мес от начала приема аксамона было выявлено статистически значимое по сравнению с контрольной группой улучшение состояния пациентов основной группы согласно шкале NIS, а также по индексу тревожности по шкале тревоги Гамильтона (pПо данным функциональных методов исследования — магнитной диагностики и ЭНМГ (см. таблицу) и нейровизуализации (КТ головного мозга) у больных основной группы через 2 мес наблюдалась отчетливая положительная динамика в виде нормализации внутримозговой проводимости и разрешения структурных изменений вещества мозга, возникших при ушибе (рис. 4). У пациентов контрольной группы также наблюдалась положительная динамика нарушений центральной проводимости, но изменения изучаемых показателей не были достоверны.
Динамика показателей центральной проводимости при травматических энцефалопатиях до и через 2 мес после курса лечения аксамоном
| Показатель | Здоровые | ЧМТ | |
| до лечения | после лечения | ||
| Межпиковый интервал (N20—N20), мс | 5,70±0,02 | 12,30±0,02* | 9,30±0,03* |
| Амплитуда кортикального ответа (N20—P25), мкв | 3,2±0,7 | 2,2±0,3* | 2,9±0,2* |
| Время центрального проведения, мс | 8,5±0,9 | 16,6±0,4* | 12,2±0,3* |
Примечание. * — различие с показателями до лечения достоверно (р
Рис. 4. Динамика разрешения структурных изменений вещества мозга у пациента с ушибом головного мозга тяжелой степени, получавшего аксамон.
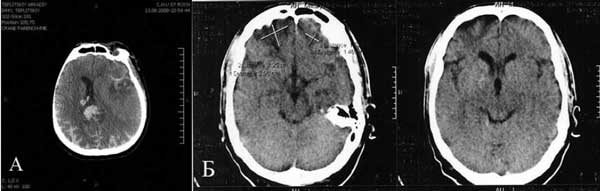
А — до лечения, Б — после лечения.
Побочные явления в группе пациентов, принимавших аксамон, значимо не отличались от таковых в контрольной группе (4 случая возникновения побочного эффекта в контрольной группе против 5 в группе принимавших аксамон), они носили единичный, непродолжительный характер и не служили причиной прекращения приема препарата.
Обсуждение
Ацетилхолин является основным медиатором в центральных проводящих системах мозга. В центральной нервной системе холинергические нейроны находятся в стриатуме, ядре Мейнерта, лимбической системе, коре больших полушарий. Холинергическая система играет определяющую роль в процессах внимания, памяти, обучения, нейропластичности. Ацетилхолинергическая недостаточность приводит к когнитивным и поведенческим нарушениям. Недостаток ацетилхолина в периферической нервной системе ведет к нарушению проведения импульса по периферическим нервам, блоку нервно-мышечной передачи.
В соответствии с асинаптической гипотезой патогенеза ТБГМ, дегенерация холинергических нейронов и снижение уровня ацетилхолина в корковых и подкорковых структурах головного мозга ответственны за развитие облигатных клинических проявлений заболевания — очаговых расстройств, нарушений памяти и высших корковых функций. Поэтому одним из направлений в разработке стратегии лечения ЧМТ считается компенсация холинергической недостаточности. Наиболее эффективным методом такой компенсаторной терапии признается применение антихолинэстеразных препаратов, предотвращающих разрушение ацетилхолина в синаптической щели. Однако частота побочных периферических эффектов даже при использовании нового поколения антихолинэстеразных препаратов, которые обладают обратимым и избирательным центральным действием, нередко не позволяет достичь необходимых терапевтических дозировок этих препаратов и ограничивает возможность их применения.
На протяжении ряда лет аксамон (ипидакрин) как антихолинестеразное средство применяется при различных заболеваниях периферической и центральной нервной системы. Вместе с тем описаны редкие побочные эффекты ипидакрина в виде гиперсаливации, брадикардии, головокружения, тошноты, аллергических реакций (зуд, кожные высыпания). Хотя аксамон осуществляет обратимое ингибирование АХЭ, в отличие от других антихолинэстеразных средств он способен блокировать калиевую проницаемость мембраны не только в нервно-мышечном синапсе, но и в нейронах центральной нервной системы. Это приводит к продлению реполяризационной фазы потенциала действия мембраны и к усилению функциональной активности как мышц, так и холинергических нейронов различных структур головного мозга. У ипидакрина имеется еще одно чрезвычайно важное, хотя и умеренно выраженное свойство — способность блокировать проницаемость нейронных мембран для ионов натрия, с чем связаны его анальгетические и седативные свойства. Кроме того, продление фазы поляризации нейронов центральной нервной системы объясняет положительное влияние этого препарата на мнестические и условно-рефлекторные процессы.
Аксамон демонстрирует отчетливый положительный эффект в комплексном лечении травматических энцефалопатий. Реализация терапевтического эффекта аксамона осуществляется посредством ликвидации нейрофункциональных нарушений (купирование застойного торможения нейрональных сетей и их взаимосвязей) и прерывания каскада эксайтотоксичности и оксидантного стресса, что увеличивает выживание холинергических нейронов в условиях развития травматической энцефалопатии. Значительное увеличение в условиях травмы содержания возбуждающих аминокислот — L-глутамата и L-аспартата — может приводить к тяжелому функциональному дефекту и гибели нейронов. При этом имеется зависимость между тяжестью травмы и степенью увеличения концентрации глутамата. Однако само по себе увеличение уровня глутамата не является единственной и обязательной причиной гибели нейронов, поскольку ряд других факторов определяет подверженность нейронов повреждениям даже при нормальном уровне глутамата, например снижение потенциала покоя клеточных мембран или накопление ионов кальция внутри клеток. Также имеют значение возникновение оксидантного стресса, воспалительные реакции и нарушение гематоэнцефалического барьера [22]. Повышение в условиях травмы уровня внеклеточного глутамата приводит к активизации глутаматных рецепторов и избыточному поступлению ионов кальция в клетки, нарушению функционирования митохондриальных структур с формированием оксидантного стресса. Поэтому целью нейропротективной терапии при ЧМТ на клеточном и молекулярном уровнях является уменьшение образования свободных радикалов, снижение процессов перекисного окисления липидов, эксайтотоксичности и избыточного поступления ионов кальция в клетки. В связи с этим чем раньше начинается использование аксамона в комплексной терапии пострадавших с ЧМТ, тем быстрее наступает разрешение диашиза.
Таким образом, впервые проведено клиническое наблюдение пациентов с ЧМТ с применением в комплексной терапии аксамона (ипидакрин) с целью оценки его эффективности в лечении пострадавших. Получен отчетливый положительный эффект, ни в одном из случаев не выявлены значимые побочные явления, все пациенты переносили препарат хорошо.
Полученные результаты позволяют рекомендовать аксамон к широкому использованию в клинической практике при ЧМТ, тем более что его многоуровневое воздействие на нервную систему позволяет предполагать в реализации положительного эффекта препарата наличие не только центральных механизмов, но и периферических. Для выяснения точек приложения действия аксамона при лечении ЧМТ, а также для разработки методических рекомендаций (дозы, курсы, методы введения) по включению его в комплексную терапию пациентов, целесообразно проведение дальнейших экспериментальных и клинических исследований.
ЛИТЕРАТУРА
1. Акимов Г.А. и др. Особенности течения последствий нетяжелых черепно-мозговых травм у лиц молодого возраста. Военно-мед журн 1993;1:31—39.
2. Воскресенская О.Н., Терещенко С.В., Шоломов И.И. Объективные характеристики острого периода сотрясения головного мозга. Нейрохирургия 2003;4:31—35.
3. Живолупов С.А. Травматические невропатии и плексопатии (патогенез, клиника, диагностика и лечение): Автореф. дис. ... д-ра мед. наук. Ст-Петербург 2000;43.
4. Живолупов С.А., Самарцев И.Н., Коломенцев С.В. Опыт применения препарата “Аксамон” в комплексной терапии больных с черепно-мозговыми травмами в восстановительном периоде. Российский национальный конгресс «Человек и лекарство», 16-й: Материалы. М 2009;100—101.
5. Жулев Н.М., Яковлев Н.А. Легкая черепно-мозговая травма и ее последствия. М 2004;23—25.
6. Лихтерман Л.Б. Очаговые ушибы головного мозга. Мед газета 2001;20—21.
7. Магалов Ш.И., Пашаева Т.С. Последствия легких закрытых черепно-мозговых травм: вопросы терминологии и классификации. Неврол журн 2002;6:16—19.
8. Одинак М.М. Невропатология сочетанной черепно-мозговой травмы: Автореф. дис. ... д-ра мед. наук. Ст-Петербург 1995;32—35.
9. Одинак М.М. Структура боевой травмы мозга и организация оказания неврологической помощи на этапах медицинской эвакуации в вооруженных конфликтах. Военно-мед журн 1997;1:56—62.
10. Потапов А.А. Доказательная нейротравматология. М: Внешторгиздат 2003;204—225.
11. Рыболовлева А.Г. Причины и структура сотрясений головного мозга у военнослужащих внутренних войск в условиях повседневной служебной деятельности и локального вооруженного конфликта. Медицина катастроф 2008;2:62:55—56.
12. Филатова М.М. Клиника и исходы сотрясения головного мозга: сопоставление результатов у пострадавших стационированных и отказавшихся от госпитализации. М: Медицина 2003;4:27—31.
13. Фраерман А.П. Проблема черепно-мозговой и сочетанной травмы на современном этапе. Актуальные проблемы нейрохирургии: сборник трудов, посвященный 40-летию Нижегородского нейрохирургического центра. Нижний Новгород 2003;23—47.
14. Dillingham T.R., Spellman N.T., Braverman S.E. et al. Analysis of casualties referred to Army physical medicine services during the Persian Gulf conflict. Am J Phys Med Rehabil 1993;72:214—218.
15. Geijerstam J.L., Britton M. Mild head injury-mortality and complication rate: meta-analysis of findings in a systematic literature review. J Acta Neu-rochirurgica 2003;4:34—36.
16. Marin R. Physical medicine and rehabilitation in the military: the Bosnian mass casualty experience. Milit Med 2001;166:335—337.
17 . Marin R. Physical Medicine and Rehabilitation in the Military: Operation Iraqi Freedom. Milit Med 2006;34—45.
18. Zigmond A.S., Snaith R.P. The hospital Anxiety and Depression Scale. Acta Psychiat Scand 1983;67:361—370.

