Лечение локализованного рака предстательной железы стадии Т1-2
Статьи| »» Содержание | Б.П. Матвеев, Б.В. Бухаркин, В.Б. Матвеев |
Глава 6. Лечение рака предстательной железы
Лечение рака предстательной железы, так же, как и всех онкологических заболеваний, определяется стадией болезни. Однако если в отношении больных с местнораспространенной опухолью или с уже имеющимися метастазами существует более или менее единый подход, то в лечении начальных стадий (Т1-Т2) рака предстательной железы единой точки зрения нет. В настоящее время больному может быть предложено три варианта лечения:
1) радикальная простатэктомия;
2) радикальная лучевая терапия;
3) выжидательная тактика (табл. 22).
Таблица 22. Методы лечения локализованного рака предстательной железы.
1. Радикальная простатэктомия
2. Лучевая терапия
а) наружная
б) внутритканевая
3. Отсроченное лечение
4. Методы в стадии разработки
а) криотерапия
б) лазеротерапия
с) сфокусированный ультразвук высокой интенсивности
Больных раком предстательной железы невозможно подвести под одну схему лечения (табл. 23). Подход во многом должен быть индивидуальным. Остановимся подробно на всех применяемых методах лечения.
Таблица 23. Алгоритм диагностики, определения стадии и лечения рака предстательной железы.
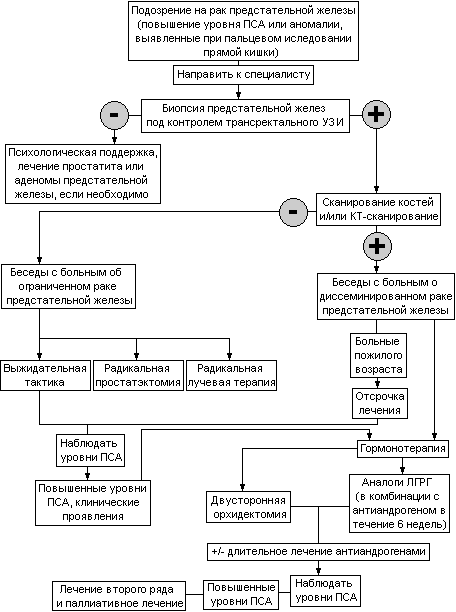
Лечение локализованного рака предстательной железы (Т1-2).
С усилением скринингового контроля населения и внедрением современных методов диагностики (определение простатоспецифического антигена, трансректального УЗИ, магнитного резонанса с использованием ректальных датчиков и т.д.) число впервые диагностированных случаев заболевания раком предстательной железы быстро увеличивается. Естественно, что при этом значительно возросло количество больных с локализованным раком предстательной железы, причем задолго до того, как у них появятся клинические проявления болезни. Увеличение количества вновь выявленных больных, однако не привело к увеличению смертности. Это наглядно отражено в табл. 24 с приведенными данными США.
Таблица 24. Случаи заболевания, смертности и летальности раком предстательной железы в США.
| 1985 | 1991 | 1993 | |
| Заболеваемость (кол-во) | 76.000 | 122.000 | 169.000 |
| Смертность (кол-во) | 27.000 | 32.000 | 34.000 |
| Летальность (%) | 35 | 26 | 20 |
Приводимая статистика вызвала много вопросов, но основной из них: не породила ли ранняя диагностика риск "сверх лечения", так как многие из вновь выявленных случаев рака предстательной железы, даже не леченные, не вызовут смерти больного. Этот же вопрос возникает при сравнении выживаемости у леченных и нелеченных больных начальными стадиями заболевания. Остановимся подробнее на применяемых методах лечения локализованного РПЖ.
Отсроченное лечение. Выжидательная тактика при раке предстательной железы, которая заключается в том, что лечение начинается с появлением клинических симптомов заболевания, до сих пор остается спорной. Если в США стандартным лечением для локализованного рака простаты является простатэктомия или лучевая терапия, отсроченное лечение без первичной терапии практиковалось в Европе, большей частью в Скандинавских странах, где самый высокий уровень заболевания РПЖ.
Наиболее достоверное и хорошо документированное исследование по отсроченному лечению представляет сообщение из Швеции Johansson J. (1994). С марта 1977 по февраль 1994 г. было выявлено 654 больных, но в исследование было взято 223. Первоначально брали больных, у которых опухоль локализовалась лишь в железе и не прорастала капсулу (Т0-Т2) и не выявлялись отдаленные метастазы. Решено было брать только больных с высокодифференцированным раком и моложе 75 лет. В среднем больные наблюдались 12.5 лет. За время наблюдения прогрессирование заболевания отмечено всего лишь у 77 (35%) больных, а умерло 148 (66%), но из них только 23(10%) умерли от рака предстательной железы. Риск прогрессирования и смерти от рака предстательной железы был значительно выше при малодифференцированном раке (3-я гистологическая стадия), нежели при высокодифференцированном. Уровень прогрессирования рака был наибольшим в первые 5 лет (68%) а к 10 годам снизился до 55%. И самое интересное в том, что уровень безметастатической выживаемости был 90% через 5 лет и 83% через 10 лет. Сравнивая полученные данные с литературными, автор отмечает, что 10-летняя выживаемость при простатэктомии равна 93%, при отстроченном лечении - 84% и при лучевой терапии - 74%. Однако подчеркивается, что не существует значительных критериев в пользу того или иного метода лечения, а руководствоваться надо прежде всего качеством жизни. Приведенное исследование Johansson J., хотя и дает очень интересные результаты, но далеко не бесспорно, так как у большей части больных (146 из 223) была высокодифференцированная форма рака предстательной железы, а средней возраст пациентов был 72 года (на этом мы остановимся далее более подробно). Для более четкого представления об отсроченном лечении приводим сводные данные различных авторов, собранные Adolfson J. (1995) (табл. 25).
Таблица 25. Выживаемость больных раком предстательной железы начальных стадий после отсроченного лечения.
| Автор | n | Стадия | Выживаемость в % | ||
| 5 лет | 10 лет | 15 лет | |||
| Moskovitz et al., 1987 | 44 | T1-2 | 61% | 34% | - |
| Graverson et al., 1990 | 50 | T1-2 | 70% | 55% | 32% |
| Johansson et al., 1992 | 117 | T1-2 | 63% | 40% | - |
| Johansson et al., 1992 | 58 | T0-2 | 78% | 58% | - |
| Adolfsson et al., 1991 | 61 | T1-2 | - | 85% | - |
| Adolfsson et al., 1992 | 122 | T1-2 | - | 51% | - |
| Chisholm et al., 1992 | 107 | T0-1 | 65% | 48% | - |
| Stenziet al., 1993 | 34 | T0-2 | 67% | 34% | - |
| Warner & Whilmore | 68 | Тв | - | 72% | 46% |
Как видно из представленной таблицы, десятилетняя выживаемость при отсроченном лечении у различных авторов колеблется от 85% до 34% .
Суммируя все последние публикации, следует сказать, что выжидательная тактика целесообразна у больных пожилого возраста при высокодифференцированных опухолях небольшой величины (Т0-Т2). Особенно это касается больных, имеющих тяжелые сопутствующие заболевания. Такие больные нуждаются в постоянном наблюдении с контролем за уровнем ПСА. Такой же подход возможен у пожилых людей с более крупными опухолями (Т3), так как результаты долгосрочных исследований свидетельствуют о низкой частоте метастазирования у таких больных.
Выжидательная тактика особенно касается людей пожилого и старческого возраста, у которых по прогнозам не ожидается долгой продолжительности жизни с момента выявления заболевания, поскольку у них часто имеются тяжелые сопутствующие заболевания. Однако больным и членам их семей необходимо разъяснять, какие соображения заставляют откладывать активное лечение.
По результатам последних исследований при выжидательной тактике высокодифференцированные опухоли (число баллов Глисона 2-4) метастазируют в 2.1% случаев в год, агрессивные опухоли (число баллов Глисона 7-10) - в 13.5% случаев в год. Больные с опухолями низкой градации живут более 10 лет в 87% случаев; больные с низкодифференцированными опухолями - в 26% случаев.
Лучевая терапия при локализированном раке предстательной железы.
Лучевая терапия при локализованных формах рака предстательной железы применяется уже много лет как метод радикального лечения и в определенной степени является конкурирующим с простатэктомией. Особенно лучевая терапия имеет преимущество у больных с тяжелыми сопутствующими заболеваниями, которые являются противопоказаниями к хирургическому лечению. Важно подчеркнуть, что выживаемость после лучевой терапии близка к таковой после радикальной простатэктомии.
Таблица 26. Критерии отбора больных раком предстательной железы для лучевой терапии.
- Гистологическая верификация рака предстательной железы
- Ограниченный местный рост опухоли
- Достаточная ожидаемая продолжительность жизни, при которой целесообразны попытки полного излечения
- Отсутствие патологии нижнего отдела мочевых путей (особенно обструкции мочевых путей)
- Отсутствие вовлечения в опухолевый процесс ободочной и прямой кишки
Выживаемость после лучевой терапии по литературным данным достигает 15 лет в 40-60% случаев. Это вполне хорошие результаты, и мы еще вернемся к этому вопросу, особенно если учесть, что лечению подвергаются в основном больные старше 60 лет. Получаемые после лечения осложнения чаще всего связаны с дизурией, вплоть до недержания мочи. Очень редко возможно сморщивание мочевого пузыря, гематурия и поражение прямой кишки.
Таблица 27. Преимущества и недостатки лучевой терапии и радикальной простатэктомии в лечении ограниченного рака предстательной железы.
Лучевая терапия
Преимущества:
Недостатки:
- поражение прямой кишки (5-10%)
- недержание мочи (- импотенция (20-30%)
- поражение мочевого пузыря (10-20%)
- гематурия (5-10%)
Радикальная простатэктомия
Преимущества:
Недостатки:
- импотенция (> 50%)
- тяжелое недержание мочи (- тромбоэмболия легочной артерии (- повреждение прямой кишки (- стриктура мочеиспускательного канала (- кровотечение ( Литература
Заридзе Д.Г. Эпидемиология рака простаты. В материалах Европейской гистомы онкологов. Рак простаты. Москва. 1997.
Шолохов В.Н. Роль и место ультразвуковой томографии в диагностике рака предстательной железы. Материалы Европейской школы онкологов "Рак простаты" Москва, 1997.
Armstrong В. and Doll R. Environmental factors and cancer incidence and mortality in different countries,with special reference to dietary practices. Int. J. Cancer, 15, 617-631, (1975).
Armitage T.Y., Cooper E.H., Hewling D.W. et al. The value of the measurement of serum prostate specific antigen in patients with benign prostatic hiperplasia and untreated prostate cancer. Br. Y. Urology, 1998, 62, N6, 584-589
Benson N.C., Wang I.S., Pontuck K.A. et al. Prostate specific antigen density: a means of distinguishing benign prostatic hypertrophy and prostate cancer. J Urol. 1992, 147:815.
Boyle P., Zaridze D.G. Risk factors for prostate and testicular cancer. Eur. J. Cancer, 29A, 7, 1048-1055 (1993).
Blhtestein D.L, Bostwick D.C., Bergstralh E.J. et al. Eliminating the need for bilateral pelvic lymphadenectomy in select patients with prostate cancer. J. Urol. 1994: 151: 13;15.
Brawer M.K., Chetner M.P., Beatie J. et al. Screening for prostate carcinoma i: with prostate-specific antigen. J. Urol. 1992; 147:841
Catalona W.J., Smith D.S., Ratliff T.L. et at. Measurement of prostate- specific antigen in serum as a screening test for prostate cancer. N Engi J Med 1991; 324:1156
Catalona W.J., Smith D.S., Ratiiff T.L. et al. Detection of organ-confined prostate cancer is increased through prostate specific antigen-based screening. JAMA 1993; 27:948
Epstein. Y. Critical issues in grading of adenocarcinomas of the prostate. The Canadian journal of urology June 1997, Supplement 2, 28-33
Ghadirian P., Cadotte M., Lacroix A., Perret Ch. Family gregation of cancer of the prostate in Quebec: The tip of the iceberg. The Prostate, 19,43-52 (1991).
Hill P., Wynder L, Garnes H. and Walker A.R.p. Environmental factors, hormones status and prostatic cancer. Prev. Med., 9, 657-666, 1980.
Hudson M.A., Bohnson R.R., Catolona W.Y. Clinical use of prostate specific antigen in patientswith prostaticcancerY, Urd., 1989, 142, 1011-1017.
Jong F.H., Oishi К., Hayes R.B., Bogdanovicz J., Raatgever J., Maas P.J. van der Yoahima O., Schroder F.H. Peripheral hormone levels in controls and patientswith prostatic cancer or benign prostatic hyperplasia: results from the Dutch-Japanese case-control study. Submitted (1990).
Kabalin J.N., McNeal J.E. et al. Unsuspected adenocarcinoma of the prostatients Undergoing cystoprostatectomyfor other causes: incidence, histology and morphometric observations. J. Urol. 1989; 141:1091
Kapish J., Flooner W.J. et al. Serum PSA adjusted for volume oftrabsition zone /PSAT/ is I ore accurable then PSA adjusted for total gland volune /PSAD/ in detecting adenocarcinoma of the prostate. Urology 1994; 43:601.
Kirby R.S. Pro-treatment staging of prostate cancer: recent advances and future prospects. Prostate cancer, 1997, September, 2-10. Mettlin C., Lilya H. A. Akallikrein - like serine proteas in prostate fluid cleaves the predominant seminal vesicle protein. Y. Clin. Invest., 1985, 76, 1899-1903
Kleer E., Larsen-Keller J.J., Zincke Hatal. Ability of preoperative serum serum prostate specific antigen value to predict pathologic stage and DNA ploidy: influence of clinical stage and tumor grade. Urology 1993; 40:207.
Klein H., Bressel M., Kastendieck H., Voigt K.D. Androgens, adrenal androgen precursors, and their metabolism in untreated primary tumors and lymph node metastases of human prostatic cancer. Am. J. Clin. Oncol. (CCt), II (Suppl.2), 30-36 (1988).
Mandelson M., Wagner E.H., Thompson R.S. PSA screening: a public health dilemma. Annual Review of Public Health. 16. 283- 306, 1995.
Mettlin С., Lee F. et al. The American Cancer Society. National Prostate Cancer Detection Project: findings on the detection of early prostate cancer in 2.425SL, men. Cancer 1991:67:2949-58.
Jimerican Cancer Society. National Prostate Cancer Detection Project. Cancer Suppi. 1995, Vol:75, N 7,1790:94.
Myrtle Y.F., Kimley P.Y., Yvor L.P. et al. Clinical utility of prostate specific antigen (ПСА) in the management for prostate cancer. In advances in cancer diagnosis. San Diego Hybritech Inc., 1986, 1, 1-6.
Osterling J.E., Chute C.C., et al. Longitudinal changes in serum PSA /PSAvelosity/ in a community-based cohort of men. J Urol. 1993; 193:412A.
Osterling Y.E., Yacobsen S.I., Chutte Y. et al. Serum prostate specific antigen in a community based population of healthy men: establishment of age-specific reference ranges Yama 1993, 270:860.
Oesterimg J.E., Suman V.J. et al. PSA-detected /clinical stage T1c or BO/ prostate cancer: pathologically significant tumors. Urol. Clin. North Am. 1993:20:687.
Osterling J.E. Prostate specific antigen: Its role in the diagnostic and staging of cancer: Nat. Conf. Prostate Cancer. Philadelphia, Sep. 29 - Oct. 1, 1994 Cancer. -1996. -75N7, Suppl-C1795-1804.
Fieissig IA., Klocker H. et al. Improvement of prostate cancer (PSA) screening by determination of the ratio free/total PSA in addition to PSA levels - a prospective stady. European Urology Abstracts XI 1 Congress of the European Association of Urology, 1996, Paris.
Parkin, D.M., Muir, C.S., Whelan, S.L, Gao Y.T., Ferlay J., (eds), Powel J. Cancer Incidence in Five Continents, vol. VI, IARC Scientific Publication, N20, Lyon (1992).
Partin A.W., Carter H.B., Chan D.W., et al. Prostate specific antigen in the staging of localized prostate cancer influence of tumor volume and benign hyperplasia. J Urol: 1990; 143:747
Partin A.W, Yoo J., Carter H.B. et al. The use of prostate specific antigen clinical stage Gleason and reason score to predict pathological stage in men with localized te cancer. J. Urol. 1993:150:110.
Pohan Т.Е., Howe G.R., Burch J.D., Jain M. Dietary factors and risk of prostate cancer: a case-control study in Ontario, Canada. Cancer /Causes/ Control, 6, 145-154(1995).
Scaletsky R., Koch M.O., Eckstein C.W. et al., Pathologic findings in prostatecancer detected because of PSA elevation. J. Urol. 1993; 149:303A.
Stamey T.A., Yong N., Hay A.R. et al. Prostate - specific antigen as a serum marker for adenocarcinomaofthe prostate. New Engl., Y. Med. 1987, 317, 909-916/. Carter H.B., Pearson J.D., Wacliwew X. et al. PSA variabilityin menwith BPH. Jtirol. 14;151:312A.
Stenman X.J.H., Leinonen J. et al. A complex between prostate-specific antigen and alphi-I-antidiomotrypsin is the major form prostate-specific antigen in serum of patients with prostatic cancerassay of the complex improves clinical sensitivityfor cancer. Cancer Res. 1991; 51:222.
Talaminii R., La Vecchia C., Decarli A., Negri E., Francheschi S. Nutrition, social factors and prostatic cancer in a Northern Italian population. Br. J. Cancer, 53,817-82
Watt K.W., Lee P.Y., M. Tirnkulu. Human prostate specific antigenistructural and functional similarity with serine proteases Proc. Natl. Acad. Sci USA, 1986, 83, 3166-3170
West D.W., Sslattery M.L., Robinson L.M., French Т.К., Manoney A.W. Adult dietary intake and prostate cancer risk in Utah: a case-control study with spacial emphasis on aggressive tumors. Cancer Causes Control, 2, 85-94(1991).
Zaridse D.G., Boyle P. Cancer of the prostate: epidemiology daetiology. Brit. J. Urol., 59, 493-502(1987).
