Влияние кардиоресинхронизирующей терапии на динамику течения желудочковых тахикардий у пациентов с дилатационной кардиомиопатией и тяжелой сердечной недостаточностью
СтатьиСтатья публикуется по итогам конкурса молодых ученых в рамках конгресса «Сердечная недостаточность ‘2013»
Лебедев Д. И., Минин С. М., Криволапов С. Н.
ФГБУ «НИИ кардиологии» СО РАМН, 634012, Томск, ул. Киевская, д. 111а Ключевые слова: дилатация, желудочковые нарушения ритма, кардиомиопатия, ресинхронизирующая терапия
Keywords: dilatation, ventricular rhythm disorder, cardiomyopathy, resynchronization therapy
Ссылка на эту статью: Лебедев Д. И., Минин С. М., Криволапов С. Н. Влияние кардиоресинхронизирующей терапии на динамику течения желудочковых тахикардий у пациентов с дилатацинной кардиомиопатией и тяжелой сердечной недостаточностью. Журнал Сердечная Недостаточность. 2014;82 (1):39–44.
Резюме
Актуальность. Несмотря на увеличивающиеся показатели выживаемости, достигаемые с помощью новых фармацевтических средств, пятилетняя смертность у больных с диагнозом СН составляет 50 %, причем в большинстве своем летальные исходы наступают внезапно и непредсказуемо. Цель. Выявить влияние кардиоресинхронизирующей (КРТ) терапии на динамику течения желудочковых тахикардий у пациентов с ДКМП и проанализировать возможность использования радионуклидных методов исследования для прогнозирования развития жизнеугрожающих нарушений ритма на фоне проводимого лечения. Материалы и методы. В исследование включено 70 пациентов с ДКМП в возрасте от 32 до 75 лет (55±12 лет), СН III ФК по NYHA, ФВ ЛЖ 30,1±3,8 %, дистанция 6-мин ходьбы составила 290,5±64,3 м, конечно-диастолический объем (КДО) – 220,7±50,9 мл. Всем до проведения КРТ и через год проводилось суточное мониторирование ЭКГ. В первую группу вошло 35 (50 %) пациентов, у которых были диагностированы пароксизмы желудочковой тахикардии (ЖТ), во вторую группу вошло 35 (50 %) пациентов, у которых не было эпизоов ЖТ. Всем имплантированы устройства для КРТ с функцией дефибриллятора. Результаты. Через 1 год у всех пациентов наблюдалась положительная клиническая динамика: увеличилась ФВ ЛЖ до 42,8±4,8 % (p≤0,001), ФК СН уменьшился до II, дистанция 6-мин ходьбы увеличилась до 377,2±45,3 м (p≤0,001), уменьшился КДО ЛЖ до 197,9±47,8 мл (p≤0,005). У 28 (80 %) пациентов в течение 1 года наблюдения не было зарегистрировано ни одного эпизода ЖТ, у 7 (20 %) сохранялись неустойчивые эпизоды ЖТ. У пациентов, у которых в течение 1 года КРТ отмечался прирост ФВ на 14 % и уменьшение КДО на 35 мл, не было зарегистрировано ни одного эпизода ЖТ. Пациенты, у которых сохранялись в течение всего исследования пароксизмы ЖТ, прирост ФВ составил 9 %, а КДО уменьшился лишь на 13 мл. Вторым этапом исследования была проведена оценка влияния изменения дефекта метаболизма миокарда (ДММ) на фоне проводимой КРТ на возможное развитие эпизодв ЖТ. Пациенты, у которых на фоне проведения КРТ ДММ стал менее 15 %, эпизоды ЖТ не были зарегистрированы, если же он превышал 15 % – у пациентов регистрировались пароксизмы ЖТ. Заключение. Эффективная КРТ у пациентов с ДКМП статистически значимо снижает число эпизодов ЖТ. Улучшение метаболизма жирных кислот у больных ДКМП позволяет снизить количество эпизодов ЖТ на фоне проводимой КРТ.
Summary
Background. Despite improved survival rate provided by new pharmaceuticals, 5-year survival of patients diagnosed with HF is 50 % and most of fatal outcomes occur suddenly and unpredictably. Aim. To study the effect of cardiac resynchronization therapy (CRT) on the course of ventricular tachycardia in patients with dilated cardiomyopathy (DCMP) and to analyze a possibility for using radionuclide methods for predicting the development of life-threatening arrhythmias during the treatment. Materials and methods. The study included 70 patients with DCMP aged from 32 to 75 years (55±12 years), NYHA FC III CHF, LV EF 30.1±3.8 %, 6-min walk distance 290.5±64.3 m, and end-diastolic volume (EDV) 220.7±50.9 ml. 34-hour ECG monitoring was performed for all patients prior to and at one year of CRT. The first group included 35 (50 %) patients with paroxysmal ventricular tachycardia (VT); the second group included 35 (50 %) patients without VT episodes. CRT devices with defibrillation option were implanted to all patients. Results. In one year, positive clinical changes were observed in all patients: LV EF increased to 42.8±4.8 % (p≤0.001); HF FC decreased to FC II; 6-min walk distance increased to 377.2±45.3 m (p≤0.001); and LV EDV reduced to 197.9±47.8 ml (p≤0.005). 28 (80 %) patients had no VT episodes over one year; 7 (20 %) patients had unstable VT episodes. Patients with an increase in EF by 14 % and a decrease in EDV by 35 ml did not have any VT episodes over the year. In patients who still had paroxysmal VT during the study, EF was increased by 9 % and EDV was reduced only by 13 ml. The second stage of study included evaluation of the effect of CRT-induced changes in myocardial metabolic defect (MMD) on possible development of VT episodes. Patients with the CRTinduced decrease in MMD to below 15 % did not have VT episodes; when post-treatment MMD exceeded 15 %, the patients had episodes of paroxysmal VT. Conclusion. Effective CRT statistically significantly reduces the number of VT episodes in patients with DCMP. The improvement in fatty acid metabolism resulting from CRT provides a decrease in the number of VT episodes.
Несмотря на увеличивающиеся показатели выживаемости, достигаемые с помощью новых фармацевтических средств, пятилетняя смертность у больных с диагнозом СН составляет 50 % [1, 2], причем в большинстве своем летальные исходы наступают внезапно и непредсказуемо.
Внезапная сердечная смерть (ВСС) у пациентов с СН, имеющих ФК II и III по NYHA, имеет место в 64 и 59 % случаев соответственно, в то время как у пациентов с IV ФК, имеющих наибольшие симптоматику СН и тяжесть заболевания, частота ВСС снижается до 33 %; напротив, значение декомпенсации СН в структуре смертности пациентов возрастает с увеличением ФК и составляет 12 % у пациентов со II ФК, 26 % – с III ФК и 56 % при IV ФК СН [3]. Среди 309 участников исследования CARE-HF, получавших оптимальную медикаментозную терапию (ОМТ), 40,9 % умерли внезапно [4].
Одним из новых перспективных способов лечения ХСН является метод кардиоресинхронизирующей терапии (КРТ). Согласно рекомендациям ВНОК данный метод показан пациентам с ХСН III–IV ФК, шириной комплекса QRS >120 мс и сниженной ФВ ЛЖ (≤35 %), у которых проводимая консервативная терапия неэффективна [5]. В ряде многоцентровых исследований было показано, что КРТ, проводимая на фоне медикаментозной терапии, увеличивает выживаемость больных с высоким ФК ХСН, повышает качество жизни и улучшает систолическую функцию [6].
КРТ внесла существенные изменения в лечение пациентов с медикаментозно рефрактерной СН, сочетающейся с сердечной диссинхронией. К настоящему времени завершены 8 крупных рандомизированных клинических исследований, посвященных КРТ [7–11]. В данных исследованиях наиболее часто в качестве первичных конечных задач использовался функциональный статус. Значительное улучшение пробы 6-мин ходьбы было продемонстрировано параллельно с улучшением ФК, качества жизни и потребления кислорода во время проведения метаболических проб. КРТ увеличивает ФВ, снижает частоту госпитализации по причине СН, при этом наибольшего эффекта удается достичь у пациентов, исходно имеющих III и IV ФК NYHA [7].
Объединенные данные 7 рандомизированных исследований (CARE-HF не включено) сообщают о позитивном влиянии КРТ на показатели летальности вследствие прогрессирования СН [7]. Как было показано в этих исследованиях, КРТ значительно снижает общую летальность, и эффект КРТ становится очевидным уже спустя 3 месяца после имплантации. Некоторые исследования наводят на мысль об антиаритмических свойствах КРТ [4, 11–15], и существуют определенные теоретические и практические данные о том, что бивентрикулярная (БиВ) стимуляция может быть использована для подавления серьезных желудочковых аритмий [16, 17]. Учитывая обобщенные результаты крупномасштабных исследований (COMPANION и CARE-HF), нет ни одного доказательства антиаритмического эффекта КРТ [4, 10, 11]. Более того, антиаритмические преимущества КРТ не были продемонстрированы в двух последовательных крупных исследованиях, непосредственно касающихся изучения возможного снижения частоты развития аритмий при использовании КРТ-Д в сравнении c традиционной ИКД-терапией [18, 19]. Недавно опубликованный мета-анализ больших рандомизированных исследований, посвященных КРТ [20], не выявил статистически значимого эффекта КРТ на частоту встречаемости желудочковой тахикардии / фибрилляции желудочков (ЖТ / ФЖ) в сравнении с терапией ИКД. Кроме того, нельзя исключить риск индукции аритмий БиВ стимуляцией и предположение о том, что улучшение сердечной функции, способствуя снижению смертности от декомпенсации СН, увеличивает тем самым риск ВСС. Как было отмечено выше, ВСС наиболее часто наблюдается у пациентов с легкой и умеренной СН [3]. Поскольку КРТ способствует значительному увеличению функциональных возможностей, пациенты перемещаются в более низкий ФК NYHA и, таким образом, относительное число пациентов с ВСС должно возрастать [21]. Более того, наблюдения свидетельствуют о потенциальном проаритмическом риске развития желудочковых аритмий, ассоциированном с КРТ [21, 22]. К числу наиболее информативных и необременительных для больного способов оценки функционального состояния сердечной мышцы относят методы радионуклидной индикации, которые, в частности, до сих пор не имеют серьезной альтернативы в комплексной оценке сократительной функции сердца [23], его миокардиальной перфузии [24], метаболизма и иннервации [25]. Однако в литературе практически отсутствуют работы, посвященные изучению роли методов радионуклидной индикации в назначении и определении эффективности КРT при СН. Не исключено, что использование данного метода исследования позволит повысить эффективность проводимого лечения и выявить факторы, влияющие на развитие жизнеугрожающих нарушений ритма сердца.
Цель исследования: выявить влияние КРТ на динамику течения желудочковых тахикардий у пациентов с дилатацинной кардиомиопатией (ДКМП) и проанализировать возможность использования радионуклидных методов исследования для прогнозирования развития жизнеугрожающих нарушений ритма на фоне проводимого лечения.
Материалы и методы
В исследование было включено 70 пациентов с ДКМП (34 мужчины и 36 женщин, средний возраст 55±12 лет). Всем больным на базе отделения хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции НИИ кардиологии СО РАМН был выполнен полный комплекс клинико-лабораторных и инструментальных исследований, включавший в себя сбор анамнеза, клиническое наблюдение, ЭКГ, биохимический и морфологический анализы крови, рентгенографию и ЭхоКГ. У всех пациентов имелась СН III ФК по NYHA, ФВ ЛЖ составила 30,1±3,8 %, дистанция 6-мин ходьбы – 290,5±64,3 м, конечно-диастолический объем (КДО) – 220,7±50,9 мл. Всем пациентам до проведения КРТ и через год проводилось суточное мониторирование ЭКГ. Пациенты были разделены на группы по принципу регистрации у них пароксизмов ЖТ. В первую группу вошло 35 (50 %) больных, у которых были диагностированы пароксизмы ЖТ, возникающие на фоне адекватных доз антиаримических препаратов. Вторую группу составили 35 (50 %) пациентов, у которых не были зарегистрированы эпизоды ЖТ. До КРТ всем пациентам выполнена равновесная радионуклидная вентрикулография (РРВГ) с оценкой прироста ФВ ЛЖ, радионуклидная томовентрикулография и перфузионная сцинтиграфия миокарда. Всем имплантированы устройства для КРТ с функцией дефибриллятора. Через 12 месяцев после имплантации кардиостимулятора всем пациентам проводили только радионуклидную томовентрикулографию и перфузионную сцинтиграфию миокарда. Все сцинтиграфические исследования выполняли на гамма–камере «Forte» фирмы «Philips» в лаборатории радионуклидных методов исследования НИИ кардиологии СО РАМН.
Для исследования перфузии сердца выполняли однофотонную эмиссионную компьютерную томографию (ОФЭКТ) миокарда с 99mTc-Технетрилом («Диамед», Россия) в покое через 1 час после внутривенной инъекции радиофармпрепарата (РФП) в дозе 740–925 МБк.
Метаболическую ОФЭКТ миокарда проводили через 3–4 дня после перфузионной сцинтиграфии сердца. Запись нативного сцинтиграфического изображения осуществляли по стандартному протоколу через 15 мин (раннее исследование) и три часа (отсроченное исследование) после инъекции 150 МБк 123I-йодфенил-метилпентадекановой кислоты (123I-ФМПДК) в покое.
Детекторы устанавливали под углом 90 градусов друг к другу. Угол поворота – 90 градусов. Для каждого детектора регистрировали 16 проекций (всего 32 проекции) по 30 секунд каждая в матрицу размером 64×64 пиксела с использованием параллельного высокоразрешающего коллиматора для низких энергий и настройкой гаммакамеры на фотопик 99mТс – 140 кэВ, 123I – 159 кэВ с шириной окна дифференциального дискриминатора 20 %.
Обработку полученных сцинтиграмм проводили при помощи пакетов прикладных программ JetStream® Workspace Release 3.0 (Philips Medical Systems, Netherlands). Реконструкцию сечений сердца по короткой и длинным осям осуществляли при помощи программы AutoSPECT+, анализ полученной информации – с использованием специализированной программы AutoQuant.
Оценку включения РФП в миокард ЛЖ проводили с использованием 17-сегментарной модели ЛЖ и системы полярных координат («бычий глаз») [9].
Анализ локальных нарушений перфузии и метаболизма ЛЖ оценивали по 4-балльной шкале, где: 1 – аккумуляция РФП более 70 % от максимального включения в миокард; 2 – незначительно (умеренно) выраженные дефекты перфузии или метаболизма (от 50 и до 70 % включения изотопа); 3 – значительно выраженные дефекты перфузии или метаболизма (менее 50 % включения РФП) и 4 – отсутствие или очень незначительное включение индикатора в миокард (от 0 до 25 %). При этом определяли средние размеры дефектов перфузии (СРДП), а также средние размеры дефектов метаболизма на раннем (СРДМ Р) и отсроченном (СРДМ ОТСР) исследованиях, вычисленные в процентах от общей площади миокарда ЛЖ.
Статистическая обработка результатов проводилась с использованием пакета программ «STATISTICA for WINDOWS» фирмы StatSoft Inc. Версия 6.0 по правилам вариационной статистики с использованием t-критерия Стьюдента (с уровнем значимости 5 %) для парных и непарных величин.
Результаты
Контрольное обследование было проведено через 1 год. У всех пациентов наблюдалась положительная клиническая динамика: увеличилась ФВ ЛЖ с 30,1±3,8 % до 42,8±4,8 % (p≤0,001), ФК СН уменьшился с III до II, дистанция 6-мин ходьбы увеличилась с 290,5±64,3 м до 377,2±45,3 м (p≤0,001). Уменьшился КДО ЛЖ с 220,7±50,9 до 197,9±47,8 мл (p≤0,005). У 28 пациентов, у которых до проведения ресинхронизирующей терапии регистрировались эпизоды ЖТ, в течение 1 года КРТ не было зарегистрировано ни одного эпизода ЖТ, у 7 сохранялись неустойчивые эпизоды ЖТ. У 35 пациентов без зарегистрированных до проведения бивентрикулярной стимуляции эпизодов ЖТ, в течение года наблюдения также не были зарегистрированы эпизоды ЖТ.
Увеличение ФВ (по данным ЭхоКГ) на фоне КРТ уменьшает частоту развития ЖТ (рис. 1). Увеличение ФВ ЛЖ на фоне проводимой КРТ в течение первых 6 месяцев с 26,8±2,3 % до 39,3±3,4 % и через 1 год до 43,2±4,2 % (р<0,0001) у пациентов с ранее зарегистрированной ЖТ привело к тому, что у пациентов не было зарегистрировано ни одного эпизода ЖТ. Пациенты, у которых через 6 месяцев произошло увеличение ФВ ЛЖ с 26,8±2,3 % до 34,3±1,5 %, а через 1 год до 38,8±1,1 % (p<0,0001), сохранялись эпизоды ЖТ в течение всего периода проведения КРТ. У пациентов, у которых ФВ ЛЖ в первые 6 месяцев КРТ в среднем увеличилась с 31,5±2,7 % до 38,5±3,7 %, а через 1 год до 43,8±5,1 % (р<0,0001), эпизодов ЖТ зарегистрировано не было. Однако у пациентов с ЖТ и без нее прирост составил 12 %. Для того чтобы найти причину, вызывающую развитие ЖТ при одинаковых эффектах КРТ, мы ранжировали пациентов по подгруппам. Было замечено, что повышение ФВ до 40 и более процентов в течение 1 года КРТ позволяет уменьшить количество жизнеугрожающих аритмий. Таким образом, мы выявили, что ФВ влияет на развитие ЖТ у пациентов с ДКМП.
Было отмечено влияние КДО (определенного с помощью ЭхоКГ) на количество эпизодов ЖТ (рис. 2). У пациентов, у которых на фоне КРТ через 6 месяцев объем КДО уменьшился с 199,3±30,6 мл до 187,2±26,2 мл, а в течение 1 года КРТ до 178,5±25,4 мл (p<0,0001), не было зарегистрировано ни одного эпизода ЖТ. В подгруппе пациентов с исходно зарегистрированными эпизодами ЖТ на фоне КРТ динамика уменьшения КДО через 6 месяцев с 266,5±57,4 мл до 243,5±33,2 мл, а через 1 год до 227,3±22,6 мл (p<0,02) привела к исчезновению эпизодов ЖТ. У пациентов, у которых на фоне КРТ, через 6 месяцев КДО уменьшился с 266,5±57,4 мл до 257,4±69,6 мл, а через 1 год КДО уменьшился до 262,3±94,7 мл (p<0,88), эпизоды ЖТ регистрировались в течение всего времени бивентрикулярной стимуляции. Таким образом, проанализировав эти данные, мы пришли к выводу, что динамика уменьшения КДО способствует снижению количества эпизодов ЖТ. Процесс обратного ремоделирования желудочков у пациентов с ДКМП оказывает положительное влияние на профилактику развития ЖТ.
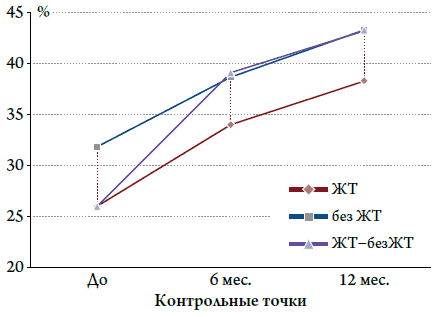
Рисунок 1. Изменение ФВ у пациентов с ЖТ и без при проведении КРТ
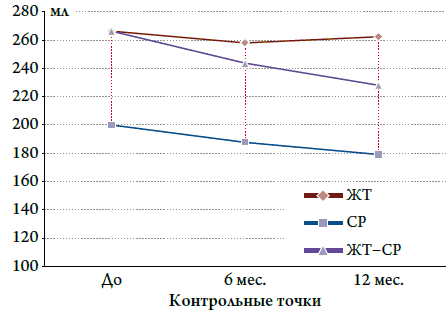
Рисунок 2. Зависимость между изменением размеров КДО и развитием ЖТ
Вторым этапом исследования была проведена оценка влияния изменения дефекта метаболизма миокарда (ДММ), оцененного с помощью методов сцинтиграфической индикации, в течение 1 года ресинхронизирующей терапии на возможное развитие эпизодов ЖТ. Важно отметить, что у всех пациентов до проведения ресинхронизирующей терапии ДММ был более 15 %.
На основании изменения ДММ в течение 1 года ресинхронизирующей терапии пациенты были разделены на 2 группы. В первую вошли 63 (90 %) пациента, у которых в течение 1 года БиВ стимуляции ДММ стал менее 15 %. Во вторую группу вошло 7 пациентов, у которых через 1 год КРТ ДММ составил более 15 %. При сравнении динамики изменения ДММ с регистрацией эпизодов ЖТ у пациентов на фоне БиВ стимуляции, было отмечено, что в группе исследуемых, у которых в через 1 год КРТ ДММ стал менее 15 %, эпизоды ЖТ перестали регистрироваться или не были зарегистрированы вовсе. У пациентов, у которых через 1 год ресинхронизирующей терапии ДММ был более 15 %, регистрировались пароксизмы ЖТ.
Таким образом, мы считаем, что уменьшение ДММ более 15 % позволяет снизить число эпизодов ЖТ.
Обсуждение
Внезапная сердечная смерть остается главной причиной смертности у больных с застойной СН. Кардиоресинхронизирующая терапия приводит к улучшению состояния этих пациентов, способствуя обратному ремоделированию ЛЖ и улучшению сократительной функции миокарда, но при этом остается проблема ВСС [26]. Остается не выясненным влияние этого вида терапии на развитие и течение ЖТ. В ряде исследований проводилась оценка как первичной, так и вторичной профилактики ВСС при патологии сердца, не связанной с поражением коронарных артерий. В работе M. Zecchin было продемонстрировано, что имплантация АИКД абсолютно показана тем больным ДКМП, у которых в анамнезе имеются указания на эпизод остановки сердца. Более того, было выявлено, что имплантация АИКД в случае сочетания сниженной ФВ (ниже 30 %), увеличения конечно-диастолического диаметра ЛЖ более 70 мм, эпизодов неустойчивой ЖТ и длительного анамнеза заболевания, согласно современным данным, является эффективным методом как вторичной, так и первичной профилактики ВСС у больных ДКМП [27].
С целью выявления влияния КРТ на динамику ЖТ пациентов разделили на три подгруппы: без эпизодов ЖТ, с зарегистрированными эпизодами и лица, у которых на фоне проводимой КРТ исчезли эпизоды ЖТ. Поскольку в исследованиях четко отмечаются параметры, влияющие на появление ЖТ, было оценено влияние динамики их изменения на развитие ЖТ. У пациентов, имевших до КРТ эпизоды ЖТ, исчезнувшие на фоне проводимой ресинхронизации ФВ увеличилась с 26,8±2,3 % до 43,2±4,2 % (р<0,0001), а ее прирост составил 17 %. У пациентов, у которых ФВ ЛЖ увеличилась с 26,8±2,3 % до 38,8±1,1 % (p<0,0001), а ее прирост составил 12 %, сохранялись эпизоды ЖТ в течение всего периода КРТ. В подгруппе пациентов, у которых ФВ ЛЖ увеличилась с 31,5±2,7 % до 43,8±5,1 % (р<0,0001), а ее прирост в среднем составил 12 %, эпизоды ЖТ зарегистрированы не были. При оценке полученных результатов было выявлено влияние ФВ на развитие ЖТ у пациентов с ДКМП. У пациентов с исходной ФВ менее 30 % до проведения КРТ регистрировались эпизоды неустойчивой ЖТ. В течение 1 года проведения КРТ у части пациентов ФВ увеличилась до 40 % и более, что совпало с исчезновением эпизодов ЖТ и явилось профилактикой развития ЖТ у тех пациентов, у которых ранее она не была зафиксирована. Таким образом, ФВ менее 30 % способствует развитию ЖТ, повышение же ФВ более 40 % способствует уменьшению эпизодов ЖТ. Вторым показателем, который оценивался у пациентов первой группы и который оказывает влияние на развитие ЖТ – КДО. У больных без зарегистрированных эпизодов ЖТ на фоне КРТ отмечалась положительная динамика – уменьшение КДО со 199,3±30,6 до 178,5±25,4 мл (p<0,0001), в среднем КДО уменьшился на 21 мл. В подгруппе лиц с исходно зарегистрированными эпизодами ЖТ и исчезновением последних на фоне КРТ КДО уменьшилось с 266,5±57,4 до 227,3±22,6 мл (p<0,02), в среднем на 39 мл. У пациентов с эпизодами ЖТ, регистрировавшейся в течение всего года, КДО уменьшился с 266,5±57,4 до 262,3±94,7 мл (p<0,88), в среднем за год – на 4 мл. Таким образом, на основании приведенных данных можно сказать, что в подгруппах больных с незарегистрированными эпизодами ЖТ и исчезнувшими эпизодами ЖТ на фоне КРТ произошло статистически достоверное снижение КДО, в среднем за 1 год на 21 мл и 39 мл соответственно. В то же время у больных с постоянно регистрировавшимися эпизодами ЖТ КДО не изменился, в среднем за 1 год уменьшился всего на 4 мл. Таким образом, статистически значимое уменьшение КДО на фоне КРТ позволяет снизить количество эпизодов ЖТ и профилактировать их развитие в дальнейшем. Это позволяет нам предположить, что уменьшение КДО влияет на развитие ЖТ. Процесс обратного ремоделирования желудочков у пациентов с ДКМП оказывает положительное влияние в плане профилактики развития ЖТ.
Полученные результаты можно объяснить следующим образом. Уменьшение замедления проводимости в желудочках на фоне КРТ, как источника re-entry механизма возникновения ЖТ, достигается исчезновением межжелудочковой диссинхронии и уменьшением КДО. Подтверждением этого являются результаты работы Kies P. с соавт. [28]. Проведение КРТ у пациентов с ДКМП способствует исключению такой важной причины ЖТ, как паузазависимая тахикардия. Постоянная бивентрикулярная стимуляция нивелирует развитие у пациентов ареста синусового узла. Повышение ФВ ЛЖ на фоне КРТ способствует снижению повышенной концентрации норадреналина в плазме крови, как одной из возможных причин развития ЖТ [28]. Снижение симпатической активации может привести к уменьшению электрической нестабильности или уязвимости желудочков, что можно расценить, как косвенное свидетельство антиаритмического эффекта КРТ. Сходные данные были представленны в ряде исследований [29, 30], оценивавших влияние КРТ на вариабельность сердечного ритма и риск развития ЖТ. Также немаловажно, что все вышеприведенные факторы, на которые воздействует КРТ, способствуют появлению у паицентов желудочковых экстрасистол, способствующих развитию ЖТ у пациентов с ДКМП [31, 32]. Как показано в ряде работ, посвященных изучению влияния КРТ на развитие ЖТ [31, 32], исключение этих факторов позволяет снизить частоту желудочковых экстрасистол и тем самым обеспечить профилактику развития ЖТ.
Механизм позитивного влияния КРТ на функцию миокарда до конца не ясен. По всей видимости, на фоне КРТ происходит прерывание порочного круга развития ХСН при желудочковой диссинхронии. Так, восстанавливается фазовая структура сердечного цикла, укорачивается период изгнания крови из ЛЖ и удлиняется время наполнения последнего. Оптимизация атрио-вентрикулярного проведения способствует увеличению времени предсердножелудочкового наполнения. Следствием восстановления синхронности сокращения миокарда является не только улучшение систолической и диастолической функции желудочков, но и восстановление нормальной легочной микроциркуляции. Само по себе улучшение миокардиальной перфузии может быть обусловлено тем, что на фоне КРТ уменьшается дискоординация сокращений кардиомиоцитов, снижается напряжение стенок ЛЖ и экстраваскулярное сжатие коронарных сосудов. Такую же гипотезу высказал и Kjekshus J. K. в своем труде, изданном в 1973 году [33]. Однако до сих пор окончательно не установлен механизм влияния изменений вышеперечисленных факторов на уменьшение числа эпизодов ЖТ. Методы радионуклидной индикации позволяют мониторировать характер изменения перфузии миокарда в процессе лечения.
В проведенном исследовании через 1 год на фоне КРТ в группе пациентов, у которых ДММ стал меньше 15 %, эпизоды ЖТ перестали регистрироваться, что, по-видимому, говорит о том, что участки миокарда с нарушенным метаболизмом, достигая «критической массы» (в нашем случае более 15 %), становятся самостоятельными генераторами патологических импульсов, способствующих развитию эпизодов ЖТ. Так, в исследовании Uebleis с соавт. [34] и Sundell c соавт. [35] была высказана достаточно обоснованная гипотеза о том, что именно выраженность нарушений миокардиального метаболизма, как индикатора жизнеспособности сердечной мышцы, может служить предиктором развития жизнеугрожающих аритмий. Таким образом, выявленная нами зависимость между развитием эпизодов ЖТ и величиной дефекта метаболизма позволяет говорить о возможности прогнозирования развития жизнеугрожающих аритмий у пациентов с тяжелой ХСН на фоне проводимой КРТ.
Список литературы
- Levy D, Kenchaiah S, Larson MG et al. Long-term trends in the incidence of and survival with heart failure. N Engl J Med. 2002;347 (18):1397–1402.
- Johnson RA, Palacios I. Dilated cardiomyopathies of the adult (first of two parts). N Engl J Med. 1982;307 (17):1051–1058.
- MERIT-HF study group. Effect of metoprolol CR / XL in chronic heart failure: Metoprolol CR / XL Randomised Intervention Trial in Congestive Heart Failure (MERIT-HF). Lancet. 1999;353 (9169):2001–2007.
- Cleland JG, Daubert JC, Erdmann E et al. Longer-term effects of cardiac resynchronization therapy on mortality in heart failure [the CArdiac REsynchronization-Heart Failure (CARE-HF) trial extension phase]. Eur Heart J. 2006;27 (16):1928–1932.
- Национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН (третий пересмотр). Журнал Сердечная Недостаточность. 2010;11 (1):3–62.
- Faran A, Lewicka-Nowak E, Dabrowska-Kugacka A et al. Cardiac resynchronisation therapy in patients with endstage heart failure – long-term follow-up. Kardiol Pol. 2008;66 (1):19–26.
- McAlister FA, Ezekowitz JA, Wiebe N et al. Systematic review: cardiac resynchronization in patients with symptomatic heart failure. Ann Intern Med. 2004;141 (5):381–390.
- Bax JJ, Abraham T, Barold SS et al. Cardiac resynchronization therapy: Part 1--issues before device implantation. J Am Coll Cardiol. 2005;46 (12):2153–2167.
- Bax JJ, Abraham T, Barold SS et al. Cardiac resynchronization therapy: part 1 – issues before device implantation; Part 2 – Issues During and After Device Implantation and Unresolved Questions. J Am Coll Cardiol. 2005;46 (12):2168–2182.
- Bristow M, Saxon L, Boehmer J et al. Comparison of Medical Therapy, Pacing and Defibrillation in Heart Failure (COMPANION) Investigators. Cardiac – resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med. 2004 May 20;350 (21):2140–2150.
- Cleland JG, Daubert JC, Erdmann E et al. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med. 2005;352 (15):1539–1549.
- Kies P, Bax JJ, Molhoek SG et al. Effect of cardiac resynchronization therapy on inducibility of ventricular tachyarrhythmias in cardiac arrest survivors with either ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol. 2005;95 (9):1111–1114.
- Garrigue S, Barold SS, Hocini M et al. Treatment of drug refractory ventricular tachycardia by biventricular pacing. Pacing Clin Electrophysiol. 2000;23 (11 Pt 1):1700–1702.
- Thackray S, Coletta A, Jones P et al. Clinical trials update: Highlights of the Scientific Sessions of Heart Failure 2001, a meeting of the Working Group on Heart Failure of the European Society of Cardiology. CONTAK-CD, CHRISTMAS, OPTIME-CHF. Eur J Heart Fail. 2001;3 (4):491–494.
- Arya A, HaghjooM, Dehghani MR et al. Effect of cardiac resynchronization therapy on the incidence of ventricular arrhythmias in patients with an implantable cardioverter-defibrillator. Heart Rhythm. 2005;2 (10):1094–1098.
- Befeler B, Berkovits BV, Aranda JM et al. Programmed simultaneous biventricular stimulation in man, with special reference to its use in the evaluation of intraventricular reentry. Eur J Cardiol. 1979;9 (5):369–378.
- Ermis C, Seutter R, Zhu AX et al. Impact of Upgrade to Cardiac Resynchronization Therapy on Ventricular Arrhythmia Frequency in Patients With Implantable Cardioverter-Defibrillators. J Am Coll Cardiol. 2005;46 (12):2258–2263.
- Higgins SL, Hummel JD, Niazi IK et al. Cardiac resynchronization therapy for the treatment of heart failure patients with intraventricular conduction delay and malignant ventricular tachyarrhythmias. J Am Coll Cardiol. 2003;42 (8):1454–1459.
- Young JB, Abraham WT, Smith AL et al. Combined cardiac resynchronization and implantable cardioversion defibrillation in advanced chronic heart failure: the MIRACLE ICD Trial. JAMA. 2003;289 (20):2685–2694.
- Bradley DJ, Bradley EA, Baughman KL et al. Cardiac resynchronization and death from progressive heart failure: a meta-analysis of randomized controlled trials. JAMA 2003;289 (6):730–740.
- Ovsyshcher IE, Auricchio A. Cardiac resynchronization therapy for heart failure shows great promise. Isr Med Assoc J. 2003;5 (8):589–591.
- Medina-Ravell VA1, Lankipalli RS, Yan GX et al. Effect of epicardial or biventricular pacing to prolong QT interval and increase transmural dispersion of repolarization. Does resynchronization therapy pose a risk for patients predisposed to long QT or torsade de pointes? Circulation. 2003;107 (5):740–746.
- Бугрий М. Е., Сергиенко В. Б. Роль радионуклидной 4D-томоветрикулографии в диагностике нарушений насосной функции сердца. Радиология-практика. 2009;4:18–33.
- Лишманов Ю. Б., Чернов В. И., Кривоногов Н. Г. и др. Радионуклидные методы исследования в диагностике сердечно-сосудистых заболеваний. Сибирский медицинский журнал. 2010;25 (4):8–13.
- Tamaki N, Yoshinaga K. Novel iodinated tracers, MIBG and BMIPP, for nuclear cardiology. J Nucl Cardiol. 2011;18 (1):135–143.
- Дощицын В. Л. Внезапная аритмическая смерть и угрожающие аритмии. Российский кардиологический журнал. 1999;1:46–51.
- Zecchin M, Sinagra G. Primary prevention of sudden death in dilated cardiomyopathy. Italian Heart J. 2004;5 (Suppl 1):81S-82S.
- Kies P, Molhoek SG, Bax JJ el al. Cardiac resynchronization therapy results in a lower arrhythmia burden [abstract]. J Coll Cardiol. 2004;43 (Suppl A): 149A.
- Adamson PB1, Kleckner KJ, VanHout WL et al. Cardiac resynchronization therapy improves heart rate variability in patients with symptomatic heart failure. Circulation. 2003;108 (3):266–269.
- Livanis EG1, Flevari P, Theodorakis GN et al. Effect of biventricular pacing on heart rate variability in patients with chronic heart failure. Eur J Heart Fail. 2003;5 (2):175–178.
- Guerra JM1, Wu J, Miller JM, Groh WJ. Increase in ventricular tachycardia frequency after biventricular implantable cardioverter defibrillator upgrade. J Cardiovasc Electrophysiol. 2003;14 (11):1245–1247.
- Di Cori A1, Bongiorni MG, Arena G et al. New-onset ventricular tachycardia after cardiac resynchronization therapy. J Interv Card Electrophysiol. 2005;12 (3):231–235.
- Kjekshus JK. Mechanism for flow distribution in normal and ischemic myocardium during increased ventricular preload in the dog. Circ Res. 1973;33 (5):489–499.
- Uebleis C1, Ulbrich M, Tegtmeyer R et al. Electrocardiogramgated 18F-FDG PET / CT hybrid imaging in patients with unsatisfactory response to cardiac resynchronization therapy: initial clinical results. J Nucl Med. 2011;52 (1):67–71.
- Sundell J1, Engblom E, Koistinen J et al. The effects of cardiac resynchronization therapy on left ventricular function, myocardial energetics, and metabolic reserve in patients with dilated cardiomyopathy and heart failure. J Am Coll Cardiol. 2004;43 (6):1027–1033.
