Терапевтическая и биофармацевтическая оценка препаратов индапамида
Статьи Опубликовано в:Кардиоваскулярная терапия и профилактика, 2011; 10(8)
Г.В. Раменская1, С.В. Недогода2, И.Е. Шохин1*, А.Ю. Савченко1, В.С. Шлыков1
1Первый Московский государственный медицинский университет им. И.М.Сеченова. Москва, Россия;
2Волгоградский государственный медицинский университет. Волгоград, Россия
Статья посвящена сравнительной оценке высвобождения воспроизведенных лекарственных средств индапамида пролонгированного действия относительно оригинального лекарственного средства - индапамида (Арифон ретард, 1,5 мг). Тест сравнительной кинетики растворения проводили в трех средах, имитирующих физиологические жидкости желудочно-кишечного тракта: растворе хлористоводородной кислоты рН 1,2; ацетатном буферном растворе рН 4,3; фосфатном буферном растворе рН 6,8. Результаты кинетики растворения сопоставлены с результатами сравнительного терапевтического исследования препаратов индапамида.
Ключевые слова: тест "Растворение", индапамид, терапевтическое действие.
Therapeutic and biopharmaceutical assessment of indapamide medications
G.V. Ramenskaya1, S.V. Nedogoda2, I.E. Shokhin1*, A.Yu. Savchenko1, V.S. Shlykov1
1I.M. Sechenov First Moscow State Medical University. Moscow, Russia;
2Volgograd State Medical University. Volgograd, Russia
The paper is focussed on the drug release comparison for multisource indapamide medications against the original medication, Arifon retard (1,5 mg; Servier Laboratories, France). The comparative test of dissolution kinetics was performed in three media modelling physiological gastrointestinal conditions: hydrochloric acid solution, pH 1,2; acetate buffer, pH 4,3; and phosphate buffer, pH 6,8. The results of the dissolution kinetics test were compared to those from the comparative therapeutic studies of indapamide medications.
Key words: Dissolution test, indapamide, therapeutic action.
ОРИГИНАЛ (Оценка эффективности пеРевода с Индапамидов ГенерИков На Арифон ретард у пациентов с артериаЛьной гипертензией: предпосылки и дизайн) было показано, что замена генериков индапамида оригинальным препаратом Арифон ретард у 1319 больных АГ с неконтролируемым АД привело к снижению его в среднем на 29/15 мм рт.ст. и позволило достигнуть целевого уровня у 80% больных за 3 мес. лечения [7].
Артериальная гипертония (АГ) остается в настоящее время одной из наиболее важных проблем здравоохранения в России и в мире. Выбор препарата для лечения АГ обычно производится между представителями 5 основных классов: диуретиков (Д), ингибиторов ангиотензин-превыращающего фермента (ИАПФ)/сартанов, блокаторов кальциевых каналов (АК) и β-адреноблокаторов (β-АБ).
Среди представителей класса Д наибольшей доказательной базой обладают индапамид и хлорталидон. Недавно опубликованные британские рекомендации по диагностике и лечению АГ прямо рекомендуют отдавать предпочтение индапамиду, либо хлорталидону вместо гидрохлортиазида (Гхт).
В современной России насчитывается ~ 30 генериков индапамида 2,5 мг и > 10 генериков индапамида 1,5 мг. При этом ряд исследователей отмечали существенные преимущества в эффективности и переносимости оригинального препарата Арифона ретард (Лаборатории Сервье, Франция) в сравнении с генериками индапамида.
По результатам одного из исследований было сделано заключение, что Арифон ретард оказывает более выраженный антигипертензивный эффект, в сравнении с генериками индапамида. Авторы акцентировали внимание на выраженном превосходстве Арифона ретард по влиянию на пульсовое артериальное давление (ПАД), гипертрофию левого желудочка (ГЛЖ) и скорость распространения пульсовой волны (СПВ) у больных пожилого возраста с изолированной систолической АГ (ИСАГ). Авторы отметили существенное превосходство Арифона ретард по переносимости. Например, Арифон ретард, в отличии от генериков, не оказывал негативного влияния на уровень калия в крови [6], избыточное снижение которого, как известно, может быть причиной развития жизнеугрожащих аритмий. В ходе реализации другого клинического исследования - программы ОРИГИНАЛ (Оценка эффективности пеРевода с Индапамидов ГенерИков На Арифон ретард у пациентов с артериаЛьной гипертензией: предпосылки и дизайн) было показано, что замена генериков индапамида оригинальным препаратом Арифон ретард у 1319 больных АГ с неконтролируемым АД привело к снижению его в среднем на 29/15 мм рт.ст. и позволило достигнуть целевого уровня у 80% больных за 3 мес. лечения [7].
Одним из объяснений значительного преимущества Арифона ретард перед генериками в клинической эффективности и безопасности может быть различная скорость и динамика высвобождения индапамида, вследствие изменений в технологии производства воспроизведенного лекарственного средства. Особенно это касается генериков индапамида с замедленным высвобождением, где действующее вещество "упаковывается" в специальный матрикс, а потому эффективность и безопасность препарата зависит не только от самого действующего вещества, но и от качества матрикса.
Для того чтобы понять насколько соответствуют генерики индапамида замедленного высвобождения оригинальному препарату Арифон ретард по высвобождению действующего вещества необходимо воспользоваться методами современной биофармацевтики.
Важнейшей задачей современной биофармации служит понимание процесса доставки лекарственного вещества (ЛВ) до органов или клеток-мишеней. Одним из ключевых этапов этого процесса является поведение лекарственной формы (ЛФ) в желудочно-кишечном тракте (ЖКТ). Для моделирования такого процесса в условиях in vitro в течение последних 30 лет применяется тест "Растворение", который стал важнейшим и незаменимым инструментом для контроля качества и оценки взаимозаменяемости твердых дозированных ЛФ [1]. Для получения наиболее достоверных данных теста "Растворение" его условия должны быть приближенными к физиологическим параметрам сред ЖКТ [2].
Особенно важно проведение теста "Растворение" для пролонгированных ЛФ по нескольким временным точкам (кинетика растворения). Это связано с тем, что для препаратов, у которых процессы высвобождения ЛВ из ЛФ определяют скорость его абсорбции в ЖКТ, высока вероятность установления корреляции in vitro-in vivo (IVIVC). Выявленная достоверная IVIVC может позволить проводить оценку поведения лекарственного средства (ЛС) in vivo путем изучения его кинетики растворения и, таким образом, оценивать его взаимозаменяемость с препаратом сравнения в терапевтической практике [3].
Целью настоящей работы было изучение сравнительной кинетики растворения воспроизведенных ЛС индапамида пролонгированного действия относительно оригинального ЛС - Арифон ретард, 1,5 мг
Материал и методы
Объекты исследования
В качестве объектов исследования были выбраны препараты индапамида пролонгированного действия в дозировке 1,5 мг, приобретенные в аптечной сети г. Москва и зарегистрированные к медицинскому применению в РФ [4].
Референтный препарат:
Исследуемые препараты:
Ионик ретард, таблетки с контролируемым высвобождением, покрытые оболочкой, (ЗАО ФП "Оболенское", Россия)
Методика изучения сравнительной кинетики растворения
Изучение сравнительной оценки высвобождения исследуемых ЛС выполнялось при следующих условиях:
- Аппарат - Лопастная мешалка (AT7 Smart, Sotax, Швейцария)
- Число оборотов - 50 об/мин
- Временные точки - 1, 2, 3, 4, 6 ч
- Температура - 37 ± 0,5 оС
- Среда растворения: раствор хлористоводородной кислоты рН 1,2; ацетатном буферном растворе рН 4,3; фосфатном буферном растворе рН 6,8
- Объем среды растворения: 500 мл
Количественное определение проводили на УФ-спектофотометре Lambda 25 (Perkin Elmer, США) при длине волны 240 нм.
Эквивалентность профилей высвобождения оценивали с помощью факторов различия и сходимости f1 и f2 которые рассчитывали по формулам [5]:
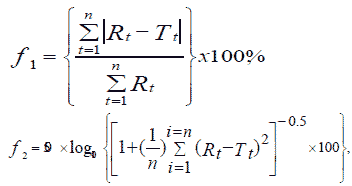
, где:
n - число временных интервалов отбора проб;
R и Т - процентное содержание определяемого вещества (среднее значение), высвободившегося в среду растворения, в каждый момент времени (t) из препарата сравнения ® и испытуемого препарата (T).
Для каждой временной точки производился расчет величин относительного стандартного отклонения для оценки достоверности результатов.
Результаты и обсуждение
Результаты сравнительной оценки высвобождения in vitro для исследуемых препаратов индапамида, а также факторы сходимости и различия относительно препарата Арифон ретард, приведены в таблице 1.
Таблица 1
Результаты сравнительной оценки высвобождения in vitro для исследуемых препаратов индапамида
| Образец | Среда | Время, час | Среднее значение высвобождения, % (x) |
| Арифон ретард 1,5 мг "Лаборатории Сервье Индастри", Франция с. 765283 | 0,01 М раствор кислоты хлористоводородной | 1 | 5,80 | 2 | 11,07 | 3 | 16,31 | 4 | 21,12 | 6 | 31,66 | Фосфатный буферный раствор, рН 6,8 | 1 | 5,04 | 2 | 9,22 | 3 | 13,80 | 4 | 18,57 | 6 | 27,88 | Ацетатный буферный раствор, рН 4,3 | 1 | 0 - 3,9* | 2 | 4,53 | 3 | 9,11 | 4 | 14,06 | 6 | 20,0 |
| Акрипамид редард ОАО "Химико-фармацевтический комбинат "Акрихин" С. 010406 | 0,01 М раствор кислоты хлористоводо-родной | 1 | 9,23 | 2 | 15,92 | 3 | 23,53 | 4 | 31,82 | 6 | 47,58 | Фосфатный буферный раствор, рН 6,8 | 1 | 8,29 | 2 | 16,64 | 3 | 21,94 | 4 | 28,76 | 6 | 39,03 | Ацетатный буферный раствор, рН 4,3 | 1 | 6,29 | 2 | 12,01 | 3 | 19,60 | 4 | 25,76 | 6 | 38,58 |
| Индапамид МВ 1,5 мг. ЗАО МАКИЗ- ФАРМА С. 220307 | 0,01 М раствор кислоты хлористоводородной | 1 | 10,35 | 2 | 19,10 | 3 | 23,02 | 4 | 31,48 | 6 | 44,24 | Фосфатный буферный раствор, рН 6,8 | 1 | 6,23 | 2 | 11,65 | 3 | 17,02 | 4 | 22,03 | 6 | 27,63 | Ацетатный буферный раствор, рН 4,3 | 1 | 3,91 | 2 | 8,86 | 3 | 13,36 | 4 | 24,12 | 6 | 31,46 |
| Равел СР 1,5 мг ООО "КРКА-РУС" С.80407 | 0,01 М раствор кислоты хлористоводородной | 1 | 9,03 | 2 | 13,79 | 3 | 19,04 | 4 | 22,64 | 6 | 33,12 | Фосфатный буферный раствор, рН 6,8 |
1 | 13,58 | 2 | 19,01 | 3 | 24,38 | 4 | 29,31 | 6 | 34,11 | Ацетатный буферный раствор, рН 4,3 | Результаты испытания не являются достоверными |
| Ионик® ретард 1,5 мг ЗАО "Фармпредприятие "Оболенское" С.40506 | 0,01 М раствор кислоты хлористоводородной | 1 | 3,07 | 2 | 5,26 | 3 | 9,82 | 4 | 17,76 | 6 | 23,89 | Фосфатный буферный раствор, рН 6,8 | 1 | 3,20 | 2 | 6,34 | 3 | 9,39 | 4 | 14,58 | 6 | 23,28 | Ацетатный буферный раствор, рН 4,3 | 1 | 4,78 | 2 | 7,72 | 3 | 11,76 | 4 | 13,79 | 6 | 22,21 |
При изучении кинетики высвобождения индапамида из ЛС пролонгированного действия различных производителей было установлено, что максимально схожие с препаратом сравнения Арифон ретард профили растворения in vitro имели препараты Индапамид МВ и Ионик ретард. Существенные различия в динамике высвобождения индапамида с препаратом сравнения были выявлены для препарата Акрипамид ретард (значение f2 для трех сред не превышало 51 - 53; разница в линейной скорости высвобождения составляла 15 - 20%). Менее существенные различия были отмечены для препарата Равел РС. В то же время, для препарата Равел РС не было получено достоверных данных для среды рН 4,3 (которая моделирует среду двенадцатиперстной кишки), поскольку величины относительного стандартного отклонения превышали рекомендуемые нормы (не более 20% для первой временной точки и не более 10% - для остальных). Таким образом, использование в качестве среды растворения ацетатного буферного раствора с рН 4,3 позволяет выявить различия, обусловленные особенностями состава и/или технологии производства исследуемых образцов индапамида.
В среде фосфатного буферного раствора с рН 6,8 кривая высвобождения препарата Арифон ретард сохраняет линейный характер. Из всех прочих препаратов только Ионик ретард и Индапамид МВ имеют практически линейных характер высвобождения, однако, разница в скорости высвобождения для каждой контрольной точки в сравнении с референтным препаратом, составляет 5 - 7%.
В растворе хлористоводородной кислоты рН 1,2 для препарата Арифон ретард наблюдается практически линейное увеличение концентрации индапамида во времени. Аналогично Арифону ретард кривая скорости высвобождения "нулевого порядка" отмечается и для препарата Акрипамид ретард. При сохранении линейности высвобождения Акрипамид ретард отличается от Арифона ретард по скорости растворения.
Кривую растворения для препарата Равел СР также можно признать сходной с кривой растворения Арифона ретард, однако у нее присутствует незначительное отклонение от линейности в области между 3 и 4 ч.
Помимо сходимости профилей растворения, а также их линейности, важным биофармацевтическим показателем для пролонгированных ЛС можно отметить время высвобождения ЛВ спустя 2-4 ч, что соответствует времени физиологического транзита препарата по ЖКТ из желудка в начальный отдел тонкого кишечника (т.е. в диапазоне значений рН 1,2 - 6,8). На рисунках 1-2 показаны относительные различия в высвобождении индапамина из его воспроизведенных ЛС относительно препарата сравнения (Арифон ретард) спустя 1, 2 и 4 ч в средах рН 1,2 и 6,8.
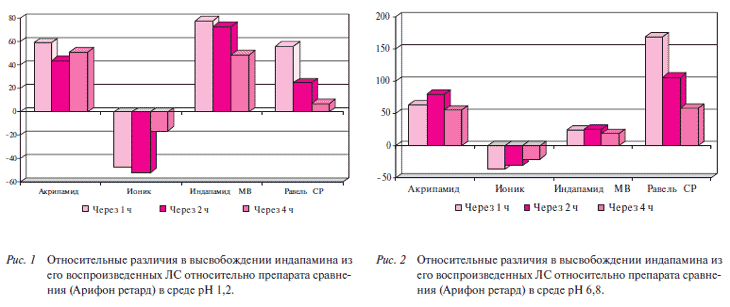
Относительные различия в высвобождении как при рН 1,2, так и при рН 6,8 появляются уже после 1 ч растворения по всем генерикам. При этом диапазон колебаний достаточно большой. При рН 1,2 от (- 47%) у Ионика ретард до +78% у Индапамида МВ. Еще более выраженный характер различия в высвобождении между Арифоном ретард и генериками носит при рН 6,8. Значения колеблются от (-37%) у Ионика ретард до + 169% у Равеля СР. Необходимо отметить, что существенные колебания концентрации индапамида при высвобождении из генериков в сравнении с оригинальным препаратом наблюдались по всем временным точкам.
Таким образом, при достижении начального отдела тонкого кишечника (основной зоны абсорбции ЛВ в ЖКТ) степень высвобождения индапамида из оригинального ЛС и генериков существенно различается. Причиной таких отличий может быть различие в строении матрикса, обеспечивающего замедленное высвобождение действующего вещества. В последующем это может оказывать влияние на динамику всасывания индапамида и, как следствие, проявляться в различном антигипертензивном действии, что согласуется с данными клинических исследований.
Выводы
По результатам исследования кинетики высвобождения для препарата Арифон ретард наблюдался практически линейный характер профиля растворения, что может обеспечивать необходимый уровень концентраций индапамида в плазме крови человека для достижения терапевтического эффекта (о чем косвенно свидетельствуют результаты сравнительных клинических исследований).
Следует отметить, что линейность профиля растворения для препарата Арифон ретард наблюдалась независимо от среды растворения (рН 1,2; 4,3; 6,8), т.е. на протяжении всей части ЖКТ, где происходят его высвобождение и абсорбция. При этом для воспроизведенных ЛС индапамида подобная картина для всех трех сред отсутствовала. Различия по концентрации индапамида при высвобождении из Арифона ретард существенно отличаются от концентрации индапамида при высвобождении из генериков, в средах со значением рН 1,2 и 6,8. Эти различия в высвобождении индапамида проявляются уже через 1 ч и сохраняются на протяжении 4 ч эксперимента.
Таким образом, одной из причин разной клинической эффективности и безопасности Арифона ретард и генериков индапамида, может быть различие в динамике высвобождения индапамида, зафиксированной в настоящем исследовании. Причиной таких отличий могут быть особенности химического строения матрикса при изменении технологии производства по сравнению с оригинальным препаратом.
Различия в высвобождении индапамида могут в последующем обеспечивать различную скорость всасывания действующего вещества в кровь после приема ЛС. Отличия в динамике всасывания индапамида может отражаться на антигипертензивном эффекте, что должно учитываться в клинической практике при выборе одного из препаратов индапамида замедленного высвобождения для пациентов с АГ.
В то же время, для подтверждения предположения зависимости терапевтического эффекта индапамида от его поведения in vitro следует проводить дальнейшие исследования его высвобождения из различных ЛС и установление корреляции полученных данных с фармакокинетическими и фармакодинамическими исследованиями.
Литература
Комментарии
ПРАКТИКА ПЕДИАТРА
