Левоцетиризин: современные аспекты применения при аллергических заболеваниях с точки зрения доказательной медицины
Статьи Опубликовано в журнале:Лечащий врач, 2010 №05 Н. Г. Астафьева, доктор медицинских наук, профессор
И. В. Гамова, кандидат медицинских наук, доцент
Е. Н. Удовиченко, кандидат медицинских наук
И. А. Перфилова
СГМУ им. В. И. Разумовского, Саратов
Разработка стратегий терапевтических вмешательств при ряде аллергических заболеваний исторически связана с выявлением роли гистамина в механизме развития главных симптомов аллергии. Существуют разные подходы к подавлению активности гистамина в организме. Так, например, кортикостероиды, циклоспорин А, пувотерапия подавляют высвобождение гистамина из тучных клеток; блокаторы гистаминовых рецепторов, антилейкотриеновые препараты, доксепин предотвращают действие гистамина на клетки-мишени.
Поиск препаратов с антигистаминным эффектом, начатый в сороковые годы XX века, продолжается до настоящего времени, и исследовательский интерес сфокусирован на полифункциональных характеристиках препаратов нового поколения, которые объединяют в себе антигистаминную, противоаллергическую и противовоспалительную активность.
Гистамин обладает широким спектром биологической активности и действует через активацию клеточных поверхностных рецепторов, сопряженных с G-белками (GPCR, от англ. — G-protein coupled receptor). Эти молекулярные структуры организованы в виде извивающегося наподобие серпантинной ленты белка, семь раз пересекающего клеточную мембрану. Наружная часть ленты служит «антенной», улавливающей химические сигналы, которые поступают к клетке, а внутренняя — запускает клеточный ответ, начинающийся с активации G-белка. В отличие от остальных видов поверхностных клеточных рецепторов GPCR универсален. С ними связываются и нейромедиаторы, всего в несколько раз превосходящие по массе атом углерода, и более крупные белки.
GPCR участвуют почти во всех жизненно важных процессах, протекающих в организме. Лекарственные вещества, мишенью которых являются GPCR, либо связываются с активным центром, имитируя действие сигнальной молекулы, либо блокируют активный центр, преграждая доступ к нему этой молекулы.
Из всех известных в настоящее время четырех типов рецепторов гистамина (Н1-, Н2-, Н3-, Н4-рецепторы), принадлежащих к группе GPCR, особый интерес для аллергологии представляют Н1-рецепторы. Именно Н1-рецепторы, преобладающие в коже и на гладкомышечных клетках, ответственны за развитие ранней и поздней (отсроченной) фазы аллергического ответа.
Расшифровка механизмов взаимодействия лекарств с гистаминовыми рецепторами позволила уточнить терминологические формулировки в отношении антигистаминных препаратов и обозначить их как «обратные агонисты». Обратные агонисты Н1-гистаминовых рецепторов являются патогенетически оправданными средствами для лечения большинства аллергических заболеваний.
В настоящем обзоре, посвященном левоцетиризину, будут использоваться привычные термины («антагонист Н1-гистаминорецепторов») наряду с современным толкованием препарата как «обратного агониста».
Большинство Н1-антигистаминных препаратов представляют собой вещества, осуществляющие основное фармакологическое действие за счет активных метаболитов, образующихся после серии трансформаций исходного лекарственного препарата. Безусловным преимуществом в связи с этим обладают новые средства, полученные на основе фармакологически активных метаболитов: весь лекарственный препарат в этом случае является действующим началом, лишенным многих побочных эффектов своего предшественника [1].
Первым антигистаминным препаратом второго поколения (ко второму поколению относятся все неседативные антигистамины), крайне незначительно подвергающимся метаболизму, был цетиризин. Препарат с доказанной эффективностью и безопасностью, он в настоящее время широко используется для лечения и профилактики аллергических заболеваний у взрослых и детей [2]. С 2005 года на фармацевтическом рынке России присутствует левовращающий оптический изомер цетиризина, селективный обратный агонист Н1-рецепторов — левоцетиризин (Ксизал) в таблетированной форме, а с 2008 года — в виде капель.
Фармакодинамика и фармакокинетика левоцетиризина достаточно хорошо изучены [3, 4].
Левоцетиризин быстро всасывается в кишечнике, достигая максимальной концентрации в плазме через 0,5–1 час после приема. Биодоступность препарата близка к 100% — это значит, что препарат почти полностью попадает в системный кровоток (около 100% относительно исходной дозы препарата). Из кишечника левоцетиризин транпортируется в печень, а оттуда поступает в кровоток. Т. к. левоцетиризин — это конечный метаболит, он не проходит печеночный метаболизм, чтобы стать активным. Левоцетиризин не взаимодействует с цитохромом печени P450, поэтому у него нет конкурентного лекарственного взаимодействия. Это дает возможность сочетать его с антибиотиками, противогрибковыми и другими препаратами и применять у пациентов с патологией печени. Левоцетиризин не обладает кардиотоксическим действием.
В связи с низким объемом распределения (0,4 л/кг), препарат обнаруживается в тканях только там, где это необходимо, а именно на клеточной мембране, и не проникает внутрь клетки. Левоцетиризин выводится с мочой в неизменном виде на 86% и фекалиями — 13%. Перечисленные параметры свидетельствуют об оптимальном фармакокинетическом профиле левоцетиризина [5, 6].
Селективность
Отличительным свойством антигистаминовых препаратов второго поколения является сродство к гистаминовым рецепторам и избирательность подавления их активности. При аллергической реакции через Н1-гистаминовые рецепторы реализуются такие патофизиологические и клинические эффекты, как зуд, вазодилятация, экссудация, эритема, гиперемия, стимуляция кашлевых рецепторов и вагусных афферентных волокон, секреция гистамина, экспрессия молекул межклеточной адгезии, а через Н4-рецепторы –зуд, продукция цитокинов, эйкозаноидов, хемотаксис лейкоцитов и дендритных клеток [6].
Н1-рецептор присутствует на клеточных мембранах в двух конформациях — активной и неактивной, между которыми в норме поддерживается равновесие (рис. A, B, C).
Рис. Принципы взаимодействия агонистов и обратных агонистов с гистаминовыми рецепторами (адаптировано: Leurs R., Church M. K., Taglialatela M. Clin Exp Allergy. 2002; 32: 489–498)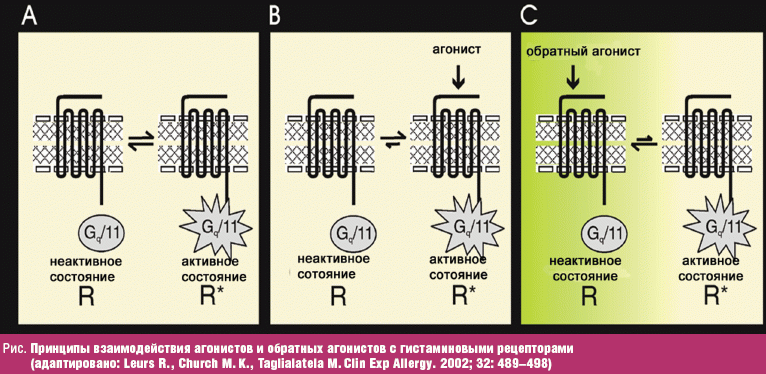
Даже при отсутствии гистамина рецептор проявляет базальную активность («конститутивная рецепторная активность» — рис., A). Гистамин, связываясь с рецептором, «закрепляет» его в форме активной конформации; активная конформация начинает преобладать над неактивной (рис., B). Все седативные и неседативные гистаминоблокаторы, являясь обратными агонистами, «закрепляют» рецептор в неактивной форме (рис., С). Поэтому они могут снижать базальную деятельность рецептора, независимо от того, повышен в данный момент выброс гистамина в межклеточное пространство или нет. В результате базальной и стимулированной гистамином активности Н1-рецептора повышается активность внутриклеточного фактора транскрипции ряда провоспалительных цитокинов и молекул адгезии (ядерного фактора NF-kB). Так, гистамин при взаимодействии с гистаминовым рецептором I типа повышает активность фактора NF-kB в 8 раз, а антигистаминные препараты снижают базальную активность фактора NF-kB и блокируют реакцию на контакт с гистамином [1, 8].
Степень смещения равновесия в сторону неактивной конформации зависит от природы обратного агониста. Чем выше сродство Н1-антигистаминных препаратов к Н1-рецептору, тем сильнее выражено их подавляющее действие на зависимое от активации NF-kB образование провоспалительных медиаторов и на клинические проявления, с ними связанные.
Еще одна важная характеристика взаимодействия обратного агониста с рецептором — это занятость рецепторов. Через 4 и 24 часа после приема левоцетиризина занятость составила 90% и 57%, для фексофенадина — 95% и 24%, для дезлоратадина — 71% и 43%. Наивысшая занятость рецепторов обеспечивает лучший терапевтический эффект [1].
Избирательность левоцетиризина в отношении Н1-гистаминовых рецепторов в два раза выше по сравнению с цетиризином, а также в 600 раз выше, чем к другим рецепторам и ионным каналам, близким по структуре (Н2-, Н3-, альфа- и бета-адренорецепторам, 5-НТ1А и 5-НТ2, дофамина D2, аденозина А1 и мускариновым рецепторам), в связи с чем его антихолинэргическое и антисеротониновое действие сводится к минимуму [7].
Выраженная способность левоцетиризина тормозить спонтанную и стимулированную гистамином активность NF-kB объясняет его угнетающее действие на секрецию медиаторов аллергического воспаления [9, 10, 11]. Этим объясняется лечебное действие — уменьшение заложенности носа, благоприятное влияние на течение бронхиальной астмы, зудящих дерматозов, крапивницы и др. [12, 13, 14].
Левоцетиризин в программах фармакотерапии аллергического ринита и конъюнктивита
Антигистаминные препараты рекомендуются в качестве лекарств первого выбора у больных аллергическим ринитом [15]. Их назначают с целью купирования эффекта гистамина, провоцирующего основные симптомы заболевания: зуд, чихание и ринорею. Проведено множество клинических испытаний антигистаминных препаратов, где отмечено их выраженное позитивное влияние на тяжесть течения ринита и качество жизни пациентов [16]. За последние несколько лет в контролируемых исследованиях левоцетиризина был подтвержден высокий терапевтический эффект и безопасность этого препарата [17, 18].
Курсы лечения у взрослых и детей, больных аллергическим ринитом, продолжались 2, 4, 8 недель и 6 месяцев. Во всех испытаниях продемонстрировано достоверное снижение интенсивности симптомов воспаления как верхних, так и нижних дыхательных путей по сравнению с группой плацебо. Курс лечения левоцетиризином кроме основного, антигистаминного эффекта, оказывал благоприятное влияние на общее состояние и самочувствие пациентов: эмоциональный статус, болевой синдром и физическую активность, которые сохранялись и после отмены препарата [19].
Клиническая эффективность левоцетиризина продемонстрирована у больных с круглогодичными и сезонными ринитами [20, 21]. В открытом многоцентровом исследовании с участием 397 врачей общей практики из Бельгии и 1290 пациентов с сезонным аллергическим ринитом (САР), которые пришли на консультацию к доктору с жалобами на неэффективность предыдущей антигистаминовой терапии или на побочные эффекты такой терапии, лечение левоцетиризином 5 мг однократно в течение 4 недель продемонстрировало преимущества назначенного лечения [22].
С появлением новой классификации ринитов (интермиттирующий и персистирующий) продолжено изучение оптимальных доз, влияние на глазные симптомы, оценку качества жизни на фоне фармакотерапии в этих группах пациентов [23, 24]. К таким исследованиям относится XPERT (Xyzal® persistent rhinitis trial), которое проводилось в 5 странах Европы: Бельгии, Франции, Германии, Италии, Испании и включало 551 пациента с персистирующим аллергическим ринитом с сенсибилизацией к пыльце трав и домашней пыли. Пациенты рандомизированы на две группы: 273 получали плацебо, 278 — левоцетиризин. Было установлено, что левоцетиризин обладает высокой клинической эффективностью, улучшает качество жизни и снижает стоимость длительного лечения персистирующего аллергического ринита [25].
Левоцетиризин в дозе 5 мг продемонстрировал высокую эффективность и безопасность при лечении пациентов с персистирующим аллергическим ринитом в отношении всех симптомов данного заболевания, включая назальные и глазные симптомы при хорошей переносимости лечения [23, 26].
Терапевтический эффект антигистаминного препарата левоцетиризина (Ксизал) у больных аллергическим персистирующим ринитом не только на назальные, но и глазные симптомы подтвержден в российском многоцентровом открытом несравнительном исследовании [27].
Левоцетиризин подавлял существенно проявления аллергии у больных с разным спектром сенсибилизации (аллергия к клещам домашней пыли, пыльце растений), а при сравнительных исследованиях с другими антигистаминами демонстрировал ряд преимуществ [28].
В двойном слепом перекрестном исследовании у 39 пациентов с аллергией к клещам домашней пыли проводили провокационный тест с аллергеном, после чего пациенты принимали 5 мг левоцетиризина, или 10 мг лоратадина, или плацебо. Существенное улучшение отмечено у 83,8% пациентов, получавших левоцетиризин, и у 66,7% получавших лоратадин [29, 30].
При контролируемом контакте пациентов с аллергеном (пыльцой луговых трав) было показано, что левоцетиризин и фексофенадин имели одинаковое время начала действия — через 1 ч после приема и оба препарата были значительно эффективнее, чем плацебо. Через 24 ч после приема препарата появлялась достоверная разница в эффективности препаратов, что говорит о большей продолжительности действия левоцетиризина по сравнению с фексофенадином [29].
При сравнении быстроты наступления и продолжительности действия левоцетиризина и дезлоратадина в двойном слепом плацебо-контролируемом исследовании 373 пациента с аллергией к пыльце амброзии получали левоцетиризин 5 мг в сутки, или дезлоратадин 5 мг в сутки, или плацебо и наблюдались в течение 2 дней контролируемого контакта с пыльцой амброзии. Самооценка симптомов проводилась каждые полчаса. Среднее время начала действия составило у дезлоратадина 3 ч, в то время как у левоцетиризина — 1 ч. Оба препарата были эффективнее, чем плацебо, а левоцетиризин эффективнее дезлоратадина для купирования симптомов аллергического риноконъюнктивита [31, 32].
Оба препарата также достоверно уменьшали заложенность носа, причем в первые сутки приема данный эффект у левоцетиризина был более выражен, чем у дезлоратадина. Через 24 ч после приема первой дозы препарата выраженность симптомов была достоверно ниже в группе левоцетиризина, что говорит о большей продолжительности действия препарата по сравнению с дезлоратадином.
Во всех исследованиях у больных с ринитами доказана безопасность использования левоцетиризина: в долгосрочном наблюдении в течение 6 месяцев не было выявлено никаких серьезных побочных и нежелательных эффектов [33]. Установлены безопасность и эффективность пероральных антигистаминных средств у детей. Их можно назначать даже маленьким детям [34].
В отличие от анализа клинической эффективности и безопасности левоцетиризина в литературе реже обсуждаются фармакоэкономические аспекты. В одном двойном слепом, плацебо-контролируемом длительном исследовании была установлена эффективность затрат на лечение левоцетиризином у больных с персистирующим аллергическим ринитом [15].
Таким образом, можно отметить, что уровень рекомендаций по использованию левоцетиризина в терапии пациентов с аллергическими ринитами можно отнести к категории А, поскольку они базируются на большом количестве рандомизированных, двойных слепых, плацебо-контролируемых клинических исследований [15, 19]. Высокая эффективность применения препарата в стандартных терапевтических дозах (5 мг однократно в сутки) установлена в разных возрастных группах, в том числе у детей дошкольного и школьного возраста, пожилых людей. Продолжительные наблюдения (в течение полугода лечения, 26 недель и более), достаточное количество пациентов (размеры выборок более 300–500 человек) показали, что длительная (годы) терапия левоцетиризином безопасна [15, 23, 25, 34].
Назальная гиперреактивность и неспецифические триггеры
Неспецифическая гиперреактивность носа — это важный признак аллергического и неаллергического ринита [15]. Она характеризуется усилением ответа носа на обычные стимулы и проявляется чиханием, заложенностью носа и выделениями, которые возникают по отдельности или сочетаются друг с другом. Феномен назальной гиперреактивности тесно связан с активностью воспаления. Препараты левоцетиризина способны оказывать влияние на зависимое от активации NF-kB образование провоспалительных посредников. Ксизал с этих позиций может рассматриваться как реальный кандидат эффективного противовоспалительного препарата [1, 15]. О противовоспалительной активности Ксизала можно судить по его способности достоверно (p < 0,05) снижать количество эозинофилов; эффекторных Т-хелперов (CD4+CD29+); Т-клеток, продуцирующих межклеточные молекул адгезии (T-клетки ICAM-1-CD4+CD54+) и IL-12 (T-клетки IL-12 Rb1-CD4+CD212+) [35, 36].
Доказаны такие противовоспалительные эффекты левоцетиризина, как снижение экспрессии молекул адгезии (ICAM-1 и VCAM-1), которые являются маркерами аллергического воспаления и, в частности, способствуют миграции эозинофилов в очаг воспаления. Препарат вызывает торможение поздней фазы миграции эозинофилов, нейтрофилов и базофилов в органы-мишени, уменьшает проницаемость капилляров и спазм гладкой мускулатуры, предупреждает развитие отека тканей [35, 37].
Ксизал повышает T-регуляторную активность, как естественную иммунную защиту, подавленную воспалительным процессом, и приводит к достоверному (p < 0,001) увеличению количества регуляторных T-клеток (CD4+CD25+), что положительно коррелирует с заложенностью носа (r = 0,771) [38].
Ринит и астма
Слизистые оболочки носа и бронхов при рините и астме имеют сходство и отличия. Большинство астматиков страдают ринитом, в то время как только у части больных ринитом имеются клинические проявления астмы, хотя у большего числа пациентов определяется неспецифическая гиперреактивность бронхов. Создается впечатление, что в носовых и дыхательных путях существует эпителиально-мезенхимальная трофическая единица, а одни и те же воспалительные клетки инфильтрируют слизистую оболочку дыхательных путей. Это позволяет предположить, что ринит и астма представляют собой континуум [15].
В исследовании XPERT, часть результатов которого цитировалась выше [25], Ксизал был эффективен в отношении пяти основных симптомов персистирующего ринита, включая назальную заложенность, улучшал показатели качества жизни больных, страдающих персистирующим ринитом, снижал бремя расходов на 33% на лечение больного персистирующим ринитом, а также существенно влиял на астматические симптомы. Число приступов астмы при сочетанной патологии было достоверно ниже в группе больных, получавших левоцетиризин (7,4%), по сравнению с группой плацебо (13,1%).
Астма
Пероральные антигистаминные средства рассматриваются как средства первой линии в лечении аллергического ринита. Хотя в некоторых исследованиях была отмечена их эффективность в лечении астмы, тем не менее, во многих исследованиях они не влияли на симптомы этого заболевания и показатели функции легких. Применять эти препараты для лечения астмы не рекомендуется [15]. Пероральные антигистаминные средства в комбинации с деконгестантами уменьшали симптомы астмы [15].
В исследовании ЕТАС (Early Treatment of Atopic Children) цетиризин по сравнению с плацебо задерживал или в некоторых случаях предупреждал развитие астмы в подгруппе детей раннего возраста с атопическим дерматитом, сенсибилизированных к пыльце травы и в меньшей степени к клещам домашней пыли [39]. Результаты исследований с Ксизалом показали, что препарат даже при длительном применении в течение 18 месяцев (как в исследовании ЕРААС (The Early Prevention of Asthma in Atopic Children), которое еще продолжается) не проявляет побочных эффектов и потенциально может быть использован для предупреждения развития астмы у детей с атопическим дерматитом, сенсибилизированных к пыльце и клещам домашней пыли [40, 41].
Крапивница и другие заболевания кожи
По данным многочисленных рандомизированных, двойных слепых, плацебо-контролируемых клинических исследований [42, 43, 44] левоцетиризин показал свою эффективность для лечения крапивницы [45]. Данные о высокой эффективности и безопасности представлены в целом ряде обзоров [46, 47] и публикациях о проведенных открытых несравнительных постмаркетинговых исследованиях [48].
Убедительное патогенетическое обоснование его применения было получено на модели гистамин-индуцированной волдырно-гиперемийной пробы [49]. Оценка эффективности левоцетиризина продемонстрировала высокую активность препарата на коже здоровых добровольцев в отношении уменьшения волдыря, эритемы и зуда после его применения. Аналогичный эффект отмечался на модели аллерген-индуцированного волдыря и покраснения [50]. Эффект угнетения эритемы был продолжительным и сохранялся даже через 24 часа [51].
Исследование клинической эффективности левоцетиризина в дозе 5 мг в сутки при лечении хронической крапивницы через 4 недели терапии показало снижение общей тяжести симптомокомплекса. Так, интенсивность и продолжительность зуда, количество и размеры высыпаний уменьшились с 7,7 до 3,5 балла [44].
В двойном слепом исследовании «Оценка лечения хронической крапивницы» (CUTE) проводили прямое сравнение эффективности левоцетиризина (5 мг) и дезлоратадина (5 мг) у 886 взрослых пациентов из 9 стран (Бельгия, Франция, Германия, Италия, Малайзия, Румыния, ЮАР, Испания и Великобритания). По достижении обеих конечных точек исследования (1-я и 4-я недели) левоцетиризин оказался более эффективным, чем дезлоратадин в снижении показателей выраженности зуда, демонстрируя быстрое и продолжительное улучшение симптомов [52]. Кроме того, разница между обеими группами пациентов была статистически значима уже с 1-го дня терапии [53].
Доказательность рекомендаций по использованию левоцетиризина при крапивнице соответствует уровню А [54].
Экономическая целесообразность терапии левоцетиризином изучена при хронической идиопатической крапивнице, отмечено сокращение расходов на 91,93 Ђ на пациента в месяц [55].
Накапливаются данные о том, что при лечении хронической резистентной к антигистаминам крапивнице эффект может быть достигнут при увеличении дозы. Это связано с тем, что в коже (в отличие от слизистых) гистамин плохо диффундирует от места его высвобождения, и поэтому его местные концентрации оказываются высокими, что было продемонстрировано при использовании метода микродиализа [56, 57, 58].
В силу этого обстоятельства для эффективного воздействия на гистамин-индуцированный элемент при крапивнице необходимы более высокие дозы антигистаминных препаратов, особенно по сравнению с ринитом, где в слизистых гистамин хорошо диффундирует от места высвобождения и местные концентрации гистамина не бывают такими высокими. Контролируемые двойные слепые, плацебо-контролируемые исследования показали, что 4-кратное увеличение дозы левоцетиризина и дезлоратадина значительно повышает клиническую эффективность при сохранении высокого профиля безопасности [59, 60].
Получен положительный опыт применения левоцетиризина при лечении хронических дерматозов, сопровождающихся зудом (атопическом дерматите, хронической экземе, псориазе) [61, 62].
Левоцетиризин при вирусных инфекциях
Хорошо известно, что респираторная вирусная инфекция у детей младшего возраста может приводить к развитию атопии в более старшем возрасте. Отмечена связь между ОРВИ у детей до года (в 48% риновирусной этиологии) и развитием астмы, атопии и обструктивных болезней легких у детей после 5 лет (n = 148) [63]. Отмечена связь между бронхиолитами у детей младшего возраста и развитием астмы или экземы в более старшем возрасте [64]. Наблюдение в течение 5 лет за 95 000 детей подтвердило связь между респираторной вирусной инфекцией у детей младшего возраста и развитием астмы [65, 66].
Существует многолетний опыт применения препаратов, блокирующих активность Н1-гистаминовых рецепторов при ОРВИ, в том числе в составе комбинированных безрецептурных лекарственных средств. Считается, что при ОРВИ антигистамины с антихолинергическим действием оказывают «подсушивающее» действие на слизистые оболочки. Такие свойства приписываются хлорфенирамину, входящему в состав патентованных средств (Антигриппин; Терафлю, Антифлу; Гексапневмин; Контак 400 и др.), фенилпропаноламину, дифенгидрамину. Однако отсутствуют четкие данные их эффективности при конкретных нозологических формах (риновирусная, аденовирусная, респираторно-синцитиальная, коронавирусная и прочие инфекции). Кроме того, отсутствуют надежные данные сравнения результативности применения (без учета побочных эффектов) препаратов разных поколений. В свете этого вполне очевидна необходимость анализа имеющихся сведений, также как и проведения целенаправленных исследований.
Результаты кокрановского метаанализа по применению антигистаминов при простудных заболеваниях, опубликованного в 2005 году [67], позволили придти к заключению о том, что монотерапия антигистаминными препаратами как у детей, так и у взрослых не влияет на продолжительность симптомов простуды (заложенность носа, ринорею, чихание или улучшение самочувствия пациентов). Антигистаминные препараты первого поколения вызывают больше побочных эффектов в сравнении с плацебо, в частности, они способны вызывать седативный эффект. Комбинация антигистаминных препаратов и деконгестантов не эффективна при использовании у маленьких детей. У детей старшего возраста и взрослых пациентов в большинстве исследований была продемонстрирована эффективность антигистаминных препаратов как в достижении выздоровления, так и в отношении назальной симптоматики. Однако остается до конца не ясным, являются ли данные эффекты клинически значимыми или нет.
Исследования по использованию левоцетиризина позволяют по-новому оценить роль селективных (без антихолинергического эффекта) антигистаминов при респираторных инфекциях. Основанием для изучения левоцетиризина (Ксизала) при риновирусной инфекции послужило появление убедительных доказательств его неантигистаминовых противовоспалительных, противоаллергических эффектов.
Было подтверждено, что Ксизал снижает продукцию ICAM-1 — главного рецептора для риновирусов человека [68]. Эта особенность обусловлена тем, что Ксизал ингибирует NF-кВ, снижает продукцию IL-8, TNF-альфа, RANTES, GM-CSF, IL-6, TLR-3 экспрессию. Ксизал достоверно снижает репликацию риновирусов, по-видимому, не только за счет ICAM-1, но также за счет подавления цитоплазматического роста вирусов, включая геномную репликацию, синтез протеина, сборку и выброс вирусов (p < 0,05). Ксизал в 100 раз снижает титр риновирусов в назальных эпителиальных и альвеолярных (II типа) клетках человека [38].
Только Ксизал в двух различных исследованиях показал снижение титра риновирусов. Было сделано заключение, что Ксизал потенциально может быть использован как для снижения смертности при риновирусной инфекции, так и для предупреждения обострения астмы [38, 68, 69].
Использование в педиатрии
Одним из главных аспектов применения антигистаминных препаратов (АГП) в педиатрии является безопасность. FDA опубликовало письмо об опасности, касающееся детских безрецептурных препаратов, содержащих антигистаминные препараты первого поколения [70].
Опубликованные данные по многоцентровым рандомизированным плацебо-контролируемым исследованиям по применению Н1-блокаторов у детей [71, 72] позволили сформулировать принципы выбора антигистаминов у детей: детям моложе 6 месяцев не рекомендуется назначать Н1-антигистаминовые препараты; для возрастной группы от 6 месяцев до 5 лет показатели безопасности продемонстрированы только у 2-го поколения H1-АГП (цетиризин, дезлоратадин, левоцетиризин, лоратадин).
В трех рандомизированных, слепых, плацебо-контролируемых исследованиях среди детей младшего возраста, принимавших длительно цетиризин (18 месяцев), левоцетиризин (18 месяцев), лоратадин (12 месяцев) клинически не было выявлено побочных эффектов, гематологических, биохимических или ЭКГ-нарушений, влияния на рост или массу тела; влияния на поведение, развитие или обучение [73, 74].
Сравнительные исследования
Влияние разных антигистаминовых препаратов изучалось на различных моделях и в клинической практике.
Сравнительное исследование ингибирующей активности левоцетиризина и дезлоратадина на волдырь и гиперемию проводилось на 18 здоровых добровольцах в течение 24 ч. Подавление волдыря через 4 часа у левоцетиризина было в три раза эффективнее, чем у дезлоратадина. Через 24 ч ингибирующая активность левоцетиризина оставалась в 2 раза выше, чем у дезлоратадина. Эти результаты коррелируют с уровнем занятости рецепторов, которая у Ксизала составляет 90% через 4 часа и 57% через 24 часа, а у дезлоратадина 71% через 4 часа и 43% через 24 часа, и доказывают, что занятость рецепторов является хорошим предсказателем AГ активности левоцетиризина и дезлоратадина на коже человека [75, 76].
Что касается продолжительности лечебного эффекта, левоцетиризин также оказался заслуживающим внимания. Было проведено рандомизированное двойное слепое плацебо-контролируемое исследование по изучению длительности сохранения эффекта лечения левоцетиризином по сравнению с другими антигистаминными препаратами [77]. Согласно результатам данного исследования, в месте подкожного введения гистамина при 5-дневном курсе лечения противогистаминная активность лоратадина и дезлоратидина устранялась спустя 24 ч, фексофенадина — спустя двое суток, цетиризина и левоцетиризина — лишь через 3–4 дня.
Двойное слепое, рандомизированное, перекрестное сравнение эффективности однократной дозы левоцетиризина, эбастина, фексофенадина, лоратадина, мизоластина и плацебо в подавлении отека и эритемы, вызванных гистамином в течение 24 часов у здоровых мужчин [78], показало, что воздействие левоцетиризина отличалось наибольшей силой и постоянством. Далее располагались эбастин, фексофенадин и мизоластин, которые оказывали практически идентичный эффект на подавление отеков. Эффективность лоратадина была самой низкой. Левоцетиризин, фексофенадин и мизоластин подавляли эритему и отеки через 1 час после назначения, и их действие достигало максимального уровня через 4 часа. Эбастин и лоратадин могут отличаться от группы плацебо только через 4 часа. Только после приема левоцетиризина отмечалось «полное» блокирование уртикарной реакции (на 95% и более). Блокирование уртикарной реакции не менее чем на 70% длилось в среднем 21,4 ч после однократного приема левоцетиризина [79].
У взрослых больных с сезонными аллергическими ринитами по сравнению с дезлоратадином 5 мг, левоцетиризин более значимо облегчал симптомы по отношению к плацебо. Терапевтический эффект оставался значительным через 24 ч после первоначальной дозы. Отмечено более быстрое начало действия по сравнению с дезлоратадином (1 ч vs 3 ч) [80].
В другом сравнительном исследовании при сезонном аллергическом рините пациенты, не ответившие на терапию другими АГП, отметили значительное улучшение в уменьшении суммарной шкалы симптомов, отражающей тяжесть болезни (T4 SS), на левоцетиризине 5 мг. Большее количество пациентов отдали предпочтение левоцетиризину 5 мг [81].
Левоцетиризин 5 мг обеспечивал более длительное облегчение симптомов (до 28 ч) по сравнению с фексофенадином 120 мг, и достоверно больше пациентов были удовлетворены лечением левоцетиризином 5 мг по сравнению с фексофенадином 120 мг через 24–28 ч после приема препаратов [77].
С появлением антилейкотриеновых препаратов в стандартах терапии аллергических ринитов представляют интерес сравнительные исследования с монтелукастом. Установлено, что левоцетиризин 5 мг значительно облегчал симптомы по сравнению с их базальным уровнем и значительно превосходил монтелукаст через 24 ч [82, 83].
В сравнительном исследовании [84] по хронической крапивнице левоцетиризин превосходил дезлоратадин по таким показателям, как тяжесть, длительность зуда, общая клиническая эффективность, удовлетворенность пациентов лечением, время начала первых улучшений симптомов.
Данные о безопасности подтверждают профили безопасности обоих препаратов [85, 86, 87, 88].
Беременность и период лактации
Недавно были опубликованы данные исследования, которое проводилось в США в течение 6 лет, целью которого было определить связь между применением АГП в I триместре беременности и врожденными дефектами развития [92]. Было рассмотрено 300 случаев врожденных дефектов, в которых матери принимали в общей сложности 54 различных АГП за месяц до беременности и в течение всего I триместра. Беременные принимали Тавегил, дифенгидрамин, гидроксизин, фексофенадин, лоратадин и цетиризин. В результате не было выявлено взаимосвязи между врожденными дефектами и приемом АГП на ранних сроках беременности. Также не были подтверждены данные о приеме лоратадина и гипоспадией, которые публиковались ранее. В список В при беременности и грудном вскармливании из препаратов 2-го поколения включены цетиризин, лоратадин [93].
Экспериментальные исследования на животных не выявили каких-либо прямых или косвенных неблагоприятных эффектов левоцетиризина на развивающийся плод, а также на развитие в постнатальном периоде; течение беременности и родов также не изменялось. Опубликованы данные о безопасном применении цетиризина у беременных, получавших цетиризин в I триместре беременности. У наблюдавшихся 917 женщин тератогенности не было выявлено.
196 беременных женщин, которые принимали левоцетиризин в I триместре беременности в связи с аллергическим заболеванием (АР, крапивница, астма и другие), не имели осложнений в течение беременности и родили здоровых детей.
Адекватных и строго контролируемых клинических исследований по безопасности применения левоцетиризина во время беременности не проводилось, поэтому препарат следует назначать при беременности с осторожностью. Левоцетиризин выделяется с грудным молоком, что необходимо учитывать, взвешивая риск/пользу от его применения.
Таким образом, представленные данные свидетельствуют о высокой эффективности и безопасности левоцетиризина. Он может использоваться в клинической практике у пациентов разных возрастных групп для лечения распространенных аллергических заболеваний, является перспективным лекарственным средством, расширяющим возможности врача и пациента при выборе оптимальной терапии.
Исследования по безопасности
Несмотря на эффективность пероральных антигистаминных препаратов первого поколения, их применение не рекомендуется, если доступны препараты второго поколения, учитывая седативные и антихолинергические свойства первых. Более того, установлена низкая эффективность антигистаминных средств первого поколения по анализу эффективности затрат, стоимость лечения увеличивается из-за вызываемой ими седации [15]. Целесообразно применять только безопасные антигистаминные средства второго поколения, характеризующиеся благоприятным отношением эффективность/безопасность.
Gandon и Allain [73] оценивали влияние Ксизала в дозе 5 мг как при однократном, так и при многократном применении на психометрические и когнитивные функции в сравнении с плацебо с помощью теста на критическую частоту слияния мельканий. Кроме того, в качестве вторичных целей оценивали влияние на результаты набора тестов, включая время реакции выбора, неустойчивость тела, а также на запоминание. Помимо того, определяли субъективное восприятие изменений настроения и внимательность. В результате проведенного исследования установлено, что левоцетиризин не обладает каким-либо отрицательным воздействием на когнитивные и психометрические функции в сравнении с плацебо.
Долгосрочная безопасность оценивалась в двух 18-месячных исследованиях по непрерывному применению Н1-антигистаминных препаратов у детей до 2 лет (Зиртек в программе ETAC и Ксизал в программе EPAAC) [40, 89, 90]. В двойных слепых рандомизированных исследованиях с участием более 250 детей в каждой группе (лечения и плацебо) при тщательном контроле за биохимическим показателями крови, поведенческим и психомоторным развитием детей не было различий препаратов по сравнению с плацебо. Во всех группах сравнения не обнаружено влияния на рост и развитие детей. Между группами, получавшими Ксизал и Зиртек, получены сходные результаты [91].
Литература
- Гущин И. С. Разнообразие противоаллергического действия цетиризина // РАЖ. 2006. № 4. C. 33–44.
- Abramovits W., Gupta A. Xyzal (levocetirizine dihydrochloride) // Skinmed. 2008, Mar-Apr; 7 (2). P. 84–85.
- Chen C. Physicochemical, pharmacological and pharmacokinetic properties of the zwitterionic antihistamines cetirizine and levocetirizine // Curr Med Chem. 2008. 15 (21). P. 2173–2191.
- Klimek L. Levocetirizine: from scientific evidence to a potent modern-day treatment of today’s allergic patients // Drugs Today (Barc). 2009. Mar. 45 (3). P. 213–225.
- Strolin M. et al. Absorption, distribution, metabolism and excretion of levocetirizine, the R enantiomer of cetirizine, in healthy volunteers // Eur J Clin Pharmacol. 2001. 57. P. 571–582.
- De Esch et al. Trends Pharmacol // Sci. 2005. 26. 462.
- Gillard M., Christophe B., Wels B. et al. H1 antagonists: receptor affinity versus selectivity // Inflamm Res. 2003, Apr. 52. Suppl 1: S49–50.
- Leurs R., Church M. K., Taglialatela M. H1-antihistamines: inverse agonism, anti-inflammatory actions and cardiac effects // Clin Exp Allergy. 2002. 32. P. 489–498.
- Hasala H., Janka-Junttila M., Moilanen E., Kankaanranta H. Levocetirizine and cytokine production and apoptosis of human eosinophils // Allergy Asthma Proc. 2007, Sep-Oct; 28 (5). P. 582–591.
- Shih M. Y., Hsu J. Y., Weng Y. S., Fu L. S. Influence of cetirizine and levocetirizine on two cytokines secretion in human airway epithelial cells // Allergy Asthma Proc. 2008 Sep-Oct. 29 (5). P. 480–485.
Полный список литературы находится в редакции
