Эффективность фармакотерапии остеоартроза коленных суставов у пациентов с соматической патологией
Статьи Опубликовано в журнале:«ПРОФИЛАКТИЧЕСКАЯ МЕДИЦИНА»; 1; 2012; стр. 32-36.
Д.м.н., проф. О.В. Любшина, асп. И.Е. Лосихин
Кафедра терапии, клинической фармакологии и скорой медицинской помощи Московского государственного медикостоматологического университета
Изучали влияние хондропротектора артра на структуру суставного хряща и возможность его безопасного применения у пациентов с остеоартрозом и хроническими соматическими заболеваниями. Установлено, что препарат артра оказывает положительное структурно-модифицируюшее действие в виде прироста высоты суставного хряща и в 2 раза уменьшает риск развития повреждения слизистой оболочки желудочно-кишечного тракта, вызванного НПВП.
Ключевые слова: остеоартроз, хондропротектор, структурно-модифицирующая эффективность, МРТ коленного сустава, артра.
EFFICIENCY OF PHARMACOTHERAPY FOR KNEE OSTEOARTHROSIS IN PATIENTS WITH SOMATIC PATHOLOGY
O.V. Lyubshina , I.E. Losikhin
Department of therapy, Clinical Pharmacology, and Emergency Medical Care, Moscow State University of Medicine and Dentistry
The effect of the chondroprotector аrtrа on the structure of articular cartilage and whether it might be safely used were studied in patients with osteoarthrosis and chronic somatic diseases. Artra was found to exert a positive structure-modifying effect as an increment in articular cartilage height and to show a 2-fold reduction in the risk of gastrointestinal mucosal injuries caused by disease-modifying anti-rheumatic drugs.
Key words: osteoarthrosis; chondroprotector; structure-modifying efficacy; magnetic resonance imaging of the knee joint; аrtra.
Одной из частых клинических ситуаций в возрасте старше 40 лет является болевой синдром в суставах. По мнению экспертов International Association on the Study of Pain, каждый седьмой пациент, обращающийся за плановой амбулаторной помощью, предъявляет жалобы на боли в суставах. Особое значение данная проблема приобретает у лиц пожилого и старческого возраста: более 50% пожилых людей испытывают затруднения при ходьбе и подъеме по лестнице, более 15% страдают явным ограничением подвижности, а после 75 лет их доля увеличивается до 30% (Powered by RiSearch 2000—2001 гг.).
Остеоартроз (ОА) — самая распространенная форма поражения суставов и главная причина нетрудоспособности, вызывающая ухудшение качества жизни и значительные финансовые затраты, особенно у пожилых людей [1]. Больному ОА в основном назначаются неспецифические противовоспалительные препараты (НПВП). Неселективные в отношении циклооксигеназы НПВП нередко усугубляют тяжесть ОА при длительном применении, поэтому рекомендовано их применение в низких дозах и короткими курсами [2].
Только длительное лечение, направленное на улучшение функции основных тканей сустава, способно привести к стойкому обезболивающему эффекту и улучшению структур хрящевой ткани [3]. Данному требованию отвечают симптоматические препараты медленного действия, для которых характерна и структурно-модифицирующая эффективность. Наиболее изученными среди них являются хондроитин и глюкозамин. Практически все проведенные исследования (как минимум 47 рандомизированных контролируемых исследований по хондроитину и не менее 20 — по глюкозамину) достоверно доказали симптоматический эффект данных препаратов при монотерапии.
В настоящее время нет единого мнения об эффективности комбинированных препаратов глюкозамина и хондроитина. Заслуживает внимание исследование GAIT, результаты которого были представлены в 2006 г. на конгрессах EULAR и ACR. По данным исследования, у больных с невысоким исходным уровнем боли (125—300 мм по WOMAC) ни одно из средств, включая целекоксиб, по эффективности статистически значимо не превышало плацебо. При рассмотрении подгруппы пациентов с интенсивным болевым синдромом (301—400 мм по WOMAC) группа комбинированной терапии отвечала на лечение значимо лучше, чем группа плацебо.
Цель работы — изучение клинической и структурно-модифицирующей эффективности комбинированной терапии ОА коленных суставов хондроитина сульфатом и глюкозамина гидрохлоридом у пациентов с соматической патологией.
Материал и методы
Скрининг ОА у пациентов с соматической патологией был проведен среди 1200 больных (средний возраст 63,1±7,8 года).
У пациентов были диагностированы артериальная гипертония, различные формы ишемической болезни сердца, хронической обструктивной болезни легких или их сочетание. У некоторых больных был выявлен сахарный диабет 2-го типа.
В скрининг включались пациенты, имеющие болевой синдром в тазобедренном и/или коленном суставах и/или суставах кисти, а также при наличии узелков Гебердена— Бушара.
Для изучения клинической и структурно-модифицирующей эффективности комбинированной терапии хондроитина сульфатом и глюкозамина гидрохлоридом были выбраны 60 больных, средний возраст которых составил 62,3±4,7 года. В качестве лекарственного средства применяли препарат артра, в состав которого входит 500 мг хондротина сульфата и 500 мг глюкозамина гидрохлорида.
Критерии включения в исследование: письменное информированное согласие; подтвержденная соматическая патология; возраст пациентов 40—75 лет; ранее не диагностированный ОА; боль при ходьбе по VAS≥40; ОА в соответствии с критериями ACR; рентгенологически подтвержденная II—III стадия по Kellgron—Lawrence; прием НПВП в течение 30 дней за предшествующие исследованию 3 мес.
Пациентов рандомизировали на две одинаковые группы, которые были сопоставимы по возрасту, полу, распространенности отдельных терапевтических нозологических форм, интенсивности болевого синдрома и степени функциональных ограничений (табл. 1). В исследование специально были включены пациенты, у которых ранее ОА диагностирован не был.
Таблица 1.
Характеристика пациентов, включенных в исследование
| Параметр | 1-я группа | 2-я группа |
| Число больных | 30 | 30 |
| Возраст | 63,3±5,4 | 62,4±6,8 |
| Пол муж/жен | 8/12 | 7/13 |
| Боль WOMAC | 386,3 | 325,6 |
| Функциональная недостаточность WOMAC | 954,7 | 923,4 |
| Потребность в НПВП | 26 (86,7%) | 27 (90%) |
| Ранее диагностированный ОА | 0 | 0 |
| Артериальная гипертония | 26 (86,7%) | 24 (80%) |
| Ишемическая болезнь сердца (стенокардия напряжения и/или постинфарктный кардиосклероз) | 13 (43,3%) | 15 (50%) |
| Хронический обструктивный бронхит | 4 (13,3%) | 3 (10%) |
| Сахарный диабет 2-го типа | 9 (30%) | 8 (26,7%) |
На момент исследования некоторые пациенты принимали НПВП, причем их число в группах было сопоставимо. (В 1-й группе 17 человек получали диклофенак натрия, 6 — нимесулид, 3 — мовалис; во 2-й группе 14 — диклофенак натрия, 10 — нимесулид, 1 — ибупрофен, 2 — мовалис.) За 2 недели до исследования все НПВП были отменены. Пациенты обеих групп перед исследованием принимали парацетамол (для «отмывки»).
В 1-й группе всем пациентам был назначен комбинированный препарат артра; пациенты получали диклофенак натрия (50 мг), в ходе исследования НПВП отменялись при отсутствии болевого синдрома и его рецидивирования без терапии НПВП.
Режим дозирования артра: 1 таблетка 2 раза в сутки в течение первых 3 нед; 1 таблетка 1 раз в сутки в течение 6 мес.
Во 2-й группе пациенты получали диклофенак натрия (50 мг), в ходе исследования НПВП отменялись при отсутствии болевого синдрома и его рецидивирования без терапии НПВП.
Через 1, 3 и 6 мес наблюдения проводили анализ по шкале WOMAC, оценивали скорость ходьбы на расстояние 15 м. После окончания лечения больным предлагалось оценить эффективность терапии по критериям: «плохо», «удовлетворительно», «хорошо», «отлично». Для оценки безопасности терапии анализировали частоту развития НПВП-гастропатии по клиническим и инструментальным (ЭГДС) данным исходно и через 6 мес наблюдения.
Проводили МРТ коленного сустава в начале исследования и через 9 мес. Исследование проводилось на магнитно-резонансном томографе Sonata («Siemens») с напряженностью магнитного поля 1,5 Тл. Плоскость сканирования — фронтальная, сагиттальная; толщина срезов — 3—5 мм; расстояние между срезами — 1 мм. Изменения хрящевой структуры сустава оценивали по высоте суставного хряща в латеральных и медиальных срезах сустава в трех локализациях: локализация I — передняя поверхность головки бедренной кости (хрящ бедренной кости); локализация II — задняя поверхность головки бедренной кости (хрящ бедренной кости); локализация III — точка наибольшего соприкосновения бедренной и большеберцовой костей (сумма толщины бедренной и большеберцовой кости). Также оценивалась площадь суставной поверхности.
Результаты исследования
До проведения скрининга лишь у 14,7% мужчин и 9,6% женщин ранее был диагностирован ОА (коксарторз или гонартроз). Жалобы на боли в одном из крупных суставов (тазобедренном или коленном) предъявлял 901 (75,1%) пациент (табл. 2). Из них 63,1% пациентов отмечали утреннюю скованность, длящуюся не более 1 ч. Ограничение подвижности и боль при ходьбе отмечали 54,3% пациентов. Узелки Гебердена—Бушара были обнаружены у 16,9% пациентов.
Таблица 2.
Клиническая характеристика больных
| Параметр | Мужчины | Женщины | ||
| абс. | % | абс. | % | |
| Число больных | 326 | 27,2 | 874 | 72,8 |
| Средний возраст, годы | 62,4±7,3 | 63,6±8,7 | ||
| Болевой синдром в коленном или тазобедренном суставе | 217 | 66,6 | 684 | 78,3 |
| Ограничение подвижности, боль при ходьбе | 164 | 50,3 | 487 | 55,7 |
| Узелки Гебердена—Бушара | 76 | 23,3 | 127 | 14,5 |
| Рентгенологические изменения | 178 | 54,6 | 532 | 60,8 |
| Ранее диагностированный ОА | 48 | 14,7 | 84 | 9,6 |
Суммарный балл болевого синдрома по шкале WOMAC составил 356,4±46,4; суммарный балл функциональной недостаточности — 948,8±39,7.
При рентгенологическом исследовании указанных суставов на основании таких обнаруженных симптомов, как сужение суставной щели и остеофиты и/или субхондральный склероз, и/или субхондральные кисты, ОА был диагностирован у 710 (59,2%) пациентов, причем у женщин несколько чаще.
Таким образом, более 2/3 больных с хроническими соматическими заболеваниями имеют болевой синдром в коленном или тазобедренном суставе, при этом практически у 60% пациентов выявлены рентгенологические признаки ОА. Оценка по шкале WOMAC у данных пациентов демонстрирует наличие как выраженного болевого синдрома, так и значительную степень функциональных ограничений, при этом более 71% пациентов получают НПВП и более 82% из них оценивают обезболивающую терапию как неудовлетворительную.
Оценка динамики болевого синдрома (WOMAC) продемонстрировала, что пациенты, получавшие комбинированную терапию, уже через 3 мес лечения имели больший регресс болевого синдрома по сравнению с контрольной группой (рис. 1). Через 6 мес терапии у пациентов 1-й группы уровень интенсивности болевого синдрома был достоверно ниже, чем у пациентов 2-й группы (178,3±37,2. против 287,4±42,8; р=0,02).
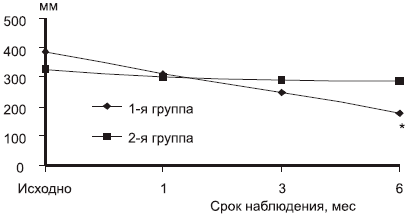
Рис. 1. Динамика болевого синдрома.
*р<0,05 по сравнению с контролем (2-й группой).
Скорость ходьбы на расстояние 15 м в 1-й группе после терапии составила 29,7 с по сравнению с 39,6 с во 2-й группе (рис. 2).
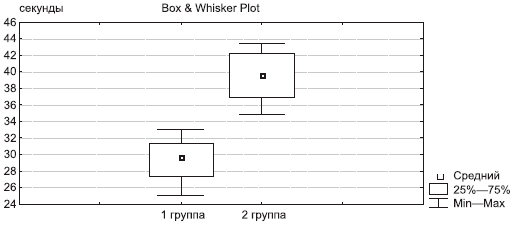
Рис. 2. Скорость ходьбы на расстояние 15 м через 6 мес терапии.
Оценка функциональной недостаточности (WOMAC) в начале исследования не выявила значимых различий между группами. В обеих группах через 6 мес терапии мы наблюдали достоверное снижение балла функциональной недостаточности, однако в 1-й группе средний балл составил 427,3, во 2-й — 658,9 (р=0,002) (рис. 3).
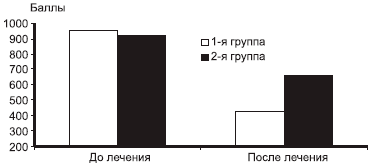
Рис. 3. Динамика функциональной недостаточности.
Таким образом, у пациентов, получавших артра, после окончания запланированного срока наблюдения отмечалась достоверно большая динамика нивелирования болевого синдрома и функциональной недостаточности.
Визуальная оценка исследований до и через 9 мес терапии врачом, проводившим МРТ коленного сустава, выявила в 1-й группе 60% пациентов с положительной динамикой, 30% — с отсутствием динамики и 10% — с отрицательной динамикой. Во 2-й группе положительной динамики не отмечено, у 63,3% пациентов наблюдалась отрицательная динамика, а у 36,7% — отсутствие динамики.
Анализ высоты суставного хряща в латеральном срезе у пациентов 1-й группы продемонстрировал положительную динамику во всех точках подсчета, площадь суставной поверхности за период наблюдения увеличилась в среднем на 40 мм2 (табл. 3). Однако во 2-й группе (пациенты принимали только НПВП) в I и II локализации отмечена отрицательная динамика, площадь суставной поверхности уменьшилась в среднем на 6 мм2.
Таблица 3.
Динамика высоты (мм) суставного хряща в латеральном срезе
| Локализация | 1-я группа | 2-я группа | ||
| до лечения | через 9 мес | до лечения | через 9 мес | |
| I | 1,76±0,1 | 2,0±0,17 | 1,81±0,1 | 1,80±0,1 |
| II | 1,64±0,2 | 1,9±0,1 | 1,61±0,07 | 1,61±0,1 |
| III | 2,1±0,07 | 2,4±0,1 | 2,0±0,2 | 2,1±0,1 |
| S, мм2 | 178,3±2,4 | 218,7±3,8 | 179,2±3,1 | 173,2±5,7 |
Анализ высоты суставного хряща в медиальном срезе показал аналогичные результаты (табл. 4).
Таблица 4.
Динамика высоты (мм) суставного хряща в медиальном срезе
| Локализация | 1-я группа | 2-я группа | ||
| до лечения | через 9 мес | до лечения | через 9 мес | |
| I | 1,42±0,2 | 1,58±0,2 | 1,47±0,3 | 1,38±0,3 |
| II | 1,43±0,3 | 1,43±0,1 | 1,52±0,4 | 1,38±0,2 |
| III | 2,2±0,2 | 2,4±0,3 | 2,32±0,26 | 2,24±0,31 |
| S, мм2 | 217,6±4,1 | 238,3±3,6 | 224,3±3,7 | 212,7±4,1 |
Таким образом, в группе пациентов, получающих артра, выявлен больший положительный эффект с позиций клинической картины, что подтверждено с помощью МРТ-исследования: обнаружены увеличение площади суставной поверхности и прирост высоты хряща в исследуемых точках.
В 1-й группе наблюдалось значительно большее число больных, оценивших результаты терапии как «отличные» и «хорошие», во 2-й группе в большинстве случаев пациенты оценили терапию как «удовлетворительную» и «плохую» (рис. 4).
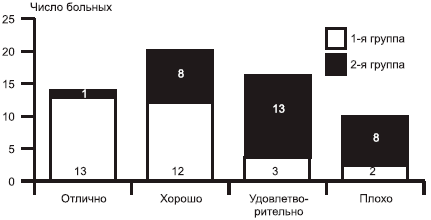
Рис. 4. Субъективная оценка терапии пациентом.
С клинической точки зрения эффективность терапии ОА у пациентов с соматической патологией в первую очередь оценивалась по потребности пациента в обезболивающих препаратах и количестве случаев развития НПВП-гастропатии и диспепсии (табл. 5). Безопасность терапии оценивалась по частоте развития НПВП-гастропатии по клиническим признакам (диспепсия) на протяжении всего курса терапии и по данным ЭГДС через 6 мес лечения.
Таблица 5.
Потребность в НПВП и частота гастропатии в группах
| Показатель | 1-я группа (n=30) | 2-я группа (n=30) | ||
| абс. | % | абс. | % | |
| Потребность в НПВП: | ||||
| в начале лечения | 26 | 86,7 | 27 | 90 |
| в конце лечения (6 мес) | 7 |
23,3 | 22 | 73,3 |
| НПВП-гастропатии и диспепсия (все случаи) | 6 | 20 | 13 | 43,3 |
В группе больных, принимавших артра, к концу лечения только 23,3% пациентов нуждались в дополнительном приеме НПВП, что, по-видимому, и повлияло на частоту случаев НПВП-гастропатии (как на случаи диспепсии, так и эрозивных поражений; данные поражения в этой группе выявлены лишь у 20% пациентов).
Таким образом, включение хондропротектора артра в терапию пациентов с хроническими терапевтическими заболеваниями и ОА позволяет быстрее добиться обезболивающего эффекта и в некоторой степени улучшить состояние хрящевой ткани пораженного сустава. При этом препарат безопасен в отношении поражения гастродуоденальной слизистой оболочки, поскольку позволяет сократить прием НПВП, обладающих системным поражающим воздействием на слизистую желудочно-кишечного тракта (ЖКТ).
Заключение
У пациентов с соматическими заболеваниями в 75,1% случаев выявляются болевые синдромы в крупных суставах, при этом в 59,2% случаев отмечаются рентгенологические признаки ОА коленных и тазобедренных суставов, что требует комплексного подхода к лечению. Прием комбинированных хондропротекторов (препарат артра) уже через 3 мес приводит к большему снижению балла функциональной недостаточности и регрессу болевого синдрома по сравнению с группой контроля, при этом скорость ходьбы на расстояние 15 м в основной группе после терапии составила 29,7 с против 39,6 с в группе контроля. Позитивный клинический эффект от препарата, вероятно, может быть также обусловлен хондропротекцией, в частности, некоторым приростом высоты хряща. Это подтверждают данные МРТ, однако учитывая сравнительно короткий период терапии и небольшой размер выборки, для формирования окончательных выводов следует провести более масштабные исследования. Использование комбинированного препарата хондроитина сульфата и глюкозамина гидрохлорида в комплексе медикаментозного лечения больных с сочетанной патологией внутренних органов и остеодистрофическими нарушениями суставов в 2 раза уменьшает риск развития повреждения слизистой оболочки ЖКТ, вызванного НПВП.
ЛИТЕРАТУРА 1. McNickle A., Provencher M.T., Cole B.J. Overview of existing cartilage repair technology. Sports Med Arthrosc Rev 2008; 16: 4: 196—201.
2. Bennett J.S., Daugherty A., Herrington D., Greenland P., Roberts H., Taubert K.A. The use of nonsteroidal anti-inflammatory drugs (NSAIDs): a science advisory from the American Heart Association. Circulation 2005; 111: 13:1713—1716.
3. OARSI recommendations for the management of hip and knee osteoarthritis, Part II: OARSI evidence-based, expert consensus guidelines 2008.
4. Daniel O., Clegg M.D. Glucosamine, Chondroitin Sulfate, and the Two in Combination for Painful Knee Osteoarthritis. N Engl J Med 2006; 354: 795—808.
5. Solomon S.D., Pfeffer M.A., McMurray J.J., APC and PreSAP Trial Investigators. Effect of celecoxib on cardiovascular events and blood pressure in two trials for the prevention of colorectal adenomas. Circulation 2006; 114: 10: 1028—1035.
6. Buckland-Wright J.C., Bird C.F., Ritter-Hrncirik C.A., Cline G.A., Tonkin C., Hangartner T.N., Ward R.J., Meyer J.M., Meredith M.P. X-ray technologists’ reproducibility from automated measurements of the medial tibiofemoral joint space width in knee osteoarthritis for a multicenter, multinational clinical trial. J Rheumatol 2003; 30: 2: 329—338.
7. Buckland-Wright J.C., Ward R.J., Peterfy C., Mojcik C.F., Leff R.L. Reproducibility of the semiflexed (metatarsophalangeal) radiographic knee position and automated measurements of medial tibiofemoral joint space width in a multicenter clinical trial of knee osteoarthritis. J Rheumatol 2004; 31: 8: 1588—1597.
8. Наумов А.В., Верткин А.Л., Шамуилова М.М., Мендель О.И., Семенов П.А. Стратификация риска и стратегические решения фармакотерапии остеоартроза в терапевтической практике. Справочник поликлинического врача 2009; 5: 38—45.
9. Наумов А.В., Верткин А.Л. и др. Справочник поликлинического врача 2009; 5.
