Новые возможности нейропротективной терапии при серозных менингитах у детей
СтатьиОпубликовано:
Журнал инфектологии, Том 6, № 2, 2014
М.В. Иванова, Н.В. Скрипченко, Н.В. Матюнина, А.А. Вильниц, В.Б. Войтенков
Научно-исследовательский институт детских инфекций ФМБА России, Санкт-Петербург, Россия
New in neuroprotective therapy for children with aseptic meningitis.
M.V. Ivanova, N.V. Skripchenko, N.V. Matyunina, A.A.Vilnits, V.B. Voytenkov
Science Research Institute of Children’s Infections of FMBA of Russia, Saint-Peterburg, Russia Резюме
Цель – оценить терапевтическую эффективность препарата нооклерин при серозных менингитах у детей.
Материалы и методы: проанализирована терапевтическая эффективность препарата нооклерин у 50 детей с серозным менингитом. В течение 2 месяцев 1 (основная) группа (35 пациентов) на фоне базовой терапии получала нооклерин с 5-го дня госпитализации, 2 (контрольная) группа получала только базовое лечение. Всем детям проводился мониторинг клинико-неврологических показателей в течение всего периода стационарного лечения и через 2 месяца после выписки из стационара. Оценка степени астении проводилась по «Шкале симптомов астении у детей» и «Шкале астении Шаца», определение уровня качества жизни при помощи опросника PedsQL4.0 и ЭЭГ-исследование проводилось дважды – при поступлении и через 2 месяца после выписки из стационара.
Результаты: при анализе полученных данных было показано, что включение нооклерина в схему терапии серозных менингитов приводит к достоверному уменьшению степени выраженности астенического синдрома и улучшению качества жизни пациентов по сравнению с контрольной группой.
Заключение: в связи с полученными результатами рекомендовано включить нооклерин в стандарт оказания помощи детям, переносящим серозный менингит.
Ключевые слова: серозный менингит, лечение, нооклерин, астения, качество жизни.
Abstract
Aim: assessment of efficienty of Nooclerin in children with aseptic meningitis.
Materials and methods: our study was performed on 50 children with aseptic meningitis; efficiency of Nooclerin was analized. First group (main, 35 patients) took standart therapy and Nooclerin from the 5th day of hospitalization within 2 months; second group (control, 15 patients) took only standart treatment. During the whole period of hospitalization and 2 months after all patients were monitored with clinilal-neurological signs. Assessment of asthenia was performed on the «Children asthenia’s symptoms scale» and «Schatz asthenia scale». Also we defined the quality of life by means of questionnaire PedsQL4.0; EEG was conducted twice: first days of hospitalization and 2 months after discharge from the hospital.
Results: we analized including of Nooclerin in the therapy of aseptic meningitis leads to significant decrease of asthenic syndrome and increase the quality of life compare to control group.
Conclusion. We recommend to include Nooclerin in standarts of management of children with aseptic meningitis.
Key words: aseptic meningitis, treatment, Nooclerin, asthenia, quality of life
Введение
Серозные менингиты (СМ) являются распространенными формами поражения центральной нервной системы, частота которых в структуре нейроинфекций достигает 25–30% [1–4]. Среди заболевших СМ дети и подростки составляют 65–78%. В последние годы наблюдается рост заболеваемости СМ, в этиологии которых имеют значение как вирусы (энтеровирусы, герпес-вирусы, вирус лихорадки Западного Нила, ВИЧ и др.), так и бактерии (туберкулезные палочки, лептоспиры, грибы рода кандида, иерсинии, боррелии и эрлихии) [3]. Тенденции распространения заболевания по-прежнему указывают на возникновение спорадических случаев и вспышек [4]. Основу клинической картины СМ составляют общемозговые и менингеальные симптомы, выраженность которых отражает степень воспалительных и гемо-ликвородинамических нарушений. Несмотря на сравнительно благоприятное течение серозных менингитов, у реконвалесцентов в 40–60% случаев диагностируются неврологические нарушения, чаще всего в виде церебрастенического (32,2%) и невротического (12,3%) синдромов [4]. В патогенезе серозных менингитов имеет значение как синдром системного воспалительного ответа, воспаление мягких мозговых оболочек, нарушение гемо- и ликвородинамики, так и нейрометаболические изменения, степень выраженности которых зависит от тяжести менингита. В этой связи общепринятой терапевтической тактикой СМ является применение не только этиотропных препаратов, но и патогенетических средств, включающих дегидратационные, сосудистые и обязательно ноотропные препараты. В настоящее время появляются новые ноотропные препараты с комплексным механизмом действия, влияющие на различные патогенетические звенья патологического процесса. Одним из таких препаратов является нооклерин, обладающий церебропротективными свойствами с отчетливым ноотропным, психостимулирующим и психогармонизирующим действием при астенических состояниях, нарушениях памяти различного генеза [5–6].
Цель исследования – оценить терапевтическую эффективность препарата нооклерин при серозных менингитах у детей.
Материалы и методы
Проведено клинико-лабораторное обследование 50 больных с СМ в возрасте от 10 до 18 лет, проходивших лечение в Научно-исследовательском институте детских инфекций в 2012–2013 гг. Все дети поступали с подозрением на менингит на 1–2-й день заболевания. Достоверных гендерных различий выявлено не было – с одинаковой частотой болели как мальчики (52%), так и девочки (48%). У 32 (64%) пациентов была установлена энтеровирусная этиология заболевания, а 18 детей (36%) переносили серозный менингит неустановленной этиологии.
Диагноз серозного менингита выставлялся на основании данных анамнеза заболевания, клинической картины и лабораторных показателей (клинический анализ ЦСЖ и общий анализ крови). Все больные были разделены на 2 группы:
1 группа (основная группа – 35 детей) вместе с базовой терапией серозного менингита получала препарат нооклерин с 5-го дня госпитализации, доза препарата зависела от возраста пациента. Так, детям с 10 до 12 лет нооклерин назначался по 2,5 мл (0,5 г) 2 раза в день, старше 12 лет — 5,0 мл (1 г) 2 раза в день, длительность приема препарата составила 2 месяца.
2 группа (группа сравнения – 15 детей) получала только базовую терапию.
Базовая терапия серозного менингита включала противовирусные (амиксин), дегидратационные (диакарб), дезинтоксикационные препараты.
Обе группы были сопоставимы по возрасту, полу, тяжести заболевания и этиологии менингита.
Всем детям проводился мониторинг клинико-неврологических показателей в течение всего периода стационарного лечения и через 2 месяца после выписки из стационара. Оценивалась длительность основных симптомов заболевания – температуры, симптомов интоксикации, головной боли, рвоты, сохранения менингеальных симптомов, сроки санации ЦСЖ. Также проводилось этиологическое обследование для определения возбудителя, вызвавшего серозный менингит (энтеровирусы, герпес-вирусы, боррелии, вирус клещевого энцефалита) в крови и ЦСЖ методом полимеразно-цепной реакции (ПЦР), одновременно с этим в крови методом иммуноферментного анализа (ИФА) определялись иммуноглобулины (Ig) IgM и IgG к тем же возбудителям.
Оценка степени астении проводилось по «Шкале симптомов астении у детей» и «Шкале астении Шаца».
Качество жизни оценивали при помощи опросника PedsQL4.0. Опросник состоит из 23 вопросов и включает 4 шкалы: физическое функционирование (8 вопросов), эмоциональное функционирование (5 вопросов), социальное функционирование (5 вопросов) и жизнь в учебном заведении (5 вопросов). Общее количество баллов после процедуры перекодирования каждого из пяти вариантов ответа рассчитывается в итоге по 100-балльной шкале (от 0 до 100 баллов): чем выше итоговая величина, тем лучше качество жизни ребенка [7]. Оценка степени астении, когнитивных функций и качества жизни проводилась дважды: в день госпитализации и через 2 месяца после выписки при диспансерном осмотре. В эти же сроки проводилось ЭЭГ-обследование.
Результаты и обсуждение
Анализ течения острого периода серозного менингита в обеих группах не выявил достоверных отличий по длительности основных симптомов заболевания (рис. 1).
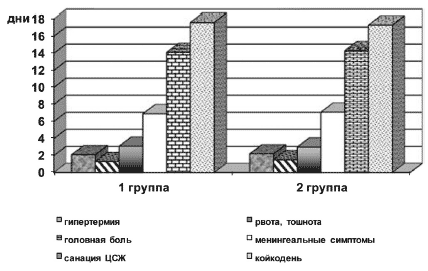
Рис. 1. Длительность основных клинических симптомов у больных с серозными менингитами, получавших нооклерин (группа 1), и в группе сравнения (группа 2) (р>0,05)
Однако при осмотре детей, перенесших серозный менингит, в периоде реконвалесценции через 2 месяца после выписки из стационара больные из контрольной группы достоверно более часто жаловались на эмоциональную лабильность, неустойчивость настроения, повышенную утомляемость в вечерние часы и к концу учебной недели, головные боли, возникающие после эмоциональной или умственной нагрузки, уменьшение работоспособности, чем дети, получавшие нооклерин (табл. 1).
Таблица 1
Частота предъявляемых жалоб больных из группы, получавшей нооклерин (группа 1) и группы сравнения (группа 2) через 2 месяца после выписки из стационара
| Жалобы | 1 группа (n=35) | 2 группа (n=15) | ||
| n | % | n | % | |
| Эмоциональная лабильность | 2 | 5.7±3,92* | 5 | 33,3±12,6* |
| Неустойчивость настроения | 2 | 5,7±3,92** | 7 | 46,7±13,3** |
| Нарушение сна | 1 | 2,9±2,84 | 2 | 13.3±9,08 |
| Утомляемость | 2 | 5,7±3,92* | 5 | 33,3±12,6* |
| Головная боль | – | – | 4 | 26± 11,72* |
| Уменьшение работоспособности | – | – | 6 | 40±13,09** |
| Снижение памяти | 1 | 2,9±2,84 | 3 | 20±10,69 |
** – достоверность различий по сравнению с группой сравнения на уровне p<0,01.
Таким образом, проявления церебрастенического синдрома в группе сравнения выявлялись значительно чаще, чем у детей, получавших нооклерин.
Для объективизации степени выраженности астенического синдрома у детей в обеих группах было проведено анкетирование пациентов по «Опроснику для выявления уровня астении И.К. Шаца» и «Шкале симптомов астении у детей». Оценка уровня астении по «Опроснику И.К. Шаца» проводилось дважды: в первые сутки поступления ребенка в стационар и через 2 месяца после выписки из стационара при диспансерном наблюдении (рис. 2).
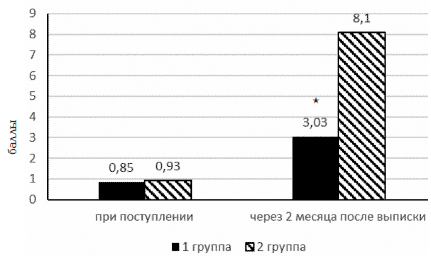
Рис. 2. Оценка уровня астении у больных серозными менингитами, получавших нооклерин (группа 1) и в группе сравнения (группа 2) до и после лечения по «Опроснику И.К. Шаца»; * – достоверность различий по сравнению с группой сравнения на уровне p<0,01
При проведении первого тестирования выявлялся уровень астении у ребенка до начала серозного менингита (исследователь просил отвечать на вопросы с учетом состояния до наступления заболевания). Анализ полученных результатов выявил, что «реакция утомления» (оценка по «Опроснику И.К. Шаца» 1–2 балла) была выявлена у 4 человек в группе 1 (11,4%) и 2 человек в группе 2 (13,3), у остальных пациентов она была меньше 1 (отсутствие астении). В целом, средний балл оценки уровня астении составил 0,86±0,5 (группа 1) и 0,93±0,9 (группа 2), что соответствует по «Опроснику И.К. Шаца» отсутствию астении.
При повторном тестировании детей, перенесших серозный менингит, через 2 месяца после выписки из стационара также получены достоверные различия по уровню астении в исследуемых группах. Так, у детей, получавших в течение 2 месяцев нооклерин, уровень астении расценивался как «реакция утомления» (средний балльный показатель в группе – 3,03±1,3), причем изменения чаще всего касались шкалы V (эмоциональная лабильность), у 9 пациентов он был равен 0, что соответствует отсутствию астении. В группе сравнения средний балльный показатель составил 8,1±0,87, что соответствует «умеренной астении» по «Опроснику И.К. Шаца», прочем изменения чаще всего касались шкалы III (изменение памяти), IV (нарушения внимания), V (эмоциональная лабильность).
Оценка уровня астении по «Шкале симптомов астении у детей» проводилось 3 раза: в первые сутки поступления ребенка в стационар, при выписке и через 2 месяца после выписки из стационара при диспансерном наблюдении (рис. 3).
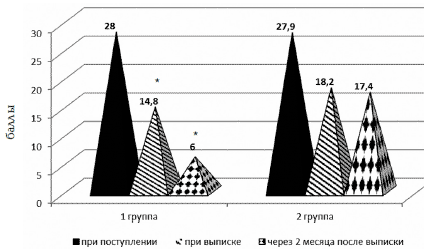
Рис. 3. Оценка уровня астении у больных серозными менингитами, получавших нооклерин (группа 1), и в группе сравнения (группа 2) до и после лечения по «Шкале симптомов астении у детей»; * – достоверность различий по сравнению с группой сравнения на уровне p<0,01
При проведении первого тестирования достоверных отличий в обеих группах получено не было. Уровень астении учитывался на момент поступления больного в стационар и соответствовал умеренной астении (средний балл оценки уровня астении 28±2,9 (группа 1) и 27,9±1,9 (группа 2). При выписке из стационара отмечались существенные отличия этого показателя в исследуемых группах, которые значительно увеличивались при третьем тестировании пациентов. Так, в группе больных, получавших нооклерин, к моменту выписки из стационара – снижался в 2 раза (14,8±0,67) и соответствовал уровню «реакции утомления», а к моменту окончания приема нооклерина (через 2 месяца после выписки из стационара) уменьшался практически до нормальных значений (6±2,6).
В группе сравнения также отмечалось снижение средней балльной оценки уровня астении к моменту выписки из стационара (18,2±0,91), но она оставалась достоверно выше, чем в группе детей, получавших нооклерин, и соответствовала умеренной степени астении. В дальнейшем, при третьем обследовании через 2 месяца после выписки из стационара, она практически не изменилась и составила 17,4±2,4, что было достоверно выше, чем в основной группе.
Таким образом, проведенное тестирование больных серозными менингитами по двум шкалам для определения уровня астении в остром периоде заболевания и в катамнезе через 2 месяца после выписки в различных группах выявило достоверно более низкий уровень развития астенических проявлений у детей, получавших нооклерин, к моменту выписки из стационара, а также значительное уменьшение проявлений астении через 2 месяца приема препарата, по сравнению с группой сравнения. Полученные данные подтверждают тот факт, что нооклерин оказывает не только психостимулирующее, но и церебропротективное действие.
Наряду с оценкой уровня астении у детей, переносящих серозный менингит, нами проводилась оценка изменения качества жизни у этих пациентов (табл. 2).
Таблица 2
Оценка показателей качества жизни больных серозными менингитами, получавших нооклерин (группа 1), и в группе сравнения (группа 2) до и после лечения
| Показатели | До заболевания | Через 2 месяца после выписки | ||
| 1 группа (n=35) | 2 группа (n=15) | 1 группа (n=35) | 2 группа (n=15) | |
| ФФ | 84,29±2,15 | 86,67±4,13 | 83,71±1,5 | 81,67±5,9 |
| ЭФ | 90,21±1,85 | 87,64±2,64* | 82,96±4,2 | 66,47±3,3* |
| СФ | 92,62±0,92 | 85,85±0,69 | 90,42±1,79 | 82,92±1,16 |
| КФ | 78,08±2,44 | 79,54±1,47* | 75,25±5,54 | 53,16±3,29* |
| ПСЗ | 86,79±1,36 | 85,11±1,68* | 81,43±3,15 | 69,82±2,41* |
| ОБ | 86,3±3,7 | 85,25±3,17* | 82,75±3,17 | 71,91±1.27* |
При проведении тестирования по опроснику для родителей PedsQL версия 4.0 в день поступления в стационар оценивался исходный уровень качества жизни ребенка до заболевания серозным менингитом. При анализе полученных данных достоверных отличий по всем шкалам качества жизни у обеих групп получено не было. Было отмечено, что в обеих группах имелось некоторое снижение качества жизни по шкале когнитивного функционирования до 78,08±2,44 баллов (группа 1) и 75,25±5,54 балла (группа 2).
При повторном тестировании детей, перенесших серозные менингиты, через 2 месяца после выписки из стационара в группе 1 отмечалось незначительное снижение балльной оценки по всем шкалам качества жизни, но оно было минимальным и статистически не достоверным. В то же время при анализе данных тестирования в группе 2, проведенного в эти же сроки, было получено достоверное снижение уровня качества жизни по сравнению с исходными показателями: общий балл снизился с 85,25±3,17 до 71,91±1,27, показатель «психосоциальное здоровье» – с 85,11±1,68 до 69,82±2,41 (p<0,01). Также можно отметить, что снижение уровня качества жизни происходило в основном за счет достоверного уменьшения показателей по шкале эмоционального функционирования (с 87,64±2,64 до 66,47±3,3, p<0,01) и шкале когнитивного функционирования (с 79,54±1,47 до 53,16±3,29, p <0,01), что коррелирует с показателями уровня астении в этой группе.
Таким образом, проведенное исследование выявило снижение уровня качества жизни через 2 месяца после перенесенного серозного менингита у детей, получавших только базовую терапию в остром периоде заболевания (группа 2), в то время как у детей, получавших вместе с базовой терапией серозного менингита в течение 2 месяцев нооклерин, качество жизни оставалось на первоначальном уровне.
Также нами проведен сравнительный анализ показателей ЭЭГ-обследования в группе детей, получавших нооклерин с 5-го дня лечения серозного менингита (группа 1) и в группе сравнения (группа 2). ЭЭГ-обследование проводилось дважды: в первые 2 суток поступления ребенка на лечение в стационар и через 2 месяца после выписки.
При ЭЭГ-исследовании в остром периоде серозного менингита достоверных отличий у больных основной группы и группы сравнения получено не было. В обеих группах наблюдалось общее понижение амплитуды альфа-ритма, в некоторых случаях альфа-ритм был представлен отдельными элементами на фоне полиморфной кривой; в обеих группах регистрировалась диффузная медленноволновая активность без четкого преобладания по отведениям. Спектр ЭЭГ в обеих группах был смещен в сторону тета-диапазона.
При повторном исследовании через 2 месяца после выписки из стационара в группе детей, получавших нооклерин (группа 1), в 37,2% случаев (n=13) наблюдалась картина ЭЭГ, соответствующая возрастной норме, в 40% (n=14) отмечались легкие признаки дезорганизации основной активности: умеренное понижение амплитуды альфа-ритма, периодическое проведение альфа-ритма в лобные отведения, отдельные медленные волны без четкого преобладания по отведениям. В 22,8% случаев (n=8) регистрировались признаки средней степени выраженности дезорганизации основной активности (постоянное проведение альфа-ритма в лобные отведения, средней степени выраженности понижение его амплитуды, медленноволновая активность с формированием редких (1–2 за все время записи) билатерально-синхронных вспышек).
В группе сравнения (группа 2) в 80% случаев (n =12) регистрировались средней степени выраженности изменения биоэлектрической активности, умеренные в 20% (n=3). Возрастной нормы не зарегистрировано ни в одном случаев. Эпилептиформной активности ни в одной группе выявлено не было (рис. 4).

Рис. 4. Частота (%) изменения ЭЭГ-показателей у больных серозными менингитами, получавших нооклерин (группа 1), и в группе сравнения (группа 2) при обследовании через 2 месяца после выписки из стационара
Таким образом, данные, полученные при ЭЭГ-обследовании в остром периоде заболевания и в катамнезе через 2 месяца после выписки из стационара полностью коррелируют с клиническими наблюдениями и данными, полученными при анкетировании больных. Не исключено, что нооклерин как препарат, по своей химической структуре близкий к естественным веществам, оптимизирующим деятельность мозга (гамма-аминомасляная и глутаминовая кислоты), при применении у детей, больных серозными менингитами, облегчая процесс передачи нервного импульса, улучшая фиксацию, консолидацию и воспроизведение памятных следов, стимулируя процессы тканевого обмена, способствует оптимизации нейрометаболических процессов, что предупреждает формирование органического дефицита. Применение нооклерина в комплексной терапии серозных менингитов сглаживает межполушарные различия в функционировании головного мозга, что также способствует протекции развития симптоматической эпилепсии в периоде поздней реконвалесценции.
Заключение
Полученные данные клинического наблюдения за больными с серозным менингитом, проведенное тестирование для определения уровня астении и качества жизни, ЭЭГ-обследование в остром периоде заболевания и в катамнезе в течение 2 месяцев у больных, получавших нооклерин и в группе сравнения, показали терапевтическую эффективность нооклерина, а также подтвердили его психостимулирующие, нейрометаболическое и церебропротективное действие. Переносимость препарата у детей хорошая. Побочных эффектов выявлено не было. В связи с этим препарат нооклерин может быть включен в стандарт оказания помощи детям, переносящим серозный менингит для профилактики и лечения постинфекционной астении для улучшения исходов заболевания.
Литература
- Лобзин, Ю.В. Энтеровирусные инфекции / Ю.В. Лобзин, Н.В. Скрипченко, Е.А. Мурина. – СПб., 2012. – 432 с.
- Михайлова, Е.В. Менингиты энтеровирусной этиологии у детей: современные подходы к диагностике и особенности клинического течения / Е.В. Михайлова, А.В. Штейнберг, И.Г. Еремеева // Инфекционные болезни. – 2008. – № 6 (1). – С. 31–34.
- Скрипченко, Н.В. Вирусные энцефалиты и менингиты у детей / Н.В. Скрипченко, М.Н. Сорокина. – М.: Медицина, 2004. – 415 с.
- Скрипченко, Н.В. Энтеровирусная (неполио) инфекция у детей : методические рекомендации / Н.В. Скрипченко [и др.]. – СПб.: – 2013. – 18 с.
- Аведисова, А.С. Новый отечественный препарат нооклерин в терапии астении и других заболеваний / А.С. Аведисова // Фармотека. – 2005. – № 6. – С. 51–54.
- Александровский, Ю.А. Применение препарата нооклерин в качестве антиастенического средства у больных с функциональной астенией / Ю.А. Александровский, А.С. Аведисова, Д.В. Ястребов // Психиатрия и психофармакотерапия. – 2003. – № 6. – С. 51–54.
- Лукьянова, Е.М. Оценка качества жизни в педиатрии /Е.М. Лукьянова // Качественная клиническая практика. – 2002. – № 4. – С. 34–42 References
References
- Lobzin Yu.V., Skripchenko, N.V., Murina E.A. Enteroviral infection, S-Pb., 2012/ – 432 p.
- Mixailova E.V., Shteinberg A.V., Eremeeva I.G. Infechionnie bolezni – 2008. – 6 (1). – P. 31–34.
- Skripchenko, N.V., Sorokina M.N. Viral encephalitis and meningitis inchildren. Moscow: Medicine, 2004. –415p.
- Shteinberg A.V., Ivanova G.P. et al Methodological guidelines – S-Pb.: – 2013. – 18 p.
- Avedisova A.S. Pharmoteka. – 2005. – №6. – P. 51-54
- Aleksandrovski Yu.A., Avedisova A.S., Yastrebov D.V. Psixiatriya i psixofarmakoterapiya. – 2003. – №6. –P . 51–54
- Lukianova E.M. Kachestvennaia klinicheskaia praktika. – 2002. – №4. – P. 34-42.
Авторский коллектив:
Иванова Марина Витальевна – старший научный сотрудник отдела нейроинфекций и органической патологии нервной системы Научно-исследовательского института детских инфекций ФМБА России, к.м.н.
Скрипченко Наталья Викторовна – заместитель директора по научной работе Научно-исследовательского института детских инфекций ФМБА России, д.м.н., профессор
Матюнина Наталья Викторовна – младший научный сотрудник отдела нейроинфекций и органической патологии нервной системы Научно-исследовательского института детских инфекций ФМБА России
Вильниц Алла Ароновна – старший научный сотрудник отдела нейроинфекций и органической патологии нервной системы Научно-исследовательского института детских инфекций ФМБА России, к.м.н.
Войтенков Владислав Борисович – заведующий отделением функциональных методов диагностики, исполняющий обязанности руководителя отдела функциональной и лучевой диагностики Научно-исследовательского института детских инфекций ФМБА России
