Релиз-активные антитела к белку S100 способны корректировать течение экспериментального аллергического энцефаломиелита
СтатьиОпубликовано в журнале:
Журнал неврологии и психиатрии, 6, 2015
К.К. Ганина1, Ю.Л. Дугина1, К.С. Жавберт1, И.А. Эртузун1, О.И. Эпштейн1, И.Н. Абдурасулова2
1 ООО «НПФ «Материа Медика Холдинг»; 2 ФГБНУ «Институт экспериментальной медицины»
Release-active antibodies to S100 protein are able to improve the experimental allergic encephalomyelitis in rats
K.K. Ganina, J.L. Dugina, E.S. Zhavbert, L.A. Ertuzun, O.I. Epstein, I.N. Abdurasulova
ООО «NPF «Materia Medica Holding»; FSBSI «Institute of Experimental Medicine» Цель исследования. Изучали эффективность релиз-активных форм антител к белку S100 на животной модели рассеянного склероза. Материал и методы. Исследование выполнено на 60 самках крыс в возрасте 12 нед. Экспериментальный аллергический энцефаломиелит индуцировали введением гомогената спинного мозга в основание хвоста. После этого в течение 30 дней самки крыс получали внутрижелудочно водный раствор релиз-активных антител к белку S100 (препарат тенотен) в дозе 2,5 мл/кг в сутки или дистиллированную воду. В качестве положительного контроля использовали внутримышечные инъекции глатирамера ацетата в дозе 4 мг/кг в сутки (препарат копаксон). Результаты и обсуждение. Показано, что введение релиз-активных форм антител к S100 приводит к увеличению латентного периода заболевания, снижению его интенсивности на пике, а также компенсирует потерю массы тела животных по сравнению с контролем. Эффект препарата был сопоставим с показателями в группе с введением копаксона.
Ключевые слова: рассеянный склероз, релиз-активные антитела, белок S100, тенотен, глатирамера ацетат (копаксон).
Objective: To reveal the effects of release-active antibodies to S100 protein in an animal model of multiple sclerosis. Materials and methods: Sixty female Wistar rats, aged 12 weeks, were included in the study. The pathology was induced by subcutaneous injection of the spinal cord homogenate. Afterwards the rats received a water solution of release-active antibodies to S100 protein (2,5 ml/kg/day, tenoten) or distilled water intragastrically during 30 days. Intramuscular injections of glatiramer acetate (4 mg/kg/day, copaxone) were used as a positive control. Results and Conclusion: Release-active antibodies to S100 protein enhanced the latency period of the disease, reduced its peak intensity and compensated the loss of body weight of the animals. The experimental drug effect was similar to the results of copaxone injections.
Keywords: multiple sclerosis, release-active antibodies, S100 protein, tenoten, glatiramer acetate (copaxone).
Экспериментальный аллергический энцефаломиелит (ЭАЭ) является общепризнанной моделью рассеянного склероза (PC) — тяжелого аутоиммунного демиелинизирующего заболевания, поражающего людей трудоспособного возраста [1].
Наиболее адекватной моделью PC является ЭАЭ, вызываемый введением гомогената спинного мозга [2, 3]. В этой модели, как и при PC, осуществляется иммунный ответ на все компоненты миелина, индуцируется воспаление с последующей демиелинизацией и дегенерацией аксонов и самих нервных клеток [2—4]; проявляется патологическая цепь событий с развитием парезов, параличей и других симптомов болезни.
В последние годы в качестве мишени терапевтического действия при некоторых нейродегенеративных заболеваниях (например, при болезнях Паркинсона и Альцгеймера) рассматриваются белки S100. S100 — это целое семейство низкомолекулярных белков, выполняющих большой диапазон функций, включая регуляцию кальциевого гомеостаза, фосфорилирование белков, активность ферментов, поддержание цитоскелета, транскрипционную активность в клетке, а также пролиферацию и активацию клеток, апоптоз и хемотаксис [5]. В нервной ткани наиболее распространен белок S100B, который локализуется преимущественно (85—90%) в астроцитах [6].
По имеющимся в литературе данным, секреция белка S100B может стимулироваться провоспалительными цитокинами [7], а повышенный внеклеточный уровень белка S100B (до mМ концентрации) может стимулировать продукцию индуцибельной NO-синтазы (iNOS) и провоспалительных цитокинов ИЛ-1β, ФНОα, ИЛ-6, а также СОХ-2 в астроцитах, клетках микроглии и макрофагах [8—10], т.е. участвовать в нейровоспалении. Повышение уровня этого белка обнаруживается в спинномозговой жидкости и плазме крови больных PC при обострении [11, 12]. Введением этого белка или адоптивным переносом S100-специфических Т-клеток можно индуцировать воспалительное демиелинизирующее заболевание у животных [13, 14].
Релиз-активная форма антител к белку S100 (AT S100) в разных модификациях применяется в клинике (препараты тенотен, пропротен-100) в качестве нейропротективного или нейромодулирующего средства. Феномен релиз-активности свойственен препаратам с высокими разведениями действующего вещества, одной из отличительных черт таких препаратов является способность модулировать эффекты исходного соединения [15].
Цель данного исследования — изучение эффективности релиз-активных форм антител к белку S100 на модели ЭАЭ, а также оценка выраженности их нейропротективного потенциала по сравнению с глатирамера ацетатом (ГА) — препаратом, широко применяемым в клинической практике для лечения PC [16, 17].
Материал и методы
Работа проводилась с соблюдением принципов гуманности (Директивы Европейского Сообщества №86/609 ЕС), одобренных локальным этическим комитетом при Институте экспериментальной медицины. Исследование выполнено на 60 самках крыс породы Вистар (возраст — 12 нед). ЭАЭ индуцировали однократной инокуляцией энцефалитогенной смеси (ЭГС) из расчета 100 мг гомогената гомологичного спинного мозга, 0,2 мл полного адъюванта Фрейнда (содержание убитых микобактерий 5 мг/мл) и 0,2 мл физиологического раствора на одно животное. Энцефалитогенную смесь водили подкожно (в основание хвоста вдоль хвостовой вены) под легким эфирным наркозом в объеме 0,4 мл (по 0,2 мл справа и слева) [18—20].
Релиз-активные АТ S100 в водном растворе (препарат тенотен, Россия) в дозе 2,5 мл/кг в сутки начинали вводить животным (n=20) внутрижелудочно сразу после инъекции энцефалитогенной смеси и продолжали в течение 30 дней (средняя продолжительность заболевания) дважды в день с семичасовым интервалом. Крысы контрольной группы (n=20) внутрижелудочно получали аналогичные объемы растворителя (дистиллированная вода) в те же сроки, крысы группы сравнения — внутримышечные инъекции ГА (препарат копаксон, «Teva», Израиль); введение начинали на 2-й день после индукции ЭАЭ и продолжали в течение 25 дней 1 раз в день в дозе 4 мг/кг в сутки.
Ежедневно, начиная со дня индукции и до 30-го дня после индукции ЭАЭ, перед введением тестируемых препаратов животных взвешивали и оценивали наличие клинических симптомов ЭАЭ. В случае стремительного развития симптомов клинический осмотр проводили не менее 2 раз в день. Тяжесть неврологических нарушений оценивали в баллах по наличию у животных мышечной слабости, тремора (0,5 балла), стойких парезов (1 балл) и параличей (1,5 балла). При поражении нескольких конечностей для расчета клинического индекса (КИ) баллы суммировались. Отсутствие видимых клинических проявлений оценивалось как КИ=0, летальный исход — КИ=6.
Таким образом, для оценки эффективности протективного действия исследуемых препаратов на модели ЭАЭ для каждой группы рассчитывали следующие показатели: 1) время начала заболевания, т.е. продолжительность латентного периода ЭАЭ у заболевших крыс (дни); 2) общее число заболевших, тяжело болеющих и умерших крыс (в процентах от числа крыс в группе); 3) КИ на пике заболевания (баллы); 4) кумулятивный индекс (сумма КИ за весь период заболевания, баллы); 5) продолжительность заболевания (дни); 6) динамика массы тела (% от исходного значения).
Результаты
Введение ЭГС самкам крыс вызывало развитие ЭАЭ у 80% животных контрольной группы и у 85% животных, получавших тенотен детский (табл. 1). В группе — крыс, получавших препарат сравнения — ГА, доля заболевших животных была на 15% ниже по сравнению с контролем. Однако все межгрупповые различия этого показателя не достигали уровня статистической значимости.
Таблица 1. Показатели течения заболевания под влиянием препаратов на модели ЭАЭ
| Показатель | Препарат | ||
| контроль | АТ S100 | ГА | |
| Число заболевших, % | 80 | 85 | 65 |
| Легкая форма, % | 20 | 40 | 5 |
| Средняя форма, % | 25 | 40 | 40 |
| Тяжелая форма, % | 35 | 5* | 20 |
| Смертность, % | 10 | 5 | 5 |
| Длительность латентного периода, дни | 11,3±0,79 | 12,4±0,75 | 10,9±0,42 |
| Клинический индекс на пике, баллы | 3,00±0,51 | 2,23±0,37 | 2,40±0,47 |
| Кумулятивный индекс, баллы | 27,53±7,19 | 18,96±5,94 | 18,03±6,20 |
У животных контрольной группы заболевание начиналось в среднем через 10 дней после индукции. На день позже заболевание развивалось у животных, получавших ГА. Самый продолжительный латентный период отмечался при введении AT SI00 — 12,5 дня, что на 2,5 дня больше, чем в контрольной группе и на 1,5 дня больше, чем в группе положительного контроля (см. табл. 1). Пик заболевания также наступал позже (рис. 1).
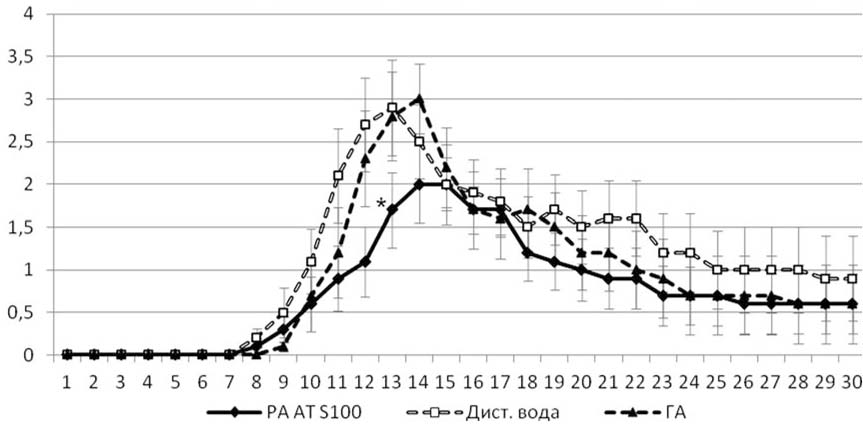
Рис. 1. Характеристика развития ЭАЭ для заболевших животных (без учета животных с КИ=0 на всем протяжении опыта). Данные представлены как среднее ± ошибка среднего. По оси абсцисс — дни после индукции ЭАЭ, по оси ординат — средний КИ по группе в баллах. * — р<0,05 при сравнении с группой введения дистиллированной воды.
Анализ тяжести заболевания у животных показал, что в опытной группе (введение AT S100) существенно сокращалась доля животных с тяжелой (4—6 баллов) формой ЭАЭ (5%), у большинства животных отмечалось заболевание легкой (0,5—2 балла) или средней тяжести (2,5—3,5 балла). Значения КИ (как на пике заболевания, так и суммарно) (см. табл. 1) и уровень смертности в группах крыс, получавших AT S100 и ГА, были ниже, чем в контрольной группе, однако уровня статистической значимости эффекты обоих препаратов не достигли.
Интересно, что при исключении из анализа незаболевших животных в группе c введением AT S100 на пике болезни (13-й день) наблюдались статистически значимые различия по сравнению с группой контроля (см. рис. 1). При этом животные из группы ГА не отличались от контрольных.
Развитие ЭАЭ сопровождалось потерей массы тела, причем для животных контрольной группы — еще до проявления клинических признаков заболевания. Уже на 2-й и 4-й дни эксперимента наименьшая потеря массы тела отмечалась у крыс, получавших ГА (рис. 2). На 5-й и 6-й дни статистически значимые позитивные отличия наблюдались и для группы с введением AT S100. В течение клинического периода ЭАЭ снижение массы тела животных в группах, получавших релиз-активную форму АТ S100 и ГА, было менее интенсивным. В группе с введением AT S100 статистически значимые отличия от контроля наблюдались на 14, 15 и 18-й дни опыта. Препарат сравнения ГА оказал более выраженное действие, хотя значения показателя у этих крыс статистически не отличались от аналогичных характеристик группы с введением AT S100. К 30-му дню после индукции ЭАЭ животные всех групп сравнялись в массе.
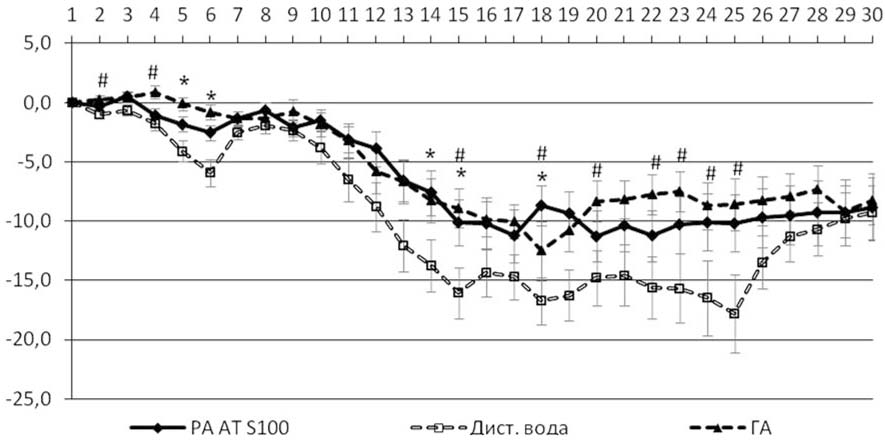
Рис. 2. Относительное изменение массы тела животных в течение развития ЭАЭ. По оси абсцисс — дни после индукции ЭАЭ, по оси ординат — изменение массы тела животных в %. За 100% взята масса на день индукции ЭАЭ. Данные представлены как среднее ± ошибка среднего. * — р<0,05 при сравнении групп с введением релиз-активных антител к S100 и дистиллированной воды; # — р<0,05 при сравнении групп с введением ГА и дистиллированной воды (дисперсионный анализ с последующим применением post-hoc критерия Фишера).
Обсуждение
В последние годы в клинической практике апробируется использование антител к различным мишеням на иммунных клетках, и у ряда препаратов выявлено протективное действие при РС (натализумаб, алемтузумаб и др.) [21]. Однако эти препараты у многих пациентов вызывают серьезные побочные реакции, и это ограничивает их широкое применение [21].
В своем исследовании мы основывались на применении низких концентраций антител, что позволяет избежать нежелательных побочных эффектов. Мишенью для антител является астроцитарный белок S100, повышение концентрации которого в спинномозговой жидкости и крови показано при РС [11, 12].
Результаты проведенного исследования действительно позволяют сделать вывод о наличии у релиз-активных АТ S100 нейропротективного действия в модели ЭАЭ, сходного с эффектом препарата сравнения — ГА. Несмотря на то что при использовании обоих препаратов частота заболеваемости не уменьшалась, у животных, получавших лечение, заболевание протекало в более легкой форме, чем в контрольной группе.
Протективный эффект AT SI00 может быть обусловлен удалением из внеклеточного пространства избыточного количества белка S100 и осуществляться на разных уровнях.
На периферии, по-видимому, защитное действие происходит за счет регуляции функций CD8+ Т-клеток и NK-клеток, которые при стимуляции экспрессируют и секретируют S100B [22], и/или их миграционной способности в ЦНС. Это предположение частично подтверждается удлинением индуктивного периода у крыс, получавших AT S100, так как клинические симптомы ЭАЭ появляются при проникновении аутореактивных Т-клеток в ЦНС и запуске экспрессии провоспалительных цитокинов в ЦНС [18].
В ЦНС нейропротекция может быть связана с подавлением воспалительного процесса. Выявлено, что повышенные (микромолярные) внеклеточные концентрации белка S100 стимулируют выработку NO и активацию микроглии [8, 23]. Другой возможный механизм выявленного протективного действия AT SI00 — снижение образования активных форм кислорода, повреждающих нейроны [24, 25]. Кроме того, AT S100, регулируя уровень S100, могут влиять на синтез и секрецию астроцитами фактора роста фибробластов-2 (FGF-2) и трансформирующего фактора роста β (TGFβ3) [26]. Известно также, что в физиологических концентрациях белок S100B стимулирует пролиферацию глии и рост нейритов через ERK-сигнальные пути [27], т.е. при PC белок S100 может оказывать не только повреждающее, но и протективное действие на клетки ЦНС, уменьшая степень повреждений и способствуя репаративным процессам.
С учетом вышеизложенного становятся очевидными преимущества использования РА-формы препарата АТ у S100, оказывающей мягкое, но эффективное модулирующее и нормализующее действие.
Проведенное исследование показало перспективность применения РА-формы препарата АТ к S100 в клинической практике, однако требуется разработать критерии отбора пациентов, схему и длительность проведения лечения, а также исследовать возможность его использования в комплексной терапии, направленной на различные патогенетические мишени.
Литература
