Место препаратов с метаболической направленностью в условиях первичного звена здравоохранения при профилактике и лечении ишемических синдромов
Статьи Опубликовано в журнале:«МЕДИЦИНСКИЙ СОВЕТ»; №12; 2015; стр. 60-65.
А.М. Шилов, д.м.н., профессор, Первый Московский государственный медицинский университет им. И.М. Сеченова
Ишемическая болезнь сердца играет ведущую роль в структуре смертности от сердечно-сосудистых заболеваний. Исследования последних десятилетий позволили уточнить особенности патофизиологических процессов, происходящих в кардиомиоцитах при ишемии, выделить новые ишемические клинические синдромы и оценить роль цитопротекторной терапии в комплексном лечении ишемической болезни сердца. Одним из наиболее изученных препаратов для цитопротекторной терапии является триметазидин. Высокая эффективность и хорошая переносимость позволяют рассматривать его как оптимальное средство для защиты кардиомиоцитов при стабильной стенокардии.
Ключевые слова:
стабильная стенокардия триметазидин цитопротекторная терапия новые ишемические синдромы
Ишемическая болезнь сердца является ведущей причиной смертности в экономически развитых странах. Так, за 2010 г. в России 56,5% всех случаев смерти пришлось на заболевания сердца и сосудов, из которых больше половины составляла именно ишемическая болезнь сердца. Частота встречаемости этой патологии увеличивается с возрастом, соответственно, учитывая рост продолжительности жизни, число пациентов с этой патологией будет только расти [1].
Сегодня накоплен большой опыт лечения и профилактики ишемической болезни сердца, тем более удивительный, что этой болезни еще нет и 100 лет! Действительно, ишемическая болезнь сердца (ИБС) была выделена Всемирной организацией здравоохранения как отдельная патология лишь в 1965 г. Долгое время в ИБС выделяли несколько клинических форм: стенокардия напряжения, нестабильная стенокардия и инфаркт миокарда [2]. При этом выделялось лишь 2 основных постишемических состояния - необратимое повреждение (инфаркт миокарда) и кратковременная ишемия с быстрым восстановлением функции миокарда. Однако это не могло объяснить ряд состояний, с которыми сталкивались кардиологи [1]. С накоплением знаний и опыта пришло понимание, что сердце - это не просто насос, выполняющий механическую функцию по перекачиванию крови. Это еще и совершенно особая мышечная ткань, в которой постоянно идут активные биохимические процессы по преобразованию энергетических субстратов. У взрослого мужчины за сутки в этом своеобразном «биологическом реакторе» может образоваться и использоваться более 30 кг аденозинтрифосфата (АТФ) [2]!
С учетом этого в 1996 г. южноафриканский ученый L.H. Opie, подчеркнув, что у пациентов с ИБС течение болезни характеризуется 9-10 различными клиническими синдромами, предложил объединить известные к тому времени новые выявленные состояния под термином «новые ишемические синдромы» [3].
Среди «новых ишемических синдромов» выделяют:
1. Оглушенность миокарда.
Впервые это состояние описал G.R. Heyndrikx с коллегами [5]. Согласно определению оглушенность миокарда - это нарушение механической функции миокарда, сохраняющееся после восстановления перфузии, несмотря на отсутствие необратимых повреждений, и полное или почти полное восстановление кровотока [4, 5]. Моделью состояния оглушенности миокарда может служить короткий (5-15 мин) период ишемии при, например, стенокардии. Такая ишемия не приводит к некрозу миокардиоцитов, но, однако, уменьшает сократимость левого желудочка на последующие 3-6 ч. Кардиологи могут столкнуться с этим состоянием в том случае, если ишемия затронула участок миокарда, кровоснабжаемый частично стенозированной артерией; после субэндокардиальной ишемии при интенсивной физической нагрузке в условиях гипертрофированного левого желудочка; при использовании тромболизиса в остром инфаркте миокарда или при остром инфаркте миокарда, осложненном кардиогенным шоком, при быстром восстановлении коронарного кровотока. В этом случае после краткого эпизода ишемии и при быстрой реперфузии сокращение пострадавшего сегмента или даже всего сердца восстанавливается не сразу, а нормализуется довольно длительно. Характерным клиническим проявлением этого состояния является диастолическая дисфункция левого желудочка [3, 5]. Выделяют несколько вариантов оглушения миокарда [6]:
2. Гибернация («заснувший миокард»)
Это нарушение местной сократимости левого желудочка, вызванное снижением коронарного кровотока [7]. В 1990 г. исследователи обнаружили эту «защиту миокарда в условиях снижения кровотока» почти в половине миокарда левого желудочка с необратимо сниженной сократимостью. То есть в местах сниженного кровотока сохранялись большие участки живой ткани, которые не могли обеспечить нормальную работу сердечной мышцы. При этом ни некроза миокарда, ни ишемических симптомов не отмечалось. Клетки «спали» [8]. Таким образом, гибернация - это нарушение сократимости миокарда, при том что клетки жизнеспособны и обладают сократительным потенциалом. В повседневной клинической практике «спящий» миокард встречается чаще, чем «оглушенный». Эти проблемы выявляются у трети пациентов со стабильной стенокардией и более чем у половины больных с нестабильной стенокардией [9].
3. Метаболическая адаптация (прекондиционирование)
С этим явлением хорошо знакомы пациенты со стенокардией. В течение дня, как правило, частота и интенсивность ишемических приступов несколько снижаются, сердце «привыкает» к нагрузке. Прекондиционирование - это один из механизмов адаптации при повторяющихся недолгих эпизодах ишемии. Кардиомиоциты повышают свою устойчивость к ишемическому воздействию, снижая накопление лактатов и фосфатов и одновременно активизируя синтез ферментов, защищающих от повреждения. При этом кардиологи выделяют две фазы метаболической адаптации: «быстрая», рассчитанная на 1-2 ч, и «отсроченная», возникающая через 12-24 ч после ишемического воздействия и продолжающаяся до 3 сут. [10, 11].
Все эти синдромы являются, по сути дела, попытками кардиомиоцитов приспособиться к условиям ишемии, но в конечном итоге комплекс метаболических нарушений приводит к снижению сократительной функции, что, в свою очередь, запускает формирование порочного круга. Снижение сердечного выброса повышают активность ренин-ангиотензин-альдостероновой, симпатоадреналовой и других компенсаторных систем, которые оказывают дополнительное повреждающее действие и могут приводить к окончательной гибели кардиомиоцитов [12].
Таким образом, тяжесть и последствия ишемии определяются не только состоянием коронарного кровотока, но и развивающимися при недостатке кислорода внутриклеточными изменениями миокарда. Соответственно, все большее внимание привлекают препараты, которые могут влиять на клеточный метаболизм миокарда при ишемии [13, 14].
В норме в клетках сердца постоянно идет работа по образованию и утилизации АТФ: поступление в клетку энергетических субстратов, доставка кислорода и окислительное фосфорилирование в митохондриях кардиомиоцитов с образованием АТФ, а затем его гидролиз для обеспечения сократительной функции. Этот энергетический обмен примерно на 85% является аэробным, т. е. осуществляется с помощью кислорода.
Основными субстратами для выработки АТФ являются свободные жирные кислоты и глюкоза (гликолиз, с расщеплением глюкозы и лактата до пирувата), причем для окисления жирных кислот требуется больше кислорода, чем для окисления глюкозы с образованием такого же количества АТФ. У здорового человека 60-80% вырабатываемого в миокарде АТФ образуется из жирных кислот. В условиях ишемии, т. е. при несоответствии объема коронарного кровотока потребностям миокарда в кислороде, анаэробный гликолиз с расщеплением гликогена становится основным источником энергии. Это запускает целый каскад изменений, который можно назвать гипоксическим типом метаболизма (рис. 1):
Рисунок 1. Схема окислительного фосфорилирования, образования активных форм кислорода (АФК) и перекисного окисления липидов (ПОЛ)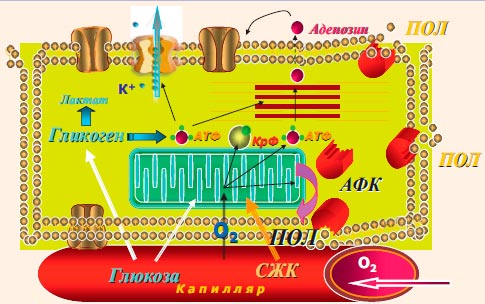
Эти изменения хорошо коррелируют с «новыми ишемическими синдромами». С этой точки зрения прекондиционирование - это метаболическая адаптация: переход на новый уровень окислительного фосфорилирования (на фоне дефицита кислорода) с сохраняющимся преимущественным p-окислением свободных жирных кислот (СЖК) в синтезе АТФ.
Гибернация («спящий миокард») - это функциональная адаптация к дефициту АТФ в клетке.Накапливающиеся недоокисленные активные формы жирных кислот и перегрузка кальцием приводит к снижению сократительной функции миокарда и формированию незавершенной диастолы.
«Оглушенный миокард» - это физиологическая реабилитация, длительность которой зависит от временного предшествующего периода ишемии.
Совмещение этих этапов адаптации во времени - дезадаптация ведет к гибели кардиомиоцитов - апоптозу (рис. 2).
Рисунок 2. Этапы адаптации при развитии ишемии миокарда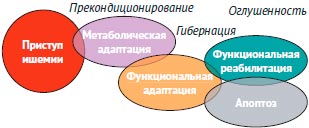
Попытки повлиять на эти процессы ведутся достаточно давно. Первые метаболические препараты появились еще в 60-70-х гг. прошлого века, в т. ч. и знаменитая глюкозо-инсулиново-калиевая смесь. Она увеличивала синтез гликогена и снижала высвобождение свободных жирных кислот [17]. Однако сложности с подбором оптимальной дозы для каждого конкретного пациента и необходимость инъекционного введения ограничили широкое использование этого комплекса.
Начиная с 80-х гг. в клиническую практику входят препараты, частично блокирующие бета-окисление жирных кислот. Они ограничивают поступление жирных кислот в клетку, замедляют скорость бета-окисления жирных кислот и уменьшают метаболический ацидоз. Классическим представителем этой группы препаратов является триметазидин [19].
Изначально этот препарат был разработан для борьбы с головокружениями, однако уже к середине 80-х гг. прошлого века стали поступать сообщения о том, что триметазидин может снижать частоту и выраженность приступов стенокардии. Фармакологическое действие триметазидина основано на селективном угнетении фермента длинноцепочечной 3-кетоацил-СоА-тиолазы, который необходим для окисления свободных жирных кислот. Это тормозит бета-окисление жирных кислот (как длинноцепочечных, так и короткоцепочечных) с одновременным активизированием менее кислородозатратных путей синтеза АТФ (анаэробный гликолиз). Это увеличивает эффективность энергообразования в кардиомиоцитах и уменьшает образование опасных свободных радикалов (рис. 3) [22, 23]. Показано, что триметазидин уменьшает внутриклеточный ацидоз, снижает уровень натрия и кальция в клетках миокарда [24].
Рисунок 3. Схема участия триметазидина во внутриклеточном метаболизме при дефиците кислорода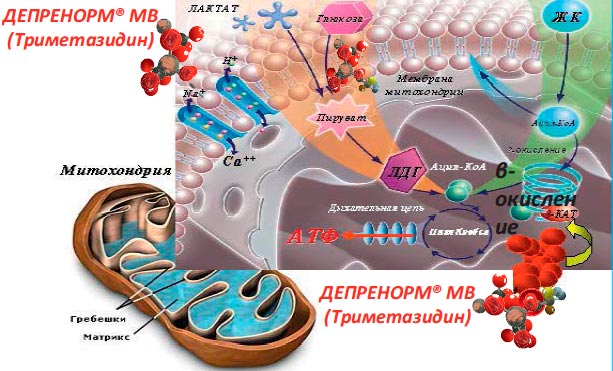
За прошедшие 30 лет было накоплено большое количество данных, подтверждающих безопасность и эффективность триметазидина, в т. ч. и результатов ряда контролируемых исследований (TEMS, TACT, TRIMPOL, TRIMPOL-II, TRIMER и др.).
В исследовании TRIMPOL I (700 участников) было показано, что добавление триметазидина в комплексную терапию долгодействующими нитратами или антагонистами кальция ведет к статистически достоверному снижению частоты приступов стенокардии [25]. TRIMPOL II (227 участников) зафиксировал, что присоединение триметазидина к лечению метопрололом уже через 4 мес. приводит к достоверному улучшению показателей проб с физической нагрузкой [26].
В исследовании ПРИМА оценивалась эффективность и безопасность триметазидина у пациентов с ишемической болезнью сердца и хронической сердечной недостаточностью (948 участника). Обнаружилось, что этот препарат улучшал функциональный статус пациентов, повышал качество жизни и выживаемость: в группе пациентов, получавших триметазидин, по сравнению с контрольной группой достоверно уменьшалась одышка и отеки нижних конечностей; пациенты отмечали лучшее самочувствие и уменьшение повышенной утомляемости [27]. Исследователи полагают, что происходило это за счет выведения плохо сокращающихся сегментов миокарда из состояния гибернации.
В открытом мультицентровом исследовании TIGER (120 пациентов) 12-недельный курс терапии триметазидином вдвое сократил число приступов стенокардии и, что немаловажно, заметно повысил качество жизни: по окончании исследования 89% пациентов оценили свое состояние как отличное или хорошее
В другом исследовании оценивался эффект 4-летнего приема триметазидина на фоне базовой терапии у пациентов с хронической сердечной недостаточностью и постинфарктным кардиосклерозом (фракция выброса менее 40%). Контрольные исследования проводились каждые полгода. Было показано, что использование триметазидина позволило снизить общую смертность на 56%, на 47% уменьшить число госпитализаций из-за сердечной недостаточности и значимо улучшить функциональное состояние пациентов. Если в контрольной группе все пациенты к концу исследования перешли в III-IV ФК, то в основной группе уменьшилось число пациентов с III ФК, а часть пациентов даже перешла в группу I ФК [28, 29].
Эффективность триметазидина при хронической сердечной недостаточности подтверждена метаанализом 17 опубликованных исследований (более 1 000 пациентов с хронической сердечной недостаточностью). Использование триметазидина увеличивало фракцию выброса левого желудочка и повышало толерантность к физической нагрузке. Одним из существенных результатов этого метаанализа стало обнаружение того факта, что комплексная терапия с триметазидином связана с уменьшением общей смертности на 71% и снижением риска кардиоваскулярных событий на 58% [33].
В открытом мультицентровом исследовании TIGER (120 пациентов) 12-недельный курс терапии триметазидином вдвое сократил число приступов стенокардии и, что немаловажно, заметно повысил качество жизни: по окончании исследования 89% пациентов оценили свое состояние как отличное или хорошее [30].
У пациентов со стенокардией Депренорм® МВ увеличивает коронарный резерв, снижает частоту приступов стенокардии, улучшает сократительную функцию левого желудочка
Европейское многоцентровое слепое исследование (TEMS) у пациентов со стабильной стенокардией отметило не только уменьшение количества приступов в неделю и улучшение показателей проб с нагрузкой, но и то, что использование триметазидина, по данным холтеровского исследования, достоверно уменьшает число приступов ишемии во время раннего утреннего пика [31].
В российском многоцентровом исследовании ТРИУМФ (846 пациентов) изучалось влияние триметазидина на стабильную стенокардию, недостаточно контролируемую стандартной терапией нитратами, бета-адреноблокаторами или антагонистами кальция. Было показано значительное снижение числа приступов стенокардии, улучшение состояния больных, уменьшение потребности в нитроглицерине [32].
В 2008 г. Кузнецов В.И. с соавт. изучали эффективность добавления триметазидина к стандартной антиангинальной терапии у больных с хроническими формами ИБС. Было показано, что комбинированная терапия в течение одного месяца приводит к достоверному уменьшению числа желудочковых экстрасистол, наджелудочковой экстрасистолии, а также эпизодов пароксизмальной наджелудочковой тахикардии. При этом положительный эффект триметазидина наиболее отчетливо наблюдался у пациентов со смещениями сегмента ST, по данным холтеровского мониторирования ЭКГ, подтверждая способность препарата уменьшать выраженность нарушений ритма, индуцированных ишемией [38, 39].
Отмечены протективные свойства триметазидина в отношении возникновения рестенозов коронарных артерий после проведения ангиопластики со стентированием по результатам исследования Chen J. и соавт. в 2013 г. Было показано, что назначение триметазидина, по крайней мере в течение 1 мес. после операции, приводит к снижению частоты рестенозов (4,2 против 11,1% в группе контроля, не принимавшей триметазидин в послеоперационном периоде, р = 0,001). Прием триметазидина сопровождался увеличением фракции выброса левого желудочка, (65,4 ± 10,7 в группе «триметазидин» против 63,1 ± 10,4 в группе контроля, р = 0,006). Годовое наблюдение за пациентами выявило снижение частоты наступления неблагоприятных сердечно-сосудистых событий в группе триметазидина [40].
Таким образом, триметазидин оказывает кардиопротективное действие при ишемии миокарда за счет влияния на энергетический метаболизм кардиомиоцитов. В клинической практике использование этого препарата в комплексной терапии стабильной стенокардии позволяет:
На основании этого российские и зарубежные кардиологические общества относят триметазидин к антиангинальным препаратам, которые могут использоваться для лечения стенокардии напряжения, в качестве дополнения к стандартной терапии или альтернативы ей, при плохой переносимости базовых препаратов [34-37].
Одним из препаратов на основе триметазидина является Депренорм® МВ, выпускаемый российской компанией «Канонфарма продакшн». Это таблетки пролонгированного действия по 35 мг и по 70 мг в одной таблетке. Особая технология модифицированного высвобождения (МВ) позволяет высвобождать действующее вещество постепенно. За счет этого Депренорм® МВ сохраняет свою антиишемическую активность на протяжении 12-24 ч, что заметно облегчает прием препарата и повышает комплаентность лечения.
Отмечены протективные свойства триметазидина в отношении возникновения рестенозов коронарных артерий после проведения ангиопластики со стентированием по результатам исследования Chen J. и соавт. в 2013 г. Было показано, что назначение триметазидина, по крайней мере в течение 1 мес. после операции, приводит к снижению частоты рестенозов
У пациентов со стенокардией Депренорм® МВ увеличивает коронарный резерв, снижает частоту приступов стенокардии, улучшает сократительную функцию левого желудочка. Эффективность и безопасность Депренорма МВ подтверждена в ходе клинических исследований. Так, в мультицентровом открытом исследовании [21] эффективность и переносимость этого препарата оценивали у 90 больных со стабильной стенокардией напряжения II-III ФК, в возрасте от 48 до 70 лет. При этом у части пациентов отмечалась также артериальная гипертензия, постинфарктный кардиосклероз, у 10% пациентов - сахарный диабет 2-го типа. В течение 2 мес. на фоне базовой терапии пациенты получали Депренорм® МВ. Результаты исследования продемонстрировали следующее:
1) Прием Депренорма МВ позволил в 2 раза снизить число приступов стенокардии, при этом снижение отмечалось уже через месяц терапии, возрастая к концу исследования. То есть имеет место достоверное накопление отсроченного антиишемического эффекта.
2) В несколько раз уменьшилось количество таблеток изосорбида динитрата, необходимого для купирования приступов.
3) У трети пациентов отмечалась положительная динамика ЭКГ.
4) 30% пациентов к концу лечения отмечали уменьшение жалоб на головокружение и снижение внимания, что было расценено как косвенные признаки улучшения мозгового кровообращения.
5) Депренорм® МВ хорошо переносился: только у 1 пациента был зарегистрирован побочный эффект в виде сильной головной боли, что потребовало отмены препарата.
Таким образом, триметазидин - эффективный антиангинальный препарат с высоким профилем безопасности, который улучшает внутриклеточный энергетический метаболизм кардиомиоцитов в условиях ишемии, достоверно снижает тяжесть и частоту приступов стенокардии, хорошо сочетается с другими медикаментами и уменьшает потребность в препаратах базовой терапии. Эти данные позволяют рассматривать триметазидин (Депренорм® МВ) как оптимальное средство для лечения пациентов со стабильной стенокардией напряжения, проявляющейся, в т. ч. и «новыми ишемическими синдромами».
ЛИТЕРАТУРА
1. Шилов А.М. и др. Возможности препаратов с метаболической направленностью при коррекции ишемических синдромов. Лечащий врач, 2013, 7.
2. Атрощенко Е.С. «Новые ишемические синдромы» и возможности цитопротекции. Медицинские новости, 2003, 1.
3. Opie LH. Недавно выявленные ишемические синдромы и эндогенная цитопротекция миокарда и их роль в клинической кардиологии в прошлом и будущем. Медикография, 1999, 21(2), 65-73.
4. Braunwald E. Stunning of the myocardium: an update Text. Cardiovasc. Drugs. Ther., 1991, 5: 849-851.
5. Heyndrickx GR. Clinical relevance of hibernation. Stunning and Hibernation in the Heart, Informal dysfunction on left ventricular dysfunction. Venice Canal. Press, 1995. 78 p.
6. Сидоренко Г.И. Кардиология на рубеже веков: перспективы и надежды. Здравоохранение, 2000, 7.
7. Rahimtoola SH. Definition of chronic left ventricular dysfunction or hibertation; Ed. R. Ferrari, P. Harris. Stunning and Hibernation in the Heart. Venice Canal Press, 1995. P. 62-66.
8. Rahimtoola SH, США. Патофизиологическая концепция гибернации миокарда: определение, обоснование и клиническое значение. Медикография, 1999, вып. 60, т. 21(2): 76-79.
9. Carlson EB, Cowley MJ, Wolfgang TC, Vetrovec GW. Acute changes in global and regional rest left ventricular function after successful coronary angioplasty: comparative results in stable and unstable angina. J Am Coll Cardiol., 1989 May, 13(6): 1262-1269.
10. Horowitz J, Frenneaux M. Metabolic manipulation in ischaemic heart disease, a novel approach to treatment. Eur Heart J, 2004, 25(8): 634-41.
11. Маколкин В.И. Ишемическая дисфункция миокарда и пути ее коррекции. Форум. Ишемическая болезнь сердца, 2000, 2: 2-4.
12. Dzau VJ, Antman EM, Black HR et al. The cardiovascular disease continuum validated: clinical evidence of improved patient outcomes: part I: Pathophysiology and clinical trial evidence (risk factors through stable coronary artery disease). Circulation, 2006, 114(25): 2850-2870.
13. Шляхто Е.В., Галагудза М.М., Нифонтов Е.М. и др. Метаболизм миокарда при хронической сердечной недостаточности и современные возможности метаболической терапии. Сердечная недостаточность, 2005, 4: 148-156.
14. Современный подход к цитопротекторной терапии. Под ред. Ю.Б. Белоусова. М., 2010: 3-28.
15. Асташкин Е.И. Коррекция энергетического обмена в миокарде - новое направление в лечении сердечно-сосудистых заболеваний. Сердце и метаболизм, 2008, 21, 1-3.
16. Белардинелли Р. Благоприятные эффекты метаболического подхода в реабилитации пациентов с заболеваниями сердца. Сердце и метаболизм. Эффективность сердечной деятельности в норме и при заболеваниях. 2009, 23, 21-24.
17. Hess ML, Okabe E, Poland J et al. Glucose, insulin, potassium protection during the course of hypothermic global ischemia and reperfusion: a new proposed mechanism by the scavenging of free radicals. J. Cardiovasc. Pharmacol., 1983, 5(1): 35-43.
18. Бизенкова М.Н. и др. Сравнительная оценка энергообеспечения миокарда в норме и в динамике экспериментальной острой ишемии. Современные наукоемкие технологии, 2006, 1.
19. Rosano GMC, Vitale C, Sposato B and al. Trimetazidine improves left ventricular function in diabetic patients with coronary artery disease: a double-blind placebo-controlled study. Cardiovasc. Diabetol., 2003, 2, 16-24.
20. Депренорм МВ. Инструкция по применению. РЛС, 2015.
21. Н.А.Шостак и др. Возможности терапевтической кардиоцитопротекции в комплексной терапии ИБС. Российский кардиологический журнал, 2009, 6(80).
22. Kantor PF, Lucien A, Kozak R, Lopaschuk GD. The antianginal drug trimetazidine shifts cardiac energy metabolism from fatty acid oxidation to glucose oxidation by inhibiting mitochondrial long-chain 3-ketoacyl coenzyme A thiolase. Circ Res., 2000, 86: 580-588.
23. Lopaschuk GD, Barr R, Thomas PD, Dyck JR. Circ Res., 2000, 393: 33-37.
24. Renaud JF. Internal pH, Na+, and Ca2+ regulation by trimetazidine during cardiac cell acidosis. Cardiovasc. Drugs. Ther., 1988, 1: 677-686.
25. Szwed H, Sadowski Z, Pachocki R et al. The antiischemic effects and tolerability of trimetazidine in coronary diabetic patients. A substudy from TRIMPOL 1. Cardiovasc Drugs Ther., 1999, 13(3): 217-222.
26. Szwed H, Sadowski Z, Elikowski W et al. Combination treatment in stable effort angina using trimetazidine and metoprolol: results of a randomized, double-blind, multicentre study (TRIMPOL II). TRIMetazidin in POLand. Eur Heart J., 2001, 22(24): 2267-2274.
27. Васюк Ю.А., Школьник Е.Л., Куликов К.Г и др. Влияние терапии Предукталом МВ на течение ХСН у больных стабильной стенокардией напряжения, перенесших острый инфаркт миокарда. Результаты исследования ПРИМА. Сердечная недостаточность, 2009, 10(1): 34-36.
28. Belardinelli R. Trimetazidine and the contractile response of dysfunctional myocardium in ischaemic cardiomyopathy. Rev Port Cardiol., 2000, 19(5): 35-39.
29. Di Napoli P, Di Giovanni P, Gaeta MA et al. Trimetazidine and reduction in mortality and hospitalization in patients with ischemic dilated cardiomyopathy: a post hoc analysis on the Villa Pini d' Abruzzo Trimetazidine Trial. J Cardiovasc Pharmacol., 2007, 50 (5): 585-589.
30. Henane T. Clinical value of combined hemodynamic and metabolic agents in the treatment of stable angina. Eur Heart J, 1997, 18(3): 394413.
31. Sellier P, Pennaforte S, et al. On behalf of the Trimetazidine European Multicenter Study Group. Trimetazidine: a new concept in the treatment of angina. Comparison with propranolol in patients with stable angina. Br J Clin Pharmacol, 1994, 37: 279-88.
32. Глезер М.Г., Жарова Е.И. Ишемия миокарда: от понимания механизмов к адекватному лечению. Кардиология, 2001, 9: 106-19.
33. Gao D, Ning N, Niu X et al. Trimetazidine: a meta-analysis of randomised controlled trials in heart failure. Heart, 2011, 97(4): 278-86.
34. Fihn SD, Cardin JM, Abrams J et al. //2012 ACCF/AHA/ACP/FCP/ AATS/PCNA/SCAI/SNS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease. J. Am. Coll. Cardiol., 2012, 60(24): 44-164.
35. ВНОК. Национальные рекомендации по диагностике и лечению стабильной стенокардии. Пересмотр 2008. Кардиоваскулярная терапия и профилактика, 2008, 7(6). Прил. 4.
36. 83. Fox K, Fox P et al. Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology; ESC Committee for Practice Guidelines (CPG). Guidelines on the management of stable angina pectoris: executive summary: The Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology. Eur Heart J., 2006, 27(11): 1341-1381.
37. Ciapponi A, Pizarro R, Harrison J. Trimetazidine for stable angina. Cochrane Database Syst. Rev. 2005: CD003614.
38. Кузнецов В.И., Чорбинская С.А., Вялов С.С., Уральцев Д.Н., Вялов И.С. Ангиозил® ретард в лечении и профилактике аритмий. Эффективная фармакотерапия в кардиологии и ангиологии. 2008/
39. Chen J1, Zhou S1, Jin J1, Tian F1, Han Y1, Wang J1, Liu J1, Chen Y2. Chronic treatment with trimetazidine after discharge reduces the incidence of restenosis in patients who received coronary stent implantation: a 1-year prospective follow-up study. Int J Cardiol., 2014 Jul 1, 174(3): 634-9.
